Молекулярно-генетические предикторы прогрессирования трижды негативного рака молочной железы
Автор: Панченко И.С., Родионов В.В., Кометова В.В., Панченко С.В., Шарафутдинов М.Г., Лаврентьева И.А.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.24, 2025 года.
Бесплатный доступ
Введение. Трижды негативный рак молочной железы (ТНРМЖ) - группа злокачественных опухолей молочной железы с неблагоприятным прогнозом и различными молекулярно-генетическими характеристиками. При данном заболевании гены определяют принадлежность пациенток к кластерам, отличающимся прогнозом. Работы, в которых гены рассматривались бы как факторы риска прогрессирования, немногочисленны. Цель исследования - определить гены ТНРМЖ, которые ассоциируются с высоким риском прогрессирования, и оценить их прогностическую значимость. Материал и методы. В исследование включено 246 пациенток с ТНРМЖ. В качестве панели генов использовались 45 генов. Методика молекулярно-генетического исследования заключалась в предварительном выделении РНК с последующей амплификацией кДНК в режиме реального времени методом ПЦР. Средние значения уровня экспрессии генов рассчитывали как меры центральной тенденции числового значения с 95 % доверительным интервалом. Значимость влияния генов на риск прогрессирования (локорегионарный рецидив или отдаленное метастазирование) оценивали с помощью формирования линейной дискриминантной функции и построения ROC-кривой. Оценку взаимосвязи генов с клинико-морфологическими параметрами проводили с помощью корреляционного анализа (критерий χ2 Пирсона и ƿ Спирмена). После определения пороговых значений уровня экспрессии генов и последующего ранжирования пациенток на группы с высоким и низким уровнями экспрессии генов проводили анализ выживаемости сформированных групп (кривые Каплана-Майера). При сравнении кривых выживаемости использовался логранговый критерий. Все расчеты были выполнены на персональном компьютере с использованием прикладных программ Microsoft Excel 2010, «Статистика 19.0» (StatSoft Inc., USA), MedCalc (версия 20). Различия между двумя сравниваемыми группами считали статистически значимыми при р≤0,05.
Трижды негативный рак молочной железы, тнрмж, локорегионарный рецидив, отдаленное метастазирование
Короткий адрес: https://sciup.org/140309649
IDR: 140309649 | УДК: 618.19-006.6-036.65:577.21 | DOI: 10.21294/1814-4861-2025-24-1-70-78
Текст научной статьи Молекулярно-генетические предикторы прогрессирования трижды негативного рака молочной железы
Трижды негативный рак молочной железы (ТНРМЖ) – гетерогенная группа злокачественных новообразований молочной железы, характеризующаяся частым развитием локорегионарного рецидива (ЛРР), отдаленных метастазов и, как следствие, неудовлетворительными отдаленными результатами лечения [1–3]. Общая 5-летняя выживаемость при ТНРМЖ на 8–16 % ниже, чем при не-трижды негативных подтипах [4]. Пациенты, которые достигают полного патоморфологического ответа на фоне неоадъювантной терапии, имеют лучший отдаленный прогноз. Данную мысль подтвердили в своих исследованиях P. Cortazar et al. [5] и C. Liedtke et al. [6]. По мнению P. Cortazar et al., у пациенток, которые не достигали полного патоморфологического регресса, в дальнейшем местный рецидив регистрировался более чем в 50 % случаев. В исследовании C. Liedtke et al. показано преимущество в общей выживаемости у пациенток, достигших полного патоморфоза, по сравнению с пациентками, у которых после лечения оставалась резидуальная опухоль.
Трижды негативный рак молочной железы (РМЖ) представляет собой семейство злокачественных новообразований молочной железы, для которых общим является отсутствие экспрессии рецепторов эстрогенов, прогестерона, Her2/neu, при любом значении Ki67 по данным иммуногистохимического исследования [7, 8]. В настоящее время большое внимание уделяется вопросам, посвященным изучению ТНРМЖ с позиций молекулярно-генетического строения опухолей [9–12]. Популярностью среди онкологов пользуется классификация, предложенная C.M. Perou et al. [12], B.D. Lehmann et al. [10, 13], M.D. Burstein et al. [9]. В вышеперечисленных работах основное внимание уделяется вопросам кластеризации пациенток по клинико-морфологическим параметрам и прогнозу, на основании различий в молекулярногенетическом строении. Так, B.D. Lehmann et. al. [10] предлагают 4 подтипа ТНРМЖ: 2 базальноподобных (BL-1, BL-2), мезенхимальный (М) и люминальный андрогеновый (LAR), которые отличаются особенностями молекулярно-генетического строения. В последние 5 лет в литературе можно встретить большое число публикаций, посвященных вопросам изучения влияния отдельных генов на клинико-морфологические параметры пациенток с ТНРМЖ [4, 13–19].
Цель исследования – отобрать гены, которые бы коррелировали с повышенным риском ЛРР и отдаленных метастазов, а также проанализировать корреляцию выделенных генов с клиникоморфологическими параметрами и оценить их прогностическую значимость на примере популяции пациенток с ТНРМЖ.
Материал и методы
В исследование включено 246 пациенток с ТНРМЖ. Критерий включения – морфологически подтвержденный инвазивный ТНРМЖ T0–4N0–3-M0–1 стадий. Критерий исключения – пациентки с другими иммуногистохимическими подтипами РМЖ. Диагноз ТНРМЖ был выставлен по данным ИГХ-исследования. Каждой из 246 пациенток выполнено определение уровня экспрессии генов, которые были ассоциированы с различными функциями: гены рецепторов гормонов (ESR1, PGR, AR), группа генов рецепторов ростовых факторов (ERBB2, GRB7, EGFR, FGFR4), группа генов, регулирующих пролиферацию, митоз, формирование веретена деления и регуляцию клеточного цикла (MKI67, MYBL2, CCNB1, AURKA, BIRC5, MYC, CCND1, CCNE1, CDKN2A, KIF14, PPP2R2A, PT-TG1, SFRP1, TMEM45B, TMEM45A, TPX2), группа генов, регулирующих миграцию клеток, инвазию, организацию цитоскелета (MMP11, CTSL2, EMSY, PAK1, ANLN), гены апоптоза (BCL2, BAG1, PTEN), группа генов, регулирующих репликацию и репарацию ДНК (TYMS, EXO1, UBE2T, TPT1), маркеры дифференцировки клеток и коэкспрессированные с ними гены (SCGB2A2, KRT5, MIA), факторы транскрипции (GATA3, FOXA1, ZNF703, NAT1), гены иммунной системы (CD68, TRAC, PD-L1).
Методика молекулярно-генетического исследования заключалась в предварительном выделении РНК c последующей амплификацией кДНК опухолевых образцов в режиме реального времени методом мультиплексной ПЦР. Для проведения молекулярно-генетического исследования парафиновые срезы толщиной 4,5 мкм в количестве 3 экземпляров помещали в сухие пластиковые пробирки объемом 1,5 мл. Перед выделением тотальной РНК проводили предварительную изоляцию парафина и обработку образцов протеиназой К с помощью набора реагентов «Проба-ПК», далее использовали наборы реагентов для выделения РНК «Проба НК-плюс», предусматривающие спиртовое осаждение нуклеиновых кислот. Полученные препараты РНК сразу использовали для постановки реакции обратной транскрипции (синтез кДНК из РНК). Амплификацию кДНК осуществляли в режиме реального времени с измерением уровня флуоресценции по каналам FAM и Cy5 (мультиплексная ПЦР) с использованием детектирующих амплификаторов «ДТпрайм» (приборное обеспечение и наборы производства ООО «НПФ ДНК-Технология», Россия). После завершения амплификации уровень представленности транскриптов рассчитывали методом сравнения индикаторных циклов (метод ∆Cq) с нормировкой относительно референсных генов В2М, GUSB, HPRT1.
Клинико-морфологические параметры представленных пациенток были опубликованы нами ранее в других работах [15, 16].
Формирование линейной дискриминантной функции проводили с помощью дискриминантного анализа. Средние значения экспрессии генов рассчитывали как меры центральной тенденции числового признака (экспрессия гена) с 95 % доверительным интервалом. Значимость влияния генов на риск развития ЛРР и отдаленных метастазов оценивали с помощью построения ROC-кривой. Взаимосвязь между генами, которые ассоциировались с повышенным риском развития ЛРР и отдаленных метастазов, с клинико-морфологическими параметрами проверяли с помощью корреляционного анализа (критерий χ2 Пирсона и ƿ Спирмена). Различия между сравниваемыми группами считали статистически значимыми при р<0,05. Для определения прогностической значимости генов проводили анализ общей выживаемости. После разделения обследуемых на группы с высокими и низкими значениями экспрессии генов проводили построение кривых Каплана–Майера. Различия между группами считали статистически значимыми при р<0,05 (логранговый критерий). Статистический анализ проводился с помощью персонального компьютера с использованием пакета прикладных программ Microsoft Excel 2010, «Статистика 19.0» (StatSoft Inc., USA), MedCalc (версия 20).
Результаты
В исследовании было зарегистрировано 12 пациенток с ЛРР (табл. 1). Случаев с отдаленными метастазами (МТС) было 34 (табл. 2). Методом пошагового отбора с исключением было отобрано 2 гена, которые статистически значимо влияли на риск возникновения ЛРР: PGR (p=0,007) и AR (p=0,001). В результате дискриминантного анализа была получена следующая модель (1):
YЛРР = 2,371 + 0,746×Х PGR – 0,498×X AR , (1)
где YЛРР – дискриминантная функция, характеризующая вероятность развития ЛРР; Х PGR – уровень экспрессии гена PGR ; X AR – уровень экспрессии гена AR .
Константа дискриминации (КД), разделяющая исследуемых на 2 группы, оказалась равной -0,553. Принадлежность пациенток к группе высокого или низкого риска ЛРР определялась, исходя из рассчитанных значений прогностической дискриминантной функции (1). При значении функции более -0,553 пациентка относилась к группе высокого риска ЛРР, при значении менее -0,533 – к группе низкого риска ЛРР. Чувствительность модели составила 66,7 %, специфичность –77,4 %.
Значимость влияния PGR и AR на риск развития ЛРР продемонстрирована при построении ROC-кривых (рис. 1). Площадь под ROC-кривой для PGR – 0,672 ± 0,083 с 95 % ДИ: 0,508–0,835. Полученная модель была статистически значимой (р=0,045). Пороговое значение PGR в точке cut-off равно -6,65. Чувствительность и специфичность метода для PGR – 75 и 59 % соответственно. Площадь под ROC-кривой для AR – 0,650 ± 0,092 с 95 % ДИ: 0,470– 0,832. Полученная модель не была статистически значимой (р=0,080). Пороговое значение AR в точке cut-off равно -4,15. Чувствительность и специфичность метода – 66,7 и 63 % соответственно
При оценке значимости генов, влияющих на риск возникновения отдаленных метастазов, методом шагового отбора с исключением был обнаружен один ген FOXA1 (p=0,001) . В результате дискриминантного анализа была получена следующая модель (2):
YМТС=2,037 + 0,493×Х FOXA1 , (2)
где YМТС – дискриминантная функция, характеризующая вероятность возникновения отдаленных метастазов; Х FOXA1 – уровень экспрессии FOXA1 .
Константа дискриминации, разделяющая исследуемых на 2 группы (с наличием отдаленных
Таблица 1/table 1
Распределение пациенток по локализации локорегионарного рецидива distribution of patients by location of locoregional relapse
|
Локализация локорегионарного рецидива/ Location of locoregional relapse |
Вид операции/Type of surgery |
Число случаев/Number of cases |
|
Послеоперационный рубец/Postoperative scar |
Радикальная мастэктомия/ Radical mastectomy |
10 (4,1 %) |
|
Молочная железа/Breast |
Органосохраняющие операции/ Organ-preserving surgeries |
2 (0,8 %) |
|
Не было рецидива/Absense of locoregional relapse |
Разные операции/ Different types of surgeries |
234 (95,1 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
Структура отдаленного метастазирования structure of distant metastasis
Таблица 2/table 2
|
Локализация МТС/Localization of metastasis |
Число случаев/Number of cases |
|
Кости/Bones |
2 (0,8 %) |
|
Легкие и плевра/Lungs and pleura |
2 (0,8 %) |
|
Печень/Liver |
2 (0,8 %) |
|
Головной мозг/Brain |
4 (1,6 %) |
|
Мягкие ткани грудной стенки/Soft tissues of chest wall |
4 (1,6 %) |
|
Множественные МТС/Multiple metastases |
20 (8,0 %) |
|
Не было метастазов/Absence of metastases |
212 (86,2 %) |
Примечание: таблица составлена авторами.
Note: created by the authors.
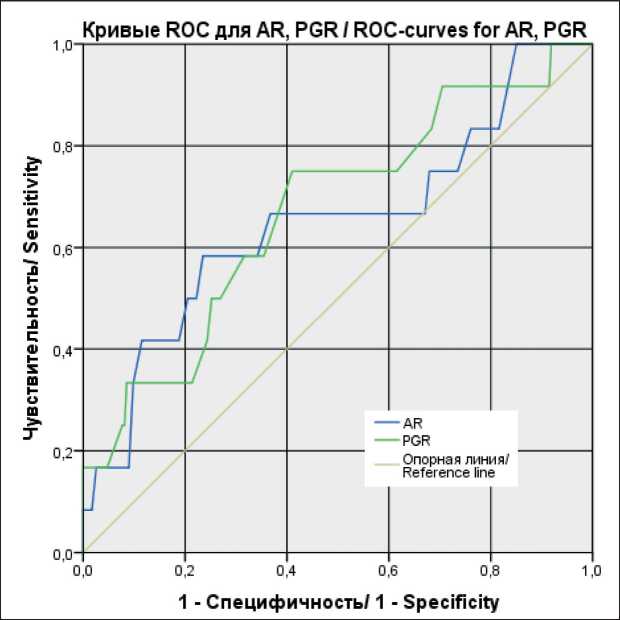
Рис. 1. SROC-кривыми, соответствующей взаимосвязи прогноза ЛРР и уровня экспрессии AR, PGR.
Примечание: рисунок выполнен авторами
Fig. 1. SROC-curves, corresponding relationship between the prognosis of LRR and the level of expression of AR, PGR. Note: created by the authors
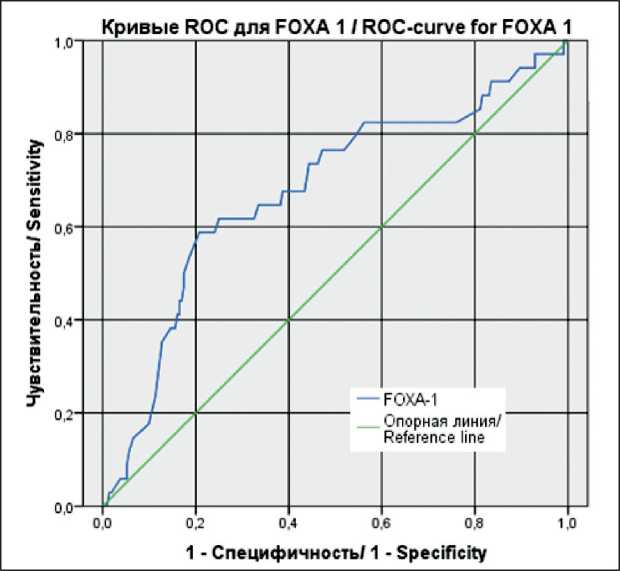
Рис. 2. SROC-кривой, соответствующей взаимосвязи прогноза отдаленных метастазов и уровня экспрессии FOXA1.
Примечание: рисунок выполнен авторами
Fig. 2. SROC-curve, corresponding relationship between the prognosis of distant metastases and the level of expression of FOXA1. Note: created by the authors
Кривые ROC для PGR, AR, FOXA 1 / ROC-curves
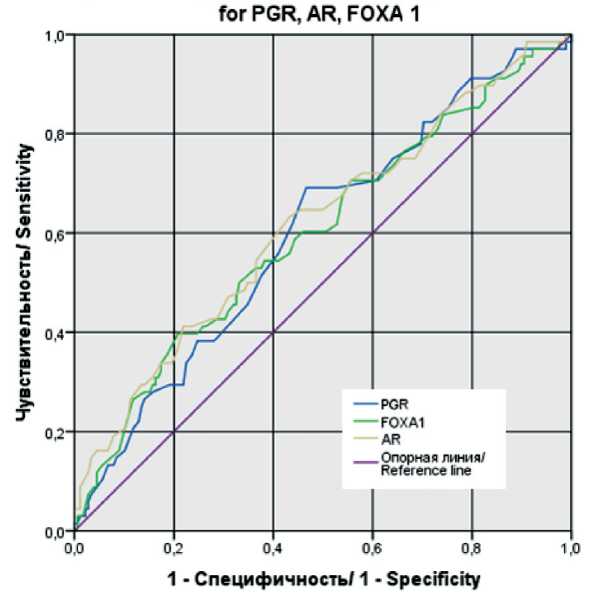
Рис. 3. SROC-кривыми, соответствующей взаимосвязи прогноза развития летального исхода и уровня экспрессии AR, PGR, FOXA1. Примечание: рисунок выполнен авторами Fig. 3. SROC-curves, corresponding relationship between the prognosis of the development fatal outcome and the level of expression of AR, PGR, FOXA1.
Note: created by the authors
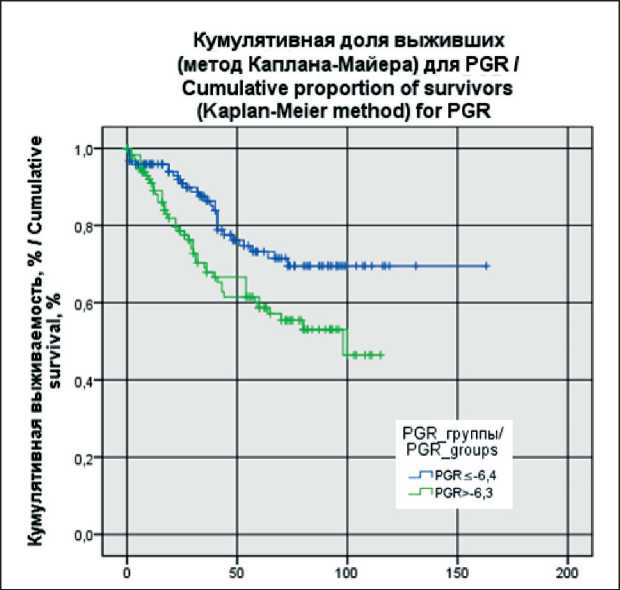
Рис. 4. Общая выживаемость в зависимости от уровня экспрессии PGR. Примечание: рисунок выполнен авторами Fig. 4 . Overall survival depending of the level of PGR expression. Note: created by the authors
метастазов и без них), составила 0,228. Принадлежность пациенток к группе высокого или низкого риска возникновения отдаленных метастазов определялась, исходя из рассчитанных значений прогностической дискриминантной функции (2):
при значении функции более 0,228 пациентка относилась к группе высокого риска отдаленного метастазирования, при значении менее 0,228 – к группе низкого риска. Чувствительность модели составила 64,7 %, специфичность – 66,5 %.
Значимость FOXA1 для прогнозирования риска развития метастазов при ТНРМЖ показана нами на примере построения ROC-кривой для данного гена (рис. 2). Площадь под ROC-кривой для FOXA1 составила 0,677 ± 0,053 с 95 % ДИ: 0,573–0,781. Полученная модель была статистически значимой (р=0,001). Пороговое значение FOXA1 в точке cutoff равно 4,25. Чувствительность и специфичность метода – 73,5 и 56 % соответственно.
Анализ выживаемости пациенток был выполнен на период 13.03.24. Всего в исследовании зарегистрировано 68 летальных исходов. Предварительно определяли пороговый уровень экспрессии анализируемых генов ESR, PGR, FOXA1 с помощью построения ROC-кривых (рис. 4). Пороговое значение уровня экспрессии PGR составило -6,4, для AR -4,7, для FOXA1 -4,4. В дальнейшем всех пациенток делили на группы с низкой и высокой экспрессией генов, исходя из полученных пороговых значений. Получены следующие кривые выживаемости (рис. 4–6).
Продемонстрировано, что пациентки с уровнем экспрессии генов ниже порогового уровня во всех представленных группах ( FOXA1 ≤-4,4; AR ≤-4,7; PGR ≤-6,4) имели лучшие показатели общей выживаемости. Различия между группами были статистически значимыми (log-rank test р=0,008 для PGR ; log-rank test р=0,005 для AR ; log-rank test р=0,033 для FOXA1 ).
Взаимосвязь экспрессии генов AR, PGR, FOXA 1 с клинико-морфологическими параметрами опухоли у пациенток с ТНРМЖ
Проводился корреляционный анализ между количественными клинико-морфологическими параметрами опухоли (возраст, степень злока- чественности опухоли (Grade), суммарный балл злокачественности (СБЗ), число метастатически пораженных лимфатических узлов, уровень пролиферативной активности опухоли Ki67). Были установлены статистически значимые прямые корреляционные связи между экспрессией анализируемых генов (PGR, AR, FOXA1) со степенью злокачественности опухоли (Grade), уровнем пролиферативной активности Ki67: Grade (rx =0,195, р=0,002), Ki67 (r =0,227, р=0,001) – для PGxRy; Grade (rxy=0,283, р=0,x0y01), Ki67 (rxy=0,369, р=0,001) – длyя AR; Grade (rx =0,268, р=0,0y01), Ki67 (rx =0,423, р=0,001) – для FxyOXA1. xy
Обсуждение
В настоящее время известно большое количество молекулярно-генетических параметров опухоли, на которые можно воздействовать с целью предотвращения рецидива или использовать их в качестве прогностических мишеней. Избранная нами генетическая панель (45 генов) для оценки прогноза ТНРМЖ основана на современных литературных данных. Некоторые гены, вошедшие в нашу панель, участвуют в регуляции пролиферативных процессов, митоза, формирования веретена деления и регуляции клеточного цикла ( MYC, CCNE1, CDKN2A ) и гены из группы апоптоза ( PTEN ) экспрессируются при BL-1 – подтипе, предложенном B.D. Lehmann et al. [13]. Для иммунного подтипа (IM) этой же классификации [13] характерна экспрессия PD-L1 генов, люминальный андрогенный ( LAR ) характеризуется гиперэкспрессией андрогеновых рецепторов и сигнальных путей, ассоциированных с ним [13].
Экспрессия АR при ТНРМЖ является перспективной мишенью для лекарственного воз-
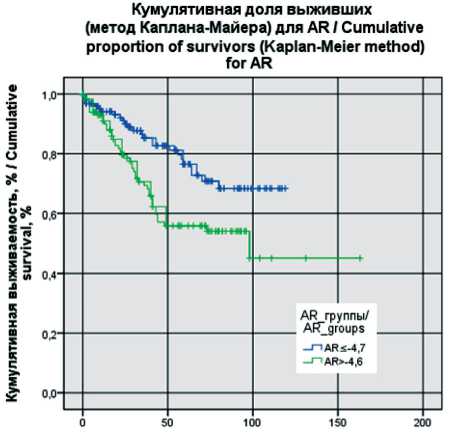
Рис. 5. Общая выживаемость в зависимости от уровня экспрессии AR. Примечание: рисунок выполнен авторами Fig. 5 . Overall survival depending of the level of AR expression. Note: created by the authors
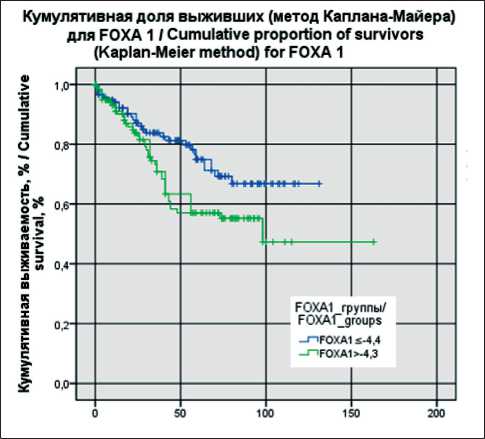
Рис. 6. Общая выживаемость в зависимости от уровня экспрессии FOXA1. Примечание: рисунок выполнен авторами Fig. 6 . Overall survival depending of the level of FOXA1 expression. Note: created by the authors
действия, однако убедительных данных о том, как этот параметр влияет на прогноз, в настоящее время не существует [20, 21]. Приводятся данные о перспективности использования в качестве предикторов прогноза при ТНРМЖ гена CCNB1 , который ассоциирован с экспрессией андрогеновых рецепторов [22].
Данных о взаимосвязи экспрессии ESR1 с риском прогрессирования ТНРМЖ в литературе крайне мало. Мы можем обратиться к ретроспективному исследованию, включавшему 488 пациенток с РМЖ различных подтипов, где было показано, что гены ESR1 и ESR2 могут влиять на риск ТНРМЖ [23].
Другими генами, которые коррелируют с экспрессией гормональных рецепторов (эстрогеновых, прогестероновых) у пациенток с ТНРМЖ, являются RHAMM, AURKA, TPX2, PLK1, PLK4 . Ген AURKA может быть использован как прогностический и терапевтический маркер [24].
Экспрессия FOXA2 , по данным A. Perez-Balaguer et al., ассоциируется с развитием рецидива у пациенток с ТНРМЖ [25]. Данных о взаимосвязи


