Молекулярно-генетический анализ верховки обыкновенной - Leucaspius delineatus (Heckel, 1843) из водоемов Республики Коми
Автор: Рафиков Р.Р., Шадрин Д.М., Пылина Я.И., Чадин И.Ф., Новоселов А.П.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Рубрика: Биологические науки
Статья в выпуске: 2 (22), 2015 года.
Бесплатный доступ
Проведено молекулярно-генетическое изучение верховки обыкновенной (Leucaspius delineatus (Heckel, 1843) бассейна р. Печора. Данные секвенирования участка мтДНК, кодирующего COI, свидетельствуют о едином механизме происхождения популяций данного вида на территории Республики Коми. AFLP анализ указывает на наличие генетической дифференциации исследованных образцов северо-восточной части ареала верховки обыкновенной. Коэффициент корреляции (0.5, p-value: 0.001) между матрицами генетических и географических расстояний популяций рыб также свидетельствует об их длительном обитании в бассейне р. Печора.
Верховка обыкновенная (leucaspius delineatus (heckel, бассейн р. печора, секвенирование гена coi мтднк, aflp анализ
Короткий адрес: https://sciup.org/14992749
IDR: 14992749 | УДК: 597.551.2:591.9
Текст научной статьи Молекулярно-генетический анализ верховки обыкновенной - Leucaspius delineatus (Heckel, 1843) из водоемов Республики Коми
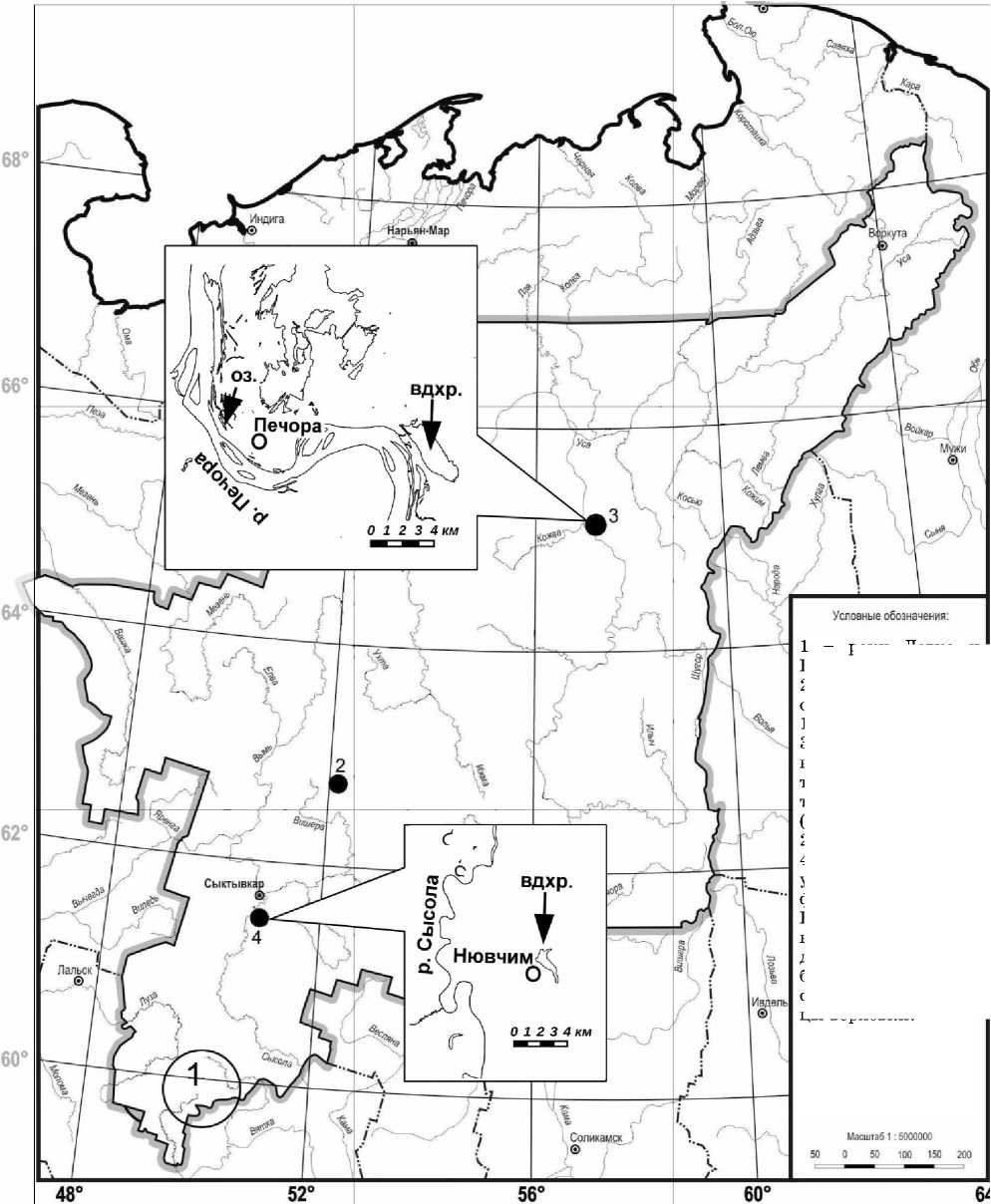
Верховка обыкновенная (Leucaspius delinea-tus (Heckel, 1843) относится к непромысловым рыбам семейства карповых и характеризуется невысокими линейно-весовыми параметрами. В ее аре- ал на территории России входят все реки, впадающие с юга в Балтику и некоторые озера бассейна р. Онега. В бассейнах Каспия – Волга, реки Дагестана до Кумы, Черного моря и Азова – Дон, Кубань и реки черноморского побережья [1]. В Республике Коми (РК) верховка до недавнего времени была отмечена лишь в некоторых водоемах рек Вычегда (оз. Синдорское, являющееся остатком большого приледникового водоема, существовавшего в период четвертичных оледенений на европейском Северо-Востоке) [2] и Кама (реки Летка и Кобра) [3]. Из-за её ограниченного распространения Л.С. Берг предположил, что этот вид относительно недавно проник в Северодвинский бассейн по системе каналов, связывающих его с Волго-Камским бассейном. В последующем вид был отмечен в некоторых малых реках (притоках 1 и 2 порядков), а также озерах-старицах верхнего и среднего течения р. Вычегда [4]. Недавние находки верховки в некоторых водоемах и водотоках среднего течения р. Печора позволяют расширить ее ареал на северо-восток (рис. 1) [5].
Известно, что естественным барьером для распространения данного вида рыб на азиатскую часть территории России являются Уральские горы. Однако с развитием сети рыбоводных хозяйств стал возможен инвазийный механизм расселения. В научной литературе есть сведения о непреднамеренной интродукции верховки с последующим ее саморасселением в различных водоемах Сибири [6–10]. На территории Печорской ГРЭС (ПГРЭС), расположенной в среднем течении р.Печора, в 90-х гг. прошлого столетия также действовало тепловодное рыбоводное хозяйство. В результате интродукции в водоеме-охладителе электростанции (водохранилище наливного типа, созданное на базе двух естественных водоемов) образовались локальные самоподдерживающиеся группировки вер-ховки Leucaspius delineatus (Heckel, 1843), уклейки Alburnus alburnus (Linnaeus, 1758) и карпа Cyprinus carpio (Linnaeus, 1758). В то же время более широкая география находок верховки обыкновенной в Печорском районе, а также соответствие ряда счетных признаков (количество позвонков, поперечных рядов чешуй и чешуй в боковой линии) в выборках рыб бассейна р.Печора общей географической закономерности изменения этих показателей, свидетельствуют об ее длительном обитании в изучаемом районе [5].
Исходя из вышеизложенного, цель настоящего исследования – определить степень генетической дифференциации популяций верховки обыкновенной Leucaspius delineatus (Heckel, 1843) из водоемов республики для выявления механизма их заселения. Подобный подход позволяет существенно углубить зоогеографические исследования и расширить представления о путях формирования ихтиофауны бассейнов рек всего европейского Северо-Востока России.
Материал и методы
Для оценки генетической дифференциации популяций верховки был проведен филогенетический анализ с использованием определения последовательности (секвенирования) участка митохондриального гена субъединицы 1 цитохромоксидазы (COI мтДНК) и анализа полиморфизма длин ам-плифицированных фрагментов ДНК (AFLP – Amp- lified Fragment Length Polymorphism). Проанализированы две выборки из среднего течения р. Печора: по 15 образцов мышечной ткани рыб из водоема-охладителя ПГРЭС (географические координаты: N065°06'58.5, E057° 21'13.0) и находящегося на удалении 15 км от озера в пойме р. Печора (географические координаты N065°07'57.6, E057°04'15). Из среднего течения р.Вычегда исследовано шесть образцов, пойманных в водохранилище (географические координаты: N061°23'41.5, E050°45'16.2) у пос. Нювчим, образованном на месте слияния рек Нювчим и Дендель – притоков второго порядка р. Вычегда (рис. 1). Расстояния между популяциями для матрицы географических дистанций были измерены по «дуге большого круга» по географическим координатам.
Тотальная ДНК была выделена с помощью набора FastDNA Spin Kit (QBioGene) согласно инструкциям производителя. Определение нуклеотидной последовательности амплифицированного участка мтДНК выполнено на генетическом анализаторе ABI PRISM 310 (Applied Biosystems) с использованием праймеров Fish F1: 5'-TCAACCAACCACAAA GACATTGGCAC-3' и Fish R2: 5'-TAGACTTCTGGG TGGCCAAAGAATCA-3' [11]. Выравнивание и анализ нуклеотидных последовательностей проводили в пакете программ MEGA 6.0. [12].
В AFLP анализе использовали рестриктазы EcoRI и MseI вместе с последовательностями адаптеров EcoRI и MseI. Смесь для реакции рестрикции-лигирования включала (на 10 реакций): 10 мкл T4 DNA Ligase buffer, 10 мкл NaCl (0,5 М), 5 мкл BSA (1 мг/мл), 10 мкл MseI adaptor, 10 мкл EcoRI adaptor и 10 мкл Enzyme Master Mix (на 10 реакций), состоящий из 1 мкл 10X T4 DNA Ligase buffer, 1 мкл NaCl (0,5 М), 5 мкл рестриктазы EcoRI, 1 мкл рестрикта-зы MseI, 0,5 мкл BSA (1 мг/мл), 0,5 мкл T4 DNA Ligase, 1 мкл воды без нуклеаз. Затем к 5,5 мкл смеси для реакции рестрикции-лигирования добавляли 5,5 мкл раствора ДНК (0,1 мкг/мкл) и инкубировали в течение 3 час при 37 ºС. После этого проводили преселективную амплификацию (преамплификация) с продуктом реакции рестрикции-лигирования, предварительно разбавленным в пять раз буфером ТЕ (20 ммоль TrisHCL, 0,1 ммоль EDTA, pH 8,0). Смесь для преселективной ПЦР включала: 2 мкл разбавленного продукта реакции рестрикции-лигирования, 0.5 мкл AFLP преселексив-ной пары праймеров (Applied Biosystems) и 7.5 мкл AFLP Core Mix (Applied Biosystems). Условия реакции преамплификации: 72ºС – 2 мин, 30 циклов (94 ºС -20 с, 56 ºС – 30 с, 72 ºС – 2 мин) и 60 ºС – 30 мин.
Затем проводили селективную амплификацию с продуктом реакции преамплификации, предварительно разбавленным в пять раз буфером ТЕ. Для реакции селективной амплификации были использованы три комбинации праймеров: EcoRI-AAG (меченый)/MseI-CAA, EcoRI-AGG (меченый) /MseI-CAT и EcoRI-ACG (меченый)/MseI-CTT. Смесь для селективной ПЦР включала: 1.5 мкл разбавленного продукта преселективной амплификации, 0.5 мкл EcoRI флуоресцентно меченого праймера, содержащего на своем конце три селективных нуклеотида (Applied Biosystems), 0.5 мкл MseI прайме-
озеро Синдор-
– малые реки и
– водохранилище
– ское (Зверева и др., 1955), водоемы поймы, а также водоем-охладитель Печорской ГРЭС (Бознак, Захаров, 2009),
Рис. 1. Сведения о находках верховки обыкновенной Leucaspius delineatus (Heckel, 1843) в водоемах Республики Коми из опубликованных литературных источников.
реки Летка и Кобра (Берг, 1949),
у пос. Нювчим (Рафиков, 2012).
На выносках стрелками обозначены во доемы, в которых были выловлены исследованные образцы верховки.
ра (Applied Biosystems) и 7.5 мкл AFLP Core Mix (Applied Biosystems). Условия реакции селективной амплификации были следующими: 94 ºС – 2 мин, 10 циклов (94 ºС – 20 с, 66 ºС (-1 ºС/цикл) – 30 с, 72 ºС – 2 мин), 20 (94 ºС – 20 с, 56 ºС – 30 с, 72 ºС – 2 мин) и 60 ºС – 30 мин. Далее проводили денатурацию продукта селективной амплификации с использованием формамида (Applied Biosystems) в течение 5 мин при 95 ºС. Реакционная смесь содержала 9,25 мкл формамида, 0,25 мкл стандарта GeneScan ROX 500 (Applied Biosystems) и 0,5 мкл продукта реакции селективной амплификации. Затем полученные образцы анализировали на генетическом анализаторе ABI PRISM 3500 (Applied Biosystems). Полученные хроматограммы были обработаны с использованием внутреннего стандарта в программе GeneMapper 5.0 (Applied Biosystems) для установления длин полученных фрагментов. Затем фрагменты, различающиеся по длине менее чем на одну пару нуклеотидов (п. н.), были объединены вручную. В анализ включены фрагменты размером от 50 до 500 п. н. Наличие или отсутствие фрагментов кодировалось как «1» или «0», соответственно.
Статистический анализ данных AFLP проводили с использованием иерархической кластеризации методом Уорда на основе матрицы сходства, рассчитанной с использованием коэффициента Жаккарда в программной среде R [13]. В ней проверяли и статистическую значимость гипотезы «Iso-lation by distance» с использованием теста Мантела [14] для оценки корреляции между матрицами генетических и географических дистанций.
Кластеризацию на основе модели, описанной в работе [15], выполняли с помощью программы STRUCTURE v. 2.34 [15]. В качестве исходных данных использована бинарная матрица, содержащая сведения о 318 AFLP локусах 36 образцов верховки обыкновенной. В настройках программы было указано: не использовать данные о географическом происхождении образцов; применить «Admixture model» (модель, допускающую обмен генетической информацией между кластерами); количество итераций – 100 тыс. С такими настройками программа запускалась по 35 раз для каждого априорного значения числа кластеров (K) в диапазоне от 1 до 9. Остальные настройки были указаны в соответствии с рекомендациями авторов программы STRUCTURE для анализа доминантных маркеров [16]. Наиболее вероятное значение K (число генетически однородных кластеров) определяли методом, предложенным в работе [17]. Для численной оценки однородности результатов, полученных при независимых запусках STRUCTURE, использовали программу CLUMPP [18]. Визуализацию результатов расчета проводили с помощью программы DISTRUCT [19]. Молекулярногенетическое исследование образцов верховки выполнено на базе ЦКП «Молекулярная биология» Института биологии Коми НЦ УрО РАН (г. Сыктывкар).
Результаты исследований
В основе популяционных исследований живых организмов с помощью методов молекулярной биологии лежит выявление степени полиморфизма отдельных групп. В пределах ранга вида наиболее информативными являются рестрикционный анализ нуклеотидной последовательности ядерной ДНК и секвенирование отдельных генов мтДНК. Известно, что «не кодирующая» часть ядерного генома, ввиду меньшего селективного ограничения, более изменчива и ее скорость мутирования в два раза выше по сравнению с кодирующей [20]. Это увеличивает уровень выявляемого полиморфизма, а соответственно разрешающую способность метода и воспроизводимость полученных результатов.
Полученные последовательности участка мтДНК, кодирующего ген субъединицы 1 фермента цитохром оксидазы (COI) всех исследуемых образцов, зарегистрированы в базе данных GenBank национального центра биотехнологической информации США (KP 794941 – KP794948) [21]. Анализ указанных последовательностей выявил абсолютную идентичность их нуклеотидного состава (рис. 2). Отсутствие изменчивости данного гена в популяциях верховки обыкновенной из разных речных бассейнов республики, может указывать на быстрое расселение указанного вида. Учитывая высокую степень консервативности ген-кодирующей последовательности, расселение могло происходить несколько тысячелетий назад. По-видимому, в случае непреднамеренной интродукции (инвазийный механизм) с посадочным материалом на рыбоводное хозяйство ПГРЭС наблюдался бы некоторый нуклеотидный полиморфизм гена COI.
KP794947-Vichegda
KP794948-Vichegda
KP794946-Pechora
KP794945-Pechora
KP794944-Pechora
KP794943-Pechora
KP794942-Pechora
KP794941-Pechora
AP009307.1-France: Dombes near Leon
NC020357.1-France: Dombes near Leon
KJ.1-France: Rhone drainage
KJ 128525.1-Sweden
KJ 128524.1-Sweden
HQ961052.1-Czech Republic
HQ961053.1-Czech Republic
KJ553907.1-Turkey: Izmit drainage
I HQ961054.1-Czech Republic
HQ961055.1-Czech Republic
HQ961056.1-Czech Republic
—KJ552433.1-Alburnus alburnus France: Rhone drainage
0.0005
Рис. 2. Филогенетическое древо, построенное методом NJ (объединение ближайших соседей) на основании последовательностей COI мтДНК образцов Leucaspius delineatus (Heckel, 1843) и Alburnus al-burnus (Linnaeus, 1758) в качестве внешней группы.
При выполнении анализа длин квалифицированных фрагментов ДНК верховки три комбинации селективных праймеров позволили выявить 318 AFLP маркеров (локусов) длиной от 50 до 500 п.н. Определенные с помощью программы GenAlEx v. 6.501 популяционные показатели представлены в таблице. На основании анализа всех частот аллелей локусов AFLP 36 проанализированных образцов верховки обыкновенной из трех разноудален-
Результаты AFLP-анализа исследованных образцов, полученные с помощью программы GenAlEx v. 6.501
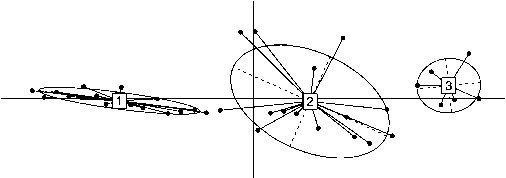
Рис. 4. Визуализация результатов анализа AFLP-маркеров Leucaspius delineatus (Heckel, 1843) из трех водоемов Республики Коми методом главных компонент. 1 – озеро пойменное (р. Печора), 2 – водоем-охладитель Печорской ГРЭС, 3 – водохранилище Нювчимское (р. Нювчим, бассейн р. Сысола).
кладу. Тем не менее, анализ главных компонент, проведенный с бинарными данными AFLP анализа в программной среде R, показал значимую обособленность исследуемых популяций (рис. 4).
Эти результаты были поддержаны анализом с применением методов байесовской статистики. С использованием алгоритма, описанного в работе [17], определили наиболее вероятное число генетических кластеров, равное 3. Это значит, что из проанализированных 36 образцов по данным AFLP анализа было выделено 3 ДНК-группы, обладающих генетическим своеобразием (рис. 5).
Результаты байесовского анализа в программе «STRUCTURE», основанного на составе AFLP-локусов, также свидетельствуют о высокой вероятности разделения исследованных рыб из пой-
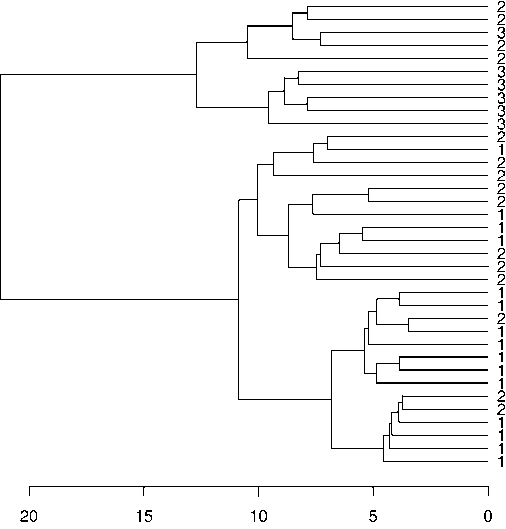
Рис. 3. Дендрограмма сходства образцов Leucaspius delineatus (Heckel, 1843), построенная на основе данных AFLP анализа (матрица сходства рассчитана с использованием эвклидова расстояния, иерархическая кластеризация выполнена с использованием метода Уорда). Происхождение образцов: 1 – озеро пойменное (р. Печора), 2 – водоем-охладитель Печорской ГРЭС, 3 – водохранилище Нювчимское (р. Нювчим, бассейн р. Сысола).
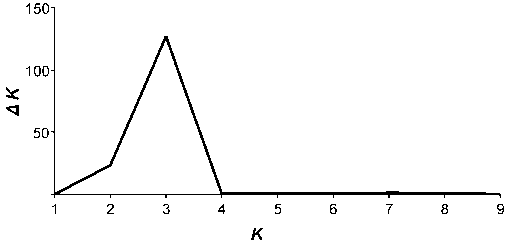
Рис. 5. Результаты байесовского анализа с помощью программы «STRUCTURE v. 2.34» состава AFLP-локусов 36 образцов Leucaspius delineatus (Heckel, 1843) различного географического происхождения. Определение наиболее вероятного числа кластеров (K) по величине Δ K.
менного озера (р. Печора) и Нювчимского водохранилища (рис.6). Часть особей, отобранных из водоема-охладителя ПГРЭС (5 экз.), могут быть классифицированы как «вычегодские», остальные – как «печорские».
Удобной количественной характеристикой при сравнении популяций является величина генетического расстояния между ними. Чаще всего используют стандартное генетическое расстояние Нея [22]. Такое генетическое расстояние между проанализированными группами (Nei Distance) варьировало от 0,04 до 0,118. Дистанция между выборками из Печорского бассейна была наименьшей. Это объясняется незначительным физическим расстоянием и свидетельствует о более близкой связи между данными группировками. Степень иден-
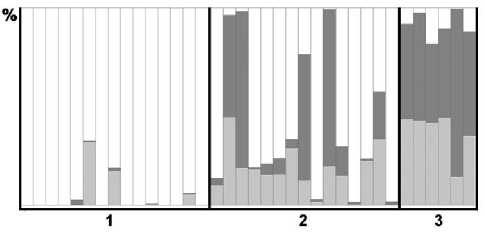
Рис. 6. Результаты байесовского анализа с помощью программы «STRUCTURE v. 2.34» состава AFLP-локусов 36 образцов Leucaspius delineatus (Heckel, 1843) различного географического происхождения. Ось абсцисс - номера выборок и код их географического происхождения (1 – озеро пойменное (р. Печора), 2 – водоем-охладитель Печорской ГРЭС, 3 – водохранилище Нювчимское (р. Нювчим, бассейн р. Сысола). Ось ординат - вероятность (%) кластеризации исследуемых образцов на группы по составу AFLP-локусов. Для подготовки рисунка использована усредненная Q-матрица, полученная с помощью программы «CLUMPP v. 1.1.2».
тичности исследованных популяций из бассейнов рек Печора и Вычегда меньше, чем в пределах Печорского бассейна. Это свидетельствует о длительном отсутствии обмена генетической информацией между популяциями вследствие давней изоляции речных бассейнов.
Обсуждение результатов
Реки северного склона Русской равнины (Печора, Вычегда) на всем своем протяжении располагаются в области покрытия льдами максимального оледенения. На территории европейского Северо-Востока России расселение верховки могло происходить в период отступания льдов максимального оледенения. Участок среднего течения р. Печора в то время был представлен тремя крупными озерами (Троицко-Печорское, Лебяжское и Усинское). По существующим предположениям, до формирования Камо-Печоро-Вычегодских водоразделов часть стока этих озер была направлена в р. Кама (р. Вель – приток р. Печора рассматривается как верховье Пракамы). Верховье р.Печора, развивавшееся изолированно со времен доледниковья, в отдельные периоды также имело сток в Каму по долинам рек Нем, Вычегда и Северная Кельтма [23].
Интересным фактом является область распространения леща в бассейне р. Печора, большая часть которого приурочена к магистральному руслу и водоемам среднего и большей части нижнего течения реки. Лещ и верховка – единственные в р.Пе-чора представители понто-каспийского фаунистического комплекса (теплолюбивые виды рыб, адаптированные к жизни в реках Понто-Каспия). По данным Г.В.Никольского [24], в теплые фазы после-ледниковья представители этого комплекса могли иметь более широкое распространение в бассейне Северного Ледовитого океана, однако вследствие изменения условий численность их значительно сократилась.
В пользу гипотезы о длительном обитании верховки обыкновенной в водоемах бассейна р.Печора также свидетельствует и результат теста Мантела, оценивающего корреляцию между матрицами генетических и географических дистанций (999 повторов; коэффициент корреляции между матрицами – 0,5; p-value: 0,001). Необходимо отметить явную гетерогенность проанализированного материала. Рыбы из пойменного озера характеризуются минимальной величиной полиморфизма, а также статистически значимо отличаются от остальных групп по таким показателям, как ожидаемая гетерозиготность (H e и uH e ), число эффективных аллелей (N e ) и информационный индекс Шеннона (I) (см. таблицу). Данный водоем расположен в пойме р. Печора и большую часть года соединяется с ней протокой, а при весеннем половодье и заливается водами реки. Возможно, его заселение небольшим числом экземпляров верховки произошло относительно недавно. Это и могло бы объяснить низкое генетическое разнообразие данной группировки (эффект основателя). По мнению авторов [25], описывающих процесс инвазийного заселения верховкой некоторых водоемов на территории Англии, основную роль в ряде случаев играли рыбаки-любители. При этом главный предполагаемый механизм – перемещение икры и молоди рыб из водоема в водоем вместе с различным снаряжением (сети, неводы, садки), используемым в процессе рыбной ловли. Необходимо отметить, что нерестовый период у данного вида рыб длится все лето (порционное икрометание) и, как показала практика, в качестве нерестового субстрата могут использоваться сетные и удилищные поплавки, дно лодки и прочие предметы. Кладка икринок имеет вид строчек шириной в 1-2 икринки и приклеена к субстрату достаточно прочно. Существует небольшая вероятность того, что при быстром переезде на другой водоем (во влажных условиях) оплодотворенные икринки действительно могут попасть в воду и продолжить свое развитие.
Основными факторами, влияющими на генетическую структуру популяций, являются генетический дрейф, поток генов и естественный отбор [26]. Для водоема-охладителя ПГРЭС установлен факт интродукции и образования устойчивых группировок уклейки и карпа. Вместе с указанными видами в этот водоем могла попасть и верховка. Однако в случае исключительно инвазийного происхождения данного вида генетическое разнообразие изучаемого материала могло быть очень низким вследствие проявления «эффекта основателя». Возможно, изменение генетической структуры вызвано привнесением дополнительного генетического материала к уже существующей популяции.
Водоем-охладитель Печорской ГРЭС характеризуется непостоянным гидрохимическим и термическим режимами, зависящими от технологических процессов электростанции [27]. Влияние измененного температурного и химического режимов проявляется на различных уровнях организации: от дефектов развития у отдельных особей разных ви- дов рыб до исчезновения типичных видов (щука, плотва, окунь) из структуры рыбной части сообщества в целом [28,29]. Устранение прямого действия отбора (прессинг хищника) при оптимальных (для верховки) температурных параметрах среды также может способствовать изменению генетического разнообразия популяций рыб.
Генетическая выборочность при небольших объемах проанализированного материала в популяционном анализе может в свою очередь повлиять на результаты исследования. Так, например, значительная доля (81 %) молекулярной дисперсии (AMOVA) приходится на внутрипопуляционную генетическую изменчивость проанализированных особей, что свидетельствует о значительной разнородности исследованного генетического материала.
Таким образом, данные секвенирования участка мтДНК, кодирующего субъединицу 1 фермента цитохромоксидазы, свидетельствуют о едином механизме происхождения популяций верховки обыкновенной. Анализ полиморфизма длин амплифи-цированных фрагментов позволяет заключить, что проанализированные выборки генетических проб верховки характеризуются явным генетическим своеобразием. Уровень изменчивости генетических и морфологических признаков данного вида, наблюдаемый при продвижении на северо-восток Республики Коми, по-видимому, отражает процесс его естественного расселения и адаптации к условиям внешней среды. Корреляция между матрицами генетических и географических расстояний также говорит в пользу предложенной нами гипотезы.
Список литературы Молекулярно-генетический анализ верховки обыкновенной - Leucaspius delineatus (Heckel, 1843) из водоемов Республики Коми
- Берг Л.С. Рыбы пресных вод СССР и сопредельных стран. М.-Л.: Изд-во АН СССР, 1949. Т. 2. С. 469-925.
- Зверева О.С., Кучина Е.С., Соловкина Л.Н. Рыбные богатства Коми АССР и пути их освоения. Сыктывкар: Коми книжн. изд-во, 1955. 106 с.
- Атлас пресноводных рыб России: в 2 т. Т. 2/Под ред. Ю.С.Решетникова. М.: Наука, 2002. 253 с.
- Рафиков Р.Р. Формирование рыбного населения искусственных водных объектов Республики Коми//Актуальные проблемы биологии и экологии: Материалы XIX Всероссийской молодежной науч. конференции (Сыктывкар, Республика Коми, Россия, 4-8 апреля 2012 г.). Сыктывкар, 2012. С. 94-96.
- Бознак Э.И., Рафиков Р.Р. О находках уклейки (Alburnus alburnus) и верховки (Leucaspius delineatus) в водоемах бассейна р. Печора//Проблемы изучения и охраны животного мира на Севере: Материалы докладов Всероссийской науч. конференции с международ. участием (Сыктывкар, Республика Коми, Россия, 16-20 ноября 2009 г.). Сыктывкар, 2009. С. 34-35.
- Интересова Е.А. Верховка Leucaspius delineatus (Cyprinidae) в водоемах юга Западной Сибири//Вопросы ихтиологии. 2012. Т. 52. № 3. С. 352-357.
- Корляков К.А., Дубчак К.А. Продукционная и паразитологическая характеристика чужеродных короткоцикловых рыб водоемов восточного склона Южного Урала//Экология. 2010. № 4. С. 312-316.
- Понкратов С.Ф. Инвазии чужеродных видов рыб в бассейн ангарских водохранилищ//Российский журнал биологических инвазий. 2013. № 4.
- Попов П.А. Характеристика ихтиоценозов водохранилищ Сибири//География и природные ресурсы. 2012. № 3. С. 77-84.
- Терещенко В.Г., Терещенко О.В. Трифонова Л.И. Формирование структуры рыбного населения водохранилища при интродукции новых видов рыб с первых лет его существования//Вопросы ихтиологии. 2004. Т. 44. №5. С. 619-631.
- Ward R.D., Zemlak T.S., Innes B.H. еt аl. Barcoding Australia’s fish species//Philosophical Transactions of the Royal Society B 360. 2005. P. 1847-1857.
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0.//Molecular Biology and Evolution. 2013. № 30. P. 2725-2729.
- R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing. Vienna, Austria, 2014.
- Mantel N. The Detection of Disease Clustering and a Generalized Regression Approach//Cancer Research. 1967. Vol. 27. № 2. P. 209-220.
- Pritchard J. K., Stephens M., Donnelly P. Inference of Population Structure Using Multilocus Genotype Data//Genetics. 2000. Vol. 155. № 2. P. 945-959.
- Pritchard J.K., Wen W., Falush D. Documentation for STRUCTURE software: version 2.3. 2010. 38 p.
- Evanno G., Regnaut S., Goudet J. Detecting the number of clusters of individuals using the software structure: a simulation study//Molecular Ecology. 2005. Vol. 14. № 8. P. 2611-2620.
- Jakobsson M., Rosenberg N.A. CLUMPP: a cluster matching and permutation program for dealing with label switching and multimodality in analysis of population structure//Bioinformatics. 2007. Vol. 23. № 14. P. 1801-1806.
- Rosenberg N.A. DISTRUCT: a program for the graphical display of population structure//Mol. Ecol. Notes. 2003. Vol. 4. № 1. P. 137-138.
- Nei M. Molecular Evolutionary Genetics. New York: Columbia University Press, 1987.
- GenBank Home. Электронный ресурс:(https://www.ncbi.nlm.nih.gov/genbank/).
- Вейр Б. С. Анализ генетических данных. М., 1995. 400 с.
- Зверева О.С. Особенности биологии главных рек Коми АССР. Л.: Наука, 1969. 279 с.
- Никольский Г.В. К истории ихтиофауны бассейна Белого моря//Зоологический журнал. 1943. Т. 22. №. 1. С. 27-32.
- Zieba G., Copp, G.H., Davies, G.D. еt аl. Recent releases and dispersal of non-native fishes in England and Wales, with emphasis on sunbleak Leucaspius delineates//Aquatic Invasions. 2010. № 5. P. 155-161.
- Алтухов Ю. П. Генетические процессы в популяциях. М.: Академкнига, 2003. 431 с.
- Бознак Э.И., Захаров А.Б. Рыбное население индустриального водоема в условиях многофакторного антропогенного воздействия//Современные проблемы водохранилищ и их водосборов: в 2 т. Т.2: Управление водными ресурсами речных водосборов. Водная экология/Труды Междунар. научно-практ. конф. (26 мая -28 мая 2009 г., г.Пермь)/Перм. гос. ун-т. Пермь, 2009. С. 220 -224.
- Рафиков Р. Р. Оценка экологического состояния водоема-охладителя Печорской ГРЭС по данным анализа флуктуирующей асимметрии//Проблемы изучения и охраны животного мира на Севере: Материалы докладов II Всероссийской науч. конференции с международ. участием (Сыктывкар, Республика Коми, Россия, 8-12 апреля 2013 г.). Сыктывкар, 2013. С. 177-179.
- Рафиков Р. Р. Особенности рыбного населения индустриального водоема в бассейне р. Печора//Экологические проблемы северных регионов и пути их решения: Материалы докладов 5-й Всероссийск. науч. конференции с международ. участием (Апатиты, Мурманская область, Россия, 24-27 июня 2014 г.). Апатиты, 2014. С. 212-215.


