Молекулярно-клеточные механизмы влияния вирусов папилломы человека на чувствительность злокачественных опухолей к лучевой терапии. Обзор
Автор: Замулаева И.А., Гусарова В.Р., Каприн А.Д.
Рубрика: Научные статьи
Статья в выпуске: 3 т.33, 2024 года.
Бесплатный доступ
Представлен обзор данных научных публикаций и результатов собственных исследований, посвящённых выяснению молекулярно-клеточных механизмов влияния вирусов папилломы человека (ВПЧ) на эффективность лучевой терапии (ЛТ) ВПЧ-ассоциированных злокачественных новообразований, включая прежде всего, рак шейки матки и орофарингеальной зоны. Данные систематизированы с точки зрения влияния ВПЧ на 6 основных факторов - т.н. 6R, определяющих ответ клеток/тканей на фракционированное облучение и, в конечном итоге, влияющих на эффективность ЛТ (репарация, реоксигенация, перераспределение по фазам клеточного цикла - «redistribution», репопуляция, радиочувствительность, реактивация иммунного ответа). По сравнению с ВПЧ-негативными опухолями, ВПЧ-позитивные демонстрируют более высокую чувствительность к редкоионизирующему излучению вследствие снижения эффективности гомологичной репарации повреждений ДНК (R1), более высокой оксигенации и подавления антиоксидантной защиты (R2), нарушений контроля клеточного цикла (R3), особенностей регуляции пула опухолевых стволовых клеток, обеспечивающих пострадиационную репопуляцию (R4), более высокой внутренней радиочувствительности (R5). Вирусные белки E6 и E7 обладают широким спектром действия на состояние врождённого и адаптивного противоопухолевого иммунитета, поэтому иммунологический профиль ВПЧ-позитивных и ВПЧ-негативных опухолей существенно различается, как и эффективность комбинированной радиоиммунотерапии онкологических больных с различным ВПЧ-статусом. Однако влияние ВПЧ на реактивацию противоопухолевого иммунного ответа (R6) в ходе фракционированного облучения изучено недостаточно. Таким образом, ВПЧ оказывают существенное влияние практически на все известные факторы, определяющие эффективность ЛТ с использованием редкоионизирующих излучений (воздействуют, по крайней мере, на 5 из 6R). Анализ механизмов такого влияния позволяет предположить, что при использовании плотноионизирующих излучений различия в эффективности ЛТ ВПЧ-позитивных и ВПЧ-негативных опухолей могут, по крайней мере частично, нивелироваться.
Вирус папилломы человека, лучевая терапия, рак шейки матки, орофарингеальный рак, 6r радиобиологии, радиочувствительность, репарация, повреждения днк, окислительный стресс, опухолевые стволовые клетки
Короткий адрес: https://sciup.org/170206288
IDR: 170206288 | УДК: 616-006.6-085.849.1:578.827.1 | DOI: 10.21870/0131-3878-2024-33-3-123-142
Текст научной статьи Молекулярно-клеточные механизмы влияния вирусов папилломы человека на чувствительность злокачественных опухолей к лучевой терапии. Обзор
Вирусы папилломы человека (ВПЧ) высокого канцерогенного риска обнаруживаются в злокачественных новообразованиях (ЗНО) различных локализаций. Так, при плоскоклеточном раке шейки матки (РШМ) ВПЧ 16,18 и других типов обнаруживаются в 85-98% случаев, при аденокарциноме шейки матки – в 70-85% случаев [1-6]. При орофарингеальном раке (ОФР) доля ВПЧ-позитивных случаев составляет 22-55% [7-9] в зависимости от метода идентификации ВПЧ, географической зоны, возраста пациентов, а по некоторым данным доля ВПЧ-ассоциированных ОФР может достигать 70% [1]. В результате мета-анализа распространённости ВПЧ при раке
Замулаева И.А.* - зав. отд., д.б.н., проф.; Гусарова В.Р. - аспирант. МРНЦ им. А.Ф. Цыба - филиал ФГБУ «НМИЦ радиологии» Минздрава России. Каприн А.Д. – ген. директор, директор МНИОИ им. П.А. Герцена, зав. каф. РУДН, акад. РАН, д.м.н., проф. ФГБУ «НМИЦ радиологии» Минздрава России.
толстой, прямой кишки и анального канала показано, что доля ВПЧ-позитивных случаев широко варьирует, составляя от 15-52% при колоректальном раке до 97% при раке анального канала [10-12]. ВПЧ высокого канцерогенного риска найдены и при исследовании урогенитальных ЗНО, включая рак полового члена, предстательной железы, мочевого пузыря и др., хотя доля ВПЧ-позитивных случаев была существенно ниже, чем при РШМ или ОФР [12, 13].
Принято считать, ВПЧ-инфекция не только является важным этиологическим фактором возникновения ЗНО большинства указанных локализаций (прежде всего, РШМ и ОФР), но и способна влиять на чувствительность к противоопухолевой терапии, важным компонентом которой является радиационное воздействие. Как хорошо известно, для РШМ и ОФР ВПЧ-позитивные ЗНО демонстрируют более высокую чувствительность к лучевой терапии (ЛТ) с использованием редкоионизирующих излучений по сравнению с таковой ВПЧ-негативных опухолей [1, 6, 14-16]. Более того, для ОФР получены доказательства клинической полезности выявления ВПЧ-позитивных случаев с целью выбора оптимальной схемы лечения, включая возможную деэскалацию доз ЛТ [17-19]. В целом изучение радиочувствительности ЗНО в зависимости от ВПЧ-статуса является важным направлением совершенствования ЛТ в плане разработки персонализированных методов лечения, а выяснение механизмов влияния ВПЧ на радиочувствительность – одной из ключевых проблем радиационной онкологии в плане поиска новых подходов к лечению. В связи с высокой актуальностью и научно-практической значимостью этих проблем, а также быстрым накоплением данных на молекулярно-клеточном уровне, целью данного обзора является анализ влияния ВПЧ-статуса на реализацию 6R радиобиологии как основных факторов, обеспечивающих более высокую чувствительность ВПЧ-позитивных ЗНО к ЛТ по сравнению с ВПЧ-негативными.
Известно, что молекулярные особенности ВПЧ-инфекции (генотип, вирусная нагрузка и интеграция ДНК ВПЧ в клеточный геном) могут оказывать существенное влияние на радиочувствительность опухолевых клеток и эффективность ЛТ, но являются предметом отдельного обсуждения и в данном обзоре не рассматриваются.
Результаты и обсуждение
Процессы (или факторы), определяющие ответ клеток/тканей на фракционированное облучение и, в конечном итоге, влияющие на эффективность ЛТ, были впервые обобщены в работе Withers (1975) в форме т.н. 4R радиобиологии [20]:
-
- repair (репарация сублетальных повреждений ДНК);
-
- reoxygenation (реоксигенация опухоли);
-
- redistribution (перераспределение по фазам клеточного цикла);
-
- regeneration (репопуляция выживших клеток между фракциями дозы).
В 1989 г. к числу таких факторов была отнесена радиочувствительность (radiosensitivity), таким образом, общее число факторов было увеличено до 5R [21]. А в 2019 г. группа французских учёных предложила считать реактивацию (reactivation) противоопухолевого иммунного ответа шестым фактором R, влияющим на эффективность ЛТ [22].
Многолетние исследования молекулярно-клеточных механизмов влияния ВПЧ на радиочувствительность, выполненные в основном в экспериментальных условиях, свидетельствуют о плейотропном действии ВПЧ на указанные процессы (факторы).
Влияние ВПЧ на репарацию повреждений ДНК
Результаты многочисленных исследований доказывают, что вирусные белки Е6/E7 подавляют гомологичную репарацию двунитевых разрывов ДНК в результате взаимодействия с разнообразными сенсорными, трансдукторными и эффекторными белками, которые участвуют в репарации (рис. 1) [23-29]. При этом некоторые авторы обнаружили «компенсаторное» переключение опухолевых клеток на другой путь репарации ‒ негомологичное соединение концов, которое в принципе не позволяет восстановить ДНК без ошибок [28, 29]. В конечном итоге эффективность репарации снижается, а радиочувствительность ВПЧ-позитивных клеток увеличивается.
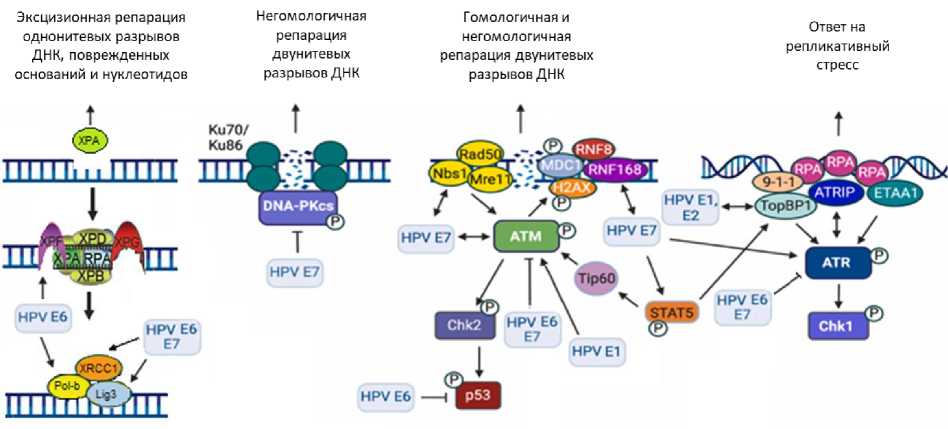
Рис. 1. Взаимодействие вирусных белков HPV E1, E2, E6 и E7 с сенсорными, трансдукторными и эффекторными белками, которые участвуют в репарации радиационных повреждений ДНК и ответе на репликативный стресс. ← стимулирующее действие; Ͱ ингибирующее действие.
Подавление гомологичной репарации имеет важное следствие: при лечении ВПЧ-позитив-ных опухолей можно использовать принцип синтетической летальности [23]. Как известно, он основан на сочетании нарушений в работе отдельных генов или молекулярных процессов, которые по отдельности не смертельны для клетки, но в совокупности приводят к её гибели. Хорошим примером является использование ингибиторов PARP, таких как олапариб, при раке молочной железы, яичника и предстательной железы с мутациями генов BRCA1/BRCA2 . В опухолевых клетках с BRCA -мутациями, как и в ВПЧ-позитивных опухолях, процесс гомологичной рекомбинации нарушен, но репарация двунитевых разрывов ДНК может осуществляться с помощью механизма негомологичного соединения концов. Если подавить и этот путь репарации двунитевых разрывов с помощью ингибирования PARP-1 ‒ одного из ключевых ферментов данного процесса, то двунитевой разрыв не восстанавливается и опухолевая клетка погибает. Ситуация усугубляется ещё и тем, что PARP-1 занимает центральное место в репарации однонитевых разрывов и повреждений оснований ДНК, а при ингибировании этого фермента однонитевые разрывы довольно быстро превращаются в двунитевые разрывы – смертельно опасные для клетки.
Влияние ВПЧ на оксигенацию опухолевых клеток и окислительный стресс
Со времени первых экспериментов Шварца в 1909 г., Хольтусена в 1921 г., Томлинсона и Грея в 1955 г. кислород известен как один из самых мощных модификаторов радиочувствительности, при этом неоднократно было показано, что гипоксические клетки в 2-3 раза более устойчивы к действию редкоионизирующих излучений, поскольку в этих клетках возникает меньше активных форм кислорода, повреждающих ДНК, чем в оксигенированных клетках. Основной причиной развития гипоксии в ЗНО является их неуправляемый рост, вследствие чего масса опухолевых клеток растёт быстрее питающей их сосудистой сети. Имеются данные, что хотя ВПЧ-позитивные опухоли характеризуются достаточно высокой пролиферативной активностью, они в целом лучше оксигенированы по ряду причин, включая высокую плотность сосудистой сети и высокое содержание ангиогенного фактора VEGF, по крайней мере при РШМ [30]. Хорошим практическим подтверждением этих данных является исследование Датской группы по раку головы и шеи (DAHANCA 5), в котором было показано, что ЛТ в сочетании с гипоксическим модификатором ниморазолом улучшала результаты лечения только ВПЧ-, но не ВПЧ+ опухолей [31]. Вместе с тем, надо признать, что не все ВПЧ-позитивные опухоли хорошо оксигенированы. Так, по данным позитронной эмиссионной томографии с 18F-флюоромизонидазолом примерно 16% ВПЧ+ опухолей орофарингеальной зоны (T0-2/N1-N2c) были отнесены к гипоксическим, поэтому больные получили стандартный курс химиолучевой терапии до достижения суммарной дозы 70 Гр [32]. Остальные ВПЧ+ опухоли, отнесённые к негипоксическим, были облучены в суммарной дозе 30 Гр. При сравнении клинических результатов в этих 2 когортах оказалось, что двухлетняя выживаемость без прогрессирования заболевания не отличалась, составляя 94% и 96% при облучении в дозах 30 и 70 Гр соответственно. Неудивительно, что частота острых постлучевых повреждений нормальных тканей 3-4 степени составляла в этих группах 32% vs 58%, поздние постлучевые повреждения отмечены только во второй группе.
Не менее важно, что ВПЧ высокого канцерогенного риска регулируют редокс состояние клеток, способствуя формированию окислительного стресса (ОС), который необходим для завершения жизненного цикла ВПЧ, поскольку ОС индуцирует сборку вирионов [33]. Например, вирусные белки Е1, Е2, Е6 снижают экспрессию и активность таких антиоксидантных ферментов как супероксиддисмутаза 1/2 и каталаза, а также уменьшают содержание глутатиона – основного неферментативного компонента клеточной антиоксидантной системы, который является ловушкой свободных радикалов благодаря наличию тиоловой группы [14, 34]. В контексте данного обзора литературы следует отметить, что в последнее время появляется всё больше доказательств участия глутатиона в ключевых процессах жизнедеятельности клеток – пролиферации, апоптотической гибели клеток, репарации повреждений ДНК [35, 36], которые оказывают сильное влияние на радиочувствительность клеток. Более того, имеются данные об увеличении активности прооксидантных ферментов под влиянием ВПЧ, в частности NOX2, который индуцирует ОС и повреждения ДНК [37]. Важно, что ВПЧ-индуцированный ОС изменяет целый ряд редокс-чув-ствительных сигнальных путей (MAPKs, Akt/TSC2/mTORC1, Wnt/β ‐ Cat, NFkB/IkB/NOX2, HIF/VHL/VEGF), которые участвуют в развитии, прогрессировании ВПЧ-ассоциированных ЗНО и формировании их чувствительности к противоопухолевой терапии.
Таким образом, ВПЧ способны повышать чувствительность ЗНО к редкоионизирующему излучению за счёт более высокой оксигенации клеток и подавления антиоксидантной защиты
(в дополнение к ингибированию репарации повреждений ДНК). Можно ожидать, что влияние ВПЧ на радиочувствительность будет снижаться при использовании ионизирующих излучений с высокой линейной передачей энергии, поскольку, как известно, в этом случае кислородный эффект отсутствует, и большая часть повреждений ДНК возникает в результате прямого действия радиации.
Влияние ВПЧ на клеточный цикл и пострадиационное перераспределение клеток по фазам цикла
Следующим фактором, влияющим на эффективность фракционированного облучения в ходе ЛТ с использованием редкоионизирующего излучения, является перераспределение клеток по фазам цикла, основные причины которого - различие фаз клеточного цикла по радиочувствительности и задержка клеток в контрольных точках клеточного цикла. Если фракция пролиферирующих клеток составляет значительную часть опухоли, эффект перераспределения опухолевых клеток по фазам цикла заметно повышает эффективность ЛТ. В частности, после облучения популяция клоногенных клеток обогащается радиорезистентными S-фазными клетками. Однако постепенно эти клетки, продвигаясь по клеточному циклу, будут переходить в более радиочувствительные фазы и при повторном облучении могут быть элиминированы в ходе фракционированной ЛТ.
Многими авторами было показано, что пролиферативная активность и радиационная задержка клеток в контрольных точках клеточного цикла зависят от ВПЧ-статуса. В частности, установлено, что вирусные белки Е6 и Е7 взаимодействуют с клеточными белками ‒ регуляторами клеточного цикла р53 и рRb, инактивируя их (рис. 2). В итоге может происходить повышение пролиферации ВПЧ-позитивных клеток, как показано во многих (хотя и не всех) работах [38, 39]. Наши данные о пролиферативной активности РШМ, полученные с помощью проточной цитометрии, подтверждают эту закономерность на уровне статистической тенденции [40]. Так, средняя доля клеток суммарно в фазах S+G2+M была в 1,4 раза выше в ВПЧ-позитивных опухолях, чем таковая в ВПЧ-негативных: 22,5±1,8% vs 16,3±4,0% соответственно (р=0,12). Более того, ранее была установлена статистически значимая корреляция между экспрессией кластера генов, связанных с пролиферацией, и экспрессией или числом копий гена Е7 в ВПЧ 16+ или ВПЧ18 + ЗНО шейки матки до лечения, что подтверждает взаимосвязь Е7 с контролем пролиферации и клеточного цикла [41].
Различия в регуляции клеточного цикла в ВПЧ-позитивных и ВПЧ-негативных клетках становятся ещё более заметными после облучения. Е7 разрушает белок Rb, который играет ключевую роль в отрицательном контроле клеточного цикла. Разрушение рRb приводит к тому, что облучённые клетки быстро проходят контрольную точку G1/S, быстрее проходят S-фазу и накапливаются в радиочувствительных фазах G2+M (рис. 3) [14, 42]. И эта задержка продолжается дольше в ВПЧ+, чем в ВПЧ- клетках, что неоднократно доказано экспериментально. Пострадиационное продвижение по клеточному циклу ВПЧ+ и ВПЧ- клеток различается не только из-за разрушения рRb в первых и сохранения этого белка в активном состоянии во вторых, но и из-за того, что в ВПЧ+ опухолях, как правило, представлен ген ТР53 дикого типа, продукт которого частично инактивируется при взаимодействии с белком Е6 (при облучении экспрессия Е6 снижается и эффект инактивации уменьшается). А в ВПЧ- опухолях мутации ТР53 встречаются значительно чаще, поэтому соответствующий белок функционально неактивен и без взаимодействия с Е6. Поскольку р53 дикого типа индуцирует остановку в G2/M, то ВПЧ+ клетки с остаточным р53 будут дольше оставаться в этих фазах после облучения и к следующему сеансу облучения будут более радиочувствительны, чем ВПЧ- клетки.
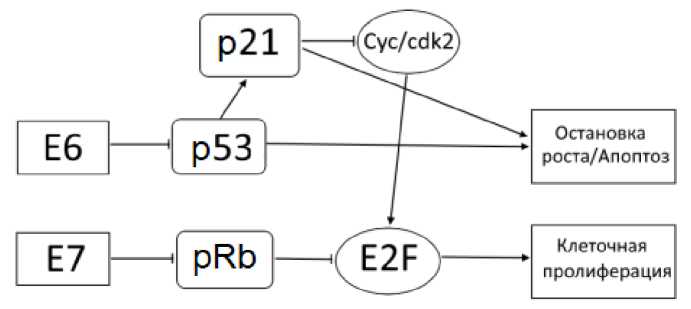
Рис. 2. Упрощённая схема контроля клеточной пролиферации при взаимодействии вирусных белков Е6 и Е7 с клеточными белками-регуляторами клеточного цикла р53 и рRb.
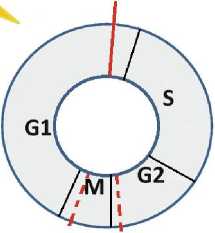
ВПЧ-негативные клетки с активным pRb и мутантным (нефункциональным) р53
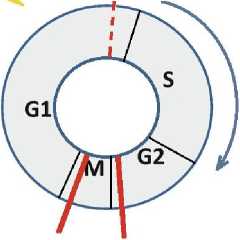
ВПЧ - позитивные клетки с инактивированным pRb и остаточным р53
Рис. 3. Особенности пострадиационного продвижения по клеточному циклу в зависимости от ВПЧ-статуса.
В заключение этого раздела обзора стоит отметить, что при использовании плотноионизи-рующих излучений различия фаз клеточного цикла по радиочувствительности сглаживаются, поэтому влияние ВПЧ на радиочувствительность может снижаться.
ВПЧ-позитивные клетки повышают радиочувствительность за счёт разрушения клеточного белка рRb при наличии остаточного p53, что приводит к остановке клеточного цикла в радиочувствительных фазах G2/М и усилению апоптоза. Таким образом, к следующему сеансу облучения радиочувствительность ВПЧ-позитивных клеток оказывается выше, чем таковая ВПЧ-негативных.
Влияние ВПЧ на пострадиационную репопуляцию и пул опухолевых стволовых клеток
Репопуляция опухолевых клеток после облучения – ещё один мощный фактор, определяющий эффективность фракционированного облучения. Биологическую основу репопуляции составляет пролиферация клеток, выживших после облучения и сохранивших клоногенную актив- ность. Выяснение природы таких клеток является одной из ключевых проблем радиационной онкологии, поскольку именно репопуляция опухолевых клеток считается непосредственной причиной неудачного лечения ЗНО части больных.
Как известно, гетерогенность опухолевых клеток по морфологическим и функциональным признакам (в том числе по чувствительности к радиационным и химическим воздействиям) является фундаментальным свойством злокачественных опухолей, которое значительно осложняет эффективное использование ЛТ. К общепризнанным причинам гетерогенности опухолевых клеток по радиочувствительности относится генетическая нестабильность опухолевых клеток, в результате которой могут возникать разные по чувствительности клоны, различный уровень оксигенации в разных участках опухоли, изменения по чувствительности в разных фазах клеточного цикла и т.д. Кроме того, в последние годы активно развивается представление о иерархическом строении ЗНО и существовании особых стволовых клеток, которые являются родоначальниками гетерогенных клонов, составляющих опухоль Они получили название опухолевых стволовых клеток (ОСК). ОСК обнаружены в ЗНО различных локализаций, включая ВПЧ-ассоциированные опухоли. ОСК обладают более высокой резистентностью к действию редкоионизирующего излучения, чем остальные клетки [43-46]. Учитывая, что ОСК характеризуются ещё и высоким клоногенным потенциалом, многие исследователи считают, что именно ОСК, выжившие после облучения, обеспечивают репопуляцию и возникновение рецидива заболевания у части больных [45, 47].
Данные литературы и результаты собственных исследований позволяют полагать, что существует взаимосвязь между ВПЧ и формированием пула ОСК и/или ответом ОСК на противоопухолевые воздействия in vitro. Так, в стабильных клеточных культурах РШМ было показано взаимодействие между онкопротеинами ВПЧ и компонентами Hedgehog сигнального пути, который вовлекается в поддержание стволовых свойств различных типов клеток и является одним из ключевых регуляторов пула ОСК [48]. ВПЧ- клеточные линии рака головы-шеи характеризовались более высоким уровнем спонтанной и индуцированной дедифференцировки по сравнению с ВПЧ+ клеточными линиями, вследствие чего в первых частота ОСК была выше [49]. Сравнительные данные о частоте ОСК в ВПЧ+ и ВПЧ- опухолях до лечения противоречивы: ряд авторов, действительно, показывает, что в ВПЧ- опухолях содержится больше ОСК, что может быть, по крайней мере частично, обусловлено гипоксическим микроокружением, которое характеризует такие ЗНО (как указывалось выше) и способствует дедифференцировке нестволовых опухолевых клеток, а, значит, приводит к пополнению пула ОСК [14, 50]. Например, было показано, что процент клеток, экспрессирующих маркер ОСК CD98, был значительно (примерно в 3 раза) выше в ВПЧ-, чем в ВПЧ+ ОФР до лечения; при этом высокая экспрессия этого маркера имела неблагоприятное прогностическое значение в отношении 5-летней общей и безрецидивной выживаемости больных [51]. В наших исследованиях ОСК были идентифицированы с помощью проточной цитометрии по экспрессии CD44 в биопсийном материале ЗНО головы и шеи, включая ОФР, и также было установлено 2-кратное повышение доли ОСК в ВПЧ- по сравнению с ВПЧ+ опухолями той же локализации и стадии до лечения (неопубликованные данные). Однако другие авторы продемонстрировали противоположный результат или отсутствие различий [52, 53]. Ясно, что взаимосвязь ОСК с ВПЧ сложна и многокомпонентна, необходимы дальнейшие исследования для прояснения этого вопроса. Можно полагать, что более высокую значимость для клиники имеет не исходное количество ОСК, а его изменение в ходе лучевой/химиолучевой терапии [54, 55], или одновременный учёт ВПЧ статуса и количества ОСК [53]. Важно, что ответ ОСК на стандартную лучевую и химиолучевую терапию зависит от особенностей ВПЧ-инфекции, в частности, от интеграции ДНК ВПЧ в клеточный геном, как показано нами для РШМ [56].
В связи с расширяющимся в последнее время использованием плотноионизирующих излучений в ЛТ, интересно отметить, что чувствительность опухолевых стволовых и не стволовых клеток к такому воздействию не отличается, как показано в экспериментальных условиях in vitro и in vivo при облучении пучками нейтронов, ионов углерода или протонов в расширенном пике Брэгга [57-61]. Поэтому можно предположить, что влияние ВПЧ на процесс пострадиационной репопуляции опухолевых клеток и радиочувствительность ОСК будет снижаться при использовании таких излучений, но это предположение требует дальнейших исследований.
Влияние ВПЧ на внутреннюю радиочувствительность
Внутренняя (исходная) радиочувствительность широкого спектра стабильных линий плоскоклеточного рака головы и шеи, в том числе ОФР, исследовалась во многих лабораториях мира с учётом ВПЧ-статуса. С помощью классического теста на образование колоний определяли размер фракции выживших клеток после воздействия γ- или рентгеновского излучения в дозе 2 Гр (SF2) в условиях нормальной оксигенации in vitro . Были получены согласующиеся данные о более высокой радиочувствительности ВПЧ-позитивных клеток по сравнению с ВПЧ-негативными. Различия в радиочувствительности достигали 2-3 раз. Так, в одной из ранних работ Kimple и со-авт. (2013) доля репродуктивно выживших клеток SF2 составляла в среднем 0,22 vs 0,59 в серии ВПЧ+ и ВПЧ- клеточных линий рака головы и шеи соответственно [62], в другой работе аналогичные показатели составили 0,20 vs 0,34 [63]. Причины различий, обнаруженных в цитируемых и многих других исследованиях, связывают с нарушениями репарации повреждений ДНК и контроля клеточного цикла и, как следствие, с бóльшим количеством остаточных двунитевых разрывов ДНК и более высоким уровнем апоптоза при ВПЧ-позитивном статусе [14, 28, 42, 64].
Влияние ВПЧ на реактивацию противоопухолевого иммунного ответа
Противоопухолевый иммунный ответ может быть представлен как циклический процесс с положительной обратной связью, приводящий к усилению иммунной реакции. Цикл может быть разделён на отдельные этапы, начиная с появления опухолевого антигена и заканчивая уничтожением опухолевых клеток. Модель противоопухолевого иммунного цикла включает гибель опухолевых клеток в результате ЛТ и др. лечебных воздействий, воспаление, активацию незрелых дендритных клеток, представление опухолевых антигенов Т-клеткам, активацию Т-лимфоцитов, миграцию Т-эффекторов в опухоль, инфильтрацию опухоли, распознавание и цитолиз опухолевых клеток. При этом высвобождаются новые порции опухолевых антигенов, что усиливает эскалацию цикла. ЛТ вызывает модификации опухолевого микроокружения, которые способствуют распознаванию опухолевых клеток иммунной системой и активации эффекторов как врождённого, так и адаптивного иммунитета, что вносит ощутимый вклад в формирование специфического противоопухолевого иммунного ответа. В определённом смысле облучённая опухоль становится настоящей вакциной in situ [22]. С другой стороны, было установлено, что ЛТ способна стимулировать некоторые иммуносупрессивные процессы, такие как увеличение регуляторных Т-клеток (Treg), инфильтрация микроокружения миелоидными супрессорными клетками и развитие толерантных макрофагов 2 типа, что ограничивает эффективность противоопухолевого иммунного ответа. Кроме того, радиация способствует высвобождению цитокинов и хемокинов, что приводит к увеличению продукции и рекрутированию фактора роста фибробластов (FGF), трансформирующего фактора роста-в (TGF-в), интерлейкина 1в (IL-1 в) и фактора некроза опухоли (TNF), которые активируют Тreg, миелоидные супрессорные клетки и ассоциированные с опухолью фибробласты. В добавление радиотерапия повышает экспрессию лиганда 1 рецептора программируемой гибели (PD-L1) на поверхности опухолевых и иммуносупрессорных миелоидных клеток. Вместе взятые, эти и ещё целый ряд процессов, здесь не упомянутых, способствуют ускользанию облучённой опухоли от иммунного надзора. В целом, эффективность радиационно-индуцированного противоопухолевого иммунного ответа зависит от баланса между иммуностимулирующим и иммуносупрессивным эффектами, который, по-видимому, в определённой мере определяется ВПЧ-статусом.
Известно, что вирусные белки E6 и E7 обладают широким спектром действия на состояние врождённого и адаптивного противоопухолевого иммунитета: снижают секрецию хемокинов CCL20 и CXCL14, что препятствует привлечению в опухоль дендритных клеток; предотвращают презентацию антигена цитотоксическим Т-клеткам путём подавления экспрессии главного комплекса гистосовместимости класса I; ингибируют путь cGAS-STING, который реагирует на аберрантную ДНК вирусов, активируя врождённую иммунную систему; снижают стимулируемую интерферонами экспрессию генов (например, TLR3, RIG-I, MDA5, TRAIL, XAF1, IFIT1, MX1 ) [65]. Поэтому не удивительно, что иммунологический профиль ВПЧ+ и ВПЧ - опухолей существенно различается. В первых отмечается более высокая плотность опухоль-инфильтрирующих лимфоцитов, в том числе CD3+ и CD8+ T-клеток, T-регуляторных клеток (Тгед), B-клеток и плазматических клеток. Интересно, что опухолевые инфильтраты 64% ВПЧ+ ОФР содержат ВПЧ16-антигенспецифические Т-клетки, что расширяет потенциал персонализированной иммунотерапии ВПЧ+ опухолей. Достаточно давно известно, что в отличие от ВПЧ ' , при ВПЧ+ статусе повышена экспрессия PD-L1 на опухолевых и иммунных клетках, а также PD-1 на опухоль-инфильтри-рующих лимфоцитах и опухоль-ассоциированных макрофагах, что, с одной стороны, способствует ускользанию ВПЧ-позитивных опухолей от иммунного ответа [66, 67], а, с другой стороны, эта особенность ВПЧ+ опухолей может быть использована при иммунотерапии. Эффективность иммунотерапии с ингибиторами контрольных точек CTLA-4, PD-1/PD-L1 в монорежиме или в комбинации с радиохимиотерапией оценивалась в зависимости от ВПЧ-статуса ОФР в клинических испытаниях I-III фазы, часть из которых пока не закончена [65]. В большинстве исследований была продемонстрирована ожидаемо более высокая эффективность иммунотерапии ВПЧ+ опухолей, а в результате мета-анализа 12 клинических испытаний показано, что вероятность ответа на лечение таких опухолей была в 1,29 раз выше, чем ВПЧ-негативных опухолей [68]. Вместе с тем, следует отметить, что комбинированная радиоиммунотерапия пребывает пока на стадии становления, необходимы дальнейшие исследования с целью разработки оптимальных схем её применения, в том числе при деэскалации доз ЛТ ОФР [69] и, возможно, с учётом молекулярногенетических параметров ВПЧ-инфекции, включая генотип, вирусную нагрузку и степень интеграции ДНК ВПЧ в клеточный геном.
Таким образом, ВПЧ оказывают значительное влияние на состояние противоопухолевого иммунитета в ЗНО шейки матки и орофарингеальной зоны, однако полученные данные относятся, в основном, к опухолям до лечения. Вопрос о влиянии ВПЧ на реактивацию противоопухолевого иммунного ответа в ходе фракционированного облучения ждёт дальнейших исследо- ваний. Но, учитывая взаимосвязь эффективности комбинированной радиоиммунотерапии онкологических больных с ВПЧ-статусом, можно предположить, что ВПЧ способны оказывать значительное влияние на состояние противоопухолевого иммунитета так же и в облучённых ЗНО.
Заключение
ВПЧ оказывают существенное влияние практически на все известные процессы, определяющие эффективность ЛТ (воздействуют, по крайней мере, на 5R из 6). По сравнению с ВПЧ-негативными опухолями, ВПЧ-позитивные демонстрируют более высокую чувствительность к редкоионизирующему излучению вследствие снижения эффективности гомологичной репарации повреждений ДНК (R1), более высокой оксигенации и подавления антиоксидантной защиты (R2), нарушений контроля клеточного цикла (R3), особенностей регуляции пула ОСК, обеспечивающих пострадиационную репопуляцию (R4), более высокой внутренней радиочувствительности (R5). Можно полагать, что использование плотноионизирующих излучений оправдано, прежде всего, при лечении ВПЧ-негативных ЗНО, а стратификация больных по ВПЧ-статусу до лечения необходима для рационального использования дорогостоящих облучательных установок.
Список литературы Молекулярно-клеточные механизмы влияния вирусов папилломы человека на чувствительность злокачественных опухолей к лучевой терапии. Обзор
- Szymonowicz K.A., Chen J. Biological and clinical aspects of HPV-related cancers //Cancer Biol. Med. 2020. V. 17, N 4. P. 864-878.
- Li M., Du X., Lu M., Zhang W., Sun Z., Li L., Ye M., Fan W., Jiang S., Liu A., Wang M., Meng Y., Li Y. Prevalence characteristics of single and multiple HPV infections in women with cervical cancer and precan-cerous lesions in Beijing, China //J. Med. Virol. 2019. V. 91, N 3. P. 473-481.
- Ye Y., Jones T., Wang T., Zeng X., Liu Y., Zhao C. Comprehensive overview of genotype distribution and prevalence of human papillomavirus in cervical lesions //Gynecol. Obstet. Clin. Med. 2024. V. 4, N 1. P. e000005. DOI: 10.1136/gocm-2024-000005.
- Giannella L., Di Giuseppe J., Delli Carpini G., Grelloni C., Fichera M., Sartini G., Caimmi S., Natalini L., Ciavattini A. HPV-negative adenocarcinomas of the uterine cervix: from molecular characterization to clinical implications //Int. J. Mol. Sci. 2022. V. 23, N 23. P. 15022. DOI: 10.3390/ijms232315022.
- Park K.J. Cervical adenocarcinoma: integration of HPV status, pattern of invasion, morphology and molecular markers into classification //Histopathology. 2020. V. 76, N 1. P. 112-127.
- Mkrtchian L., Zamulaeva I., Krikunova L., Kiseleva V., Matchuk O., Liubina L., Kulieva G., Ivanov S., Kaprin A. HPV status and individual characteristics of human papillomavirus infection as predictors for clinical outcome of locally advanced cervical cancer //J. Pers. Med. 2021. V. 11, N 6. P. 479. DOI: 10.3390/jpm11060479.
- Vani N.V., Rama R., Madhanagopal R., Vijayalakshmi R., Swaminathan R. Human papillomavirus-attribut-able head and neck cancers in India ‒ a systematic review and meta-analysis //JCO Glob. Oncol. 2024. V. 10. P. e2300464. DOI: 10.1200/GO.23.00464.
- Agelaki S., Boukovinas I., Athanasiadis I., Trimis G., Dimitriadis I., Poughias L., Morais E., Sabale U., Bencina G., Athanasopoulos C. A systematic literature review of the human papillomavirus prevalence in locally and regionally advanced and recurrent/metastatic head and neck cancers through the last decade: the "ALARM" study //Cancer Med. 2024. V. 13, N 3. P. e6916. DOI: 10.1002/cam4.6916.
- Bhat G.R., Hyole R.G., Li J. Head and neck cancer: current challenges and future perspectives //Adv. Cancer Res. 2021. V. 152. P. 67-102.
- Ibragimova M.K., Tsyganov M.M., Litviakov N.V. Human papillomavirus and colorectal cancer //Med. Oncol. 2018. V. 35, N 11. P. 140. DOI: 10.1007/s12032-018-1201-9.
- Pelizzer T., Dias C.P., Poeta J., Torriani T., Roncada C. Colorectal cancer prevalence linked to human papillomavirus: a systematic review with meta-analysis //Rev. Bras. Epidemiol. 2016. V. 19, N 4. P. 791-802.
- Opeyemi Bello R., Willis-Powell L., James O., Sharma A., Marsh E., Ellis L., Gaston K., Siddiqui Y. Does human papillomavirus play a causative role in prostate cancer? A systematic review using Bradford Hill's criteria //Cancers (Basel). 2023. V. 15, N 15. P. 3897. DOI: 10.3390/cancers15153897.
- Karaoğlan B.B., Ürün Y. Unveiling the role of human papillomavirus in urogenital carcinogenesis a compre-hensive review //Viruses. 2024. V. 16, N 5. P. 667. DOI: 10.3390/v16050667.
- Huang Y., Zou D., Guo M., He M., He H., Li X., Zheng Q., Li Q., Mao Z. HPV and radiosensitivity of cervical cancer: a narrative review //Ann. Transl. Med. 2022. V. 10, N 24. P. 1405. DOI: 10.21037/atm-22-5930.
- Okuma K., Yamashita H., Yokoyama T., Nakagawa K., Kawana K. Undetected human papillomavirus DNA and uterine cervical carcinoma: association with cancer recurrence //Strahlenther. Onkol. 2016. V. 192, N 1. P. 55-62.
- Wang Y., He M., He T., Ouyang X., Shen X., Shi W., Huang S., Xiang L., Zou D., Jiang W., Yang H. Integrated genomic and transcriptomic analysis reveals the activation of PI3K signaling pathway in HPV-independent cervical cancers //Br. J. Cancer. 2024. V. 130, N 6. P. 987-1000.
- Zakeri K., Dunn L., Lee N. HPV-associated oropharyngeal cancer de-escalation strategies and trials: past failures and future promise //J. Surg. Oncol. 2021. V. 124, N 6. P. 962-966.
- Silver J.A., Turkdogan S., Roy C.F., Subramaniam T., Henry M., Sadeghi N. De-escalation strategies for human papillomavirus-associated oropharyngeal squamous cell carcinoma – Where are we now? //Curr. Oncol. 2022. V. 29, N 5. P. 3668-3697.
- Chen A.M. De-escalated radiation for human papillomavirus virus-related oropharyngeal cancer: who, why, what, where, when, how, how much … and what next? //Radiother. Oncol. 2024. P. 110373. DOI: 10.1016/j.ra-donc.2024.110373. (In press).
- Withers H.R. The four R’s of radiotherapy //Adv. Radiat. Biol. 1975. V. 5. P. 241-271.
- Steel G.G., McMillan T.J., Peacock J.H. The 5Rs of radiobiology //Int. J. Radiat. Biol. 1989. V. 56, N 6. P. 1045-1048.
- Boustani J., Grapin M., Laurent P.A., Apetoh L., Mirjolet C. The 6th R of radiobiology: reactivation of anti-tumor immune response //Cancers (Basel). 2019. V. 11, N 6. P. 860. DOI: 10.3390/cancers11060860.
- He S., Wang A., Wang J., Tang Z., Wang X., Wang D., Chen J., Liu C., Zhao M., Chen H., Song L. Human papillomavirus E7 protein induces homologous recombination defects and PARPi sensitivity //J. Cancer Res. Clin. Oncol. 2024. V. 150, N 1. P. 27. DOI: 10.1007/s00432-023-05511-6.
- Kushwah A.S., Masood S., Mishra R., Banerjee M. Genetic and epigenetic alterations in DNA repair genes and treatment outcome of chemoradiotherapy in cervical cancer //Crit. Rev. Oncol. Hematol. 2024. V. 194. P. 104240. DOI: 10.1016/j.critrevonc.2023.104240.
- Studstill C.J., Mac M., Moody C.A. Interplay between the DNA damage response and the life cycle of DNA tumor viruses //Tumour Virus Res. 2023. V. 16. P. 200272. DOI: 10.1016/j.tvr.2023.200272.
- Zuo N., Ma L., Liu T., Hu W., Luo Y., Meng H., Ren Q., Deng Y., Wei L., Liu Q. Human papillomavirus associated XPF deficiency increases alternative end joining and cisplatin sensitivity in head and neck squa-mous cell carcinoma //Oral Oncol. 2023. V. 140. P. 106367. DOI: 10.1016/j.oraloncology.2023.106367.
- Papalouka C., Adamaki M., Batsaki P., Zoumpourlis P., Tsintarakis A., Goulielmaki M., Fortis S.P., Baxevanis C.N., Zoumpourlis V. DNA damage response mechanisms in head and neck cancer: significant implications for therapy and survival //Int. J. Mol. Sci. 2023. V. 24, N 3. P. 2760. DOI: 10.3390/ijms24032760.
- Zhou C., Parsons J.L. The radiobiology of HPV-positive and HPV-negative head and neck squamous cell carcinoma //Expert Rev. Mol. Med. 2020. V. 22. P. e3. DOI: 10.1017/erm.2020.4.
- Nickson C.M., Moori P., Carter R.J., Rubbi C.P., Parsons J.L. Misregulation of DNA damage repair path-ways in HPV-positive head and neck squamous cell carcinoma contributes to cellular radiosensitivity //Onco-target. 2017. V. 8, N 18. P. 29963-29975.
- Huang Q., Qu Q.X., Xie F., Zhang T., Hu J.M., Chen Y.G., Zhang X.G. CD40 is overexpressed by HPV16/18-E6 positive cervical carcinoma and correlated with clinical parameters and vascular density //Cancer Epidemiol. 2011. V. 35, N 4. P. 388-392.
- Lassen P., Eriksen J.G., Hamilton-Dutoit S., Tramm T., Alsner J., Overgaard J.; Danish Head and Neck Cancer Group (DAHANCA). HPV-associated p16-expression and response to hypoxic modification of radio-therapy in head and neck cancer //Radiother. Oncol. 2010. V. 94, N 1. P. 30-35.
- Lee N.Y., Sherman E.J., Schöder H., Wray R., Boyle J.O., Singh B., Grkovski M., Paudyal R., Cunning-ham L., Zhang Z., Hatzoglou V., Katabi N., Diplas B.H., Han J., Imber B.S., Pham K., Yu Y., Zakeri K., McBride S.M., Kang J.J., Tsai C.J., Chen L.C., Gelblum D.Y., Shah J.P., Ganly I., Cohen M.A., Cracchiolo J.R., Morris L.G.T., Dunn L.A., Michel L.S., Fetten J.V., Kripani A., Pfister D.G., Ho A.L., Shukla-Dave A., Humm J.L., Powell S.N., Li B.T., Reis-Filho J.S., Diaz L.A., Wong R.J., Riaz N. Hypoxia-directed treatment of human papillomavirus-related oropharyngeal carcinoma //J. Clin. Oncol. 2024. V. 42, N 8. P. 940-950.
- Conway M.J., Alam S., Ryndock E.J., Cruz L., Christensen N.D., Roden R.B., Meyers C. Tissue-spanning redox gradient-dependent assembly of native human papillomavirus type 16 virions //J. Virol. 2009. V. 83, N 20. P. 10515-10526.
- Cruz-Gregorio A., Aranda-Rivera A.K. Redox-sensitive signalling pathways regulated by human papil
- Corso C.R., Acco A. Glutathione system in animal model of solid tumors: from regulation to therapeutic target //Crit. Rev. Oncol. Hematol. 2018. V. 128. P. 43-57.
- Борисенок О.А., Бушма М.И., Басалай О.Н., Радковец А.Ю. Биологическая роль глутатиона //Меди-цинские новости. 2019. № 7. С. 3-8.
- Cruz-Gregorio A., Manzo-Merino J., Gonzaléz-García M.C., Pedraza-Chaverri J., Medina-Campos O.N., Valverde M., Rojas E., Rodríguez-Sastre M.A., García-Cuellar C.M., Lizano M. Human papillomavirus types 16 and 18 early-expressed proteins differentially modulate the cellular redox state and DNA damage //Int. J. Biol. Sci. 2018. V. 14, N 1. P. 21-35.
- Cambruzzi E., Zettler C.G., Alexandre C.O. Expression of Ki-67 and squamous intraepithelial lesions are related with HPV in endocervical adenocarcinoma //Pathol. Oncol. Res. 2005. V. 11, N 2. P. 114-120.
- Ullah M.I., Mikhailova M.V., Alkhathami A.G., Carbajal N.C., Zuta M.E.C., Rasulova I., Najm M.A.A., Abosoda M., Alsalamy A., Deorari M. Molecular pathways in the development of HPV-induced oropharyn-geal cancer //Cell Commun. Signal. 2023. V. 21, N 1. P. 351. DOI: 10.1186/s12964-023-01365-0.
- Замулаева И.А., Киселева В.И., Крикунова Л.И., Любина Л.В., Орлова Н.В., Селиванова Е.И., Смирнова С.Г., Шинкаркина А.П. Роль вирусов папилломы человека в регуляции пролиферативной активности рака шейки матки //Труды регионального конкурса научных проектов в области естествен-ных наук. Выпуск 13. Калуга: Калужский научный центр, 2008. С. 196-205.
- Rosty C., Sheffer M., Tsafrir D., Stransky N., Tsafrir I., Peter M., de Crémoux P., de La Rochefordière A., Salmon R., Dorval T., Thiery J.P., Couturier J., Radvanyi F., Domany E., Sastre-Garau X. Identification of a proliferation gene cluster associated with HPV E6/E7 expression level and viral DNA load in invasive cervical carcinoma //Oncogene. 2005. V. 24, N 47. P. 7094-7104.
- Wang H., Wang B., Wei J., Meng L., Zhang Q., Qu C., Xin Y., Jiang X. Molecular mechanisms underlying increased radiosensitivity in human papillomavirus-associated oropharyngeal squamous cell carcinoma //Int. J. Biol. Sci. 2020. V. 16, N 6. P. 1035-1043.
- Olivares-Urbano M.A., Griñán-Lisón C., Marchal J.A., Núñez M.I. CSC radioresistance: a therapeutic chal-lenge to improve radiotherapy effectiveness in cancer //Cells. 2020. V. 9, N 7. P. 1651. DOI: 10.3390/cells9071651.
- Matchuk O.N., Zamulaeva I.A., Selivanova E.I., Mkrtchyan L.S., Krikunova L.I., Saburov V.O., Lychagin A.A., Kuliyeva G.Z., Yakimova A.O., Khokhlova A.V., Ivanov S.A., Kaprin A.D. Effect of frac-tionated low-LET radiation exposure on cervical cancer stem cells under experimental and clinical conditions //Biology Bulletin. 2020. V. 47, N 11. P. 1471-1479.
- Lytle N.K., Barber A.G., Reya T. Stem cell fate in cancer growth, progression and therapy resistance //Nat. Rev. Cancer. 2018. V. 18, N 11. P. 669-680.
- Rycaj K., Tang D.G. Cancer stem cells and radioresistance //Int. J. Radiat. Biol. 2014. V. 90, N 8. P. 615-621.
- Hoque S., Dhar R., Kar R., Mukherjee S., Mukherjee D., Mukerjee N., Nag S., Tomar N., Mallik S. Cancer stem cells (CSCs): key player of radiotherapy resistance and its clinical significance //Biomarkers. 2023. V. 28, N 2. P. 139-151.
- Vishnoi K., Mahata S., Tyagi A., Pandey A., Verma G., Jadli M., Singh T., Singh S.M., Bharti A.C. Cross-talk between human papillomavirus oncoproteins and hedgehog signaling synergistically promotes stemness in cervical cancer cells //Sci. Rep. 2016. V. 6. P. 34377. DOI: 10.1038/srep34377.
- Vlashi E., Chen A.M., Boyrie S., Yu G., Nguyen A., Brower P.A., Hess C.B., Pajonk F. Radiation-induced dedifferentiation of head and neck cancer cells into cancer stem cells depends on human papillomavirus status //Int. J. Radiat. Oncol. Biol. Phys. 2016. V. 94, N 5. P. 1198-1206.
- Kabakov A.E., Yakimova A.O. Hypoxia-induced cancer cell responses driving radioresistance of hypoxic tumors: approaches to targeting and radiosensitizing //Cancers (Basel). 2021. V. 13, N 5. P. 1102. DOI: 10.3390/cancers13051102.
- Rietbergen M.M., Martens-de Kemp S.R., Bloemena E., Witte B.I., Brink A., Baatenburg de Jong R.J., Leemans C.R., Braakhuis B.J., Brakenhoff R.H. Cancer stem cell enrichment marker CD98: a prognostic factor for survival in patients with human papillomavirus-positive oropharyngeal cancer //Eur. J. Cancer. 2014. V. 50, N 4. P. 765-773.
- Zhang M., Kumar B., Piao L., Xie X., Schmitt A., Arradaza N., Cippola M., Old M., Agrawal A., Ozer E., Schuller D.E., Teknos T.N., Pan Q. Elevated intrinsic cancer stem cell population in human papillomavirus-associated head and neck squamous cell carcinoma //Cancer. 2014. V. 120, N 7. P. 992-1001.
- Reid P., Marcu L.G., Olver I., Moghaddasi L., Staudacher A.H., Bezak E. Diversity of cancer stem cells in head and neck carcinomas: the role of HPV in cancer stem cell heterogeneity, plasticity and treatment response //Radiother. Oncol. 2019. V. 135. P. 1-12.
- Zamulaeva I.A., Selivanova E.I., Matchuk O.N., Krikunova L.I., Mkrtchyan L.S., Kulieva G.Z., Kaprin A.D. Quantitative changes in the population of cancer stem cells after radiation exposure in a dose of 10 Gy as a prognostic marker of immediate results of the treatment of squamous cell cervical cancer //Bull. Exp. Biol. Med. 2019. V. 168, N 1. P. 156-159.
- Замулаева И.А., Селиванова Е.И., Андреев В.Г. Способ прогнозирования радиочувствительности злокачественных новообразований верхних дыхательных путей //Патент РФ № RU 2735982 C2 от 11.11.2020.
- Zamulaeva I., Selivanova E., Matchuk O., Kiseleva V., Mkrtchyan L., Krikunova L. Radiation response of cervical cancer stem cells is associated with pretreatment proportion of these cells and physical status of HPV DNA //Int. J. Mol. Sci. 2021. V. 22, N 3. P. 1445. DOI: 10.3390/ijms22031445.
- Матчук О.Н., Замулаева И.А., Селиванова Е.И., Липунов Н.М., Пронюшкина К.А., Ульяненко С.Е., Лычагин А.А., Смирнова С.Г., Орлова Н.В., Саенко А.С. Чувствительность клеток SP линии мела-номы В16 к действию редко- и плотноионизирующего излучений //Радиационная биология. Радиоэко-логия. 2012. Т. 52, № 3. С. 261-267.
- Dini V., Belli M., Tabocchini M.A. Targeting cancer stem cells: protons versus photons //Br. J. Radiol. 2020. V. 93, N 1107. P. 20190225. DOI: 10.1259/bjr.20190225.
- Zamulaeva I.A., Matchuk O.N., Selivanova E.I., Yakimova A.O., Mosina V.A., Koryakin S.N., Kaprin A.D., Boreyko A.V., Bugay A.N., Chausov V.N., Krasavin E.A. Radiobiological effects of the combined action of 1--D-Arabinofuranosylcytosine and proton radiation on B16 melanoma in vivo //Phys. Part. Nuclei Lett. 2023. V. 20, N 1. P. 63-75.
- Wang Q., Liu R., Zhang Q., Luo H., Wu X., Du T., Chen Y., Tan M., Liu Z., Sun S., Yang K., Tian J., Wang X. Biological effects of cancer stem cells irradiated by charged particle: a systematic review of in vitro studies //J. Cancer Res. Clin. Oncol. 2023. V. 149, N 9. P. 6625-6638.
- Schniewind I., Hadiwikarta W.W., Grajek J., Poleszczuk J., Richter S., Peitzsch M., Müller J., Klusa D., Beyreuther E., Löck S., Lühr A., Frosch S., Groeben C., Sommer U., Krause M., Dubrovska A., von Neubeck C., Kurth I., Peitzsch C. Cellular plasticity upon proton irradiation determines tumor cell radiosensitivity //Cell Rep. 2022. V. 38, N 8. P. 110422. DOI: 10.1016/j.celrep.2022.110422.
- Kimple R.J., Smith M.A., Blitzer G.C., Torres A.D., Martin J.A., Yang R.Z., Peet C.R., Lorenz L.D., Nickel K.P., Klingelhutz A.J., Lambert P.F., Harari P.M. Enhanced radiation sensitivity in HPV-positive head and neck cancer //Cancer Res. 2013. V. 73, N 15. P. 4791-4800.
- Arenz A., Ziemann F., Mayer C., Wittig A., Dreffke K., Preising S., Wagner S., Klussmann J.P., Engen-hart-Cabillic R., Wittekindt C. Increased radiosensitivity of HPV-positive head and neck cancer cell lines due to cell cycle dysregulation and induction of apoptosis //Strahlenther. Onkol. 2014. V. 190, N 9. P. 839-846.
- Jones K.M., Bryan A., McCunn E., Lantz P.E., Blalock H., Ojeda I.C., Mehta K., Cosper P.F. The causes and consequences of DNA damage and chromosomal instability induced by human papillomavirus //Cancers (Basel). 2024. V. 16, N 9. P. 1662. DOI: 10.3390/cancers16091662.
- Khoo A., Boyer M., Jafri Z., Makeham T., Pham T., Khachigian L.M., Floros P., Dowling E., Fedder K., Shonka D. Jr., Garneau J., O'Meara C.H. Human papilloma virus positive oropharyngeal squamous cell carcinoma and the immune system: pathogenesis, immunotherapy and future perspectives //Int. J. Mol. Sci. 2024. V. 25, N 5. P. 2798. DOI: 10.3390/ijms25052798.
- Yang W., Lu Y.P., Yang Y.Z., Kang J.R., Jin Y.D., Wang H.W. Expressions of programmed death (PD)-1 and PD-1 ligand (PD-L1) in cervical intraepithelial neoplasia and cervical squamous cell carcinomas are of prognostic value and associated with human papillomavirus status //J. Obstet. Gynaecol. Res. 2017. V. 43, N 10. P. 1602-1612.
- Mezache L., Paniccia B., Nyinawabera A., Nuovo G.J. Enhanced expression of PD L1 in cervical intraepi-thelial neoplasia and cervical cancers //Mod. Pathol. 2015. V. 28, N 12. P. 1594-1602.
- Galvis M.M., Borges G.A., Oliveira T.B., Toledo I.P., Castilho R.M., Guerra E.N.S., Kowalski L.P., Squar-ize C.H. Immunotherapy improves efficacy and safety of patients with HPV positive and negative head and neck cancer: A systematic review and meta-analysis //Crit. Rev. Oncol. Hematol. 2020. V. 150. P. 102966. DOI: 10.1016/j.critrevonc.2020.102966.
- Roof L., Yilmaz E. Immunotherapy in HPV-Related Oropharyngeal Cancers //Curr. Treat. Options Oncol. 2023. V. 24, N 3. P. 170-183.


