Молекулярные и клеточные механизмы действия смешанного гамма-нейтронного излучения различной мощности дозы
Автор: Рябченко Н.И., Антощина М.М., Насонова В.А., Фесенко Э.В., Рябченко В.И., Иванник Б.П., Ульяненко С.Е., Соколов В.А.
Рубрика: Научные статьи
Статья в выпуске: 1-2 т.15, 2006 года.
Бесплатный доступ
Облучение проводили на импульсном реакторе Барс-6 (ГНЦ РФ - ФЭИ, Обнинск) в виде одиночного импульса длительностью порядка 100 мксек и в виде непрерывного смешанного гамма-нейтронного излучения длительностью 60 минут при мощностях дозы, отличающихся в 3,6-107 раз. Полученные данные свидетельствуют о дифференциальной чувствительности изученных показателей к повреждающему действию смешанных гамма-нейтронных излучений различной мощностью дозы. Проведенные исследования показали, что при облучении мышей в дозах до 2 Гр импульсное излучение в 1,3-1,7 раз более эффективно увеличивает число аберраций в клетках костного мозга по сравнению с непрерывным излучением. В тоже время не было найдено статистически достоверных различий между этими режимами облучения при анализе хромосомных аберраций, индуцированных действием гамма-нейтронного излучения при облучении лимфоцитов человека на стадии G0. Повышенная эффективность цитогенетического действия импульсного гамма-нейтронного излучения на костный мозг мышей может быть связана с естественной гетерогенностью клеточной популяции кариоци-тов, находящихся на различных стадиях клеточного цикла, и увеличением выхода аберраций хромосом в этих клетках за счет ингибирования репарационных процессов при импульсном режиме облучения. В тоже время полученные нами данные свидетельствуют о том, что непрерывный режим облучения более эффективен в повышении уровня полиплоидизации клеток и нарушении мембранных структур. Полученные экспериментальные результаты и анализ данных литературы свидетельствует о перспективности использования импульсных гамма-нейтронных излучений для терапии злокачественных новообразований.
Короткий адрес: https://sciup.org/170169896
IDR: 170169896
Текст научной статьи Молекулярные и клеточные механизмы действия смешанного гамма-нейтронного излучения различной мощности дозы
В последние годы для медико-биологических исследований начали использоваться источники импульсных нейтронных излучений с частотой следования импульсов от 1 до 1000 Гц и мощностью дозы в импульсе более 105 Гр/с, которые могут быть перспективны для лучевой терапии злокачественных новообразований [1, 2]. Изменение временного фактора воздействия поглощенной дозы может оказывать различное влияние на реакцию клеток и тканей, как в сторону усиления, так и в сторону ослабления лучевого воздействия [3]. В связи с этим, представляет интерес импульсный ядерный реактор БАРС-6, созданный в ГНЦ РФ – ФЭИ, Обнинск, который позволяет проводить облучение биологических объектов смешанным гамма-нейтронным излучением в виде одиночного импульса длительностью порядка ~100 мкс (мощность дозы до 106 Гр/с) и в виде непрерывного гамма-нейтронного излучения длительностью 3600 с (мощность дозы до 10-2 Гр/с) [2, 4]. Данные проведенных исследований биологической эффективности смешанных гамма-нейтронных излучений различной мощности дозы противоречивы. Результаты работ, выполненных на лимфоцитах человека [5] и клетках млекопитающих V-79 [6] и аберраций хромосом костного мозга облученных мышей [7], указывали на большую эффективность повреждающего действия импульсного излучения реактора БАРС-6. Однако в других работах при исследовании выживаемости микроорганизмов [8], аберраций хромосом лимфоцитов человека [7, 9] и выживаемости животных [10] не удалось выявить разницы в биологическом действии импульсного и непрерывного нейтронного излучения.
В настоящей работе обобщены результаты исследований по оценке на молекулярном и клеточном уровнях биологического действия смешанных гамма-нейтронных излучений различной мощности дозы. В качестве объектов исследований были использованы облученные на реакторе БАРС-6 в непрерывном режиме и в режиме одиночного импульса суспензии липосом, растворы белков и ферросульфата, лимфоциты периферической крови человека (появление структурных и численных повреждений хромосом), а также структурные аберрации в костном мозге облученных мышей.
Материалы и методы
Конструкция реактора БАРС-6 (ГНЦ РФ – ФЭИ, Обнинск) позволяла проводить облучение в импульсном и непрерывном режимах при сохранении в этих условиях одинакового (с точностью до 2 %) числа делений в АЗ (активных зонах) реактора [2, 4]. Благодаря этому биологические объекты, размещенные на одних и тех же фиксированных расстояниях от реактора, получали за 100 мкс и 60 мин одну и ту же дозу смешанного гамма-нейтронного излучения при мощностях дозы, отличающихся друг от друга в 3,6 - 10 7 раза. Показано, что по мере увеличения расстояния от реактора меняется не только доза смешанного гамма-нейтронного излучения, но и средняя энергия нейтронов (от 1,4 до 0,5 МэВ), а также увеличивается до 50 % вклад гамма-компоненты в общую дозу гамма-нейтронного излучения. Однако при облучении объектов, расположенных на одних и тех же расстояниях от реактора, энергетический спектр нейтронов и соотношение доз нейтронной и гамма-компонент сохраняли свои значения при облучении в режиме одиночного импульса и непрерывном режиме [4]. Измерение флюенса быстрых нейтронов проводили с помощью активационного детектора из никеля (марка НП-2М), а для определения величины флюенса нейтронов всех энергий вносили поправку на спектр нейтронов на различных расстояниях от реактора. Измерение дозы у -излучения проводили с помощью тер-молюминисцентного дозиметра ИКС-А с использованием термолюминисцентного алюмофос-фатного стекла ИС-7 [4].
Мультиламеллярные липосомы получали из фосфолипидов желтков куриных яиц. Эффективность радиационного окисления фосфолипидов липосом оценивали по выходу малондиальдегида (МДА), который является одним из конечных продуктов перекисного окисления липидов. Концентрацию МДА определяли с помощью тиобарбитуровой кислоты (ТБК) по модифицированному методу [11]. Для проведения определения к 0,5 мл суспензии липосом прибавляли 2,5 мл раствора, содержащего 12 % трихлоруксусной кислоты (ТХУ), 0,3 % ТБК, 0,2 М HCl, 0,004 % ЭДТА и 0,0002 % ионола. Полученную смесь прогревали в течение 20 минут при 100 ° С, охлаждали и центрифугировали. Супернатант фотометрировали при 532 нм и рассчитывали концентрацию МДА, используя коэффициент экстинкции, равный 156000 М-1 см-1.
Для цитогенетического анализа аберраций хромосом, индуцированных в лимфоцитах на стадии G 0 , облучали гепаринизированную (200 ед/мл) кровь. Облучение крови гамма-квантами 60Со проводили на установке «Луч» («Изотоп», Россия) при мощности дозы 0,5 Гр/мин. Облучение крови на реакторе БАРС-6 проводили в пластиковых пробирках, которые размещали на различных фиксированных расстояниях от реактора. В опытах использовали стандартную методику культивирования лимфоцитов человека, согласно которой через 3-4 часа после облучения 1 мл гепаринизированной крови добавляли к 8 мл культуральной среды, состоящей из 80 % среды RPMI c глютамином, 20 % эмбриональной сыворотки телят, антибиотиков пенициллина и стрептомицина. Затем в среду для культивирования для стимуляции деления лимфоцитов вносили ФГА (10-20 мкг/мл) и для дифференциальной окраски хроматид вносили бромдезоксиуридин в конечной концентрации 20 мкг/мл. Идентификацию метафаз первого, второго, третьего и четвертого митозов в облученных и необлученных лимфоцитах проводили по модифицированной методике дифференциального окрашивания сестринских хроматид с помощью бромдезоксиуридина [7]. За два часа до фиксации клеток для накопления метафаз в среду для культивирования вводили колхицин в конечной концентрации 0,5 мкг/мл. Для получения цитологических препаратов клетки гипотонизировали, фиксировали смесью ледяной уксусной кислоты и метилового спирта в соотношении 1:3 и окрашивали азур-эозином. На цитологических препаратах в метафазах первого митоза, содержащих 44-46 хромосом, анализировали структурные аберрации хромосом. В метафазах 1-го, 2-го, 3-го и 4-го митозов определяли также число полиплоидных клеток (ППК), к которым относили тетраплоидные клетки, а также гипотетраплоидные клетки, содержащие более 86 хромосом.
В опытах использовали мышей линии С57Bl и F1(CBAxC57Bl). Животных облучали в контейнерах из органического стекла толщиной 5 мм, расположенных на различных расстояниях от реактора. При проведении облучения на реакторе БАРС-6 в двух изучаемых режимах контейнеры с животными располагали на одних и тех расстояниях от реактора. Через 24 часа после облучения мышей забивали, извлекали костный мозг и тимус, которые использовали для определения аберраций хромосом и числа тимомоцитов. За 2 часа до забоя для накопления метафаз мышам вводили внутрибрюшинно по 0,2 мл 0,025 %-ного раствора колхицина. Клетки костного мозга гипотонизировали в 0,075 М KCl в течение 20 минут при температуре 37 ° С. По окончании гипотонизации клетки осаждали центрифугированием, фиксировали в смеси, состоящей из метилового спирта и ледяной уксусной кислоты в соотношении 3:1, наносили на предметные стекла, высушивали над пламенем и окрашивали азур-эозином.
Результаты и обсуждение
Особенность использования реактора БАРС-6 в режиме одиночного импульса и непрерывном режиме состоит в том, что в обоих режимах потоки нейтронов создавали одну и ту же поглощенную дозу смешанного гамма-нейтронного излучения, величина которой определялась расстоянием от реактора [2, 4]. Обработка методом двухфакторного дисперсионного анализа экспериментально полученных результатов дозиметрических измерений подтвердила этот факт и показала отсутствие (p>0,05) статистически достоверной разницы в поглощенных дозах, создаваемыми двумя режимами облучения на одних и тех расстояниях от реактора. Результаты обработки экспериментальных данных показали, что вклад гамма-компоненты в общую дозу смешанного гамма-нейтронного излучения различен на различных расстояниях от реактора (р<0,05), однако для режима одиночного импульса и непрерывного режима облучения этот вклад одинаков (p>0,05) для объектов, расположенных одних и тех же расстояниях от реактора. В табл. 1 приведены для различных расстояний от реактора БАРС-6 усредненные для этих режимов данные о поглощенных дозах смешанного гамма-нейтронного излучения и вкладе в общую дозу гамма-компоненты. Следует отметить, что дозиметрия гамма-нейтронного импульсного излучения представляет серьезную научную задачу, поскольку на разных расстояниях от реактора не только изменяется соотношение гамма- и нейтронного излучения, но, что более существенно, изменяется и энергетический спектр нейтронов. В связи с этим данные табл. 1 следует рассматривать в качестве полученных с точностью 15-25 % оценочных данных о поглощенных дозах, и которые в процессе проведения дальнейших исследований будут уточняться.
Таблица 1 Дозиметрические характеристики смешанного гамма-нейтронного излучения на различных расстояниях от реактора
|
Расстояние от реактора , м |
Доза смешанного гамма - нейтронного излучения , Гр |
Доля γ - компоненты в общей дозе излучения , % |
Мощность дозы при различных режимах облучения , Гр / с |
||
|
одиночный импульс II |
непрерывный |
||||
|
0 |
808,0 |
8,0 |
8,1 ⋅ |
106 |
0,22 |
|
100 |
671 |
8,7 |
6,7 ⋅ |
106 |
0,19 |
|
200 |
371 |
9,8 |
3,7 ⋅ |
106 |
0,10 |
|
300 |
191 |
12,0 |
1,9 ⋅ |
106 |
0,053 |
|
400 |
117 |
12,7 |
1,2 ⋅ |
106 |
0,032 |
|
800 |
40 |
20,1 |
0,4 ⋅ |
106 |
0,011 |
|
6500 |
2,8 |
37,9 |
2,6 ⋅ |
106 |
0,047 |
|
8500 |
2,1 |
46,2 |
2,0 ⋅ |
106 |
0,036 |
|
10200 |
1,6 |
50,8 |
1,5 ⋅ |
106 |
0,026 |
|
12000 |
1,1 |
44,3 |
1,0 ⋅ |
106 |
0,018 |
|
15000 |
0,62 |
35,7 |
0,6 ⋅ |
106 |
0,010 |
Примечание : расстояние 0 мм означает , что образцы были размещены непосредственно на наруж ной поверхности реактора .
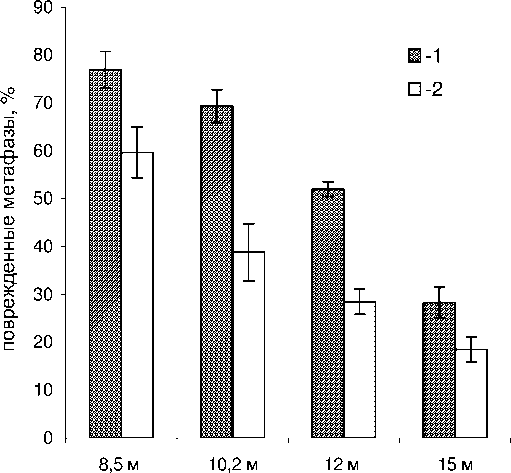
Учитывая особенности облучения на реакторе БАРС-6, нами сравнивалось действие излучений различной мощности дозы на объекты, которые были расположены на одинаковых для обоих режимов расстояниях от реактора. Было проведено облучение мышей смешанным гамма-нейтронным излучением реактора БАРС-6 в режиме одиночного импульса длительностью порядка 100 мкс и в режиме непрерывного облучения длительностью 60 минут. В каждую группу мышей, облученных в этих режимах на различных расстояниях от реактора, входило по 3-4 животных, у каждого из которых анализировали по 100 метафаз. На рис. 1 и 2 представлены данные, полученные при цитогенетическом анализе хромосомных аберраций в костном мозге мышей линии С57Bl и мышей линии F1(CBAxC57Bl), облученных на реакторе БАРС-6. У необ-лученных животных в костном мозге мышей линии С57Bl6 содержание поврежденных метафаз составляло 2,3±0,9 %, а у мышей линии F1(CBAxC57Bl) процент поврежденных метафаз составлял 0,6±0,4 %. Полученные результаты свидетельствуют о том, что через 24 часа после облучения мышей в костном мозге увеличивается содержание метафаз с аберрациями хромосом. Выход аберраций увеличивается по мере уменьшения расстояния от реактора, что является следствием увеличения дозы облучения по мере приближения мышей к реактору. Методом двухфакторного дисперсионного анализа была проведена статистическая обработка данных о появлении поврежденных метафаз в костном мозге мышей при облучении в режиме одиночного импульса и непрерывном режиме. Результаты проведенной статистической обработки данных показали у анализируемых линий мышей наличие достоверной (p<0,001) разницы между двумя режимами облучении в отношении индукции поврежденных метафаз. Аналогичные данные о более эффективном цитогенетическом воздействии облучения в режиме одиночного импульса были получены при анализе общего числа аберраций в метафазах костного мозга двух линий мышей. В отличие от результатов определения аберраций хромосом при анализе клеточности тимуса не было обнаружено статистически достоверной разницы в эффективности лимфолитического действия режима облучения одиночным импульсом и непрерывного режима облучения.
расстояние от реактора, м
Рис. 1. Поврежденные метафазы, %, в костном мозге мышей линии С57Bl, облученных на реакторе БАРС-6 при различных режимах облучения.
-
1 – облучение одиночным импульсом ; 2 – непрерывный режим облучения .
Абсцисса – расстояние от реактора , м . Ордината – % поврежденных метафаз .
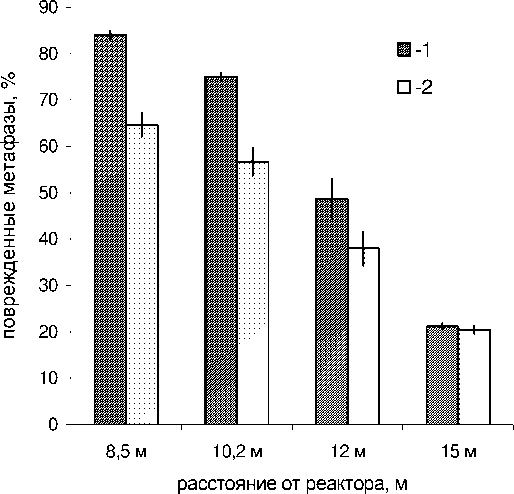
Рис. 2. Поврежденные метафазы, %, в костном мозге мышей линии F1(С57BlxCBA), облученных на реакторе БАРС-6 при различных режимах облучения.
1 – облучение одиночным импульсом ; 2 – непрерывный режим облучения . Абсцисса – расстояние от реактора , м . Ордината – % поврежденных метафаз .
Было изучено влияние различных режимов гамма-нейтронного излучения реактора БАРС-6 на выход хромосомных аберраций в метафазах первого митоза облученных лимфоцитов периферической крови человека. Проведенные ранее исследования [12] показали, что выход аберраций хромосом в метафазах первого митоза одинаков при различных (до 120 часов) сроках культивирования облученных лимфоцитов. Поэтому нами были суммированы результаты определения аберраций хромосом в метафазах первого митоза, полученных после культивирования лимфоцитов с ФГА и бромдезоксиуридином в течение 48 и 72 часов. В контроле в метафазах первого митоза процент поврежденных клеток составлял в среднем 1,1 ± 0,5 %. Как следует из данных, представленных на рис. 3, в метафазах первого митоза при облучении смешанным гамма-нейтронным излучением реактора БАРС-6 выход аберраций хромосом увеличивается по мере приближения облучаемых образцов к активной зоне реактора. Методом двухфакторного дисперсионного анализа была проведена статистическая обработка данных о появлении поврежденных метафаз при облучении в режиме одиночного импульса и непрерывном режиме облучения лимфоцитов. Результаты проведенного статистического анализа показали отсутствие достоверной (p>0,05) разницы в появлении поврежденных метафаз под влиянием этих режимов облучения. Аналогичные результаты об отсутствии достоверной разницы между эффективностью действия гамма-нейтронного излучения различной мощности дозы на лимфоциты человека были получены и при двухфакторном дисперсионном анализе результатов определения числа индуцированных структурных аберраций, приходящихся на одну метафазу первого митоза.
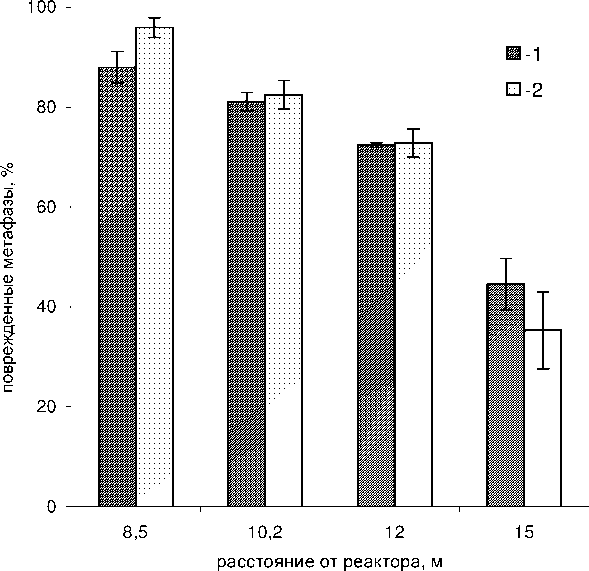
Рис. 3. Поврежденные метафазы первого митоза, %, в лимфоцитах периферической крови человека, облученных на реакторе БАРС-6 при различных режимах облучения. 1 – облучение одиночным импульсом; 2 – непрерывный режим облучения.
Абсцисса – расстояние от реактора, м. Ордината – % поврежденных метафаз.
Для анализа возможных механизмов различной чувствительности кариоцитов костного мозга мышей и лимфоцитов человека к воздействию гамма-нейтронного излучения в режиме одиночного импульса и непрерывном режиме был исследован качественный состав индуцированных структурных аберраций хромосом. В табл. 2 приведены результаты определения соотношения аберраций хромосомного и хроматидного типов в лимфоцитах человека и костном мозге мышей при различных условиях облучения гамма-квантами 60Со и гамма-нейтронным излучением реактора БАРС-6. При определении этого соотношения были суммированы результаты анализов аберраций хромосом при дозах излучения, индуцирующих более 10 % поврежденных метафаз. Лимфоциты периферической крови представлены естественно синхронизированной популяцией клеток, находящихся на стадии G0. Анализ качественного состава структурных аберраций хромосом (табл. 2) свидетельствует о том, что при воздействии гамма-квантов на лимфоциты в стадии G0 (дозы 0,5-3 Гр) в метафазах индуцируются структурные аберрации, более 90 % которых представлены аберрациями хромосомного типа. В то же время при облучении лимфоцитов на стадии G2 более 95 % индуцируемых аберраций составляют аберрации хроматидного типа. При облучении лимфоцитов на стадии G0 смешанным гамма-нейтронным излучением с различной мощностью дозы более 90 % индуцируемых аберраций представлены аберрациями хромосомного типа (табл. 2). Эти результаты находятся в соответствии с извест- ными в литературе данными [13] о смене типов аберраций хромосом при облучении клеток на различных стадиях клеточного цикла. Согласно этим данным, лучевое воздействие на пресин-тетических стадиях G0 и G1 индуцирует появление аберраций хромосомного типа. При облучении на постсинтетической стадии G2 индуцируются аберрации хроматидного типа, а на стадии S в метафазах появляются аберраций как хромосомного, так и хроматидного типов.
Таблица 2 Соотношение аберраций хромосомного (ХС) и хроматидного (ХТ) типов в лимфоцитах человека и костном мозге (КМ) мышей при различных условиях гамма ( у ) облучения и гамма-нейтронного ( у , n) облучения на реакторе БАРС-6 в режиме одиночного импульса и непрерывном режиме
|
Объект |
Условия облучения |
Число метафаз |
Общее число ХС и ХТ аберраций |
Соотношение, %, ХС и ХТ аберраций |
|
|
Лимфоциты, стадия G0 |
γ -кванты 60Со, 0,5 Гр/мин |
3167 |
1401 |
ХС ХТ: |
: 94,3 ± 3,6 5,7 ± 3,6 |
|
Лимфоциты, стадия G2 |
γ -кванты 60Со, 0,5 Гр/мин |
1350 |
1287 |
ХС ХТ: |
: 1,7 ± 1,3 98,3 ± 1,3 |
|
Лимфоциты, стадия G0 |
( γ ,n)-излучение, импульс 100 мкс |
1246 |
1889 |
ХС ХТ: |
: 97,1 ± 3,2 2,9 ± 3,2 |
|
Лимфоциты, стадия G0 |
( γ , n)-излучение, непрерывный |
1067 |
1477 |
ХС ХТ: |
: 96,1 ± 3,6 3,9 ± 3,6 |
|
КМ, мыши С57Bl |
γ -кванты 60Со, 0,5 Гр/мин |
700 |
227 |
ХС ХТ: |
: 45,4 ± 5,4 54,6 ± 5,4 |
|
КМ, мыши F1(CBAxC57Bl) |
γ -кванты 60Со, 0,5 Гр/мин |
1400 |
632 |
ХС ХТ: |
: 38,1 ± 2,9 62,9 ± 2,9 |
|
КМ, мыши С57Bl |
( γ , n)-излучение, импульс 100 мкс |
1200 |
2530 |
ХС ХТ: |
: 58,7 ± 1,9 41,3 ± 1,9 |
|
КМ, мыши С57Bl |
( γ , n)-излучение, непрерывный |
1563 |
1505 |
ХС ХТ: |
: 57,1 ± 1,5 42,9 ± 1,5 |
|
КМ, мыши F1(CBAxC57Bl) |
( γ , n)-излучение, импульс 100 мкс |
1285 |
4208 |
ХС ХТ: |
: 46,2 ± 1,3 53,8 ± 1,3 |
|
КМ, мыши F1(CBAxC57B) |
( γ , n)-излучение, непрерывный |
1500 |
3026 |
ХС ХТ: |
: 52,8 ± 1,8 47,2 ± 1,8 |
Как следует из данных, представленных в табл. 2, у мышей, облученных на реакторе БАРС-6, в метафазах костного мозга доля индуцируемых аберраций хромосомного типа составляет 46-58 %. Возможной причиной повышения выхода аберраций хроматидного типа состоит в том, что популяция кариоцитов гетерогенна и представлена клетками, находящимися в момент облучения на пресинтетической, синтетической и постсинтетической стадиях клеточного цикла. При облучении такой гетерогенной популяции, с учетом возможной радиационной задержки продвижения по циклу, индуцируются аберрации как хромосомного, так и хроматидного типов. Следует также отметить, что согласно данным литературы [13, 14] повышенный уровень аберраций хроматидного типа может также указывать на появление в пресинтетической стадии клеточного цикла длительно живущих потенциальных повреждений, которые реализуются в постсинтетической стадии в хроматидные аберрации. Предполагается [13, 14], что появление таких потенциальных повреждений может быть следствием ингибирования репарации разрывов ДНК.
Наряду со структурными аберрациями хромосом, появляющимися в результате воздействия кластогенных факторов (ионизирующее излучение, блеомицин, митомицин), важнейшим показателем нарушения хромосомного аппарата клеток является изменения числа хромосом, вызываемое действием анеогенных факторов (винкрестин, винбластин, таксол и другие), нарушающих структуру митотического веретена. Предполагается, что анеуплоидия и полиплоидия играет существенную роль в индукции канцерогенеза и хромосомной нестабильности [15, 16]. Проведенные нами исследования показали, что под влиянием смешанного гамма-нейтронного излучения различной мощности в метафазах лимфоцитов человека увеличивается число полиплоидных клеток (ППК).
При анализе 979 метафаз первого, второго, третьего и четвертого митозов необлученных лимфоцитов не было найдено ни одной ППК, в то время как при анализе 5297 метафаз первого-четвертого митозов облученных лимфоцитов было найдено 335 ППК. Из 335 ППК в метафазах первого митоза было найдено 8 ППК (2,4 %), в метафазах второго митоза было найдено 233 ППК (69,6 %), в метафазах третьего митоза было найдено 91 ППК (27,2 %) и 3 ППК (0,8 %) было найдено в метафазах четвертого митоза. Полученные данные свидетельствуют о том, что более 96 % ППК, индуцированных гамма-нейтронным излучением, появляются в метафазах второго и третьего митозов. В связи с этим представляло интерес выяснить связь между числом аберраций хромосом, индуцированных облучением в метафазах первого митоза, и долей (%) ППК в метафазах второго и третьего митозов. Для этого образцы крови располагали на различных расстояниях (15 м, 12 м и 10,2 м) от активной зоны реактора, облучали в условиях одиночного импульса и непрерывном режиме. Данные по анализу процента аберрантных метафаз первого митоза при различных дозах гамма-нейтронного излучения различной мощности дозы приведены на рис. 3. На рис. 4 приведены данные о проценте ППК в метафазах второго и третьего митозов при различных уровнях повреждения хромосом в метафазах первого митоза. Полученные данные свидетельствуют о том, что по сравнению с импульсным режимом при одном и том же числе структурных аберраций хромосом непрерывный режим гамма-нейтронного излучения индуцирует в метафазах второго и третьего митозов большее число ППК.
Известно, что изменение численного содержания хромосом под влиянием анеогенных факторов является следствием не только повреждения хромосом, но влиянием этих факторов на структуру митотического веретена, в состав которого входят белково-липидные комплексы. В этой связи представляло интерес оценить эффективность гамма-нейтронного излучения различной мощности в повреждении мембранных структур.
Для исследования радиационной пероксидации липосом при различных мощностях дозы смешанного гамма-нейтронного излучения реактора БАРС-6 в облученных суспензиях липосом определяли содержание малондиальдегида (МДА), который является одним из основных конечных продуктов перекисного окисления липидов. На рис. 5 представлены результаты анализа появления МДА в облученных суспензиях липосом. Полученные результаты свидетельствуют о том, что гамма-нейтронное излучение реактора БАРС-6 увеличивает содержание МДА в липосомах, однако при облучении образцов на расстояниях менее 200 мм от реактора процесс об- разования МДА выходит на плато. Как следует из полученных данных, при одних и тех же поглощенных дозах непрерывное облучение суспензии липосом в течение 60 минут в среднем в 3,8 раза более эффективно увеличивает содержание МДА в липосомах по сравнению с режимом облучения в виде одиночного импульса длительностью 100 мкс.
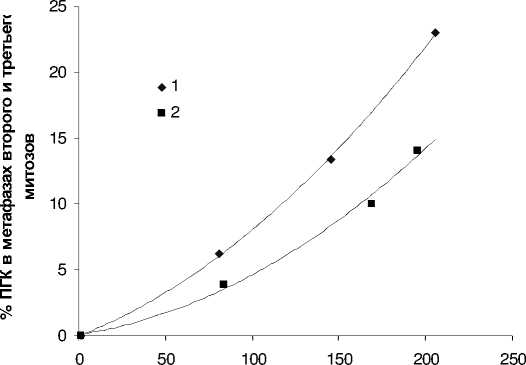
число аберраций на 100 метафаз первого митоза
Рис. 4. Содержание полиплоидных клеток (ППК), %, в метафазах второго и третьего митозов при различных уровнях аберраций хромосом в метафазах первого митоза.
1 – непрерывный режим облучения; 2 – облучение одиночным импульсом. Абсцисса – число аберраций хромосом на 100 метафаз первого митоза. Ордината – % ППК в метафазах второго и третьего митозов.
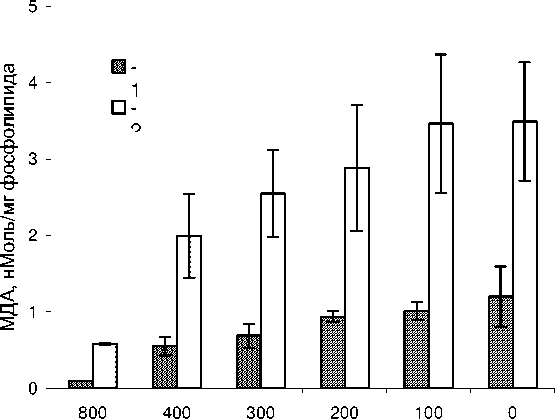
расстояние от реактора, мм
Рис. 5. Радиолиз суспензии липосом смешанным гамма-нейтронным излучением различной мощности дозы.
-
1 – облучение в режиме одиночного импульса; 2 – непрерывный режим облучения. Абсцисса – расстояние от реактора, мм. Ордината – концентрация малондиальдегида, нМоль на 1 мг фосфолипида.
Дальнейшее исследование влияние мощности дозы на радиолиз водных растворов был проведен с использованием ферросульфатного раствора Фрике. Полученные данные показали, что облучение раствора ферросульфата увеличивает концентрацию Fe(3+) за счет радиационного окисления Fe(2+). Степень радиационного окисления Fe(2+) увеличивается по мере приближения образцов к реактору, однако оба режима облучения при одних и тех же поглощенных дозах имеют одинаковую эффективность в отношении изменения этого показателя. Аналогичные результаты были получены и при исследовании влияния гамма-нейтронного излучения БАРС-6 на появление в облученных растворах БСА белковых перекисей (ROOH). Сравнительный анализ растворов БСА, облученных в режиме одиночного импульса и в непрерывном режиме, свидетельствует о том, что оба режима облучения на одних и тех расстояниях от реактора практически с одинаковой эффективностью увеличивают концентрацию перекисей белков в растворах БСА.
Результаты, полученные при анализе суспензий липосом, растворов ферросульфата и БСА, свидетельствуют о том, что изменение мощности дозы гамма-нейтронного излучения по-разному влияет на радиолиз исследуемых систем. При малых интенсивностях излучения радикальные продукты, диффундирующие в объем раствора из ионизационных треков, практически все перехватываются растворенными соединениями и не рекомбинируют, поскольку не достигают соседних треков. При больших мощностях дозы треки располагаются достаточно близко друг от друга и, несмотря на присутствие в растворе перехватчиков, часть радикалов достигают соседних треков и рекомбинируют. Можно выделить несколько факторов, способствующих снижению эффективности радиационной пероксидации липосом при высоких мощностях дозы смешанного гамма-нейтронного излучения. Одной из причин снижения эффективности окислительной модификации липосом при облучении их суспензий в режиме одиночного импульса может служить концентрационная гетерогенность фосфолипидных эмульсий, что повышает вероятность рекомбинации радикальных продуктов в микрообъемах воды, находящихся вне ли-посомных структур. Известно, что кислород существенно ускоряет процессы радиационной пероксидации липидов. Поэтому нельзя исключить участия в снижении эффективности повреждения фосфолипидов липосом при высоких мощностях доз гамма-нейтронного излучения и радиационного уменьшения концентрации кислорода, которое не восполняется за счет диффузионных процессов во время проведения облучения одиночным импульсом длительностью 100 мкс.
Полученные данные свидетельствуют о дифференциальной чувствительности изученных показателей к повреждающему действию смешанных гамма-нейтронных излучений различной мощностью дозы. Повышенная эффективность цитогенетического действия импульсного гамма-нейтронного излучения на костный мозг мышей (рис. 1, 2) может быть связана с естественной гетерогенностью клеточной популяции кариоцитов (табл. 2), находящихся на различных стадиях клеточного цикла, и увеличением выхода аберраций хромосом в этих клетках за счет ингибирования репарационных процессов при импульсном режиме облучения. В тоже время полученные нами данные свидетельствуют о том, что непрерывный режим облучения более эффективен в повышении уровня полиплоидизации клеток (рис. 4) и нарушении мембранных структур (рис. 5).
Полученные нами результаты позволяют сделать вывод о том, что импульсный режим облучения более эффективен в повреждении генетического аппарата делящихся клеток и в то же время менее эффективен в индукции полиплоидных клеток и повреждении мембранных структур. Увеличенная степень полиплоидизации клеток, повышающая риск возникновения вторичного канцерогенеза, и повышенная пероксидация липидов может приводить к развитию постлучевых повреждений в нормальных тканях. В этой связи проведенные нами исследования дают основание полагать, что использование для лучевой терапии импульсных источников гамма-нейтронного излучения позволит повысить поражаемость генетического аппарата делящихся злокачественных клеток и снизить риск появления побочных эффектов воздействия излучения, связанных с развитием повреждения мембранных структур нормальных тканей и развитием у них опасности возникновения отдаленных канцерогенных эффектов.
Работа выполнена при финансовой поддержке РФФИ и Правительства Калужской области (проект 04-04-97240).
Список литературы Молекулярные и клеточные механизмы действия смешанного гамма-нейтронного излучения различной мощности дозы
- Hall E., Brenner D. The dose-rate effect revisited: radiobiological considerations of importance in radiotherapy//Radiation Oncology Biol. Phys. -1991. -V. 21. -P. 1403-1414.
- Цыб А.Ф., Ульяненко С.Е., Мардынский Ю.С. и др. Нейтроны в лечении злокачественных новообразований. Научно-методическое пособие. -Обнинск: МРНЦ РАМН, 2003. -110 с.
- Даренская Н.Г., Козлова Л.Б., Акоев И.Г. и др. Относительная биологическая эффективность излучений. Фактор времени облучения. -М.: Атомиздат, 1968. -376 с.
- Прохоров Ю.А., Кононов В.И., Кувшинников В.И. и др. Дозиметрия на импульсном реакторе БАРС-6//Атомная энергия. -1998. -Т. 85, № 5. -С. 391-397.
- Поздышкина О.В., Севанькаев А.В., Обатуров Г.М. Сравнительное изучение закономерностей образования аберраций хромосом в культуре лимфоцитов человека при импульсном и пролонгированном нейтронном облучении//Радиационная биология. Радиоэкология. -2000. -Т. 40, № 6. -С. 251-255.
- Филимонов А.С., Обатуров Г.М. Математическое моделирование радиобиологических эффектов при действии стационарного и импульсного нейтронного излучения//Атомная энергия. -1998. -Т. 85, № 5. -С. 396-400.
- Рябченко Н.И., Ульяненко С.Е., Антощина М.М. и др. Действие смешанного у-нейтронного излучения с различной мощностью дозы на содержание клеток в тимусе и хромосомы костного мозга мышей и лимфоцитов человека//Радиационная Биология. Радиоэкология. -2005. -Т. 45, № 5. -С. 592-598.
- Цыб Т.С., Комарова Е.В., Потетня В.И. и др. Биологическая эффективность импульсного и непрерывного нейтронного излучения для клеток дрожжей Sacharamyces//Радиационная биология. Радиоэкология. -2001. -Т. 41, № 3. -С. 291 -295.
- Корякина Е.В., Севанькаев А.В., Потетня В.И., Потетня О.И. Цитогенетическое действие излучения импульсного реактора БАРС в режиме непрерывного и однократного импульсного воздействия со сверхвысокой мощностью дозы на лимфоциты человека//Радиационная Биология. Радиоэкология. -2005. -Т. 45, Вып. 4. -С. 405-411.
- Ульяненко С.Е., Ротт Г.М., Кузнецова М.Н. и др. Выживаемость мышей и содержание металлотионеинов в их печени и почках как критерий оценки воздействия импульсного нейтронного излучения//Радиационная биология. Радиоэкология. -2000. -Т. 40, № 4. -С. 396-400.
- Рябченко Н.И., Ульяненко С.Е., Рябченко В.И. и др. Радиолиз липосом, растворов ферросульфата и альбумина смешанным у-нейтронным излучением с различной мощностью дозы//Радиационная Биология. Радиоэкология. -2005. -Т. 45, № 5. -С. 571-573.
- Рябченко Н.И., Антощина М.М., Насонова В.А. и др. Аберрации хромосом в лимфоцитах человека при различной продолжительности культивирования после облучения//Радиационная Биология. Радиоэкология. -2004. -Т. 44, № 2. -С. 146-150.
- Севанькаев А.В. Радиочувствительность хромосом лимфоцитов человека в митотическом цикле. -М.: Энергоатомиздат, 1987. -158 с.
- Дубинин Н.П. Потенциальные изменения в ДНК и мутации. -Молекулярная цитогенетика. -М.: Наука, 1978.-246 с.
- Li R., Sonik A., Stindl R. et al. Aneuploidy vs. gene mutation hypotasis of cancer: Resend study claims mutation but is found to support aneuploidy//Proc. Natl. Acad. Sc. USA. -2000. -V. 97, N 7. -P. 3236-3241.
- Olaharski A.J., Sotekr R., Solorza-Luna G. et al. Tetraploidy and chromosomal instability are early events during cervical carcinogenesis//Carcinogenesis. -2006. -V. 27, N 2. -P. 337-343.


