Молекулярные маркеры генов, определяющих эффективность минерального питания у риса (Oryza sativa L.): мини-обзор
Автор: Гончарова Ю.К., Харитонов Е.М., Шелег В.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Зерновые: генетический потенциал, селекционное улучшение, агробиотехнологии
Статья в выпуске: 3 т.52, 2017 года.
Бесплатный доступ
В настоящее время на Азию и Европу приходятся самые высокие нормы расхода минеральных удобрений. Возникают серьезные проблемы, связанные с загрязнением окружающей среды, в том числе наблюдается подкисление почвы и воды, загрязнение поверхностных и подземных водных объектов, возрастает выброс парниковых газов. У риса, пшеницы и кукурузы коэффициент использования азота составляет 26-30 %, у овощных культур - менее 20 % (K. Vinod с соавт., 2012). Последние 50 лет селекция сортов ведется на фоне высоких доз минерального питания. Сорта, которые высокопродуктивны за счет внесения удобрений, как правило, менее эффективно их используют. Кроме того, урожайность таких сортов очень нестабильна, поскольку на нее в значительной мере влияют дозы удобрений, сроки их внесения, температура окружающей среды и другие факторы. В настоящей статье рассмотрены механизмы приспособления растений риса к низкому содержанию азота и фосфора и генотипические различия образцов по эффективности использования этих элементов. Отмечается различная реакция генотипов на дозы вносимого азота и фосфора, а также влияние источника элемента питания и взаимодействия генотип-среда на реакцию сортов. Сравнение генотипов риса показало 20-кратное различие в эффективности усвоения фосфора между крайними типами (M. Wissuwa с соавт., 2001). Все высокоэффективные генотипы - это стародавние сорта или эндемичные образцы. Питательные вещества в почве должны быть переведены в доступную для растений форму. Так, генотипические различия в эффективности использования фосфора у разных культур связаны с неодинаковой активностью фосфатаз. Фитиновая кислота - одно из веществ, способствующих переводу связанного фосфора в доступный (A.E. Ric-hardson с соавт., 2001). Ее образуют корни растений и микроорганизмы, поэтому свойство корней поддерживать выгодные микробные сообщества служит дополнительным адаптивным механизмом. Другие приспособления растений к низкому содержанию азота и фосфора могут быть связаны с увеличением поверхности корневой системы, интенсификацией поглощения элементов, повышением внутренней эффективности их использования, а также с биосинтезом и выделением корнями органических кислот, повышающих доступность элементов питания (H. Lambers с соавт., 2006). Под внутренней эффективностью в указанном случае понимается перераспределение поступающего элемента питания между генеративными и вегетативными органами, между листьями одного или разных побегов и т.д. Вариабельность по эффективности использования элементов минерального питания среди генотипов риса главным образом объясняется различиями в росте корневой системы, что увеличивает площадь питания растений. Вариабельность устойчивости к недостатку фосфора в большей степени связана с различиями генотипов риса по способности поглощать этот элемент, в то время как эффективность его использования оказывает незначительное влияние. Описаны молекулярные маркеры, которые сцеплены с QTL, определяющими эффективность минерального питания у риса, - RM 53, RM 25, RM 600, RM 242, RM 235, RM 247, RM 322, RM 13, RM 261, RM 19 (D. Wei с соавт., 2012; Y. Cho с соавт., 2007). У российских сортов риса выявлен полиморфизм для всех изученных маркеров QTL, определяющих эффективность поглощения элементов минерального питания (Ю.К. Гончарова с соавт., 2015), что позволяет вести маркерную селекцию по этому признаку и отбор сортов-доноров.
Рис, минеральное питание, эффективность использования азота и фосфора, микросателлитные (ssr) маркеры
Короткий адрес: https://sciup.org/142213806
IDR: 142213806 | УДК: 633.18:631.811:631.523:575.116 | DOI: 10.15389/agrobiology.2017.3.515rus
Текст обзорной статьи Молекулярные маркеры генов, определяющих эффективность минерального питания у риса (Oryza sativa L.): мини-обзор
Доступность азота и фосфора для усвоения — один из наиболее важных факторов, определяющих продуктивность сельскохозяйственных культур. При недостатке удобрений питательные вещества в почве не пополняются, что ведет к ее деградации и снижению урожаев (1-3). В то же время избыточное использование удобрений на территории Евросоюза привело к накоплению азота в почве, которое угрожает устойчивости 70 % агроценозов. До сих пор не уделялось достаточного внимания повышению эффективности минерального питания у создаваемых сортов риса и других культур, однако работы в этом направлении необходимы. Важно изучать как механизмы устойчивости к недостатку элементов минерального питания в почве, так и гены, определяющие формирование этого признака. В представленном обзоре обсуждаются основные достижения и проблемы генетики минерального питания у риса (Oryza sativa L.), а также перспективы молекулярно-генетических подходов для повышения его эффективности.
В последние 40 лет минеральные удобрения обеспечивают 40 % прироста производства продовольствия. Их применение в мире с 1961 по 2002 год выросло почти на 350 % (с 33 до 146 млн т) и часто наносит вред окружающей среде (4, 5). В настоящее время на Азию и Европу приходятся самые высокие нормы расхода минеральных удобрений на 1 га. Как последствие наблюдается подкисление почвы и воды, загрязнение поверхностных и подземных водных объектов, увеличение выброса парниковых газов. Воздействие минеральных удобрений на окружающую среду определяется их количеством, методами и сроками внесения. Задача состоит в том, чтобы отказаться от нерациональных методов и перейти к земледелию, которое обеспечит надежную основу для устойчивой интенсификации растениеводства.
Азот как базовый компонент многих органических молекул, нуклеиновых кислот, белков необходим для развития растений в значительно большем количестве, чем другие минеральные элементы. Будучи наиболее доступным элементом в атмосфере (78 %), он становится лимитирующим фактором в большинстве сельскохозяйственных экосистем. Его запасы в почве составляют 2-20 т/га, однако растениям доступна лишь незначительная часть (3). Для риса, пшеницы и кукурузы коэффициент использования азота составляет 26-30 %, для овощных культур — менее 20 % (6-8).
Некоторое количество аммонийных удобрений, а также аммония, накапливающегося при минерализации органических соединений, закрепляется почвенными минералами (иллитом, монтмориллонитом, вермикулитом и др.). Азот почвы, входящий в состав гумусовых соединений, трудно разлагается микроорганизмами. Небольшое количество азота входит в другие органические (аминокислоты, аминосахара, нуклеиновые кислоты и т.д.), а также в минеральные (преимущественно аммоний и азотная кислота) соединения. Аммонийный азот, образующийся в процессе аммонификации и внесенный с удобрениями, нестабилен. Под влиянием нитрифицирующих бактерий он окисляется до азотной кислоты. Нитраты не поглощаются почвенными коллоидами и могут вымываться из почвы. Также азот попадает в атмосферу за счет восстановления нитратного азота до свободного молекулярного азота (N2) или до газообразных окиси и закиси азота (NO и N2O) (7, 8). Только небольшое количество азота остается в почве и доступно следующим поколениям растений. В большинстве случаев на хорошо аэрируемых почвах они используют азот в форме нитратов (NO3), на плохо аэрируемых или затопленных почвах — в аммонийной форме (NН4+) (4). Хотя на поглощение NH4+ требуется меньше энергии, немногие растения (в их число входит рис) способны расти, используя только эти ионы (9).
Фосфор — по важности второй после азота неорганический элемент питания растений и один из наименее доступных. В почве он находится преимущественно в связанном состоянии. Приблизительно 5,7 млрд га почв во всем мире содержат недостаточное количество доступного для растений фосфора. Почти 50 % почв, занятых под рисом, в настоящее время обеднены этим элементом. Дефицит фосфора может существенно затронуть рост и развитие риса. Растения, выращенные на почвах с дефицитом фосфора, чахлые, с темно-зелеными листьями, подавленным развитием корневой системы и сниженным кущением (4, 5). Задерживается их созревание, повышается пустозерность, снижается качество зерна. Этот дефицит может быть 516
ликвидирован посредством применения удобрений, которые фермеры часто не вносят из-за высокой цены. Кроме того, природные фосфаты горных пород, относительно легкодоступные растениям, представляют ресурс, который может быть исчерпан к концу XXI века (10). Получение сортов культурных растений, способных к более эффективному поглощению связанного фосфора из почвы, формированию высоких урожаев при внесении невысоких доз фосфорных удобрений и более эффективному использованию поглощенного фосфора, имеет первостепенную важность (11).
С 2008 по 2012 год потребление удобрений возрастало ежегодно на 1,7 %, или на 15 млн т, в 2012 году потребление азота увеличилось на 1,4 %, или 7,3 млн т (12). В то же время отмечено снижение эффективности удобрений в расчете на 1 кг получаемой продукции и снижение темпов прироста урожайности риса с 1,6 % в 1990 году до менее 1 % в 2010 году (5). Другими факторами, заставляющими изменить стратегию использования удобрений, становятся рост цен на них, лимитированность запасов, а также загрязнение окружающей среды при бесконтрольном применении (2).
В последние 50 лет велась селекция сортов, характеризующихся высокой урожайностью на высоком фоне минерального питания (13). Однако внесение все больших доз удобрений привело к уменьшению их эффективности и увеличению влияния среды на продуктивность (14). Кроме того, урожайность таких сортов очень нестабильна.
Генотипические различия по эффективности по-гло ще ния эле ме нто в мин ер альн ого питания. Не только на дозы азота, но и на его источник генотипы реагируют неодинаково. Важным фактором также считается взаимодействие генотип—среда (15). Различают несколько признаков, связанных с потреблением азота, среди которых — толерантность к его дефициту (NDT) и эффективность использования (NUE) (16). У образцов риса установлены генотипические различия по способности усваивать фосфор при его дефиците (17-19). Сравнение 30 генотипов показало 20-кратное различие по этому показателю между крайними типами (20). Все высокоэффективные генотипы — стародавние сорта или эндемичные образцы. Современные высокоурожайные сорта недостаточно адаптированы к дефициту элементов минерального питания.
Механизмы приспособления растений к низкому содержанию азота и фосфора могут быть связаны с увеличением площади поверхности корней, интенсификацией поглощения элементов и внутренней эффективностью их использования. Под внутренней эффективностью понимается перераспределение поступающего фосфора между генеративными и вегетативными органами, между листьями одного или разных побегов и т.д. В работе M. Wissuwa (21) по изучению эффективности минерального питания у 30 генотипов риса (высокопродуктивные сорта и эндемичные образцы) вариабельность по этому признаку объяснялась главным образом различиями в росте корневой системы и, соответственно, увеличением площади питания растений. У риса устойчивость к недостатку фосфора в большей мере связана со способностью генотипов его поглощать, в то время как внутренняя эффективность использования оказывает незначительное влияние (21). При дефиците фосфора растения перераспределяют больше ассимилятов к корням, замедляя развитие побегов. Серьезный дефицит препятствует также росту корня (22, 23). Эффективный способ увеличения поверхности корневой системы состоит в увеличении длины и числа корней, а также количества корневых волосков. Несколько мутаций, затрагивающих их развитие, были локализованы у арабидопсиса. Гомологи некоторых генов, отвечающих за развитие корневых волосков, идентифицированы в геноме риса (24). Однако до сих пор не установлено, дифференцируют ли они генотипы риса на устойчивые и неустойчивые.
Модификации архитектоники корневой системы в почве, связанные с устойчивостью к недостатку фосфора, были отмечены у белого люпина, других бобовых растений и риса (25). У бобовых поглощающая способность корня оказалась ключевой при адаптации к дефициту фосфора (26). Роль этого механизма в повышении устойчивости риса к недостатку элемента не определена. Значительные различия по длине корней не всегда обеспечивают разницу в эффективности поглощения элементов минерального питания (22). Поэтому необходимо рассматривать все взаимосвязанные факторы, управляющие процессами адаптации. Факторы, вовлеченные в эффективную ремобилизацию, перемещение азота и фосфора в пределах растения и регулирование этих процессов на уровне генома, изучены мало (27, 28).
Б о льшая часть фосфора может находиться в почве в виде органических комплексов, которые переводятся в доступную для растения форму фосфатазами. У пшеницы генотипические различия в эффективности использования фосфора связаны с неодинаковой активностью фосфатаз (29, 30). У риса аналогичные различия не обнаружены (23). Фитиновая кислота (вещество, способствующее переводу связанного фосфора в доступный) часто присутствует в почвах, но корни растений образуют ее в очень небольших количествах, тогда как микроорганизмы могут выделять значительно больше кислоты, поэтому свойство корней поддерживать выгодные микробные сообщества служит дополнительным адаптивным механизмом (31). Большинство растений, включая рис, способны к симбиотическим ассоциациям с микоризными грибами. Эти взаимодействия генетически обусловлены (14). Однако в случае сорта Nipponbare стерилизация почвы не уменьшала эффективности поглощения фосфора (21). Биосинтез и выделение ризосферой органических кислот, повышающих доступность элементов, положительно сказывались на росте толерантности к дефициту азота, цинка и фосфора у пшеницы, ячменя, риса (32, 33).
Перспективы улучшения сортов риса связывают с идентификацией генетических детерминант толерантности к дефициту элементов минерального питания и переносом таких детерминант в высокоурожайные сорта, контролируемым с помощью молекулярных маркеров.
Локусы количественных признаков (QTL), определяющие толерантность к дефициту азота. При маркировании разных популяций риса на хромосомах 1-й, 2-й, 3-й, 4-й, 7-й, 9-й, 10-й и 11-й идентифицированы от 7 до 8 QTL, связанных с толерантностью к дефициту азота (NDT). За NDT принимают отношение величины признака при низком количестве азота (LN, 0 кг/га; в большинстве работ имеется в виду отсутствие дополнительных подкормок) к его значению при оптимальном минеральном питании (NN, 130 кг/га).
Индикаторами приспособленности сорта к недостатку азота служат продуктивность растения, урожай с делянки, количество полученной биомассы, высота растений, длина корней, содержание пигментов и т.д. (3436). Однако при анализе этих признаков было установлено, что у генотипов с низкой биомассой относительное значение показателя высокое (35). Наиболее информативными показателями посчитали относительный урожай зерна (урожай зерна LN/урожай зерна NN) ½ 100, относительную биомассу, относительное содержание азота в зерне и биомассе, отзывчивость на азот (NR кг/га, разница между потреблением азота растением на оптимальном и низком фоне минерального питания — TNf - TNo).
Эффективность использования азота определяют как разницу меж- ду значением на оптимальном и низком фоне минерального питания (36), физиологическую эффективность использования азота (PE, кг зерна/кг азота) — как отношение отзывчивости растения по урожаю зерна (GYf - GYo) к общей отзывчивости на азот (TNf - TNo).
-
1. QTL, связанные с эффективностью использования азота, которые выявлены при маркировании сортов риса ( Oryza sativa L.) подвида indica (Zhenshan 97 ½ Minghui 63) (37)
-
2. QTL, связанные с эффективностью использования азота, которые выявлены при маркировании сортов риса (Oryza sativa L.) подвида japonica (38)
Признак
Название локуса
Хромосома
Фланкирующие маркеры
Фенотипическое проявление признака, %
Содержание азота в зерне (NCG)
ncg8.1
8-я
RM25-S8090
10,2
ncg9
9-я
S9058-S9062
10,2
ncg10
10-я
S10023-S1001B
7,5
ncg8.2
8-я
S8055-RM72
32,1
Содержание азота в соломе (NCS)
ncs9
9-я
S9093-S9073
11,1
ncs10
10-я
S10019-S1001B
13,3
Содержание азота в побегах (TNCS)
tncs1b
1-я
RM600-RM312
19,7
tncs10
10-я
S1003-S10013
14,1
Индекс урожая (HI)
hi5b
5-я
RM87-RM31
8,7
hi7b
7-я
RM420-RM248
23,1
Урожай зерна (GY)
gy2b
2-я
S2052-S2054
6,9
gy9
9-я
RM242-RM215
12,9
Биомасса соломы (SY)
sy1b
1-я
RM600-RM312
12,1
sy8.1
8-я
S8055-RM72
23,8
sy8.2
8-я
RM25-S8090
8,4
sy5a
5-я
S5014B-S5029
9,6
sy5b
5-я
RM87-RM31
9,1
sy7b
7-я
RM420-RM248
8,4
sy12b
12-я
S12038-RM277
9,9
Физиологическая эффективность
pnue9
9-я
S9093-S9073
15,3
использования азота (PNUE)
-
3. Полиморфизм российских сортов риса (Oryza sativa L.) по маркерам, связанным с генами, которые определяют эффективное использование азота (12)
SSR маркер
Признак
Размер продукта, п.н.
Хромосома
Наличие полиморфизма
RM 53
Относительное содержание азота в биомассе (RBN)
182
2-я
Полиморфен, 2 аллеля
RM 25
Биомасса соломы (SY), содержание азота в зерне (NCG), адаптивность к засухе, эффективность фотосинтеза
146
8-я
Полиморфен, 2 аллеля
RM 600
Содержание азота в побегах (TNCS), биомасса соломы (SY)
220
1-я
Полиморфен, 5 аллелей
RM 242
Урожай зерна (GY), относительная биомасса (RBM), адаптивность к низким температурам
225
9-я
Полиморфен, 2 аллеля
П р и м е ч а н и е. 1 — название локуса; 2 — хромосома (год); 3 — фланкирующие маркеры; 4 — наиболее вероятная позиция гена, сМ; 5 — позиция на хромосоме, сМ; 6 — фенотипическое проявление признака, %; RGY = (GY 0 /GY F ) ½ 100; RBM = (BM 0 /BM F ) ½ 100; RGN = (GN 0 /GN F ) ½ 100; RBN = (BN 0 /BN F ) ½ 100; NR = TN f - TN o ; GR = GY f - GY o ; PE = (GY f - GY o )/(TN f - TN o ); GN o и GN f ; BM o и BM f ; BN o и BNF; TN0 и ТNF; GY0 и GYF — содержание азота в зерне; биомасса; содержание азота в биомассе; содержание азота в растении; урожай зерна (соответственно без удобрений — 0, с их использованием — F).
При маркировании сортов подвида indica (Zhenshan 97 ½ Minghui 63) выявлены QTL, связанные с эффективностью использования азота (табл. 1). QTL, определяющие этот признак (NUE), обнаружены на 1-й, 2-й, 3-й, 4-й, 6-й, 7-й, 9-й, 10-й и 11-й хромосомах (33-40). Для четырех геномных регионов показана связь с обоими изучаемыми признаками (NDT и NUE): на 1-й хромосоме этот регион фланкирован маркерами G393-C922, на 3-й — RM232-C63, на 4-й — G235-G102, на 7-й — RG678-R1440. Однако фенотипическое проявление многих из выявленных локусов было связано с влиянием года (погодных условий или других, не учтенных факторов) на признак (34). С максимальной отзывчивостью на азот были связаны три хромосомных региона на 4-й, 6-й и 10-й хромосомах, которые определяли соответственно 11,1; 16,6 и 7,5 % фенотипического проявления признака. Сухую биомассу растения в этой работе измеряли, срезая его под корень и высушивая при 75 ° С в течение 4 сут, азот — по Кьельдалю. Отмечена негативная корреляция между указанными признаками (36). В другой работе (37) выделены локусы, определяющие более высокий процент фенотипического проявления признака при маркировании сортов подвида japonica . Так, QTL ncg 8.2 , расположенный на 8-й хромосоме и фланкированный маркерами S8055-RM72, определял 32,1 % фенотипического проявления по признаку содержание азота в зерне. На индекс урожая при стрессе оказывал влияние локус hi7b (23,1 %), локализованный на 7-й хромосоме и фланкированный SSR маркерами RM420-RM248 (табл. 2). Фенотипическое проявление признака биомасса соломы определял локус sy8.1 (23,8 %), находящийся на 8-й хромосоме и фланкированный маркерами S8055-RM72 (38).
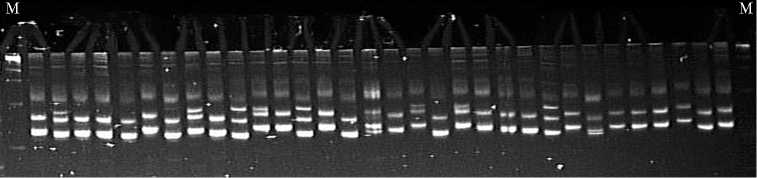
Рис. 1. Полиморфизм российских сортов риса ( Oryza sativa L.) по маркеру RM 600, связанному с генами, которые определяют эффективное использование азота: слева направо — Ханкай-ский, Садко, Приморский, Лиман, Гарант, Павловский, Рапан, Новатор, Серпантин, Боярин, Регул, Янтарь, Жемчуг, Лидер, Хазар, Аметист, Нарцисс, Дружный, Спринт, Виола, Дальневосточный, Фонтан, Касун, Юпитер, Атлант, Курчанка, Факел, Снежинка, Шарм, Анаит, Флагман, Изумруд; M — маркер молекулярной массы (12).
Изучение полиморфизма российских сортов по маркерам, связанным с генами, которые определяют эффективное использование азота, показало наличие полиморфизма по некоторым из них (12). Максимальное число аллелей отмечено при использовании маркера RM 600, расположенного на 1-й хромосоме (табл. 3, рис. 1).
Маркеры RM 242, RM 53, RM 25 выявляли по два аллеля. Наличие этого полиморфизма позволяет вести маркерную селекцию на эффективность использования азота, а также отбор доноров соответствующих генов среди российских сортов. Интересно, что указанные маркеры также были связаны с признаками, определяющими адаптивность к другим стрессам 520
(засухе, низким температурам).
QTL, определяющие толерантность к дефициту фосфора. Несмотря на широкую генетическую изменчивость по этому признаку, прогресс в создании высокоурожайных, эффективно использующих фосфор сортов риса невелик. Установлено, что наследование признаков, связанных с устойчивостью к дефициту фосфора, в значительной степени определяется двумя независимыми QTL (41). Основной локус, названный Pup1 и фланкированный маркерами RM 235 и RM 247, локализовали в 12-й хромосоме, расстояние между маркерами составляет 0,2 сМ. С использованием фланкирующих маркеров ген Pup1 был идентифицирован у сортов Дулар, IAC 47, IAC 25, AUS 257, Vary Lava 701. При кластеризация 80 сортов, несущих различные аллельные варианты гена Pup1 , аллель устойчивости идентифицировали у сортов, адаптированных к засухе. Он практически не встречался у сортов, культивируемых при орошении. Выделенные сорта-доноры характеризовались более длинной и разветвленной корневой системой по сравнению с другими генотипами, что подтверждает необходимость селекции на указанный признак при создании форм, устойчивых к дефициту фосфора. С помощью маркеров была проведена успешная интрогрессия гена Pup1 в ряд неустойчивых к этому стрессу сортов: IR 64, IR 74, Dodokah, Batur, Sity Bagendit (42, 43). Ген Pup1 определяет почти 80 % фенотипических различий в популяции (21).
Кроме того, в 6-й хромосоме выявлен локус с менее значительным эффектом. QTL на 6-й хромосоме определял 25-34 % фенотипических различий по признаку (41). Однако изучение его влияния в полевых условиях показало менее значительный эффект (23). Несколько минорных локусов были нанесены на генетические карты других хромосом (43-45). Некоторые из этих QTL локализованы в тех же хромосомных регионах, что и гены-кандидаты устойчивости к дефициту фосфора, выявленные ранее.
В другой маркированной популяции (Kasalath ½ Gimbozu) QTL, вызывающий удлинение корня при дефиците фосфора, также локализован в 6-й хромосоме (45). Позднее еще несколько локусов, участвующих в процессе усвоения фосфора, было выявлено на 1-й, 2-й, 5-й и 9-й хромосомах (43). Как правило, гены, определяющие адаптивность, располагаются кластерами, но других генов, связанных с признаком, кроме Pup1 , на 12-й хромосоме не обнаружили. Положительный эффект гена Pup1 был более явным, когда дефицит фосфора совпадал с водным дефицитом.
Расстояние между другими маркерами, которые фланкируют гены, определяющие устойчивость к недостатку фосфора, не превышает 12,9 сМ. Это позволяет применять их в генетических и селекционных исследованиях, поскольку при использовании двух маркеров для контроля включения аллеля вероятность двойного кроссинговера значительно снижается, а достоверность оценки повышается: для двух фланкирующих маркеров с расстоянием между ними 10 сМ вероятность ложной идентификации гена не превышает 1,2 %, что ниже принятой для биологических исследований (35). В более поздних работах на разных популяциях показана эффективность применения выделенных маркеров для контроля интрогрессии (39).
У российских и зарубежных сортов по всем исследованным маркерам, сцепленным с генами, которые определяют эффективное использование фосфора, выявлен полиморфизм, что позволяет использовать их для селекции на признак (46-48). Максимальное число аллелей отмечено для маркера RM 247, расположенного на 12-й хромосоме (рис. 2). По маркеру RM 322 все российские сорта (исключение — Янтарь, Дальневосточный, Анаит) мономорфны. Маркер RM 13 выявлял 3 аллеля (у сортов Павлов-521
ский, Боярин, Регул, Янтарь, Дружный, Касун размер амплифицируемых фрагментов ДНК больше, чем у большинства других), RM 261 — 2 аллеля (молекулярная масса фрагментов больше у сортов Садко, Новатор и Регул).
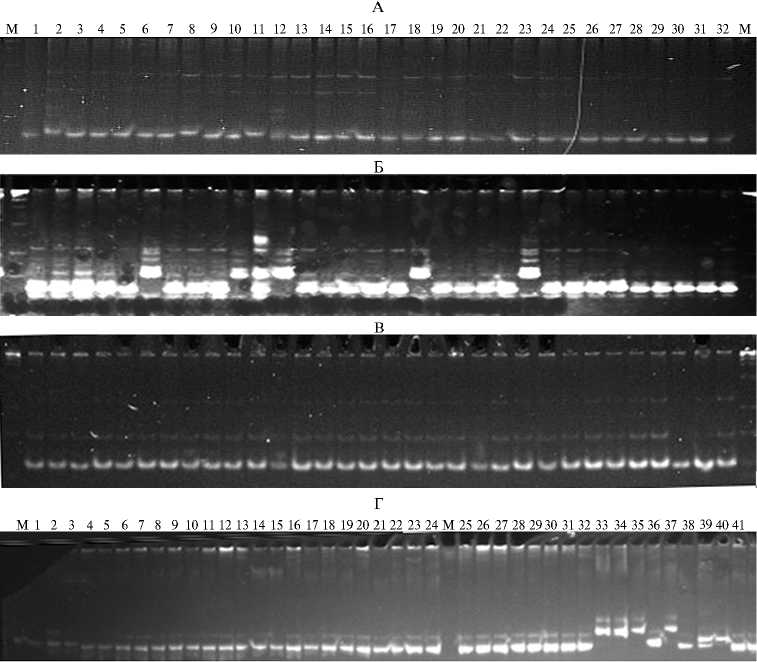
Рис. 2. Полиморфизм российских и зарубежных сортов риса ( Oryza sativa L.) по маркерам RM 261 (А) , RM 13 (Б) , RM 322 (В) и RM 19 (Г) , связанным с генами, определяющими эффективное использование фосфора: 1 — Ханкайский, 2 — Садко, 3 — Приморский, 4 — Лиман, 5 — Гарант, 6 — Павловский, 7 — Рапан, 8 — Новатор, 9 — Серпантин, 10 — Боярин, 11 — Регул, 12 — Янтарь, 13 — Жемчуг, 14 — Лидер, 15— Хазар, 16 — Аметист, 17 — Нарцисс, 18 — Дружный, 19 — Спринт, 20 — Виола, 21 — Дальневосточный, 22 — Фонтан, 23 — Касун, 24 — Юпитер, 25 — Атлант, 26 — Курчанка, 27 — Факел, 28 — Снежинка, 29 — Шарм, 30 — Анаит, 31 — Флагман, 32 — Изумруд; 33 — IR 66, 34 — NSIC RC 158, 35 — IR68897B, 36 — IR 73328B (сорта-доноры генов WC ); 37 — Мороберикан, 38 — N 22, 39 — Азусена, 40 — Дулар, 41 — Тайпей 309; М — маркер молекулярной массы (48).
Все изучаемые маркеры, связанные с признаком эффективность поглощения фосфора, удобно использовать в селекции и отборе генотипов-доноров среди российских сортов, поскольку показано, что доноры и сорта, в которые планируется интрогрессировать локус, несут его разные аллели, следовательно, растения, получившие аллель донора, выявляются при электрофоретическом разделении продуктов ПЦР.
Таким образом, установлены механизмы приспособления растений к низкому содержанию азота и фосфора в почве, которые связаны с ростом и развитием корневой системы, интенсификацией поглощения и внутренней эффективностью использования элементов, а также с повышением их доступности благодаря синтезу и выделению органических кислот в ризосферу. Выявлены генотипические различия в эффективности использования азота и фосфора у разных культур. Вариабельность по этому признаку среди генотипов риса главным образом объясняется различиями в росте корневой системы, что увеличивает площадь питания растений, и в большей мере связана с различиями генотипов по способности поглощать элементы минерального питания, в то время как изменение внутренней эффективности их использования влияет незначительно. Выявлены молекулярные маркеры, сцепленные с изучаемыми признаками. У российских сортов риса отмечено наличие полиморфизма по всем изучаемым маркерам, связанным с эффективностью поглощения элементов минерального питания. Все это позволяет более результативно отбирать источники целевых генов и вести селекционную работу, в том числе с использованием молекулярных маркеров.
Список литературы Молекулярные маркеры генов, определяющих эффективность минерального питания у риса (Oryza sativa L.): мини-обзор
- Гончарова Ю.К., Литвинова Е.В., Очкас Н.А. Генетика признаков, обеспечивающих эффективность минерального питания у риса. Тр. Кубанского государственного аграрного университета, 2010: 54-58.
- Гончарова Ю.К. Наследование признаков, определяющих физиологический базис гетерозиса у гибридов риса. Сельскохозяйственная биология, 2010, 5: 72-78.
- Kharitonov E.M., Goncharova Y.K. Mineral nutrient efficiency of rice. Russian Agricultural Sciences, 2011, 37(2): 103-105 ( ) DOI: 10.3103/S1068367411020133
- Batjes N.H. A world data set of derived soil properties by FAOUNESCO soil unit for global modeling. Soil Use Manage, 1997, 13: 9-16 ( ) DOI: 10.1111/j.1475-2743.1997.tb00550.x
- Dobermann A., Fairhurst T. Rice: nutrient disorders and nutrient management. Oxford Graphic Printers Pte Ltd, 2000: 60-71.
- Fageria N.K., Baligar V.C. Upland rice genotypes evaluation for phosphorus use efficiency. J. Plant Nutr., 2010, 20:499-509 ( ) DOI: 10.1080/01904169709365270
- Lea P.J., Miflin B.J. Nitrogen assimilation and its relevance to crop improvement. In: Annual plant reviews. V. 42. Nitrogen metabolism in plants in the post-genomic era/C.H. Foyer, H. Zhang (eds.). Wiley-Blackwell, Oxford, UK, 2010 ( ) DOI: 10.1002/9781444328608.ch1
- Vinod K.K., Heuer S. Approaches towards nitrogen-and phosphorus-efficient rice. AoB Plants, 2012: pls028 ( ) DOI: 10.1093/aobpla/pls028
- Huang Y.Z., Feng Z.W., Zhang F.Z. Study on loss of nitrogen fertilizer from agricultural fields and countermeasure. Journal of the Graduate School of Academia Sinica, 2000, 17: 49-58.
- Runge-Metzger A. Closing the cycle: obstacles to efficient P management for improved global food security. In: Phosphorus in the global environment: transfers, cycles and management/H. Tiessen (ed.). NY, 1995: 27-42.
- Food and Agriculture Organization of the United Nations. Current world fertilizer trends and outlook to 2011/12. FAO, Rome, Italy, 2008.
- Гончарова Ю.К., Харитонов Е.М. Генетический контроль признаков, связанных с усвоением фосфора у сортов риса (Oryza sativa L.). Вавиловский журнал генетики и селекции, 2015, 19(2): 197-204 ( ) DOI: 10.18699/VJ15.025
- Hammond J.P., Broadley M.R., White P.J. Genetic responses to phosphorus deficiency. Ann. Bot., 2004, 94: 323-332 ( ) DOI: 10.1093/aob/mch156
- Guimil S., Chang H.S., Zhu T., Sesma A., Osbourn A., Roux C., Ioannidis V., Oakeley E.J., Docquier M., Descombes P., Briggs S.P., Paszkowski U. Comparative transcriptomics of rice reveals an ancient pattern of response to microbial colonization. PNAS USA, 2005, 102: 8066-8070 ( ) DOI: 10.1073/pnas.0502999102
- Piao Z., Cho Y.I., Koh H.J. Inheritance of physiological nitrogen-use efficiency and relationship among its associated charaters in rice. Korean J. Breed., 2001, 33: 332-337.
- Li B.Z., Merrick M., Li S.M., Li H.Y., Zhu S.W., Shi W.M., Su Y.H. Molecular basis and regulation of ammonium transporter in rice. Rice Science, 2009, 16: 314-322.
- Kirk G.D., George T., Courtois B., Senadhira D. Opportunities to improve phosphorus efficiency and soil fertility in rainfed lowland and upland rice ecosystems. Field Crops Res., 1998, 56: 73-92 ( ) DOI: 10.1016/S0378-4290(97)00141-X
- Peng S., Yang J., Lasa R., Sanico A., Visperas R., Son T. Physiological bases of heterosis and crop management strategies for hybrid rice in the tropics. Proc. Int. Conf. «Hybrid rice for food security, poverty alleviation, and environmental protection». Hanoi, 2003: 153-173.
- Wissuwa M., Wegner J., Ae N., Yano M. Substitution mapping of Pup1: a major QTL increasing phosphorus uptake of rice from a phosphorus-deficient soil. Theor. Appl. Genet., 2002, 105: 890-897 ( ) DOI: 10.1007/s00122-002-1051-9
- Wissuwa M., Ae N. Genotypic variation for tolerance to phosphorus deficiency in rice and the potential for its exploitation in rice improvement. Plant Breeding, 2001, 120: 43-48 ( ) DOI: 10.1046/j.1439-0523.2001.00561.x
- Wissuwa M. Combining a modeling with a genetic approach in establishing associations between genetic and physiological effects in relation to phosphorus uptake. Plant Soil, 2005, 269: 57-68 ( ) DOI: 10.1007/s11104-004-2026-1
- Wissuwa M. How do plants achieve tolerance to phosphorus deficiency? Small causes with big effects. Plant Physiol., 2003, 133: 1947-1958 ( ) DOI: 10.1104/pp.103.029306
- Wissuwa M., Gamat G., Ismail A.M. Is root growth under phosphorus deficiency affected by source or sink limitations. J. Exp. Bot., 2005, 56: 1943-1950 ( ) DOI: 10.1093/jxb/eri189
- Гончарова Ю.К. Генетические основы повышения продуктивности риса. Докт. дис. Краснодар, 2014.
- Lambers H., Shane M.W., Cramer M.D., Pearse S.J., Veneklaas E.J. Root structure and functioning for efficient acquisition of phosphorus: matching morphological and physiological traits. Ann. Bot., 2006, 98: 693-713 ( ) DOI: 10.1093/aob/mcl114
- Shane M.W., Lambers H. Cluster roots: a curiosity in context. Plant Soil, 2005, 274: 99-123 ( ) DOI: 10.1007/s11104-004-2725-7
- Misson J., Raghothama K.G., Jain A., Jouhet J., Block M.A., Bligny R., Ortet P., Creff A., Somerville S., Rolland N., Doumas P., Nacry P., Herrerra-Estrella L., Nussaume L., Thibaud M.C. Agenome-wide transcriptional analysis using Arabidopsis thaliana. Affymetrix gene chips determined plant responses to phosphate deprivation. PNAS USA, 2005, 102: 11934-11939 ( ) DOI: 10.1073/pnas.0505266102
- Morcuende R., Bari R., Gibon Y., Zheng W., Pant B.D., Blasing O., Usadel B., Czechowski T., Udvardi M.K., Stitt M., Scheible W.R. Genome-wide reprogramming of metabolism and regulatory networks of Arabidopsis in response to phosphorus. Plant, Cell & Environment, 2007, 30: 85-112 ( ) DOI: 10.1111/j.1365-3040.2006.01608.x
- Marschner P., Solaiman Z., Rengel Z. Rhizosphere properties of Poaceae genotypes under P-limiting conditions. Plant Soil, 2006, 283: 11-24 ( ) DOI: 10.1007/s11104-005-8295-5
- Radersma S., Grierson P.F. Phosphorus mobilisation in agroforestry: organic anions, phosphatase activity and phosphorus fractions in the rhizosphere. Plant Soil, 2004, 259: 209-219 ( ) DOI: 10.1023/b:plso.0000020970.40167.40
- Richardson A.E., Hadobas P.A., Hayes J.E. Extracellular secretion of Aspergillusphytase from Arabidopsis roots enables plants to obtain phosphorus from phytate. Plant J., 2001, 256: 641-649.
- Rengel Z., Romheld V., Marschner H. Uptake of zinc and iron by wheat genotypes differing in tolerance to zinc deficiency. J. Plant Physiol., 1998, 152: 433-438 ( ) DOI: 10.1016/S0176-1617(98)80260-5
- Suzuki M.T., Takashi T., Satoshi W., Shinpei M., Junshi Y., Naoki K., Shoshi K., Hiromi N., Satoshi M., Naoko K.N. Biosynthesis and secretion of mugineic acid family phytosiderophores in zinc deficient barley. Plant J., 2006, 48: 85-97 ( ) DOI: 10.1111/j.1365-313x.2006.02853.x
- Nguyen B.D., Brar D.S., Bui B.C., Nguyen T.V., Pham L.N., Nguyen H.T. Identification and mapping of the QTL for aluminum tolerance introgressed from the new source, Oryza rufipogon Griff., into indica rice (Oryza sativa L.). Theor. Appl. Genet., 2003, 106: 583-593 ( ) DOI: 10.1007/s00122-002-1072-4
- Ye G., Smith K.F. Marker-assisted gene pyramiding for cultivar development. In: Plant Breeding Reviews, V. 33/J. Janick (ed.). John Wiley & Sons, Inc., Hoboken, 2010 ( ). ( ) DOI: 10.1002/9780470535486.ch5
- Zhang Y.J., Dong Y.J., Zhang J.Z., Xiao K., Xu J.L., Terao H. Mapping QTLs for deficiency phosphorus response to root-growth of rice seedling. Rice Genetics Newsletter, 2006, 25:36-37.
- Wei D., Cui K., Pan J., Xiang J., Huang J., Nie L. QTL mapping for nitrogen-use efficiency and nitrogen-deficiency tolerance traits in rice. Plant Soil, 2012, 359: 281-295 ( ) DOI: 10.1007/s11104-012-1142-6
- Cho Y., Jiang W., Chin J., Piao Z., Cho Y., Mc Couch S.R., Koh H. Identification of QTLs associated with physiological nitrogen use efficiency in rice. Mol. Cells, 2007, 23, 1: 72-79.
- Peng S., Ismail A.M. Physiological basis of yield and environmental adaptation in rice. In: Physiology and biotechnology integration for plant breeding/H.T. Nguyen, A. Blum (eds.). NY, 2004: 83-140.
- Chin J.H., Gamuyao R., Dalid C., Bustamam M., Prasetiyono J., Moeljopawiro S., Wissuwa M., Heuerm S. Developing rice with high yield under phosphorus deficiency: Pup1 sequence to application. Plant Physiol., 2011, 156: 1202-1216.
- Su J., Xiao Y., Li M., Liu Q., Li B., Tong Y., Jia J., Li Z. Mapping QTLs for phosphorus-deficiency tolerance at wheat seedling stage. Plant Soil, 2006, 281: 25-36 ( ) DOI: 10.1007/s11104-005-3771-5
- Lang N., Buu B. Mapping QTLs for phosphorus deficiency tolerance in rice (Oryza sativa L.). Omon Rice, 2006, 14: 1-9.
- Ni J.J., Wu P., Senadhira D., Huang N. Mapping QTLs for phosphorus deficiency tolerance in rice (Oryza sativa L.). Theor. Appl. Genet., 1998, 97: 1361-1369 ( ) DOI: 10.1007/s001220051030
- Xu Y., Crouch J.H. Marker-assisted selection in plant breeding: from publications to practice. Crop Sci., 2008, 48: 391-407 ( ) DOI: 10.2135/cropsci2007.04.0191
- Рariasca-Tanaka J., Satoh K., Rose T., Mauleon R., Wissuwa M. Stress response versus stress tolerance: a transcriptome analysis of two Rice lines contrast in tolerance to phosphorus deficiency. Rice, 2009, 2:167-185.
- Runge-Metzger A. Closing the cycle: obstacles to efficient P management for improved global food security. In: Phosphorus in the global environment: transfers, cycles and management/H. Tiessen (ed.). NY, 1995: 27-42.
- Shimizu A., Yanagihara S., Kawasaki S., Ikehashi H. Phosphorus deficiency -induced root elongation and its QTL in rice (Oryza sativa L.). Theor. Appl. Genet., 2004, 109: 1361-1368 ( ) DOI: 10.1007/s00122-004-1751-4
- Гончарова Ю.К., Харитонов Е.М. Генетические основы повышения продуктивности риса. Краснодар, 2015.


