Молекулярные механизмы обработки протеома реорганизации межфазного хроматина во время стресса и адаптации к зиме в пшенице
Автор: Иванов Р.С., Терещенко Л.М., Вафина Г.Г., Иванова Е.А.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 2 т.11, 2015 года.
Бесплатный доступ
Исследование фундаментальных молекулярных и генетических процессов взаимодействия растений с окружающей средой является прогрессивной областью понимания фундаментальных проблем супрамолекулярной биохимии стресса биологии развития. Целью работы был анализ локализации, защищенной протеазой, перерабатывающей белки супраструктур межфазной хроматиновой матрицы в условиях адаптации в течение вегетативной фазы пшеницы к стрессовым факторам окружающей среды. Показано, что в условиях многолетней адаптации к холодному шоку пшеницы на уровне супраструктур хроматина, тесно связанных с ядерной матрицей, наблюдается полное экранирование сайтов аргинина-X для обработки протеазы. Возможно, это зоны, которые влияют на архитектуру организации ядра клетки, которая может помочь выжить в сложных условиях окружающей среды. В соответствии с приоритетами в исследовании сельскохозяйственных растений, которые были предложены EPIC (The Epigenomics of Plants International Consortium) в 2011 году в течение следующего десятилетия, была включена точка необходимости понимания молекулярной основы взаимодействия генотипа и окружающей среды, которые меняются характеристики растений в разных условиях окружающей среды. Эти данные будут полезны тем, кто участвует в разработке математических логических схем теории и практики биологической специфичности, и могут быть включены в онтологию развития и развития растений.
Короткий адрес: https://sciup.org/14323969
IDR: 14323969
Текст научной статьи Молекулярные механизмы обработки протеома реорганизации межфазного хроматина во время стресса и адаптации к зиме в пшенице
Пшеница относится к одним из первых окультуренных растений. Проблема повышения продуктивности пшеницы многоплановая. От простейших методов народной селекции до проникновения в сложный механизм наследственности – таков путь совершенствования сортов пшеницы, главного хлеба всей планеты. Растение пшеницы – поливариантная система. Поливариантность структурной организации растения пшеницы определяется кроме генотипических особенностей отдельных особей, также эпигенетическим аппаратом морфогенеза. Чтобы чувствовать своё окружение, координировать свой рост и развитие, растения развили ряд систем мониторинга. Яровизация является одним из примеров, в которых цветение происходит только после того, как растения были подвержены воздействию долгосрочной холодной температуре зимнего периода (Kim, Sung, 2014).
За последние несколько десятилетий наши знания о том, как растения воспринимают внешние раздражители, значительно возросли. Например, возросли наши знания о преобразовании стимулов экологического стресса в клеточных сигнальных каскадах в сетях транскрипции генов (Diallo, Ali-Benali, et al., 2012). Кроме того, показано, что растения могут помнить прошлые события окружающей среды и воспользоваться этой памятью при повторяющихся событиях. Эти эпигенетические механизмы важное условие памяти стресса и адаптации в растениях, которые могут помочь растению более эффективно справляться с последующим стрессом (Kinoshita, Seki, 2014). Стало известно, что экспрессия генов управляется развитием и стрессовыми сигналами, и часто зависит от посттрансляционных модификаций хроматиновой матрицы, структурными единицами которой являются нуклеосомы. Большинство стресс индуцированных изменений сбрасывается до исходного уровня, как только стресс снимается (Kosová, Vítámvás et al., 2014). Однако при определенных стечениях обстоятельств некоторые модификации могут перейти в ранг «стабильной стрессовой памяти» и наследоваться в дальнейшем через митотические или даже мейотические деления клеток (Chinnusamy, Zhu, 2009). Долгосрочный холодный период в жизни растения оставляет определенный паттерн в его вегетативном морфогенетическом периоде (Morozova, Murashev, 2009). Этот период контролирует важнейший физиологический процесс перехода растения от вегетативной фазы развития к генеративной. Очевидно, что для выживания и адаптации требуется сопряжение данных моментов развития растения с благоприятными климатическими условиями, поэтому в ходе эволюции была создана генетическая система, контролирующая переход к генеративной стадии в зависимости от основных внешних факторов – температуры и длины светового дня (Cockram, Jones et al., 2007; Jung, Muller, 2009; Laurie, 2009). Соответствующие этим факторам гены яровизации и фотопериода тесно взаимосвязаны и образуют единую динамическую сеть в организации протеомного процессинга хроматиновой матрицы. Биохимическим эффектом этого влияния может быть закрепившийся паттерн супрамолекулярного морфогенеза. Особенности биохимической адаптации (Hochachka, Somero, 1977), которые имеют место также и в клеточном ядре могут быть отражены в супрамолекулярных механизмах внутриядерного Арг-Х протеолиза на хроматиновой матрице при индукции ростовых процессов вегетативной фазы, сформировавшихся зрелых яровых и озимых зародышей. Известно, что протеом клеточного ядра обогащен аргинином, аминокислотой обладающей резонансным свойством и образующей хвостовые участки на уровне нуклеосом хроматиновой матрицы.
Целью данной работы был анализ локализации Арг-Х протеазочувствительных сайтов в негистоновых и гистоновых блоках супраструктур (нуклеоплазмы, хроматина, ядерного матрикса), как возможных зон влияющих на конформационные перестройки тотального интерфазного хроматина G1/S-переходной фазы клеточного цикла, при индукции вегетативной фазы ростового морфогенеза зрелых зародышей яровой и озимой пшениц.
MATERIALS AND METHODS
Объектом исследования служили семена суперэлитных пшениц ( Triticum aestivum L .) сортов Артемовка (яровая), Мироновская 808 (озимая), Мироновская Яровая, полученные из коллекции Всероссийского института растениеводства им. Н.И. Вавилова. Подробное описание метода выведения озимого сорта Мироновской 808 из ярового Артёмовки представлено в работе
(Remeslo, 1964). По данным Украинского Мироновского научно-исследовательского института селекции и семеноводства им. В. Н. Ремесло, сорт Мироновской Яровой пшеницы был получен путем «расшатывания» наследственности озимой Мироновской 808. То есть, изменением цикла развития озимой формы с применением метода яровизации (воздействием низких температур). Метод направленного изменения озимых форм в яровые под воздействием условий внешней среды изменяет природу некоторых хозяйственно-ценных признаков. Эти биологические свойства определяются реализацией глубинных молекулярных механизмов, где большую роль играют условия внешней среды (Tumanov, 1979). Состояние воздушно-сухого семени и зародыша (находящиеся в состоянии биологического покоя), мы условно приняли за 0ч. Из воздушно-сухих семян (0ч), замоченных-набухших (3ч) и проращиваемых, в определённые интервалы времени от начала замачивания: 6ч, 9ч, 12ч, 15ч, 18ч, 21ч; отделяли от эндосперма зародыши (рис 1С). Надмолекулярные супраструктуры (рис 2): нуклеоплазму (Нп), хроматин непрочно- (Хр-I) и прочно- (Хр-II) связанный с ядерным матриксом (ЯМ) и собственно ЯМ из клеточных ядер выделяли по способу подробно описанному в работах (Ivanova, Vafina, 1992; Ivanova, Vafina, 2011). Отделение негистоновых белков (НГБ) от гистонов из выделенных супраструктур клеточных ядер проводили по способу (Ivanova, 1972; Ivanova, Vafina, 2011). Трипсиноподобные комплексы (ТПК)
из НГБ и гистоновых блоков выделяли методом аффинной хроматографии по способу, описанному ранее в работе (Ivanova, Vafina, 1991; Ivanova, Vafina, 1992). Арг-Х протеазоактивность ТПК, выделенных из негистоновых и гистоновых блоков супраструктур клеточных ядер, оценивали по расщеплению Арг-Х связей в аргинин-обогащенном белке – протамине- Salmine-A-I («Merk» ).
RESULTS
На рисунке 1 представлена характеристика: массы семян (рис 1A) их всхожести (рис 1B) и массы зародышей (рис 1C) в период воздушносухого состояния (0ч), набухания семян (3ч) и индукции ростовых морфогенетических процессов через каждые 3ч интервалы (3ч→18ч) до проклёвывания (21ч). Как видно из рисунка (рис. 1A) различия между семенами, используемыми в нашем эксперименте, уже проявляются на уровне их морфологической целостности. По массе семена озимой пшеницы тяжелее яровой (рис.1A). По-видимому, это связано с накоплением трофической и защитной основы, необходимой зародышу, для выживания в стрессовых условиях окружающей среды. Кроме того, из рис.1 C видно, что в период перед проклевыванием (рис. 1 C, 18ч) и проклевыванием (рис 1 C, 21ч) происходит интенсивное увеличение массы зародыша озимых семян в сравнении с массой зародыша семян исходного ярового сорта. Возможно, этот период связан с усиленным питанием зародыша от эндосперма. Все эти особенности сорта Мироновской 808, по-видимому, связаны со стрессовым характером эпигенетической памяти, о которой сообщается в статье (Amasino, 2004). Известно, что сорт Мироновская 808 был выведен методом многократно-группового отбора (с точным указанием лучших семейств, минимальной температуры на поверхности почвы при перезимовках в течение 7лет) высокопродуктивных, морфологически выровненных однородных растений из сорта Артемовки (Remeslo, 1964). Метод направленного изменения озимых форм в Яровые под воздействием условий внешней среды связан с изменением природы некоторых хозяйственноценных признаков, которые отражены в увеличении «всхожести» семян (рис. 1B). Глубинные молекулярные процессы вегетативного морфогенетического периода, связанные с механизмами эпигенетической памяти, мы решили рассмотреть на уровне протеома клеточных ядер отобранных проклюнувшихся зародышей (Рис. 1; B, C: 21ч) гетерополимерных супраструктур хроматиновой матрицы (рис.2).
DISCUSSION
В данном сообщении рассматриваются и обсуждаются факторы, которые одновременно взаимосвязаны с физиологическими процессами проклюнувшихся целых зародышей 21ч (рис 1 B, C) и их внутриядерным молекулярно-протеомным состоянием супраструктур хроматиновой матрицы (рис 2). Как известно, период инициации ростовых процессов зародыша, характеризуется возникновением механического натяжения клеточно-тканевых масс, которое приводит к появлению у растений в ходе морфогенеза конусов роста побегов. В статье Л.В. Белоусов (2006) анализирует это состояние с позиции механических натяжений и влияния их на экспрессию генов.
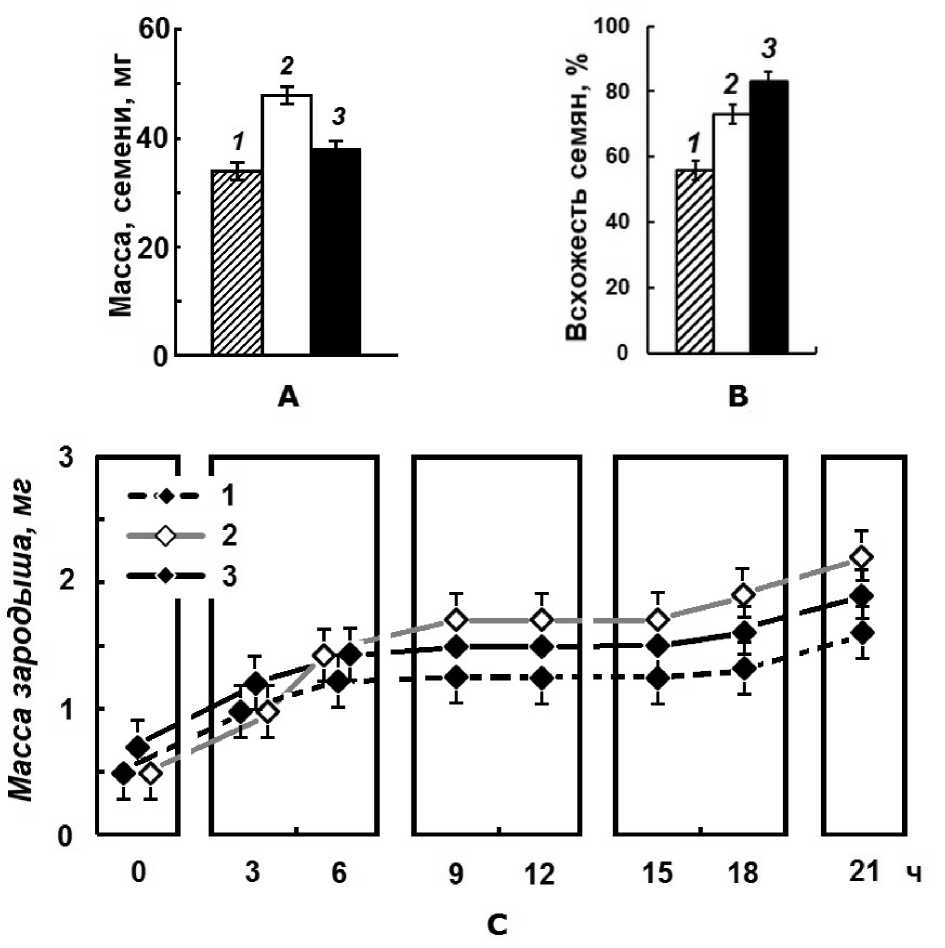
Рисунок 1 . Физиологическая характеристика семян: Артемовки (яровой) (1), выведенной из неё Мироновской 808 (озимой) (2), выведенной из последней Мироновской Яровой (3). А -масса семян в состоянии биологического покоя; B - всхожесть семян через 21 ч; C -масса зародышей до 21 ч при индукции ростовых процессов морфогенеза вегетативной фазы.
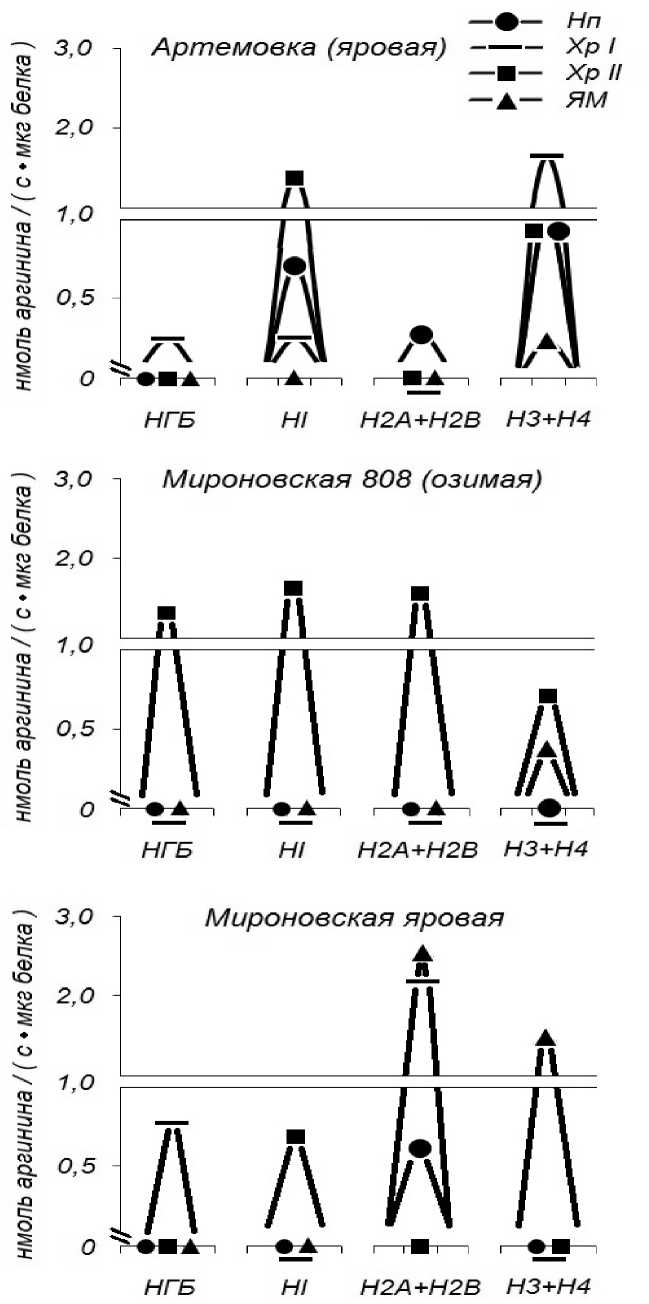
Рисунок 2 . Арг -Х протеазочувствительность в ТПК НГБ, линкерных (HI) и коровых (H2A+H2B;
H3+H4) гистоновых блоках супраструктур клеточных ядер зародышей пшениц.
Значительное место в исследовании механизмов экспрессии генов продолжает занимать изучение свойств тотальной хроматиновой матрицы, блоки которой могут быть представлены супраструктурами эу- и гетерохроматином. В данном случае клеточные ядра зрелых зародышей пшениц используются как модельная система, где происходит формирование функциональной группы, координировано экспрессирующихся генов. Из литературы известно, что адаптивная эволюция происходила у белков контролирующих фазу роста G1 и G1/S-переход – наиболее вариабельных фаз клеточного цикла эукариот (Caldis, 2006). Эти вариабельные периоды клеточного цикла находятся под управлением внешних ростовых факторов (Turnaev, Gunbin et al. 2009). В G1 фазе клеточного цикла 42 хромосомы пшеницы развернуты в виде хромонемной нити (Avetisova, Shaposhnikov et al., 1998). Здесь действуют механизмы, которые не дают запутываться этому нитевому клубку. В G1 фазе клеточного цикла крупные ядра апикальной и латеральной меристем занимают более половины клеток, конденсированные хромонемные тяжи равномерно распределены по всему объему ядра, а в межхромонемных участках присутствует довольно развитая сеть РНП-фибрилл (Avetisova, Shaposhnikov et al., 1998). За последнее время появились работы, которые считают, что физическую связь между хромосомами осуществляет межхромосомная нить, которая разрывается под действием ДНК-азы, но под действием трипсина и РНК-азы она становится менее упругой (Podgornaja, Kuznecov et al., 2005). Следует отметить, протеолитическая система это не набор хаотических реакций, а сложная и высокоупорядоченная система со специфическим для каждой ткани набором протеолитических ферментов. К самым значительным открытиям в настоящее время принадлежит выяснение расположения хромосом в интерфазных ядрах и то, что их структура контролируется как генетическими, так и экологическими факторами (Tiang, He et al., 2012; Pawlowski, 2010). Вопросы самоорганизации биологических систем находятся в центре внимания специалистов по высокомолекулярным соединениям, а именно биополимерам. Как известно, взаимодействующие в клетке молекулы иммобилизованы на полимерных структурах внеклеточного матрикса, цитоскелета, ядерного матрикса или мембранах. То есть, они входят в какие-то определенные надмолекулярные комплексы, где уже интегрированы взаимодействия многих макромолекул. Представляя морфогенез как многоуровневый процесс, из всех межуровневых отношений в онтогенезе, пространственно-временного G1 и G1/S периода, мы для эксперимента выделяем уровень организации интерфазной хроматиновой матрицы клеточного ядра и входящих в её архитектурный состав следующих надмолекулярных комплексных супраструктур: нуклеоплазмы, хроматина непрочно- и прочносвязанных с ядерным матриксом и собственно ядерного матрикса. Расположение хромосомных территорий имеет важное значение для процессов репликации, транскрипции, репарации и рекомбинации. По всей вероятности филогенетическая принадлежность вида, клеточный цикл, состояние дифференциации влияют на архитектуру интерфазного ядра. Авторы считают, что имеются морфологические ограничения и эпигенетические воздействия на ядерную архитектуру, эволюционную стабильность механизмов хромосомных территорий и изменения ядерной архитектуры (Schubert, Shaw, 2011). То есть, мы предположили, что молекулярный морфогенез на уровне надмолекулярных структур клеточного ядра может быть связан с ослаблением межмолекулярных белковых связей. Фактически наша экспериментальная задача заключалась в том, чтобы выявить в надмолекулярных структурах клеточного ядра участки чувствительные к Арг-Х протеолизу. Для того, чтобы судить о молекулярном морфопроцессе, мы выбрали определенный временной интервал эксперимента (рис 1 B, C; 21ч). В связи с тем, что популяция зародышей проявляет в процессе набухания и инициации ростовых процессов неоднородность (рис.1 B, C), которая выявляется только во временном периоде 21ч (Рис.1 B), мы взяли в эксперимент только физиологически однородные зародыши (рис.1 A, C: «0ч»; B, C: 21ч).
Ранее в работе (Ivanov, Vafina et al., 2012) на уровне гетерополимерных супраструктур клеточных ядер, индуцированных к росту зародышей (21ч), а также впоследствии по выявлению из последних гиперчувствительных к протеолизу сайтов на уровне НГБ, линкерных и коровых гистонов (Ivanova, Vafina et al. 2012) была показана динамика функционирования Арг-Х протеолиза. На следующем этапе, представленной экспериментальной работы, мы решили выделить (методом аффинной хроматографии) из блоков протеома вышеперечисленных НГБ, линкерных и коровых гистонов, трипсиноподобные зоны и определить в них экранируемость к Арг-Х протеазочувствительности. Данные рисунка 2 показывают, что гиперчувствительные к Арг-Х протеолизу трипсиноподобные сайты 21ч зародышей-проростков яровой и выведенной из неё озимой пшеницы и вновь выведенной из последней Яровой пшеницы, имеют свои особенности локализации в гетерополимерных супраструктурах хроматиновой матрицы интерфазных клеточных ядер. Мы специально сфокусировали своё внимание на Арг-Х протеазочувствительных трипсиноподобных сайтах, исходя из роли аргинина, участвующего в эволюционной стабильности аргининбогатых гистонов и представили двухслойный рисунок, чтобы нагляднее показать участки в гетерополимерных супраструктурах хроматиновой матрицы, где наиболее активно могут происходить динамические перестройки ядерного протеома. Считают, что «хроматиновая матрица – это физиологически важный субстрат, на котором развертываются ремоделинг и механизм транскрипции» (Allis, Dzhenjuvejn et al., 2007). Из представленного рисунка видно, что у озимого сорта (рис. 2) наиболее чувствительные к Арг-Х протеолизу трипсиноподобные сайты находятся в структурах хроматина прочносвязанного с ядерным матриксом. Предполагают, что протеолитический процессинг является одним из способов необратимой посттрансляционной модификации, осуществляемой в процессе ремоделирования хроматина (Purohit, Chaturvedi et al., 2012). Наиболее чувствительны к протеолизу N-терминальные/C-терминальные хвосты гистонов, в то время как глобулярные домены относительно устойчивы к этой модификации при условии, что гистоны находятся в составе хроматина (Purohit, Chaturvedi et al., 2012). В гипотезе гистонового кода протеолиз рассматривается как новый вид необратимых пост трансляционных модификаций гистонов. Однако экспериментального подтверждения удаления эпигенетических меток с гистоновых хвостов с помощью протеазы все еще не доказано (Purohit, Chaturvedi et al., 2012). Тем не менее, поиск такой протеазы продолжается. Мы считаем, что Арг-Х гиперчувствительные трипсиноподобные зоны могут представлять собой один из элементов LCR (locus control regions), имеющих отношение к гистоновому коду. Возможно, наши экспериментальные данные будут полезны для тех, кто занимается разработкой логико-математических схем теории биологической специфичности, о которых писали Ж-М Лен (1998), Р.Том (2002), в области сложной проблемы динамики молекулярного и супрамолекулярного морфогенеза.
ACKNOWLEDGMENT
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 14-04-31243.
Список литературы Молекулярные механизмы обработки протеома реорганизации межфазного хроматина во время стресса и адаптации к зиме в пшенице
- Allis S.D., Dzhenjuvejn T., Rejnberg D. (2010) Jepigenetika. Per. s angl. M.: Tehnosfera, 496 s
- Amasino R. (2004) Vernalization, competence, and the epigenetic memory of winter. The Plant Cell. 16, 2553-2559
- Avetisova L.V., Shaposhnikov Ja.D., Kadykov V.A. (1988) Izmenenija ul'trastruktury jader kletok apeksa pobega pshenicy v processe prorastanija. Ontogenez, 19(2), 181-190
- Belousov L.V. (2006) Morfomehanicheskij aspekt jepigeneza. Genetika, 42(9), 1165-1169
- Caldis P. (2006) Cell Cycle Regulation. B. Heidelberg: Springer, 374p
- Chinnusamy V., Zhu J.K. (2009) Epigenetic regulation of stress responses in plants. Curr Opin Plant Biol., 2, 133-139
- Cockram J., Jones H., Leigh F. J., O’Sullivan D., Powell W., Laurie D. A., Greenland A. J. (2007) Control of flowering time in temperate cereals: genes, domestication, and sustainable productivity. J. Exp. Bot., 58, 1231-1244
- Diallo A.O., Ali-Benali M.A., Badawi M., Houde M., Sarhan F. (2012) Expression of vernalization responsive genes in wheat is associated with histone H3 trimethylation. Mol Genet Genomics, 287, 575-590
- Hochachka P., Somero D. (1977) Strategija biohimicheskoj adaptacii. M.: Mir, 286 s
- Ivanova E.A., (1972) Frakcionirovanie rastitel'nyh gistonov na kolonkah s amberlitom IRC-50. Materialy III-j nauchnoj konferencii molodyh uchenyh. Ufa, 54-55
- Ivanova E.A., Vafina G.H. (1991) Analiz jadernyh «proteoliticheskih» i «ingibitornyh» kompleksov v processe prorastanija semjan pshenicy. Fiziologija rastenij, 38(3), 574-579
- Ivanova E.A., Vafina G.H. (1992) Sposob poluchenija jadernyh frakcij, obladajushhih proteinaznoj i ingibirujushhej aktivnost'ju. Avtorskoe svidetel'stvo № 1733471
- Ivanova E.A., Vafina G.H. (2011) Sposob preparativnogo vydelenija osnovnyh belkov iz suprastruktur kletochnyh jader rastenij. Patent № 2408602
- Ivanova E.A., Vafina G.H., Ivanov R.S. (2012) Dinamika Arg-X roteazochuvstvitel'nyh uchastkov v prostranstvennoj reorganizacii hromatina pri indukcii rostovogo morfogeneza zrelyh zarodyshej pshenicy. Izvestija Nacional'noj akademii nauk Belarusi. Serija biologicheskih nauk, 4, 11-15
- Ivanov R.S., Vafina G.H., Ivanova E.A. (2012) Arg-X protease -sensitive in supramolecular structures of interphase cell nucleus during growth morphogenesis mature germs of wheat. Journal of Life Sciences, 6(12), 1351-1355
- Jung C., Muller A. E. (2009) Flowering time control and applications in plant breeding. Trends Plant Sci. 14, 563-573
- Kim D.H., Sung S. (2014) Genetic and Epigenetic Mechanisms Underlying Vernalization. The Arabidopsis Book, 12, e0171
- Kinoshita T., Seki M. (2014) Epigenetic Memory for Stress Response and Adaptation in Plants. Plant Cell Physiol., 55(11), 1859-1863
- Kosová K., Vítámvás P., Prášil I.T. (2014) Proteomics of stress responses in wheat and barley -search for potential protein markers of stress tolerance. Front Plant Sci., 5, 711
- Laurie D.A. (2009) Developmental and reproductive traits in the Triticeae. In: Genetics and genomics of the Triticeae. Plant genetics and genomics: crops and models.7. New York: Springer Science & Business Media, LLC. 591-609 p
- Len Zh-M. (1998) Supramolekuljarnaja himija: Koncepcii i perspektivy: Per. s angl. Novosibirsk: Nauka, 334 s
- Morozova Z.A., Murashev V.V. (2009) Rod Triticum L., Morfogenez vidov pshenicy. M.: Triada, 232 s
- Pawlowski W.P. (2010) Chromosome organization and dynamics in plants. Current Opinion in Plant Biology, 13, 640-645
- Podgornaja O.I., Kuznecov I.S., Enukashvili N.I., Shatrova A.N., Aksenov N.D., Zenin V.V., Noniashvili E.N., Dyban A.P. (2005) Issledovanie «niti», svjazyvajushhej hromosomy. Citologija, 47(9), 825
- Purohit J.S., Chaturvedi M.M., Panda P. (2012) Histone proteases: the tale of tail clippers. Int. J. Int sci. Inn. Tech., 1(1), pp. 51-60
- Remeslo V.N. (1964) Ozimaja pshenica Mironovskaja 264 i Mironovskaja 808. M.: Kolos, 52-53
- Schubert I., Shaw P. (2011) Organization and dynamics of plant interphase chromosomes. Trends in Plant Science, 16(5), 273-281
- Tiang C.L., He Y., Pawlowski W.P. (2012) Chromosome Organization and Dynamics during Interphase, Mitosis, and Meiosis in Plants. Plant Physiol, 158, 26-34
- Tom R. (2002) Strukturnaja ustojchivost' i morfogenez. M.: Logos, 280 s
- Tumanov I.I. (1979) Fiziologija zakalivanija i morozostojkosti rastenij. M.: Nauka, 350s
- Turnaev I. I., Gunbin K. V., Kolchanov N. A. (2009) Jevoljucija kljuchevyh belkov kletochnogo cikla korreliruet s uvelicheniem slozhnosti jeukarioticheskih organizmov. Doklady Akademii nauk, 426(2), 265-269


