Молекулярные механизмы патогенеза розацеа
Автор: Давыдова А.В., Бакулев А.Л., Моррисон А.В., Леонова М.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 3 т.9, 2013 года.
Бесплатный доступ
Рассматриваются возможные молекулярные механизмы патогенеза розацеа отечественных и зарубежных клинических наблюдений и лабораторных исследований: нарушение регуляции и экспрессии антимикробных пептидов, фактора роста эндотелия сосудов, влияние сериновых протеаз, окислительного стресса, активных форм кислорода и ферритина на возникновение и течение розацеа. Новые разработки в области молекулярной биологии и генетики перспективны для выяснения взаимодействия множества факторов, участвующих в патогенезе розацеа, а также для создания потенциально новых методов лечения.
Антимикробные пептиды, врожденный иммунитет, молекулярные механизмы, неоангиогенез, розацеа
Короткий адрес: https://sciup.org/14917790
IDR: 14917790
Текст научной статьи Молекулярные механизмы патогенеза розацеа
Адрес: г. Саратов, ул. Навашина, 30, кв. 55.
Тел. (сот.): +79179861126
центральную часть лица (щеки, подбородок, нос и центральную часть лба) и характеризующееся стадийным течением. Проблема розацеа приобретает все большее значение в современной дерматологии. Рост заболеваемости в последнее время, хроническое с частыми рецидивами течение заболевания,
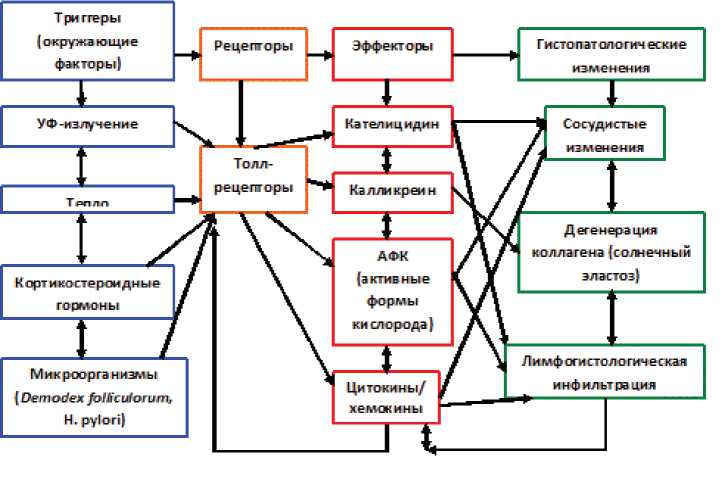
Рис. 1. Элементы системы врожденного иммунитета
недостаточная эффективность существующих методов лечения ставят проблему изучения данного дерматоза в ряд наиболее актуальных. Широкое разнообразие клинических форм розацеа вызывает споры в объяснении патогенеза данного заболевания. В настоящее время четкого понимания патофизиологии розацеа не существует. По данным литературы, потенциальную роль в развитии заболевания отводят таким патогенетическим факторам, как изменение иммунного ответа на фоне повышенного количества антимикробных пептидов (АМП), активация витаминообразующей функции кератиноцитов при длительной экспозиции УФ-излучения, сосудистые нарушения, патология иммунной и эндокринной систем [1–3]. Предрасполагающими факторами (триггерами), вызывающими развитие или обострение розацеа, являются солнечное излучение, стресс, изменение гормонального баланса, некоторые лекарственные препараты, в частности кортикостероидные гормоны, алкоголь, определенные пищевые продукты, инфицирование микроорганизмами (Demodex folliculorum и Helicobacter pylori) [3].
Кожа как орган иммунитета обеспечивает эффективную защиту посредством трех барьеров. При низком рН катионные белки с антимикробной активностью служат химическим щитом на поверхности кожи, при этом роговой слой образует начальный физический барьер, а эпидермальные кератиноциты образуют первый клеточный барьер против инфекционных агентов. Эти клетки вместе со спецальными антиген-представляющими (лимфоцитами, тучными клетками, клетками Лангерганса, эозинофилами, моноцитами) образуют первую линию клеточного врожденного иммунитета кожи [4]. Несмотря на экзогенные или эндогенные причины возникновения заболевания, существенную роль в патогенезе розацеа большинство исследователей отводят сосудистым нарушениям. Одной из причин нарушения регионарного кровообращения и микроциркуляции является эндотелиальная дисфункция, которая может приводить к спазму сосудов, усиленному тромбообра-зованию и адгезии лейкоцитов к эндотелию [5–7]. Доказано, что при розацеа выявлены аномалии эн- дотелия капилляров, представленные его утолщением, разрывами базальной мембраны и недостаточно плотным сочленением клеток эндотелиального слоя [8–10]. До конца не изучено участие системы гемостаза в патогенезе розацеа, взаимосвязь имунных механизмов с клиническими характеристиками заболевания. Выяснение этих вопросов важно не только для раскрытия патогенеза, но и для разработки методов терапии и профилактики заболевания.
Влияние врожденного иммунитета и антимикробных пептидов. Толл-рецепторы (TLRs) — главные компоненты системы врожденного иммунитета. Каждый из TLRs связывает патогенассоциированные молекулярные PAMPs, выступающие в качестве молекулярных маркеров потенциальных возбудителей (рис. 1) [11]. Различные экзо- и эндогенные факторы (УФ-излучение, тепло, кортикостероидные гормоны, мокроорганизмы Demodex folliculorumи Helicobacter pylori) воспринимаются толл-рецепторами, которые вызывают синтез молекул: кателицидина, калликре-ина, матриксных металлопротеиназ (ММР), активных форм кислорода (АФК), окиси азота (NO), цитокинов и хемокинов. Данные эффекторы изменяют структуру сосудов, дегенерируют коллаген, вызывают лимфогистологическую инфильтрацию, что сопровождается воспалением [12, 13]. Одни из последних молекулярных исследований предполагают, что измененный врожденный иммунный ответ участвует в патогенезе сосудистых и воспалительных заболеваний и наблюдается у пациентов с розацеа [10]. Проникновение нейтрофилов и лимфоцитов — это дополнительные источники эффекторных молекул, которые напрямую и косвенно активируют TLRs [14]. Тесная связь между сосудистой и иммунной системами, а также успех противовоспалительных средств при лечении розацеа предопределяют, что воспалительные клетки, такие, как нейтрофилы и другие медиаторы воспаления, являются ключевыми в патофизиологических факторах развития розацеа как нейтрофильного дерматоза [15]. Таким образом, фармакологическая модуляция функции нейтрофилов имеет решающее значение для разрешения розацеа [15]. Также одним из пусковых механизмов активации TLRs является хитин клещей Demodex folliculorum, обнаружение которых прямо пропорционально коррелирует с воспалением на коже [16].
Взаимодействие механизмов врожденного иммунного ответа осуществляется на фоне повышенного количества в коже больных розацеа антимикробного пептида кателицидина, его активатора калликреи-на-5 (трипсинового фермента рогового слоя) и кал-ликреина-7 (хемотрипсинового фермента рогового слоя) [13, 17]. Усилители низкомолекулярных белков, которые являются частью врожденного иммунного ответа, вовлечены в патогенез многих воспалительных заболеваний кожи — кателлицидины — это семейство антимикробных белков, которые, главным образом, обнаружены в пероксидаза-отрицательных гранулах нейтрофилов [18, 19]. Непосредственно эндогенные антимикробные пептиды представляют собой небольшие молекулы, построенные из аминокислот, и являются важной составляющей врожденной иммунной системы. Как правило, защитные свойства врожденного иммунитета реализуются через острую воспалительную реакцию, сопряженную с активацией сосудистого эндотелия и клеток-фагоцитов (преимущественно нейтрофилов) в месте повреждения. Антимикробные пептиды, являющиеся динамическим механизмом защиты от повреждений кожи и инфекционных агентов, усиливают экспрессию синтеза пропептидами и активацию после протеолитического расщепления от своих молекул-предшественников [20]. Одним из наиболее изученных кателицидинов при розацеа является LL-37, который помимо антимикробной активности имеет дополнительные функции в активации и контроле иммунного ответа: увеличивает активность цитокинов и хемокинов, оказывает хемотаксический эффект на большое количество иммунных клеток [17], совместно с цитокинами усиливает врожденный иммунный ответ, пролиферацию эндотелиальных клеток и влияет на ангиогенез [21].
Длительная экспозиция УФ-излучения вызывает активацию витамина Д в кератиноцитах с последующей экспрессией кателицидина [22, 23]. 1,25-ди-гидроксивитамина D3, активная форма витамина D, является основным регулятором антимикробных пептидов не только в моноцитах, но и в эпидермальных кератиноцитах. Причем у пациентов с розацеа наблюдаются аномально высокие уровни, в частности, LL-37 пептида формы кателлиицидина и трипсинового энзима рогового слоя кожи по сравнению со здоровыми лицами [24]. Кателицидин LL-37, найденный у пациентов с розацеа, качественно также отличается от аналогичного у клинически здоровых людей [25]. LL-37 взаимодействует с эндотелиальными клетками, стимулирует ангиогенез, а также модулирует экспрессию VEGF [26]. Доказано, что введение этого фермента и LL-37 в кожу животных приводит к развитию розацеаподобного дерматита у мышей [18]. Но изолированное повышение активности сериновых протеаз кателицидина не вызывает клинически выраженных воспалительных изменений на коже [27]. Этот механизм частично объясняет эффективность применения антибактериальных препаратов тетрациклинового ряда у больных розацеа, действие которых направлено не на микробный агент, а на снижение количества антимикробных пептидов. Таким образом, с точки зрения врожденного иммунитета, кателицидин является одним из эффекторов гиперваскуляризации при розацеа.
Влияние окислительного стресса, активных форм кислорода (АФК) и экспрессия феррити- на. Продуктом любых окислительных взаимоотношений в организме являются свободные радикалы и пероксиды, которые при вступлении в реакцию с металлами могут вызывать обширные клеточные повреждения. Свободные радикалы, а именно суперок-сид-анионы и гидроксильные радиалы, в дополнение к другим реактивным молекулам, таким, как молекулярный кислород, синглетный кислород и перекись водорода (АФК), приводят к окислительному повреждению тканей, изменению липидного баланса кожи, производству цитокинов и медиаторов воспаления с помощью кератиноцитов, фибробластов, эндотелиальных клеток, что и способствует образованию пустул при розацеа [28, 29]. Одним из активных металлов, присутствующих в организме, является железо, которое катализирует превращение перекиси водорода в свободные радикалы, что приводит к повреждению тканей, клеточных мембран, белков и ДНК. На клеточном уровне железо, которое не метаболизируется, хранится в виде ферритина. Поэтому связь обострения заболевания при воздействии УФ-облучения может объясняться активацией окислительных процессов, способствующих деградации ферритина и выделению свободного железа. В зарубежных исследованиях при проведении биопсии кожи пациентов с розацеа количество ферритин-позитивных клеток было значительно выше по сравнению с контрольной группой и его количество коррелировало с тяжестью патологического процесса. Причем у пациентов с первым подтипом розацеа (эритематозно-телеан-гиэктатическая стадия) расположение ферритин-по-зитивных клеток наблюдалось лишь в верхней трети эпидермиса; у пациентов со вторым подтипом (папулезно-пустулезной стадией) — в верхних двух третях эпидермиса; максимальное количество ферритин-позитивных клеток почти во всех слоях эпидермиса определялось у пациентов с третьим подтипом розацеа (ринофима). В эпидермисе клинически здоровых людей ферритин-позитивных клеток выявлено практически не было [30].
Неоангиогенез и гиперэкспрессия фактора роста эндотелия сосудов (VEGF). Фактор роста эндотелия сосудов — это димер, гепарин-связывающий белок, с молекулярной массой 34-42 кДа [31]. Он, взаимодействуя с двумя близкими по строению мембранными тирозинкиназными рецепторами (рецепторы VEGF-1 и VEGF-2), активирует их и запускает сигнальный каскад процессов, стимулирующих рост и пролиферацию клеток эндотелия.
Многочисленные исследования, проведенные с помощью видеокапилляроскопа при эритематозной стадии розацеа, показали повышение неоангиогенеза и расширение кровеносных сосудов, повышенную иммуногистохимию VEGF (Vаscular Endothelial Growth Factor), выраженную в эндотелии сосудов у пациентов с розацеа [32]. Способность изменять тонус сосудов, повышать проницаемость капилляров и вызывать эритему, принадлежит вазоактивным пептидам желудочно-кишечного тракта (VIP, пентагастрин), простагландину Е2, ряду медиаторных веществ (эндорфины, брадикинин, серотонин, гистамин, субстанция Р), компонентам калликреин-кининовой системы. С одной стороны, возможна первичная или активная дилатация сосудов, которая развивается из-за изменений капилляров и мелких сосудов, представленных утолщением их стенок, разрывами эластической мембраны и нарушениями плотного сочленения между клетками эндотелия. С другой стороны, дилатация сосудов может происходить вто- рично или пассивно в результате повреждения каркаса соединительной ткани дермы вследствие деструкции ее коллагеновых и эластических волокон. УФ-облучение вызывает отек в дерме в сочетании с солнечным эластозом, появлением небольших периваскулярных лимфоцитарных инфильтратов и расширением лимфатических сосудов в дерме (пятна с селективными антителами LYVE-1). Это убедительно доказывает, что розацеа начинается как актиническая васкулопатия лимфатической системы [33]. Экспрессия рецепторов VEGF (VEGF-R) наблюдается и на эндотелии сосудов и моноцитах. VEGF рецептор-лиганд может способствовать сосудистым изменениям и клеточной инфильтрации при розацеа. После интенсивного УФ-облучения CD11β + макрофаги и нейтрофилы проникают в эпидермис, увеличение циклооксигеназы-2 (COX-2) в кератиноцитах вызывает индукцию эйкозаноидов, простагландина Е2, происходит дегрануляция тучных клеток, гистамина и лейкотриенов, а также активация нейтрофилов [34, 35]. В исследовании in vitro, проведенном на культуре человеческих кератиноцитов, показано, что VEGF синтезируется активированными кератиноцитами после их стимуляции провоспалительными цитокинами после воздействия ультрафиолетового облучения провоцируется выработка провоспалительных цитокинов — интерлейкина 1 (ИЛ-1) и фактора некроза опухоли (TNF-α), которые стимулируют кератиноци-ты к синтезу VEGF [36, 37].
Патофизиологические механизмы возникновения и развития розацеа до сих пор являются предметом научных споров. Многочисленные исследования показывают участие большого количества иммунных клеток, клеток крови, протеаз, медиаторов воспаления, антимикробных пептидов, приводящих последовательно к гиперваскуляризации, воспалению и гиперплазии. Необходимы дальнейшие исследования, которые позволили бы связать воедино механизмы развития розацеа и определить инновационные методы лечения и прогнозирование течения дерматоза.
Список литературы Молекулярные механизмы патогенеза розацеа
- Потекаев Н. Н., Янсен Т., Флайг М. Гемангиома и роза-цеа//Вестн. дерматол. и венерол. 2000. № 2. С. 32-34
- Темников В. Е. Особенности иммунного статуса при розовых угрях//Иммунология в дерматовенерологии. 1999. С. 86-88
- Laser and light therapies for acne rosacea/K. L. Butterwick [et al.]//J. Drugs Dermatol. 2006. Vol. 5, № 3. pt. 35. P. 9
- Skin immune sentinels in health and disease/F. O. Nestle, Di Meglio P., J.Z. Qin, B.J. Nickoloff//Nat. Rev. Immunol. 2009. Pt. 9. P. 679-691
- Сницаренко О. В. Вазоактивные полипептиды при ро-зацеа//Вестн. дерматол. и венерол. 1995. № 9. С. 42-44
- Objective and Quantitative Improvement of Rosacea-Associated Erythema after IPL Treatment/K.A. Mark, R.M. Sparacio, A. Voigt [et al.]//Dermatol. Surg. 2003. Vol. 29. P. 600-604
- Самцов А. В. Учебно-исследовательская лаборатория клинической дерматогистопатологии на основе систем искусственного интеллекта//Вестн. Рос. воен.-мед. акад. 2000. № 1. С. 94-97
- Papules of the face/N. Ghariani, M. Kourda, M. Denguczli [et al.]//Ann. Dermatol. Venereol. 2002. Vol. 129, № 10, pt. 1. P. 1181-1182
- Yamasaki K., Gallo R.L. The molecular pathology of rosacea///Journal of Dermatological Science. 2009. Vol. 55. P. 77-81
- Природная устойчивость бактерий к факторам врожденной иммунной системы, обусловленная бактериальными протеазами/Ю.А. Тюрин, И.Г. Мустафин, PC. Фасса-хов//Практическая медицина. Казань. 2010. № 1. С. 7-13
- Toll-like receptors/К. Takeda, Т. Kaisho, S. Akira//Ann. Rev. Immunol. 2003. № 21. P. 335-376
- Kallikrein-mediated proteolysis regulates the antimicrobial effects of cathelicidins in skin/K. Yamasaki, J. Schauber, A. Coda [et al.]//FASEB J. 2006. № 20. P. 2068-2080
- Increased serine protease activity and cathelicidin promotes skin inflammation in rosacea/K. Yamasaki, D.A. Nardo, A. Bardan [et al.]//Nat. Med. 2007. № 13. P. 975-980
- Cathelicidin LL-37 induces the generation of reactive oxygen species and release of human alpha-defensins from neutrophils/Y Zheng, F. Niyonsaba, H. Ushio [et al.]//Br.J. Dermatol. 2007. № 157. P. 1124-1131
- Host defense peptide LL-37, in synergy with inflammatory mediator IL-1 beta, augments immune responses by multiple pathways/J. Yu, N. Mookherjee, K. Wee [et al.]//J. Immunol. 2007. № 179. P. 7684-7691
- IL-17A enhances vitamin D3-induced expression of cathelicidin antimicrobial peptide in human keratinocytes/M. Peric, S. Koglin, S. M. Kim [et al.]//J. Immunol. 2008. № 181. P. 8504-8512
- Keratinocyte production of cathelicidin provides direct activity against bacterial skin pathogens/M.H. Braff, M. Zaiou, J. Fierer[etal.]//Infect. Immun. 2005. №73. P. 6771-6781
- Angiogenesis in cutaneous disease: part II/V Laquer, V Hoang, A. Nguyen, K.M. Kelly//J.Am. Acad. Dermatol. 2009. Vol. 61, № 6. P. 945-960
- Injury enhances TLR2 function and antimicrobial peptide expression through a vitamin D-dependent mechanism/J. Schauber, R.A. Dorschner, A. B. Coda [et al.]//J. Clin. Invest.2007. №117. P. 803-811
- Antimicrobial peptides: key components of the innate immune system/M. Pasupuleti, A. Schmidtchen, M. Malmsten//Crit. Rev. Biotechnol. 2011. [Epub ahead of print]
- A New Perspective on Rosacea: The Role of Innate Immunity/L. E. Maier, K. Yamasaki, R. L. Gallo//US Dermatol. Rev. 2007. P. 19-21
- UV-B-triggered induction of vitamin D3 metabolism differentially affects antimicrobial peptide expression in keratinocytes/M. Peric, B. Lehmann, G. Vashina [et al.]//J. Allergy. Clin. Immunol. 2010. № 125. P. 746-749
- The potential role of microorganisms in the development of rosacea/E. Lazaridou, О Giannopoulou, О Fotiadou [et al.]//J. Dtsch. Dermatol. Ges. 2011. № 9. P. 21-25
- Chosidow O. Epidemiology of rosacea: updated data//Ann. Dermatol. Venereol. 2011. Vol. 138 (Suppl. 2). P. 124-128
- Impact of vitamin D3 on cutaneous immunity and antimicrobial peptide expression/A.S. Antal, Y. Dombrowski, S. Koglin, [et al.]//J. Dermatoendocrinol. 2011. № 3. P. 18-22
- Jones D.A. Rosacea, reactive oxygen species, and azelaic acid//J. Clin. Aesthetic Derm. 2009. Vol. 2, № 1. P. 26-30
- Schauber J., Gallo R. L. The vitamin D pathway: a new target for control of the skin»s immune response//Exp. Dermatol. 2008. №17. P. 633-639
- Oxidative stress and ferritin expression in the skin of patients with rosacea/VS. Tisma, A. Basta-Juzbasic, M. Jaganjac [et al.]//J.Am. Acad. Dermatol. 2009. Vol. 60, № 2. P. 270-276
- Smith J.R., Lanier V B. Expression of VEGF and its receptors in rosacea//Br.J. Ophthalmol. 2007. № 91. P. 226-229
- Cuevas P., Arrazola J.M. Therapeutic response of rosacea to dobesilate//Eur.J. Med. Res. 2005. Vol. 10, № 10. P 454-456.
- Folkman J., Klagsburn M. Angiogenic factors//Science. 1987. Vol. 235. P. 442-447
- Lymphangiogenesis and angiogenesis in non-phymatous rosacea/A.H. Gomaa, M. Yaar, M.M. Eyada, J. Bhawan//J. Cutan. Pathol. 2007. № 34. P. 748-753
- Functional changes induced by chronic UVA irritation to cultured human dermal fibroblasts/E. Naru, T. Suzuki, M. Moriyama [et al.]//Br.J. Dermatol. 2005. Vol. 153 (Suppl. 2). P. 6-12
- Myeloid Differentiation Factor 88 Regulates Basal and UV-lnduced Expressions of IL-6 and MMP-1 in Human Epidermal Keratinocytes/Y Lee, S. Kim, M.H. Shin, К H. Kim [et al.]//J. Invest. Dermatol. 2009. № 129. P. 460-467
- A study of the pathogenesis of Rosacea: how angiogenesis and mast cells may participate in a complex multifactorial process/К. Aroni, E. Tsagroni, N. Kavantzas [et al.]//Arch. Dermatol. Res. 2008. Vol. 300, № 3. P. 125-131
- Reactive oxygen species in tumor necrosis factor-alpha-activated primary human keratinocytes: implications for psoriasis and inflammatory skin disease/С N. Young, J.I. Koepke, L.J. Terlecky [et al.]//J. Invest. Dermatol. 2008. № 128. P. 2606-2614
- Schauber J., Gallo R.L. Expanding the roles of antimicrobial peptides in skin: alarming and arming keratinocytes//J. Invest. Dermatol. 2007. № 127. P. 510-512.


