Молекулярные механизмы противоопухолевого эффекта Д-глюкуронил С5-эпимеразы в экспериментальной модели рака легкого in vivo
Автор: Мостович Л.А., Прудникова Т.Ю., Доманицкая Н.В., Вержбицкая Н.Е., Харченко О.В., Непомнящих Г.И., Айдагулова С.В., Рыкова В.И., Григорьева Э.в
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (38), 2010 года.
Бесплатный доступ
Изучено влияние эктопической экспрессии гена D-глюкуронил C5-эпимеразы на рост экспериментальных опухолей мелкоклеточного рака легкого человека у мышей линии SCID. Исследование показало, что экспрессия эпимеразы в клетках мелкоклеточного рака легких U2020 значительно ингибирует рост опухолей у экспериментальных животных, тогда как в растущих опухолях экспрессия эпимеразы почти не наблюдается. С помощью набора реактивов Cancer PathFinder RT Profiler PCR, позволяющего оценить экспрессию 84 генов, вовлеченных в процессы канцерогенеза, был проведен анализ возможных молекулярных механизмов действия эпимеразы in vivo. Результаты показали, что экспрессия D-глюкуронил C5-эпимеразы связана с молекулярными путями ангиогенеза и апоптоза. Таким образом, инактивация эпимеразы в растущих эксперимен- тальных опухолях является важным звеном в процессе развития рака, что дает возможность рассматривать D-глюкуронил C5-эпимеразу в качестве потенциального регулятора клеточной пролиферации и роста опухолей и возможную основу для создания новых препаратов для генотерапии мелкоклеточного рака легкого.
Д-глюкуронил с5-эпимераза, экспрессия, опухоль, супрессия, молекулярный механизм
Короткий адрес: https://sciup.org/14055608
IDR: 14055608 | УДК: 616.24-006.6
Текст научной статьи Молекулярные механизмы противоопухолевого эффекта Д-глюкуронил С5-эпимеразы в экспериментальной модели рака легкого in vivo
Д-глюкуронил С5-эпимераза (GLCE) является одним из ключевых ферментов биосинтеза гепарансульфат протеогликанов (ГСПГ) – сложных белково-углеводных молекул, локализованных на поверхности клеток и во внеклеточном матриксе (ВКМ). ГСПГ играют существенную роль в межклеточных взаимодействиях и взаимодействии клеток с ВКМ, принимают участие в передаче сигнальной информации и механизмах действия факторов роста и других сигнальных молекул [13]. ГСПГ необходимы для нормального клеточного роста и развития, изменения их состава и/или структуры приводят к различным патологическим процессам, в том числе раку [2, 12]. Во многих случаях именно структура углеводных цепей гепарансульфатов (ГС) определяет функциональную активность молекулы протеогликана, и изучение механизма биосинтеза гепарансульфатов является очень актуальной задачей, так как его дефекты будут влиять на структуру и функции всех клеточных ГСПГ [15].
Поскольку D-глюкуронил C5-эпимераза является одним из ключевых ферментов биосинтеза гепарансульфатов, определяющим все последующие модификации углеводной цепи, нарушение ее функциональной активности и, соответственно, структуры всех синтезируемых клеткой ГС может приводить к различным патологиям. Однако в течение длительного времени эпимераза изучалась исключительно как фермент биосинтеза протеогликанов. Было показано его участие в процессах биосинтеза гепарансульфатов [3] и дерматансульфатов [14], изучена субстратная специфичность и проведены исследования кинетических свойств [6] и механизма эпимеризации [7, 8]. Ген D-глюкуронил-C5-эпимеразы был клонирован для легкого быка [9], печени мышей [10] и мышиной мастоцитомы [4], и показано, что его направленное разрушение у мышей приводило к летальному фенотипу с дефектом легких, почек и нарушениями скелета [11]. Хотя эти данные убедительно свидетельствуют о высокой важности D-глюкуронил-C5-эпимеразы для жизнедеятельности организма, до самого последнего времени не проводилось исследований функциональной роли эпимеразы в злокачественных процессах. Нами было высказано предположение о воз- можном участии D-глюкуронил-C5-эпимеразы в процессе злокачественной трансформации и получены первые данные о снижении уровня экспрессии эпимеразы в опухолях молочной железы человека [1, 5].
В данной работе было изучено влияние эктопической экспрессии гена D-глюкуронил C5-эпимеразы на рост экспериментальных опухолей мелкоклеточного рака легкого человека у мышей линии SCID и проведен анализ возможных молекулярных механизмов действия эпимеразы in vivo .
Материал и методы
Клеточная линия мелкоклеточного рака легкого человека U2020 была получена из Каролинского Института (Стокгольм, Швеция). Клетки поддерживали в среде IMDM, cодержащей 2мМ L-глутамина, 100 ед./пенициллина, 100 мкг/мл стрептомицина и 10 % (v/v) телячьей эмбриональной сыворотки в инкубаторе при 37°С во влажной атмосфере, содержащей 5 % CО2. Для анализа получали взвесь клеток по стандартному протоколу с использованием смеси трипсин/ ЭДТА.
Анализ экспрессии GLCE методом обратно-транскриптазией (ОТ) ПЦР
Суммарную РНК выделяли из клеток с помощью PureLink Total RNA Purification System (Invitrogen, Carlsbad, CA,USA) в соответствии с инструкцией производителя. Синтез кДНК из 1–2 мкг общей РНК проводили с помощью First Strand cDNA Synthesis kit (Fermentas, Hanover, MD, USA) согласно инструкции производителя. Мультиплексную ПЦР проводили в амплифика-торе Терцик (ДНК-технология, Россия) в объеме 20 мкл (~200 нг кДНК, 2 мкл 10 × ПЦР-буфера 10 мМ Tris-HCl, 1,5 мМ MgCl2, 50 мМ KCl, pH 8,3, 5 пмоль каждого праймера, 0,2 ммоль каждого dNTP и 1 ед. Taq-полимеразы). Условия ПЦР: 95°C – 10 мин, 95°C – 15 сек, 59°C – 15 сек и 72°C – 1 мин с конечной стадией элонгации при 72°C – 10 мин; 32 цикла для GAPDH и 20 для GLCE. Продукты амплификации анализировали с помощью электрофореза в 1,2 % агарозном геле, для визуализации была использована система «DNA Analyzer» (Москва, Россия). Уровень экспрессии GLCE оценивался как отношение интенсивностей амплифицированных фрагментов ДНК GLCE и GAPDH (TotalLab Рrogramme, Nonlinear Dynamics, UK).
В работе использовали праймеры: GLCE-F, 5′-AAGGGAGACGAGA GGGGAACGAA-3′; GLCE-R, 5′GCCAC-CTTTCTCATCCTGGTTC-3′; GAPDH-F, 5′-GGGCGCCTGGTCACAA-3′;GAPDH-R,5′-AAC ATGGGGGCATCAGCAGA-3′.
Количественный ОТ-ПЦР в реальном времени был проведен с использованием BioRad IQ5 Multicolor Real-Time PCR Detection System (BioRad) и Custom GLCE TaqMan Assay (Applied Biosystems) при следующих условиях: 95°C 3 мин, 40 циклов 95°C 10 сек и 60°C 30 сек. Общий реакционный объем составил 25 мкл. В качестве гена домашнего хозяйства использовали β-актин. Праймеры ПЦР и TaqMan-зонды: GLCE-F, 5′-TTCCAAAGTCTATGCACAGA-GAGC-3′; GLCE-R, 5′-TCCACATTGTAGCCT-TCAAAAGACA-3′; GLCE-зонд, 5′-FAM-CCCC TATCACCCCGATGGT-TAMRA-3′; β-актин-F, 5′-GGCACCCAGCACAA TGAAG-3′, β-актин-R, 5′-GCCGATCCA-CACGGAGTACT-3′, β-актин-зонд, 5′-FAM-TCAAGATCATTGCTCCTCCTGAGCGC-TAMRA-3′.
Рост опухоли in vivoу мышей линии SCID
Клетки U2020, стабильно трансфецирован-ные плазмидой pETE-Bsd (pETE-U2020) или плазмидой epi-pETE-Bsd (epi-U2020), осаждали при 800 rpm в течение 2 мин, суспендировали в 100 мкл среды IMDM, не содержащей сыворотку, и смешивали с Матригелем согласно инструкции производителя (BD Biosciences, Belgium). Суспензию клеток вводили мышам линии SCID (возраст 6–8 нед) из расчета 2–3 × 106 клеток на животное. Наблюдения за формированием опухолей проводились дважды в неделю в течение 35 дней, выросшие опухоли были использованы для определения уровня экспрессии эпимеразы методами ОТ-ПЦР и иммуногистохимического анализа.
Иммуногистохимический анализ
Иммунохимическое окрашивание парафиновых срезов проводили при помощи системы ImmunoPure Ultra-Sensitive ABC Standard
Peroxidase Staining Kit (Pierce, США) согласно инструкции производителя. Срезы депарафинировали, блокировали и инкубировали 30 мин с первичными антителами (rabbit anti-human epimerase, 1:200), затем 15 мин с вторичными антителами (sheep anti-rabbit, 1:2000) при комнатной температуре. В качестве субстрата использовали ДАБ, окрашивание проводили 5–15 мин при комнатной температуре, промывали буфером, окрашивали гематоксилином в течение 2 мин и анализировали на микроскопе Axiostar Plus (Carl Zeiss).
Анализ возможных молекулярных механизмов биологического эффекта эпимеразы
Для определения возможных механизмов действия гена использовали набор реактивов Cancer PathFinder RT2 Profiler™ PCR Array (SABioscience, Frederick, MD, USA). Суммарную РНК выделяли с использованием RNAqueous Micro Kit (Applied Biosystems, Foster City, CA) согласно инструкции производителя, концентрацию РНК оценивали с помощью набора реактивов Quant-iT Assay Kit для количественного определения РНК на приборе Qubit (Invitrogen, USA), качество оценивали с помощью электрофореза. кДНК была синтезирована из 1–2 мкг общей РНК с использованием набора реактивов First Strand cDNA Synthesis (Fermentas, Hanover, MD). ПЦР в реальном времени проводили в соответствии с руководством пользователя RT2 Profiler PCR Array System, используя SYBR Green PCR Master Mix (Fermentas, Hanover, MD) в iCycler iQ5 Multicolor Detection System (Bio-Rad, USA). Полученные результаты анализировали программой Excel-based PCR Array Data Analysis Software (SABioscience).
Результаты и обсуждение
Для изучения влияния D-глюкуронил-C5-эпимеразы на формирование экспериментальных опухолей in vivo иммунодефицитным мышам линии SCID были инокулированы опухолевые клетки мелкоклеточного рака легкого человека U2020, стабильно трансфецированные плазмидой epi-pETE\Bsd (epi-U2020, клоны 4, 7 и 8), способные к экспрессии эпимеразы. В качестве контроля использованы клетки, несущие пустой вектор – pETE-U2020. У группы мышей, инокулированных клетками epi-U2020, рост опухолей не наблюдался совсем или был медленнее, чем в контрольной группе (рис. 1А). В течение 31–35 дней солидные опухоли были выявлены у 5 из 6 мышей, инокулированных контрольными клетками pETE-U2020 (контрольные опухоли), тогда как только у 5 из 10 мышей, инокулированных клетками epi-U2020, отмечено образование опухолей, сопоставимых по размеру и скорости роста с контрольными (рис. 1Б).
У остальных мышей в местах инокуляции отмечено наличие опухолеподобного образования, соответствующего по объему исходному количеству введенных опухолевых клеток («опухолевое тельце», ОТ). Нас заинтересовало такое различие в скорости формирования экспериментальных опухолей, и была поставлена задача сравнить их в плане экспрессии гена эпимеразы и ключевых молекул канцерогенеза. Для этого все опухоли и опухолевые тельца были подвергнуты эксплантации, после чего в них была определена экспрессия эпимеразы методом мультиплексной ОТ-ПЦР. Несмотря на то, что исходные клетки обладали эктопическим уровнем экспрессии эпимеразы, сравнимым с уровнем нормальной легочной ткани, во всех опухолевых образцах epi-U2020 экспрессия эпимеразы практически не определялась (рис. 1В). Данные, полученные с помощью мультиплексной ОТ-ПЦР, были подтверждены количественной ОТ-ПЦР в реальном времени,
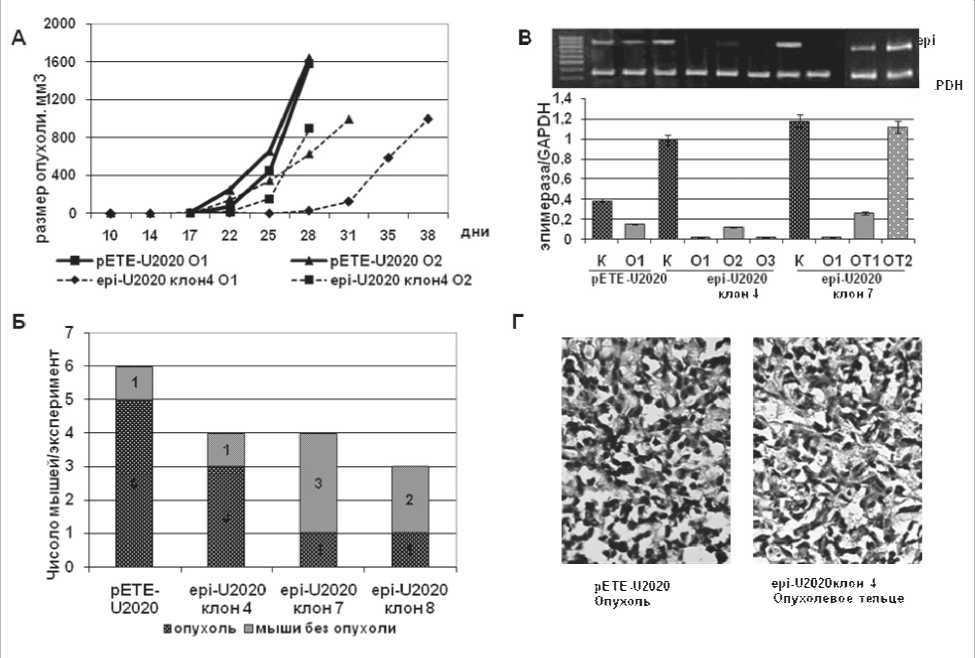
Рис. 1. А, Б – влияние D-глюкуронил С5-эпимеразы на формирование экспериментальных опухолей у иммунодефицитных мышей линии SCID
В – экспрессия эпимеразы в экспериментальных опухолях. Электрофореграмма мультиплексной ОТ-ПЦР и относительная экспрессия гена эпимеразы по отношению к GAPDH; К – клетки, использованные для инокуляции; О – выросшие из них опухоли, ОТ – «опухолевые тельца». Подписи на графике соответствуют дорожкам на электрофореграмме;
Г – иммуногистохимический aнализ экспериментальных опухолей
оценка экспрессии D-глюкуронилC5-эпимеразы в первичных клетках показала 720–960 молекул эпимеразы/1000 молекул GAPDH и почти полное отсутствие экспрессии в образцах опухолей. Экспрессия эпимеразы в «опухолевых тельцах» была сравнима с экспрессией в первичных клетках epi-U2020 (рис. 1В). Иммуногистохимический анализ также показал наличие экспрессии эпимеразы в «опухолевых тельцах» и ее отсутствие в выросших экспериментальных опухолях epi-U2020 (рис. 1Г).
Полученный результат свидетельствует о том, что D-глюкуронил C5-эпимераза обладает свойствами гена-супрессора развития опухоли и ее инактивация является необходимым условием развития экспериментальных опухолей. Чтобы определить возможные молекулярные механизмы противоопухолевого эффекта эпимеразы для мелкоклеточного рака легкого in vivo, мы использовали систему Cancer PathFinder RT Profiler PCR Array (SABiosciences). Она основана на одновременном определении уровня экспрессии 84 генов, вовлеченных в процесс канцерогенеза и относящихся к 6 различным молекулярным механизмам (регуляция клеточного цикла, передача сигнальной информации, апоптоз, ангиогенез, адгезия, инвазия и метастазирование). Уровень экспрессии каждого из 84 тестовых генов определяется в экспериментальном и контрольном образцах, и его изменение говорит о возможном участии исследуемого гена (в нашем случае D-глюкуронил С5-эпимеразы) в молекулярном механизме канцерогенеза, связанном с этим тестовым геном.
В данном случае было проведено сравнение относительных уровней экспрессии генов, участвующих в процессах канцерогенеза, в «опухолевых тельцах» (эпимераза экспрессируется) и выросших экспериментальных опухолях epi-U2020 (эпимераза инактивирована) (рис. 2). Согласно полученным данным, эктопическая экспрессия D-глюкуронил С5-эпимеразы в клетках epi-U2020 приводила к тому, что их инокуляция мышам SCID не приводила к развитию опухоли. Эти клетки характеризовались повышенной экспрессией генов IGF1 (в 273 раза), HTATIP2 (54 раза), BCL2 (31 раз), TNF (25,7 раза), RB1 (9,2 раза) и TNFRSF6 (8,4 раза).
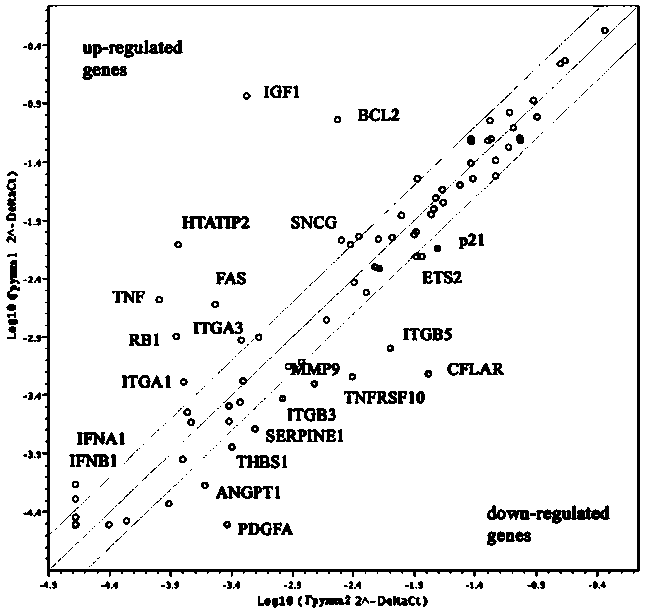
Рис. 2. Изменение экспрессии генов в «опухолевых тельцах» (группа 1) относительно выросших опухолей epi-U2020 (группа 2). Диагональ на графике соответствует одинаковой экспрессии гена в экспериментальном и контрольном образцах, параллельные прямые ограничивают зону 2-кратного изменения уровня экспрессии. Верхняя и нижняя части диаграммы – гены, экспрессия которых в «опухолевых тельцах» повышена и понижена (соответственно) по сравнению с выросшими опухолями
Менее выраженная разница (2–4-кратное изменение) была показана для IFNA1 (3,4), IFNB1 (2,5), ITGA1 (3,2), ITGA3 (2,5), SNCG (2,7), NME1 (2,3) и BCL2L1, TGFB1, FGFR2 (2,1). Гены, уровень экспрессии которых в «опухолевых тельцах» был ниже, чем в выросших опухолях (где эпимераза была инактивирована) – CFLAR (27,2 раза), PDGFA (11,8 раза), ITGB5 (7,9 раза), TNFRSF10B (6,7 раза). Менее выраженная разница (в 2–4 раза) наблюдалась для MMP9 (3,9), ANGPT1 (3,6), SERPINE1 (3), THBS1 (2,8), ITGB3 (2,8), p21 (2,7), MET (2,6) и ETS (2,3).
Полученные результаты позволяют высказать предположение, что эктопическая экспрессия эпимеразы в клетках epi-U2020 подавляет развитие опухоли в первую очередь благодаря значительному снижению уровня экспрессии фактора роста сосудов (PDGFA –11,8 раза), изменению экспрессии фактора некроза опухоли TNF (+25,7 раза) и его рецепторов (TNFRSF6 +8,4 раза и TNFRSF10B – 6,7 раза) и повышению экспрессии супрессора клеточной пролиферации RB1 (+9,2 раза). Если учитывать также гены, для которых было показано умеренное (в 2–4 раза) изменение экспрессии в «опухолевых тельцах», можно сделать вывод, что антиопу-холевый эффект D-глюкуронил С5-эпимеразы в первую очередь реализуется через механизм подавления опухолевого ангиогенеза (IGF1, PDGFA, TNF, IFNA1, IFNB1, THBS1, ANGPT1) и в меньшей степени апоптоза (CFLAR, HTATIP2, TNFRSF10B и BCL2).
Таким образом, полученные нами данные о супрессирующем эффекте D-глюкуронил С5-эпимеразы на формирование экспериментальных опухолей у мышей SCID дают возможность рассматривать ген D-глюкуронил С5-эпимеразы как новый потенциальный регулятор клеточной пролиферации и роста опухолей и возможную основу для создания новых препаратов для ге-нотерапии мелкоклеточного рака легкого.
(Каролинский Институт, Стокгольм) за помощь в проведении экспериментов, поддержку и обсуждение данной работы.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (РФФИ № 09–04–01599а).


