Молекулярные мишени действия инновационного антиконвульсанта Галодиф в терапии алкогольной зависимости
Автор: Шушпанова Тамара Владимировна, Новожеева Татьяна Петровна, Мандель Анна Исаевна, Князева Елена Михайловна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 2 (99), 2018 года.
Бесплатный доступ
Алкоголь вызывает нейропластические изменения бензодиазепиновых рецепторов, модулирующих ГАМКА-рецепторы (ГАМКА-Р), поддерживающие алкогольную аддикцию. Изучение свойств бензодиазепиновых рецепторов (БДР) в мозге крыс Вистар с разным предпочтением к алкоголю показало, что аффинность связывания [3H] флунитразепама и [3H]Ro5-4864 во фракциях мембран была снижена, а плотность мест специфического связывания повышена в коре мозга «многопьющих» и «малопьющих» крыс по сравнению с «отвергающими» этанол животными. Введение антиконвульсанта мета-хлор-бензгидрилмочевины (галодифа) повышает аффинность бензодиазепиновых рецепторов в коре головного мозга у «многопьющих» крыс, что приводит к повышению нейромедиации ГАМК в мозге этих животных, вызывает снижение потребления алкоголя. Галодиф снижает экспрессию БДР плазматических мембран тромбоцитов крови больных алкоголизмом до уровня контрольных значений. Применение противосудорожных препаратов, влияющих на мишени действия алкоголя - БДР, и в частности галодифа, может обеспечить новый фармакотерапевтический подход к профилактике и лечению этого заболевания.
Алкоголь, алкоголизм, антиконвульсант, γ-аминомасляная кислота, бензодиазепиновые рецепторы, мозг
Короткий адрес: https://sciup.org/142212928
IDR: 142212928 | УДК: 616.89-008.441.13:615.03 | DOI: 10.26617/1810-3111-2018-2(99)-120-126
Текст научной статьи Молекулярные мишени действия инновационного антиконвульсанта Галодиф в терапии алкогольной зависимости
Механизм формирования алкогольной зависимости и возникновения синдрома отмены алкоголя еще недостаточно изучен и понятен, несмотря на большое количество данных экспериментальных и клинических исследований [1]. Алкоголизм является одной из форм импульсивного поведения у больных, обусловленной общим дефицитом торможения в поведении, или как результат нарушений, предвосхищающих негативные последствия алкоголизма. Нарушение процессов возбуждения и торможения в мозге может с высокой степенью риска являться основой развития алкоголизма. Возникновение рецидива у больных алкоголизмом часто связано с развитием тревоги при синдроме отмены хронического употребления этанола. Некоторые клинические симптомы, характерные для синдрома отмены алкоголя, являются общими среди пациентов с лекарственной зависимостью, вызванной злоупотреблением различных препаратов, в том числе бензодиазепинов [2, 3].
Исследования, проведённые на различных экспериментальных моделях животных, показали, что воздействие алкоголя приводит к снижению чувствительности к алкоголю и другим бензодиазепиновым агонистам [2, 4]. Злоупотребление алкоголем вызывает развитие толерантности и зависимости, посредством взаимодействия этанола с ГАМК А / бензодиазепиновым рецепторным комплексом (ГАМК А /БДР)
в различных структурах головного мозга [5]. ГАМ-К А /БДР – пентамерный макромолекулярный мембранный комплекс, имеющий места специфического связывания для многих лигандов: γ -аминомасляной кислоты (ГАМК), барбитуратов, бензодиазепинов, алкоголя и нейростероидов [6]. Предполагают, что умеренные дозы этанола действуют, непосредственно связываясь с белками, которые формируют ГАМК А /БДР, связанных с CL–-ионным каналом, функция которого аллостерически модулируется в различных областях мозга, участвующих в развитии эффектов этанола. Антагонисты ГАМК А -рецепторов способны препятствовать развитию эффектов этанола, ингибируя его седативное, анксиолитическое действие, а также подкрепляющий эффект этанола [2, 6]. Изучение генетических факторов, влияющих на предрасположенность к алкогольной аддикции и развитие алкогольной зависимости у человека в различных популяциях, подтверждает роль гена, кодирующего a 2 -субъединицу ГАМК А /БДР, в чувствительности к острому воздействию алкоголя и развитию алкогольной зависимости [6, 7]. Исследование ГАМК А /БДР в мозге у больных алкоголизмом в состоянии абстиненции с использованием позитронной и однофотонной эмиссионной компьютерной томографии, основанной на поглощении радиоактивных лигандов [11C] флюмазенила и [123I] иомазе-нила, показало снижение способности связывания рецепторов во фронтальной коре у этих пациентов
[8], что может приводить к снижению ГАМК-ергической функции в мозге, нарушению процессов торможения в ЦНС и развитию синдрома отмены алкоголя.
Одной из ведущих проблем в лечении алкоголизма является необходимость формирования новых подходов к профилактике и лечению этого заболевания, поиск эффективных фармакологических средств коррекции, действующих на молекулярные мишени влияния алкоголя в ЦНС, способных препятствовать развитию алкогольной интоксикации и зависимости.
Инновационный противосудорожный препарат галодиф (мета-хлоро-бензгидрилмочевина) является производным гидантоина. В отличие от большинства аналогов, он сам является действующим веществом, не требующим трансформации в печени, что значительно (в 8–12 раз) снижает токсичность и исключает побочные эффекты (сонливость, гепато-и нейротоксические эффекты). Результаты клинических испытаний показали высокую эффективность антиконвульсанта галодифа, обладающего широким спектром терапевтического действия.
Целью данного исследования было изучение влияния терапии с использованием оригинального инновационного антиконвульсанта галодифа на пластичность бензодиазепиновой рецепторной системы коры головного мозга крыс при экспериментальном алкоголизме и БДР тромбоцитов крови у больных алкоголизмом в качестве экстрацеребральной модели оценки эффективности проводимой терапии.
МАТЕРИАЛ И МЕТОДЫ
Эксперименты проводили на 250 крысах-самцах Вистар массой 150–200 г. Для изучения влияния оригинального антиконвульсанта м-хБГМ на потребление этанола и выраженность патологического влечения к нему животных тестировали на предпочтение (выраженность алкогольной мотивации) в условиях свободного выбора между 15% раствором этанола и водой в течение 14 суток (двухбутылочный оральный тест). Животных, предпочитавших этанол (уровень потребления составил более 50%), делили на две группы: 1-я группа в течение 10 месяцев подвергалась принудительной алкоголизации (15% раствор этанола в качестве единственного источника жидкости) – «многопьющие» крысы; 2-я группа не имела доступа к этанолу весь экспериментальный период – «малопьющие» крысы. Животные, у которых уровень потребления этанола был менее 10% от общего количества жидкости, составили группу «отвергавших» этанол (3-я группа) и содержались без доступа к этанолу весь период. По окончании экспериментального периода проводили повторное тестирование на предпочтение в группе «многопьющих» крыс и выделяли животных, не изменивших свое предпочтение к этанолу; животных, изменивших свое предпочтение, в эксперимент не включали. Таким образом, были отобраны крысы с высокой алкогольной мотивацией («многопьющие»).
Крыс всех экспериментальных групп распределяли на равные группы: одним группам, начиная с 15-х суток, вводили м-хБГМ в виде суспензии на 1% крахмальной слизи внутрижелудочно в дозе 100 мг/кг массы тела и регистрировали среднесуточное потребление 15% раствора этанола с последующим пересчётом на 96% раствор этанола, другим (группы сравнения – контроль) вместо м-хБГМ вводили соответствующий объем 1% крахмальной слизи.
Для изучения бензодиазепиновой рецепторной системы мозга крыс с различным предпочтением к алкоголю и влияния м-хБГМ на бензодиазепиновую рецепторную систему мозга при экспериментальном алкоголизме часть крыс из всех исследуемых групп распределяли следующим образом: «многопьющие» крысы составили 1-ю группу; «малопьющие» – 2-ю группу; а «отвергавшие» этанол – 3-ю группу; «многопьющие» крысы, получавшие м-хБГМ в течение 14 суток, вошли в 4-ю группу.
Для проведения радиорецепторного анализа (РРА) свойств БДР в мозге крыс декапитировали под легким эфирным наркозом, мозг извлекали, кору головного мозга отделяли и замораживали в жидком азоте. Разделение образцов ткани мозга крыс на фракции мембран (синаптосом и митохондрий) проводили с помощью препаративного ультрацентрифугирования. Фракции мембран замораживали и хранили при -80оС. Свойства БДР исследовали методом РРА связывания синаптосомальных и митохондриальных мембран с селективными лигандами.
Свойства БДР «центрального» типа (ЦБР) коры мозга крысы изучали методом РРА связывания [3Н] флунитразепама (85 Ки/моль; 0,2–15 нМ) с мембранами синаптосомальной фракции ткани мозга при 0оС в течение 60 минут. Концентрация мембран по белку составляла 0,2 мг/мл. Неспецифическое связывание проводили с флунитразепамом в концентрации 10 мкМ. Свойства БДР «периферического» типа (ПБР) коры мозга крысы исследовали методом РРА связывания [3Н] Ro5-4864 (90 Ки/моль) с мембранами митохондриальной фракции коры головного мозга крысы.
Группу пациентов составили 68 мужчин в возрасте от 23 до 52 лет, страдавших алкоголизмом второй стадии (диагноз по МКБ-10: F10.302; F10.232), при осложненных формах алкоголизма с коморбидным органическим поражением головного мозга, находившихся на лечении в клинике ад-диктивных состояний НИИ психического здоровья ТНИМЦ РАН. Контрольную группу составили 20 здоровых мужчин-добровольцев.
Свойства БДР «периферического» типа (ПБР) тромбоцитов крови человека исследовали методом РРА связывания [3Н] РК 11195 (90 Ки/моль). Радиоактивный анализ количества связанного лиганда проводили в сцинтилляционном бета-счетчике «Rack-beta» (LKB). Константу диссоциации (Kd) и максимальное число мест специфического связывания (Вmax) определяли методом анализа кривых насыщения в координатах Скэтчарда. Распределение признаков достоверно не отличалось от нормального, поэтому для статистической обработки данных применяли параметрический метод вариационной статистики (критерий Стьюдента) с использованием программы «Statistica 10.0».
Работу проводили в лаборатории клинической психонейроиммунологии и нейробиологии НИИ психического здоровья ТНИМЦ РАН (Томск), лаборатории физиологии, молекулярной и клинической фармакологии НИИ фармакологии и регенеративной медицины им. Е.Д. Гольдберга ТНИМЦ РАН (Томск) и лаборатории клинической биохимии НЦ психического здоровья РАН (Москва).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
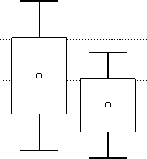
Изучение свойств БДР в мозге крыс показало, что бензодиазепиновая рецепторная система головного мозга у крыс с разным отношением к этанолу имеет существенные различия. В коре головного мозга крыс, предпочитавших алкоголь, аффинность (1/Kd) БДР «центрального» (ЦБР) и «периферического» (ПБР) типов была достоверно снижена: у 1-й группы животных – в 1,7–2 раза, у 2-й – в 1,3–1,5 раза по сравнению с животными 3-й группы (рис. 1), что приводило к снижению чувствительности к алкоголю, способствовало развитию толерантности и формированию физической зависимости. Плотность рецепторов в коре головного мозга крыс 1-й и 2-й групп была повышена по сравнению с животными 3-й группы, причем наиболее существенные изменения выявлены для рецепторов «периферического» типа (150–160%), что подтверждает большую степень ответа ПБР на интоксикационное и повреждающее действие этанола.
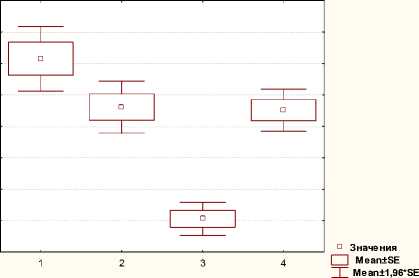
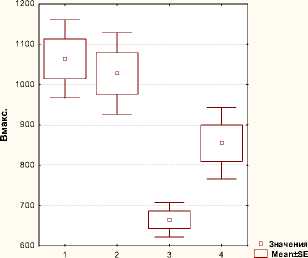
Галодиф эффективно снижал выраженность алкогольной мотивации у крыс, предпочитавших алкоголь, и оказывал модулирующее действие на бензодиазепиновую рецепторную систему головного мозга крыс 1-й группы («многопьющих»). В коре головного мозга крыс 1-й группы при хроническом воздействии 15% этанола галодиф повышал аффинность ЦБР и ПБР (1/Kd) (в 1,2–1,6 раза соответственно, рис. 2), что приводило к увеличению нейромедиации ГАМК, вызывало снижение толерантности к алкоголю и уменьшение уровня его потребления. Галодиф вызывал тенденцию к снижению плотности (B max ) ЦБР и ПБР в мозге крыс 1-й группы, приближая их значение к данным 3-й группы («отвергавших» этанол) (рис. 2), что свидетельствует о снижении экспрессии БДР, вызванной воздействием алкоголя.
Полученные нами результаты доказывают снижение аффинности БДР в коре головного мозга крыс, предпочитавших алкоголь. Это может свидетельствовать о том, что нейропластические адаптивные изменения БДР в мозге возникают раньше, чем формируется выраженное токсическое воздействие алкоголя на мозг [5, 8]. Действие этанола может быть обусловлено разной экспрессией субъединиц ГАМК А Р [6].
Плотность связывания [3H]флунитразепама с синаптосомальными мембранами коры мозга крыс в различных группах

группа
Значения
2,8
Аффинность связывания [3H]флунитразепама с синаптосомальными мембранами коры мозга крыс в различных группах
2,6
2,4
2,2
2,0
1,8
1,6
1,4
1,2
группа
Рисунок 1. Статистический анализ показателей плотности (а) и аффинности (б) связывания [3H] флунитразепама с синаптосомальными мембранами коры мозга крыс в различных экспериментальных группах
Нами установлено, что воздействие этанола вызывает изменение ПБР, не связанных с ГАМК А Р, локализованных в митохондриальной мембране, в основном в глиальных клетках мозга, и обеспечивающих перенос холестерола внутрь митохондрий [14].
Плотность связывания [3H]Ro5-4864 c митохондриальными мембранами коры мозга крыс в различных группах
Mean±1,96*SE группа
Аффинность связывания [3H]Ro5-4864 c митохондриальными мембранами коры мозга крыс в различных группах

Значения
1 2 3 4 Mean±SE
Mean±1,96*SE группа
Рисунок 2. Статистический анализ показателей плотности (а) и аффинности (б) связывания [3H] Ro5-4864 с митохондриальными мембранами коры мозга крыс в различных экспериментальных группах
Таким образом, ПБР влияют на регуляцию синтеза нейростероидов, являющихся эндогенными модуляторами ГАМКа/БДР в ЦНС [9]. Бензодиазепины, анксиолитики, анестетики и алкоголь осуществляют некоторые эффекты через ПБР, регулируя продукцию нейростероидови их метаболитов, являющихся критичными компонентами нормальной функции мозга [12, 13, 14]. ПБР опосредованно влияют на ГАМК-ергическую функцию мозга, в основном реагируя на нейротоксическое воздействие и разные повреждения мозга.
Одной из ведущих является гипотеза развития толерантности к этанолу за счет усиления ГАМК-действия в эффектах этанола. Это подтверждает, что нечувствительность к этанолу может быть обусловлена сниженной чувствительностью к ГАМК и ГАМК-модуляторам. В результате исследований мы получили фактический материал, подтверждающий гипотезу о биологической детерминированности свойств БДР в коре головного мозга крыс с разным предпочтением этанола и однонаправленным изменением их под влиянием хронической алкоголизации.
Результаты наших исследований влияния гало-дифа на выраженность патологического влечения к этанолу у крыс в эксперименте свидетельствуют о терапевтической эффективности галодифа, связанной с его влиянием на функцию бензодиазепиновой рецепторной системы мозга. Влияние курсового применения препарата в течение 14 суток (100 мг/кг в сутки) приводит к изменению свойств БДР «центрального» и «периферического» типов. Причем в большей степени отмечено влияние на БДР михо-тондриальной локализации - ПБР, связанные с энергетическими и нейроэндокринными функциями нейронов и глии, что приобретает особое значение при нейротоксическом действии алкоголя. Галодиф повышал аффинность БДР к [3Н] флунитразепаму и снижал компенсаторную экспрессию (плотность) рецепторов в коре головного мозга крыс при экспериментальном алкоголизме, что свидетельствует о повышении функции ГАМК А /БДР и, соответственно, ГАМК-нейротрансмиссии, нормализующей баланс возбуждающей и ингибиторной функций мозга. Аналогичные изменения выявлены при изучении связывания селективного лиганда [3Н] Ro5- 4864 с БДР «периферического типа» в коре мозга крыс, регулирующих экспрессию нейроактивных стероидных гормонов под влиянием терапии. Повышение чувствительности ГАМК А /БДР-комплекса под влиянием галодифа может быть следствием более эффективной функциональной связи активных сайтов рецепторного комплекса: БДР и хлорного канала, препарат можно рассматривать в качестве позитивного аллостерического модулятора БДР.
Результаты исследования клинической эффективности галодифа у больных алкоголизмом выявили антиконвульсивный, аналгезирующий и седативный эффекты и были рекомендованы авторами для применения как в стационарах, так и в амбулаторных условиях в качестве противорецидивного и профилактического средства в лечении алкоголизма. Кроме того, был выявлен целый ряд дополнительных ценных свойств препарата: галодиф обладает антиоксидантным, ноотропным, антиаритми-ческим, дегидратирующим и антигипоксическим свойствами. Курсовое применение оригинального антиконвульсанта галодиф в течение 21 дня в суточной дозе 300 мг (по 100 мг 3 раза в день) у больных в абстинентном и постабстинентном состоянии вызывало редукцию выраженности симптомов, характерных для синдрома отмены алкоголя. Галодиф оказывал выраженное вегетостабилизирующее, нормолептическое, аналгезирующее действие, а также проявлял устойчивый лечебный эффект за счёт снижения выраженности симптомов синдрома отмены алкоголя и патологического влечения к этанолу. Сравнительный анализ плотности БДР плазматических мембран тромбоцитов крови показал достоверное повышение плотности БДР (Вmax) у больных алкоголизмом по сравнению со здоровыми добровольцами.
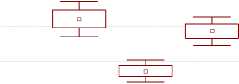
Терапия галодифом приводила к снижению экспрессии БДР, модулирующих функцию ГАМК А -рецепторов, что выражалось в снижении плотности рецепторов тромбоцитов крови у больных алкоголизмом до уровня контрольных значений у здоровых добровольцев (рис. 3).
Пл отность связывания [3H]PK11195 с мембранами тромбоцитов
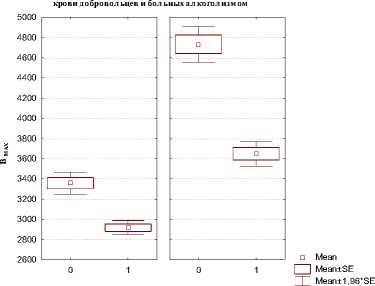
группа: добровольцы группа: больные
0 - до лечения галодиф ом
1 - после терапии галодиф ом
Р и с у н о к 3. Статистический анализ плотности связывания [3Н] PK11195 (Bmax) с мембранами тромбоцитов крови больных алкоголизмом и добровольцев до и после терапии галодифом
Экспрессия рецепторов – плотность БДР тромбоцитов – экстрацеребральный показатель нейро-пластических изменений в ЦНС, лежащих в основе развития патологического влечения к алкоголю и аддикции.
ЗАКЛЮЧЕНИЕ
Нами показана эффективность терапии с использованием оригинального антиконвульсанта галодиф у больных с выраженным компульсивным влечением к алкоголю, ассоциированным с изменением экспрессии БДР тромбоцитов крови, используемой в качестве экстрацеребральной модели оценки нейропластических изменений под влиянием хронического воздействия алкоголя и терапевтической эффективности фармакологических препаратов.
Перспективы лечения алкогольной аддикции связаны с использованием новых препаратов, оказывающих модулирующее действие на ГАМК А /бензодиазепиовые рецепторы, стимулирующих ГАМК-медиацию, проявляющих анксиолитические свойства без выраженного седативного эффекта, не формирующих зависимость и синдром отмены при их использовании [15, 16]. В этой связи применение противосудорожных препаратов, влияющих на мишени действия алкоголя – БДР, и в частности гало-дифа, может обеспечить новый фармакотерапевти-ческий подход к профилактике и лечению этого заболевания [17].
Список литературы Молекулярные мишени действия инновационного антиконвульсанта Галодиф в терапии алкогольной зависимости
- Анохина И.П. Основные биологические механизмы зависимости от психоактивных веществ. Наркология: национальное руководство/под ред. Н.Н. Иванца, И.П. Анохиной, М.А. Винниковой. М.: ГЭОТАР-Медиа, 2008.
- Балашов А.М. Система ГАМК и алкоголь: существует ли «этанольный рецептор»? (обзор). Журнал неврологии и психиатрии им. С.С. Корсакова. Алкоголизм. Приложение к журналу. 2007; 1: 56-62.
- Бохан Н.А., Мандель А.И. Старые и новые проблемы наркологии в контексте междисциплинарных исследований. Вопросы наркологии. 2017; 1: 26-62.
- Criswell H.E., Breese G.R. A conceptualization of integrated actions of ethanol contributing to its GABA mimetic profile: a commentary. Neuropsychopharmacology. 2005; 30: 1407-1425.
- Collingridge G.L., Isaac J.T., Wang Y.T. Receptor trafficking and synaptic plasticity. Nature Reviews. Neuroscience. 2004; 5: 952-962.
- Mehta A.K., Ticku M.K. Effect of chronic administration of ethanol on GABA(A) receptor assemblies derived from alpha2-, alpha3, beta2-and gamma2-subunits in the rat cerebral cortex. Brain Res. 2005; 1031 (1): 134-137.
- Li D., Sulovari A., Cheng C., Zhao H., Kranzler H.R., Gelernter J. Association of gamma-aminobutyric acid A receptor a2 gene (GABRA2) with alcohol use disorder. Neuropsychopharmacology. 2014; 39 (4): 907-918.
- Goldstein R.Z., Volkow N.D. Dysfunction of the prefrontal cortex in addiction: neuroimaging findings and clinical implications. Nat. Rev. Neurosci. 2008; 12: 652-669.
- Шушпанова Т.В., Солонский А.В. Синаптогенез и формирование бензодиазепиновых рецепторов мозга человека в условиях пренатальной алкоголизации. Журнал неврологии и психиатрии им. С.С. Корсакова. 2012; 1 (112): 60-67.
- Shushpanova T.V., Solonskii A.V. Synaptogenesis and the formation of benzodiazepine receptors in the human brain in conditions of prenatal alcoholization. Neurosci Behav Phisiol. 2013; 43 (4): 423-430.
- Shushpanova T.V., Bokhan N.A., Lebedeva V.F., Solonskii A.V., Udut V.V. The effect of chronic alcohol abuse on the benzodiazepine receptor system in various areas of the human brain. African J Psychiatry. 2016; 19 (3):1000365 DOI: 10.4172/23785756.1000365
- Papadopolous V., Baraldi M., Guilarte T. R. et al. Translocator protein (18 kDa): New nomenclature for the peripheral-type benzodiazepine receptor based on its structure and molecular function. Trends Pharmacol. Sci. 2006; 27: 402-409.
- Шушпанова Т.В., Семке В.Я. Периферические бензодиазепиновые рецепторы тромбоцитов при алкоголизме. Журнал неврологии и психиатрии им. С. С. Корсакова. 2006; 11 (106): 53-56.
- Shushpanova T., Bokhan N., Novozheyeva T. Density of thrombocyte benzodiazepine receptors and levels of neuroactive steroid hormones in alcoholic patients. European Neuropsychopharmacology. 2013. 23 (Suppl 2): S555 (P.6.a.005)
- Shushpanova T.V. Influence of maternal alcoholism on the brain benzodiazepine receptor in human embryo and fetus during ontogeny. J of Alcohol & Drug Depend. 2014; 2: 176 DOI: 10.4172/2329-6488.1000176
- Markova E., Knyazeva M., Kozlov V. Applied and Fundamental Studies: Proceedings of the 1st International Academic Conference. October 27-28, 2012; St. Louis, Missouri, USA. 2012: 21-26.
- Шушпанова Т.В., Семке В.Я., Солонский А.В., Бохан Н.А., Удут В.В. Бензодиазепиновая рецепторная система мозга человека и крысы в развитии алкогольной аддикции. Журнал неврологии и психиатрии им. С.С. Корсакова, 2014; 5: 50-54


