Молекулярные основы формирования карликовости у культурных растений. Сообщение I. Нарушения роста из-за мутаций генов метаболизма и сигналинга гиббереллинов
Автор: Билова Т.Е., Рябова Д.Н., Анисимова И.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Обзоры
Статья в выпуске: 1 т.51, 2016 года.
Бесплатный доступ
Создание низкорослых (карликовых) форм зерновых культур, устойчивых к полеганию, привело к значительному повышению урожайности в 1960-1970-х годах и было одной из главных задач «зеленой революции», направленной на преобразования в сельском хозяйстве развивающихся стран (G.S. Khush, 2001). В настоящее время признак карликовости широко используется в селекции. Помимо компактности и устойчивости к полеганию, карликовые формы эффективнее утилизируют питательные вещества и более устойчивы к болезням (К.У. Куркиев с соавт., 2006). В этой связи в последние годы возрастает интерес к изучению факторов, предопределяющих рост растений. Показано, что многие низкорослые сорта, участвовавшие в «зеленой революции», несли мутации в генах, ответственных за метаболизм или передачу сигнала фитогормона гиббереллина (ГА) (M. Ueguchi-Tanaka с соавт., 2001; T. Sakamoto с соавт., 2004). ГА вовлечены во многие этапы развития растения, в том числе прорастание семян, рост стеблей и корней (E. Tanimoto, 2012; P. Hedden, V. Sponsel, 2015). Однако изменения на различных этапах ГА-зависимых процессов могут приводить как к низкорослости, так и к высокому росту. Выявлению ключевых звеньев, целенаправленные изменения в которых приведут к созданию желаемых низкорослых форм, поможет только четкое схематичное понимание взаимодействия генетических и молекулярных механизмов, вовлеченных в ГА-контроль роста растений. В статье рассмотрены пути биосинтеза и деактивации гиббереллинов. Обсуждаются механизмы поддержания пула активных ГА. Среди известных к настоящему времени многочисленных ГA, продуцируемых растениями, физиологически активны только ГА1, ГА3, ГА4, ГА5 и ГА7. В продукцию этих активных гиббереллинов вовлечены ГА20-оксидазы и С3,β-оксидазы (или С3,β-гидроксилазы), катализирующие последние реакции биосинтетического пути. С2,β-оксидазы - основные ферменты, которые могут быстро инактивировать активные ГА посредством добавления к молекуле гидроксильной (-ОН) группы. Проанализированы современные представления о ГА-сигналинге, в который вовлечены рецептор гиббереллинов GID1, негативные регуляторы ГА-сигналинга DELLA-белки, SCF E3-убиквитин-протеин-лигаза и 26S-протеасома, транскрипционные факторы с ДНК-связывающим доменом, гиббереллин-регулируемые гены. Накопленные к настоящему времени данные дают основание предполагать, что в трансдукции гиббереллинового сигнала молекула ГА индуцирует деградацию репрессора DELLA через взаимодействие GID1-DELLA с убиквитин-протеин-лигазным комплексом E3 SCFSLY1/GID2 (T.-P. Sun, 2011). Таким образом, низкий рост может быть связан с нарушениями биосинтеза ГА или накоплением репрессоров ГА-сигналинга DELLA-белков, а высокий рост - с повреждением ферментов деактивации ГА или с потерей репрессивной функции DELLA-белков (H. Claeys c соавт., 2014). Обсуждается участие гиббереллина в сложной гормональной регуляции роста растений, которое часто реализуется посредством контроля репрессивной функции DELLA (P. Achard с соавт., 2003). Особое внимание уделяется характеристике мутаций генов, приводящих к изменению роста растений - карликовости или гигантизму.
Карликовость, торможение роста, гиббереллины, трансдукция гиббереллинового сигнала
Короткий адрес: https://sciup.org/142133656
IDR: 142133656 | УДК: 631.523/.524:581.14:575.1 | DOI: 10.15389/agrobiology.2016.1.3rus
Текст обзорной статьи Молекулярные основы формирования карликовости у культурных растений. Сообщение I. Нарушения роста из-за мутаций генов метаболизма и сигналинга гиббереллинов
Признак карликовости (низкорослости) широко используется в селекции культурных растений. Низкорослые формы компактны, устойчивы к полеганию, что делает их удобными для механизированной уборки. Кроме того, они эффективнее используют питательные вещества и зачастую более устойчивы к болезням. Отечественные ученые внесли значимый вклад в разработку проблемы использования низкорослости в селекции
Работа поддержана Санкт-Петербургским государственным университетом (проект ¹ 1-38-233-14) и Российским фондом фундаментальных исследований (проект ¹ 14-04-01-624).
ржи (1), пшеницы (2-4), сорго (5), тритикале (6), подсолнечника (7), плодовых (8) и других экономически важных сельскохозяйственных растений.
Н.И. Вавилов, формулируя в 1920 году закон гомологических рядов в наследственной изменчивости, обращал внимание на возникновение карликовых форм и гигантов внутри генетически не связанных семейств ( Gramineae , Papilionaceae , Urticaceae , Solanaceae , Rosaceae и др.). При этом закономерно повторяющиеся в разных таксонах наследственные вариации рассматривались как отражение конвергенции, эволюции, параллельной изменчивости или мимикрии (9). Впоследствии факторы, предопределяющие рост растений, а также генетические и молекулярные механизмы этого явления, стали предметом многочисленных исследований. Было показано, что карликовые сорта различных растений несли мутации в идентичных генах. Среди таких мутаций, приводящих к карликовости, наиболее детально изучены мутации генов биосинтеза и сигнальных путей гиббереллина. Именно при их активном использовании в 1940-1970-х годах произошла «зеленая революция», автор которой — американский селекционер и фитопатолог, Нобелевский лауреат Норманн Эрнст Борлоуг (Norman Ernest Borlaug) (10). «Зеленая революция» продемонстрировала новые возможности использования изменчивости хозяйственно ценных генов в селекции на повышение урожайности культурных растений (11).
К настоящему времени накоплен обширный материал о том, как гены синтеза гиббереллинов и гены, вовлеченные в трансдукцию сигнала этого фитогормона, регулируют рост растений. Стали понятны молекулярно-генетические причины, обусловливающие развитие фенотипов с измененной ростовой реакцией. В связи с этим цель настоящего обзора заключалась в обобщении и систематизации данных литературы, создании схематичного представления об участии гиббереллинов в развитии карликовости растений и объяснении молекулярной причины карликовых мутантов, уже традиционно используемых в растениеводстве.
Гиббереллины (ГА; сокращение происходит от наиболее известного гиббереллина — гибберелловой кислоты, gibberellic acid, GA) — тетрациклические дитерпены, способные индуцировать сильное удлинение стеблей (12). Среди известных к настоящему времени многочисленных ГA, продуцируемых растениями, физиологически активны только ГА1, ГА3, ГА4, ГА5 и ГА7. Активные ГА могут быстро инактивироваться добавлением к молекуле метильной (–СН3), гидроксильной (–ОН) и других функциональных групп. ГА вовлечены во многие этапы развития растения, в том числе в прорастание семян, рост стеблей и корней, формирование фло-ральных меристем, развитие цветка, плода и семян, фотоморфогенез и регуляцию циркадных ритмов. При нарушении биосинтеза и недостатке активных ГА развиваются растения-карлики с темно-зелеными листьями, иногда с аномалиями цветения, мужской стерильностью и продолжительным периодом покоя семян, для индукции прорастания которых нередко необходимо удаление семенной кожуры (13-16).
Среди растений с измененной ростовой реакцией выделяют ГA-чувствительные и ГA-нечувствительные мутанты (табл.). К первой группе относятся мутанты (карлики и великаны), фенотип которых чувствителен к эндогенному уровню ГА. У этих растений мутации затрагивают гены, кодирующие ферменты биосинтеза или деактивации активных ГA. Поэтому рост карликов можно восстановить с помощью обработки активными ГА, а великанов — затормозить, применив ингибиторы биосинтеза ГА. У растений второй группы изменения роста (карликовость или гигантизм) могут быть связаны с нарушением процессов рецепции и трансдукции гиббереллинового сигнала на ГА-индуцибельные гены. Эта группа в отличие от первой характери-4
зуется сниженным ответом на гиббереллин или нечувствительностью к нему.
Изменение ростовой реакции у мутантов по генам биосинтеза, деактивации и сигналинга гиббереллинов
|
Объект |
Мутация |
Кодируемый белок |
Потеря функции (нарушение структуры) белка |
Фенотип |
Ссылка |
|
Арабидопсис ga1-3 |
Би CPS ( энт -копалилдифос- |
о си нт ез ГА Блокирование синтеза ГА на этапе |
ГА-чувстви- |
(16) |
|
|
Горох |
ls |
фат-синтаза, EC 5.5.1.13) |
образования энт -копалилдифосфата |
тельный карлик (17) |
|
|
Рис |
osks |
KS ( энт -каурен-синтаза, |
Блокирование синтеза ГА на этапе |
ГА-чувстви- |
(14) |
|
Кукуруза |
d5 |
EC 4.2.3.19) |
образования энт -каурена |
тельный карлик (15) |
|
|
Рис |
d35 |
KO ( энт -каурен-оксида- |
Блокирование синтеза ГА на этапе |
ГА-чувстви- |
(13) |
|
Горох |
lh |
за, EC 1.14.13.78) |
образования энт -кауреновой кислоты тельный карлик (17) |
||
|
Арабидопсис kao1, kao2 |
KAO (оксидаза энт -кау- |
Блокирование синтеза ГА на этапе |
ГА-чувстви- |
(16) |
|
|
Горох |
na |
реновой кислоты, ЕС |
образования альдегида ГA12 |
тельный карлик (17) |
|
|
Кукуруза Ячмень Рис |
d3 grd5 sd1 |
1.14.13.79 ); относится к группе цитР450 88А1 (CYP88A1) из семейства цитохрома Р450 (CYP) ГА20-оксидаза (ГА20- |
Блокирование окисления С20-гиббе- |
ГА-чувстви- |
(18) (19) (13) |
|
Рис |
d18 |
гиббереллин оксидаза, EC 1.14.11.12) D18 (Dwarf18) и LE |
реллинов в С19-гиббереллины Блокирование гидроксилирования |
тельный карлик ГА-чувстви- |
(13, 20) |
|
Горох |
le |
(Length) (гиббереллин 3- |
по С3, β -положению при биосинте-тельный карлик (21, 22) |
||
|
Горох |
sln |
β -оксидаза, ЕС 1.14.11.15, зе активных гиббереллинов или С3, β -оксидаза) Деакти вация актив ных ГА SLN (Slender) (гибберел- Блокирование гидроксилирования Slender-форма |
(17, 23) |
||
|
Рис, араби- |
gid1-1 |
лин 2- β -оксидаза, ЕС по С2, β -положению при деактива-1.14.11.13, или С2, β - ции активных гиббереллинов оксидаза) Ре це пц ия ГА GID1 (Gibberellin Insen- Замена аминокислот в мотиве |
(ГА-индуци-руемый рост) ГА-нечувстви- |
(20, 24, |
|
|
допсис, рапс, соя Рис |
d1 |
sitive Dwarf 1) (высокая степень гомологии с растительными карбокси-лэстеразами из надсемейства α - и β -гидролаз) G α ( α -субъединица ге- |
GXSXG (не образуется комплекс ГА-GID1) Функция G α в ГА-сигналинге не |
тельный карлик 25) Полукарлик (ро-(26, 27) |
|
|
теротримерного G-белка (ГТФаза, EC 3.6.5.1) |
определена |
стовая реакция на ГА ослаблена) |
|||
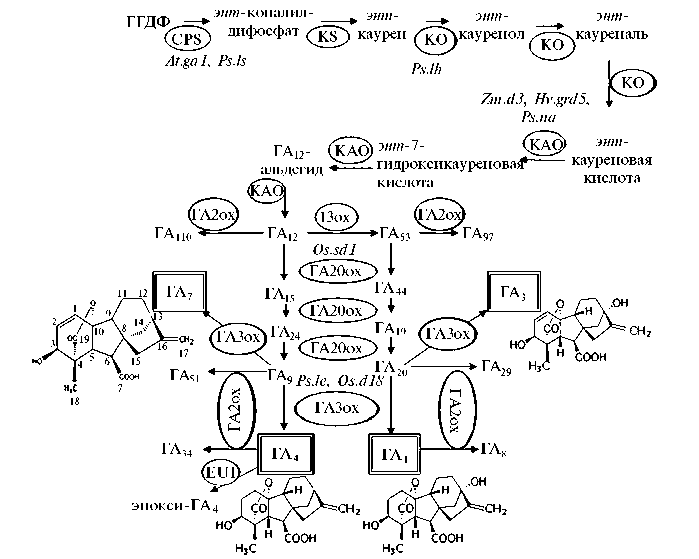
Рис. 1. Схема биосинтеза гиббереллинов (28) (с изменениями): ГГДФ — геранилгераниол- дифосфат, ГА1-110 — гиббереллины; CPS — энт-копалилдифосфат-синтаза, KS — энт-ка-урен-синтаза, KO — энт-каурен-оксидаза, KAO — оксидаза энт-кауреновой кислоты; 13ох — монооксигеназа, гидроксилирующая гибберелловый альдегид ГА12 по положению С13; ГА20ох, ГА3ох и ГА2ох — три группы 2-оксоглутарат-зависимых диоксигеназ (ГA20-ок-сидазы, С3,β-оксидазы и С2,β-оксидазы); EUI (Elongated Uppermost Internode) — эпоксидаза, деактивирующая ГА; At.ga1, Ps.ls, Ps.lh, Zm.d3, Hv.grd5, Ps.na, Оs.sd1, Ps.le, Оs.d18 — карликовые мутанты по соответствующим генам. Квадратной рамкой выделены активные гиббереллины, овалами отмечены ферменты биосинтеза и деактивации гиббереллинов.
Нарушения роста из-за мутаций генов ферментов биосинтеза ГА. Все гиббереллины образуются из дитерпена геранилгерани-олдифосфата (рис. 1), который также служит предшественником для каротиноидов и непредельного спирта фитола, входящего в состав хлорофилла. Биосинтез гиббереллинов начинается с циклизации геранилгераниолди-фосфата и происходит в строме пропластид (29, 30). Конечный продукт циклизации — гидрофобный энт -каурен. Реакция его образования катализируется энт -копалилдифосфат-синтазой (CPS) и энт -каурен-синтазой (KS). Растения арабидопсиса с нокаутной мутацией в гене, кодирующем CPS ( ga1-3 ), плохо прорастают, характеризуются карликовостью, слаборазвитой корневой системой, поздним цветением и мужской стерильностью (16, 29, 31-33). Карликовый рост, нарушения цветения и формирования семян наблюдались и у мутантов гороха, кукурузы и риса, нокаутных по генам CPS и KS, а также генам последующих этапов биосинтеза ГА — энт -каурен-оксидазы (KO) и оксидазы энт -кауреновой кислоты (KAO) (13, 15, 17). Обработка гиббереллином и его предшественниками восстанавливала нормальный фенотип растений, доказывая тем самым важную роль этих ферментов в биосинтезе гиббереллинов.
Следующий этап биосинтеза ГA заключается в последовательном окислении энт -каурена до альдегида ГA12 двумя монооксигеназами из семейства цитохромов Р450 (см. рис. 1): энт -каурен-оксидазой (КО) и оксидазой энт -кауреновой кислоты (КАО), относящейся к подсемейству CYP88A1. У арабидопсиса КО локализована на внешней поверхности наружной мембраны пластид, а КАО ассоциирована с мембранами эндоплазматического ретикулума (16, 19, 29). Из-за мутаций, приводящих к потере активности KAO, формируются карлики у кукурузы d3 ( dwarf3 ), ячменя grd5 ( GA-responsive dwarf ) и гороха na ( nana ), чувствительные к ГА (17-19). Дальнейшие реакции, начиная с окисления альдегида ГA12, происходят в цитоплазме и приводят к образованию различных форм гиббереллинов (28-30).
В продукцию активных гиббереллинов вовлечены растворимые диоксигеназы, использующие в качестве субстрата 2-оксоглутарат. Одна группа этих ферментов — ГA20-оксидазы (ГA20ox), другая — С3, β -оксидазы (ГA3ох, или С3, β -гидроксилазы); первые окисляют С20-гиббереллины в С19-гиббереллины, вторые катализируют гидроксилирование молекул ГА по С3, β -положению на завершающем этапе биосинтетического пути. Мутанты риса с выключенными генами ГA3ох и ГА20ох были низкорослыми (13, 34). Полукарликовый мутант риса sd1 ( semi-dwarf1 ), использованный в «зеленой революции», нес мутацию в гене ГА20ох (13). Наряду с биосинтетическими ферментами в поддержании пула активных гиббереллинов важную роль также играет третья группа диоксигеназ, названная С2, β -ок-сидазами (ГA2ox). Эти ферменты переводят активные ГA и их предшественников в неактивные формы посредством гидроксилирования молекулы по С2, β -положению (29, 35, 36). Помимо С2, β -оксидаз, в деактивацию гиббереллинов у растений риса могут быть вовлечены эпоксидаза EUI (фенотип Elongated Uppermost Internode — удлиненные верхние междоуз-6
лия) из семейства монооксигеназ Р450 (28, 29), а у арабидопсиса — метил-трансферазы (GAMT1 и GAMT2, Gibberellin Methyl Transferases 1, 2) (37). Таким образом, пул активных ГА поддерживается различными механизмами, которые с помощью прямых и обратных связей регулируют экспрессию генов биосинтеза ГA ( ГA20ox , ГA3ох ) и катаболизма ГА ( ГA2ox ). Активность экспрессии этих генов специфична по времени и локализации, зависит от условий освещенности, температурного режима и содержания фитогормонов (29). Уровень экспрессии генов, вовлеченных в контроль последних этапов биосинтеза ГА, находится в обратной корреляции с содержанием активных гиббереллинов. Так, при накоплении ГА экспрессия генов ГA20-оксидаз снижается, а генов катаболизма ГА — усиливается (38-40). У мутантных карликовых растений гороха ( le ) (21, 22) с недостатком ГA из-за сниженной функции С3, β -оксидаз регистрировали высокую транскрипционную активность генов биосинтеза ГA ( ГA20ox ) и низкую — генов деактивации ГA ( ГA2ox ). У форм гороха с удлиненными побегами, мутантных по SLN ( SLENDER ), нарушения затрагивают ген С2, β -оксидазы. У таких растений из-за подавления процессов деактивации активные ГА накапливаются даже на фоне очень малого количества транскриптов генов ГA20-оксидаз (23, 29).
Рецепция ГА и передача сигнала. Накопленные к настоящему времени данные дают основание предполагать, что в рецепцию и передачу сигнала ГА вовлечены рецептор гиббереллинов GID1 (Gibberellin Insensitive Dwarf 1); белки c консервативным мотивом DELLA — негативные регуляторы ГА-сигналинга; SCF (SKP-Cullin-F-box) убиквитин-проте-ин-лигаза E3, ковалентно присоединяющая убиквитин к белку-мишени, и 26S-протеасома; транскрипционные факторы (ТФ), имеющие ДНК-связы-вающий домен; гиббереллин-регулируемые гены.
В начале 1990-х годов было выдвинуто предположение о существовании на плазматической мембране (ПМ) рецептора ГА. Гипотезу о том, что связывание молекулы гиббереллина рецептором ПМ — необходимый этап трансдукции ГА-сигнала, подтвердили результаты экспериментов на протопластах алейроновых клеток. В течение многих лет алейроновый слой зерновок служил удобной моделью для изучения передачи гиббереллинового сигнала и ответных реакций (30). При прорастании семян ГА вызывает в клетках этого слоя синтез α -амилазы и секрецию указанного и других гидролитических ферментов в эндосперм для гидролиза запасенных там веществ, которые затем используются в гетеротрофном питании развивающегося проростка. В экспериментах ГА4, связанная ковалентно с гранулами сефарозы, вызывала экспрессию гена α -амилазы в протопластах алейроновых клеток, лишенных клеточных стенок. Размер гранул не позволял молекулам ГА проникнуть внутрь клеток, следовательно, рецепция фитогормона должна была происходить на клеточной поверхности (41). Гипотетический рецептор гиббереллина на ПМ алейроновых клеток так и не обнаружили. Тем не менее, была предложена схема ГА-сигналинга с участием этого гипотетического рецептора, которую построили по аналогии с известным для клеток животных механизмом передачи гормонального сигнала от трансмембранного рецептора GPCR-типа (G-Protein-Coupled Receptor) к гетеротримерному G-белку (ГТФаза, EC 3.6.5.1) (25). Вопрос о существовании рецепторов GPCR-типа у растений до сих пор не решен (42). В настоящее время на эту роль предлагается несколько трансмембранных белков (27), тогда как G-белки обнаружены, и их участие в ГА-сигналинге действительно подтверждается экспериментально. Так, у риса мутация d1 ( dwarf1 ) затрагивает ген, кодирующий α -субъединицу G-белка.
Мутанты, у которых активность G α -белка не выявлялась, оказались низкорослыми и характеризовались ослабленными ответами на ГА (26). Тем не менее, окончательно механизм участия G α -белка в передаче ГА-сигнала еще не определен (28, 43, 44). Известно, что G α -белок модулировал физиологические реакции не только гиббереллинового сигналинга, но и воздействие других гормонов (брассиностероидов, абсцизовой кислоты — АБК) и внешних факторов (синий свет, озон) (43).
Ген GID1 ( Gibberellin Insensitive Dwarf 1 ) был идентифицирован у карликовых мутантов риса, не отвечающих на обработку ГА (24). Полагают, что это единственный ген рецептора ГА у риса (44). Подобный ген также обнаружен у рапса и сои (45). Взаимосвязь между карликовым фенотипом растения и пониженной экспрессией гена GID1 у рапса предположительно обусловлена мутацией в промоторной области (46). В геноме арабидопсиса выявлены три гена, гомологичных GID1 , — AtGID1a , At-GID1b и AtGID1с . Тройной инсерционный мутант по этим генам характеризуется ярко выраженной низкорослостью и неспособностью к размножению (47).
Растворимый белок GID1 локализован в ядре и в цитоплазме (24, 48, 49). Его С-концевой домен высокогомологичен растительным карбок-силэстеразам, относящимся к надсемейству α - и β -гидролаз. Однако GID1 не проявляет активности эстераз из-за замещения ключевого аминокислотного остатка в каталитическом центре (49). GID1 включает консервативные для карбоксилэстераз мотивы HGG и GXSXG. Показана важная роль GXSXG в рецепции ГА. Замещение в этом мотиве остатка глицина (G) на остаток аспартата (D) у мутантов риса gid1-1 приводит к развитию ГА-нечувствительного карликового фенотипа (50). Недавно была показана возможность ассоциации GID1b с плазматической мембраной в тканях листьев арабидопсиса (33), однако функция белка с такой локализацией до сих пор не исследована.
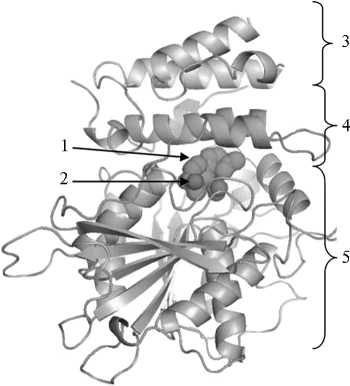
Рис. 2. Структура ГА-GID1-DELLA комплекса (51) : 1 — молекула гиббереллина (ГА), 2 — полярные группы молекулы ГА, 3 — домен DELLA-белка, содержащий консервативную последовательность Asp-Glu-Leu-Leu-Ala (DELLA), 4 — N-концевой домен «крышка» белка GID1 (Gibberellin Insensitive Dwarf 1), 5 — рецепторный карман белка GID1.
Известно, что GID1 состоит из двух разных по величине доменов. Основная часть рецептора (C-концевой домен) формирует карман (рис. 2, 3, А), в котором находится сайт связывания ГA. Второй небольшой домен расположен в N-концевой части белка (51). При взаимодействии с GID1 молекула гиббе- реллина ориентируется неполярной частью к входу в карман белка, а полярными группами связывается с рецептором. В этом процессе также принимают участие примерно 10 молекул воды. Взаимодействие с ГА изменяет конформацию белка GID1: N-концевой домен, подобно крышке, захлопывает рецепторный карман. GID1 связывает только активные гиббереллины, причем его аффинность к ГА4 в 20 раз выше, чем к ГА3. Комплекс ГА-GID1 нестабилен, он быстро диссоциирует и затем образу- ется вновь (50). Когда этот комплекс сформирован, его аффинность к DELLA-белкам сильно увеличивается. В свою очередь, взаимодействие комплекса с DELLA значительно повышает стабильность связывания GID1 c ГА. Показано, что в присутствии DELLA-белков скорость диссоциации ГА от GID1 снижается (50).
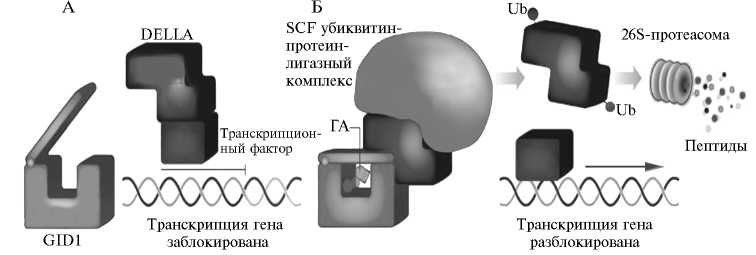
Рис. 3 . Модель рецепции и трансдукции гиббереллинового (ГА) сигнала (52) : А — рецептор GID1 (Gibberellin Insensitive Dwarf 1) не связан с молекулой гиббереллина; Б — трансдукция ГА-сигнала в результате взаимодействия молекулы гиббереллина с рецептором GID1; DELLA — белок с доменом, содержащим консервативную последовательность Asp-Glu-Leu-Leu-Ala (DELLA), SCF — убиквитин-протеин-лигаза E3 из группы SCF (сокращение происходит от названий трех субъединиц комплекса: SKP, Cullin и F-box), Ub — убиквитиновая метка на DELLA-белке.
При взаимодействии ГА-GID1 с DELLA-белком формируется тройной комплекс ГA-GID1-DELLA. В этом комплексе DELLA-белок N-концевыми доменами, содержащими консервативные последовательности DELLA и TVHYNP, связывается с «крышкой» белка GID1. С-концевой домен DELLA-белка, известный как GRAS (назван по начальным буквам обозначений белков Gibberellic Acid Insensitive, GAI; Repressor of GA1-3, RGA; ScareСRow, SCR, в которых впервые был обнаружен этот домен) (53), взаимодействует с карманом белка GID1, фиксируя молекулу гиббереллина внутри комплекса (45). Сформированный комплекс ГA-GID1-DELLA распознается убиквитин-протеин-лигазой E3 SCFSLY1/GID2 (47) (см. рис. 3, Б). В этом опознавании важную роль играет содержащая F-box домен субъединица лигазы — SLY1 (SLEEPY1) у арабидопсиса или GID2 (Gibberellin Insensitive Dwarf 2) у риса. Эти белки высокоаффинны к ГA-GID1-DELLA комплексу и индуцируют взаимодействие с ним убикви-тин-протеин-лигазы, которое далее приводит к убиквитинизации и последующей деградации DELLA-белка в 26S-протеасоме (см. рис. 3) (47, 52, 54, 55). Интересно, что необходимым условием для убиквитинизации DELLA-белка служит его взаимосвязь с GID1, содержащим ГА внутри рецепторного кармана. Показано, что DELLA также может связываться с GID1 без ГА, но такое взаимодействие не повышает его аффинности к белкам F-box убиквитин-протеин-лигазы (33, 56).
DELLA белки подавляют гиббереллиновый ответ, поскольку снижают экспрессию ГA-зависимых генов. Деградация этих белков снимает их ингибирующее влияние, благодаря чему инициируется экспрессия генов, регулируемых ГА (56-58), продукты которых служат сигналами к ГA-инду-цированному росту растения и другим ГА-зависимым ответам, таким как прорастание семян, цветение. Однако для подавления репрессивной функции DELLA не всегда требуется его деградация. Не зависящий от протеолиза тип инактивации DELLA наблюдается при взаимодействии в комплексе ГА-GID1-DELLA и сверхэкспрессии GID1 (40, 49, 59).
Белки, содержащие F-box. При трансдукции гиббереллино- вого сигнала ГА индуцирует деградацию репрессора DELLA через взаимодействие GID1-DELLA c убиквитин-протеин-лигазным комплексом E3 SCFSLY1/GID2. Впервые участие этой убиквитинлигазы в ГА-сигналинге было обнаружено у мутантов риса gid2-1 и арабидопсиса sly1-10, имеющих карликовый фенотип, нечувствительный к обработке ГА. У этих мутантов также отмечалось необычно высокое содержание DELLA белков (54, 55, 60). Гены SLY1 (Sleepy) и GID2 (Gibberellin Insensitive Dwarf 2) оказались позитивными регуляторами ГА-сигнала. Они кодируют белки, содержащие консервативный домен — F-box (около 60 аминокислотных остатков), который необходим для взаимодействия c DELLA и его последующей деградации. Мутации, приводящие к потере репрессивной функции DELLA белков, частично восстанавливали рост у растений gid2 и sly1, подтверждая таким образом предположение о том, что карликовость у мутантов была вызвана накоплением DELLA (54, 55).
SLY1 и GID2, в структуре которых имеется F-box, входят в состав убиквитин-протеин-лигазного комплекса E3 SCF-типа, основная функция которого заключается в избирательном мечении белков убиквитином для их последующей деградации в протеасоме (60). Название группы SCF, к которой относится эта убиквитинлигаза, происходит от обозначений белков, входящих в состав этого сложного белкового комплекса: SKР1 (S phase Kinase-associated Protein 1), CUL1 (Cullin) и белок, имеющий F-box домен (61). Белок с F-box отвечает за распознавание мишени. В геноме арабидопсиса выявлено 694 гена белков, имеющих этот домен. По-види-мому, белки, содержащие в структуре F-box, составляют одно из самых больших белковых семейств у растений (61).
N-концевой частью (через F-box) белки SLY1 или GID2 связываются c SKР1, а С-терминальным доменом, включающим высококонсервативные последовательности GGF и LSL, — с мишенью (DELLA-белком) (60). У риса карликовые мутанты gid2 несли делецию в области, кодирующей домен F-box, а мутанты арабидопсиса sly1-2 и sly1-10 имели усеченные с С-конца белки SLY. Из-за этих повреждений белки утрачивали способность ассоциировать с DELLA-белком (54, 55).
У DELLA-белков во взаимодействие с F-box-белками вовлечено два участка домена GRAS, один из которых имеет консервативную последовательность VHIID, а второй содержит серию лейциновых повторов (LR) (45, 56). Таким образом, в результате распознавания F-box-белком своей мишени в описанном случае образуется тройной комплекс GID1-DELLA-SLY1. Интересно, что у мутанта sly1-d из-за замещения остатка глутаминовой кислоты (E138) на лизин (K138) в GRAS домене SLY приобретал способность ассоциировать с белком DELLA с его последующим протеолизом независимо от наличия комплекса ГА-GID1. Эти мутанты превосходили растения-карлики gai по высоте (54).
Взаимодействие между гиббереллиновым и другими сигнальными путями. Рост и развитие растительного организма и его адаптации к внешним факторам находятся под контролем фитогормонов. Гиббереллины вовлечены во многие процессы жизнедеятельности растений. Тем не менее, в отсутствие таких гормонов развитие стеблей, листьев и корней не прекращается, но при этом формируются плохо прорастающие и нерепродуктивные растения-карлики с измененной чувствительностью к внешним условиям, что указывает на включение элементов трансдукции ГА-сигнала в сложную сигнальную сеть, передающую информацию от других гормонов и внешних факторов.
АБК (абсцизовая кислота) и ГА — антагонисты, каждый из кото- рых негативно регулирует транскрипцию генов биосинтеза другого. Кроме того, эти гормоны противоположно регулируют экспрессию генов, которые в промоторах одновременно содержат ГА- и АБК-чувствительные элементы (38). Известно, что ауксин и ГА стимулируют рост клеток и тканей растений. Эти гормоны оказывают позитивное влияние на биосинтез друг друга. Удаление апикальной почки побега (главного источника ауксина) вызывало снижение содержания ГА у гороха, тополя и табака (62). Кроме того, выявлено взаимодействие сигнальных путей этих гормонов: ауксин способствовал ГА-опосредованной деградации DELLA, а ГА стимулировал активный полярный транспорт ауксина. У тополя при исследовании транскрипционных профилей стебля обнаружено, что около 83 % генов, регулируемых ГА, также регулировались ауксином. К ним относятся гены транскрипционных регуляторов ауксинового (Aux/IAA — auxin/indolyl-3-acetic acid), гиббереллинового (DELLA) и этиленового сиг-налинга (EIN3 — белок, подобный Ethylene Insensitive 3), а также гены, чьи продукты регулируют растяжение клеточной стенки (62). Взаимовлияние сигнальных путей цитокинина, ауксина и гиббереллина хорошо изучено в апикальной меристеме побега (63). Низким содержанием ГА и высоким — цитокинина поддерживалось недифференцированное состояние пролиферующих клеток апекса. Высокое накопление ауксина и ГА способствовало дифференцировке клеток и определяло место закладки листового примордия. Взаимодействие между ГА, ауксином и этиленом показано на примере формирования гипокотильного крючка у этиолированных проростков арабидопсиса. Гипокотильный крючок защищает апикальную меристему, помогая проростку продвигаться к поверхности почвы. Он образуется за счет асимметричного роста внутренней и наружной стороны гипокотиля. Этилен вместе с ауксином контролируют образование изгиба гипокотиля через деградацию DELLA. В то же время этилен индуцирует замедление роста корней у арабидопсиса, снижая эндогенный уровень ГА через блокирование экспрессии генов биосинтеза, и увеличивает стабильность белков DELLA (64).
Таким образом, активное использование карликовых форм сельскохозяйственных растений в селекционных программах в 1940-1970-х годах послужило мощным стимулом для исследований генетических и физиологических механизмов признака низкорослости. Из анализа литературы последних 30 лет можно заключить, что большая часть известных мутаций, связанных с получением карликовых растений, вызвана нарушениями метаболизма или передачи сигнала гиббереллина. Однако изменения этих процессов на различных этапах могут приводить к противоположным модификациям роста растения — как к низкорослости, так и к удлинению стебля. Показано, что карликовость растений связана с недостатком гиббереллинов из-за нарушения биосинтеза гиббереллинов (ГА) или с накоплением DELLA белков (репрессоры ГА-сигналинга), а гигантизм обусловлен избытком гиббереллинов из-за повреждения ферментов деактивации ГА и(или) с потерей репрессивной функции DELLA белков. Такое ГА-индуцируемое подавление репрессивной функции DELLA на сегодняшний день представляет собой единственный охарактеризованный путь трансдукции ГА сигнала и хорошо объясняет участие гиббереллинов в сложной гормональной регуляции роста растений. Тем не менее, вероятно, существуют альтернативные пути трансдукции ГА сигнала (например, не зависящий от DELLA-протеолиза или включающий участие G-белка), роль которых в контроле роста растений еще не изучена. Кроме того, невыясненным остается вопрос о том, как гиббереллин регули- рует соотношение роста стеблей и корней растения. Известно, что корни значительно более чувствительны к ГА, чем стебли. Рост корней активируется низкими концентрациями ГА, недостаточными для индукции роста стеблей. И наоборот, концентрации ГА, достаточные для активации растяжения стеблей, тормозят рост корней. Полагают, что, регулируя соотношение роста стеблей и корней, гиббереллин вовлечен в контроль формы растения (65).
В селекционно-генетических исследованиях культурных растений неодинаковая реакция низкорослых форм на обработку экзогенным гиббереллином традиционно используется для доказательства их различий по локусам, определяющим карликовый фенотип (66). Понимание молекулярных механизмов, обусловливающих внутривидовую изменчивость культурных растений по высоте, позволит прогнозировать результаты скрещиваний, проводить целенаправленный подбор исходного материала для создания сортов и межлинейных гибридов с желаемым фенотипом. Так, для получения оптимальных по высоте форм у подсолнечника, современная селекция которого ориентирована преимущественно на получение высокопродуктивных гетерозисных гибридов, предпочтительно использование карликовых линий в качестве родителей. В генетической коллекции подсолнечника ВИР (Всероссийский институт генетических ресурсов растений им. Н.И. Вавилова) имеются карликовые линии, у которых признак низкорослости детерминирован неаллельными генами и, следовательно, опосредован различными физиолого-генетическими механизмами (67). Углубленное исследование этих форм, выяснение физиолого-генетических причин их уникальности необходимо для подбора исходного селекционного материала и разработки рациональных схем скрещиваний.
Итак, показано, что многие низкорослые сорта, участвовавшие в «зеленой революции», несли мутации в генах, ответственных за метаболизм или передачу сигнала фитогормона гиббереллина (ГА). ГА вовлечены в процессы прорастания семян, роста стеблей и корней. При этом изменения на различных этапах ГА-зависимых процессов могут приводить как к низкорослости, так и к гигантизму. Среди известных к настоящему времени многочисленных ГA, продуцируемых растениями, физиологически активны ГА1, ГА3, ГА4, ГА5 и ГА7. В их продукцию вовлечены ГА20-оксидазы и С3, β -оксидазы (или С3, β -гидроксилазы). С2, β -оксидазы — основные ферменты, которые могут быстро инактивировать активные ГА. Накопленные экспериментальные данные дают основание предполагать, что в трансдукции гиббереллинового сигнала молекула ГА индуцирует деградацию репрессора DELLA через взаимодействие GID1-DELLA с уби-квитин-протеин-лигазным комплексом E3 SCFSLY1/GID2. Низкий рост может быть связан с нарушениями биосинтеза ГА или накоплением репрессоров ГА-сигналинга — DELLA-белков, а высокий рост — с повреждением ферментов деактивации ГА или потерей репрессивной функции DELLA-белков. ГА-индуцируемое подавление репрессивной функции DELLA на сегодняшний день известно как единственный охарактеризованный путь трансдукции ГА сигнала. Тем не менее, нельзя исключить существования альтернативных путей ГА-сигналинга, роль которых пока не изучена. Углубленное исследование низко- и высокорослых форм растений, выяснение физиолого-генетических причин их уникальности необходимо для подбора исходного селекционного материала и разработки рациональных схем в целевых программах скрещиваний.
верситета О.В. Танкелюн за чтение рукописи и сделанные замечания.
Список литературы Молекулярные основы формирования карликовости у культурных растений. Сообщение I. Нарушения роста из-за мутаций генов метаболизма и сигналинга гиббереллинов
- Кобылянский В.Д. Рожь: Генетические основы селекции. М., 1982.
- Лукьяненко П.П., Жогин А.Ф. Использование индуцированных карликовых мутантов в селекции озимой пшеницы. Селекция и семеноводство, 1974, 1: 13-16.
- Альдеров А.А. Генетика короткостебельности тетраплоидных пшениц. СПб, 2001.
- Беспалова Л.А. О наследовании высоты растений гибридами озимой мягкой пшеницы. В сб.: Научные труды КНИИСХ. Краснодар, 1982: 103-120.
- Якушевский В.С. Мировое сортовое разнообразие сорго и пути селекционного использования в СССР. В сб.: Сорго в Южных и Юго-Восточных районах СССР. М., 1967: 19-36.
- Куркиев К.У., Куркиев У.К., Альдеров А.А. Генетический контроль короткостебельности гексаплоидных тритикале (Triticosecale Wittm.). Генетика, 2006, 42(3): 369-376 ( ) DOI: 10.1134/S1022795406030082
- Жданов Л.А. О селекции подсолнечника на низкорослость. Доклады ВАСХНИЛ, 1964, 6: 7-12.
- Бурмистров Л.А. Достижения мировой селекции груши в 1980-1990 годах и интродукция ВИР новых сортов. В сб.: Проблемы оценки исходного материала и подбора родительских пар в селекции плодовых растений. Мичуринск, 1996: 88-91.
- Вавилов Н.И. Закон гомологических рядов в наследственной изменчивости. М.-Л., 1935.
- Borlaug N.E. The impact of agricultural research on Mexican wheat production. Transactions of the New York Academy of Science, 1958, 20(3): 278-295 ( ) DOI: 10.1111/j.2164-0947.1958.tb00588.x
- Khush G.S. Green revolution: the way forward. Nat. Rev. Genet., 2001, 2(10): 815-822 ( ) DOI: 10.1038/35093585
- Kurosawa E. Experimental studies on the nature of the substance secreted by the «bakanae» fungus. Trans. Nat. Hist. Soc. Formosa, 1926, 16: 213-227.
- Sakamoto T., Miura K., Itoh H., Tatsumi T., Ueguchi-Tanaka M., Ishiyama K., Kobayashi M., Agrawal G.K., Takeda S., Abe K., Miyao A., Hirochika H., Kitano H., Ashikari M., Matsuoka M. An overview of gibberellin metabolism enzyme genes and their related mutants in rice. Plant Physiol., 2004, 134(4): 1642-1653 ( ) DOI: 10.1104/pp.103.033696
- Ji S.H., Gururani M.A., Lee J.W., Ahn B.-O., Chun S.-C. Isolation and characterization of a dwarf rice mutant exhibiting defective gibberellins biosynthesis. Plant Biol., 2014, 16(2): 428-439 ( ) DOI: 10.1111/plb.12069
- Phinney B.O., Spray C. Chemical genetics and the gibberellin pathway in Zea mays L. In: Plant Growth Substances 1982/P. Wareing (ed.). Academic Press, London, NY, 1982: 101-110.
- Regnault T., Daviere J.-M., Heintz D., Lange T., Achard P. The gibberellin biosynthetic genes AtKAO1 and AtKAO2 have overlapping roles throughout Arabidopsis development. Plant J., 2014, 80: 462-474 ( ) DOI: 10.1111/tpj.12648
- Davidson S.E., Elliott R.C., Helliwell C.A., Poole A.T., Reid J.B. The pea gene NA encodes ent-kaurenoic acid oxidase. Plant Physiol., 2003, 131(1): 335-344 ( ) DOI: 10.1104/pp.012963
- Winkler R.G., Helentjaris T. The maize Dwarf3 gene encodes a cytochrome P450-mediated early step in gibberellin biosynthesis. Plant Cell, 1995, 7(8): 1307-1317 ( ) DOI: 10.1105/tpc.7.8.1307
- Helliwell C.A., Chandler P.M., Poole A., Dennis E.S., Peacock W.J. The CYP88A cytochrome P450, ent-kaurenoic acid oxidase, catalyzes three steps of the gibberellin biosynthesis pathway. PNAS USA, 2001, 98(4): 2065-2070 ( ) DOI: 10.1073/pnas.98.4.2065
- Ayano M., Kani T., Kojima M., Sakakibara H., Kitaoka T., Kuroha T., Angeles-Shim R.B., Kitano H., Nagai K., Ashikari M. Gibberellin biosynthesis and signal transduction is essential for internode elongation in deepwater rice. Plant Cell Envir., 2014, 37: 2313-2324 ( ) DOI: 10.1111/pce.12377
- Reid J.B., Ross J.J. Mendel’s genes: toward a full molecular characterization. Genetics, 2011, 189: 3-10 ( ) DOI: 10.1534/genetics.111.132118
- Reinecke D.M., Wickramarathna A.D., Ozga J.A., Kurepin L.V., Jin A.L., Good A.G., Pharis R.P. Gibberellin 3-oxidase gene expression patterns influence gibberellin biosynthesis, growth, and development in pea. Plant Physiol., 2013, 163: 929-945 ( ) DOI: 10.1104/pp.113.225987
- Martin D.N., Proebsting W.M., Hedden P. The SLENDER gene of pea encodes a gibberellin 2-oxidase. Plant Physiol., 1999, 121(3): 775-781 ( ) DOI: 10.1104/pp.121.3.775
- Ueguchi-Tanaka M., Ashikari M., Nakajima M., Itoh H., Katoh E., Kobayashi M., Chow T.Y., Hsing Y.I., Kitano H., Yamaguchi I., Matsuoka M. GIBBERELLIN INSENSITIVE DWARF1 encodes a soluble receptor for gibberellins. Nature, 2005, 437(7059): 693-698 ( ) DOI: 10.1038/nature04028
- Hartweck L.M., Olszewski N.E. Rice GIBBERELLIN INSENSITIVE DWARF1 is a gibberellin receptor that illuminates and raises questions about GA signaling. Plant Cell, 2006, 18(2): 278-282 ( ) DOI: 10.1105/tpc.105.039958
- Ueguchi-Tanaka M., Fujisawa Y., Kobayashi M., Ashikari M., Iwasaki Y., Kitano H., Matsuoka M. Rice dwarf mutant d1, which is defective in the subunit of the heterotrimeric G protein, affects gibberellin signal transduction. PNAS USA, 2000, 97(21): 11638-1643 ( ) DOI: 10.1073/pnas.97.21.11638
- Izawa Y., Takayanagi Y., Inaba N., Abe Y., Minami M., Fujisawa Y., Kato H., Ohki S., Kitano H., Iwasaki Y. Function and expression pattern of the subunit of the heterotrimeric G protein in rice. Plant Cell Physiol., 2010, 51: 271-281 ( ) DOI: 10.1093/pcp/pcp186
- Ma Q., Hedden P., Zhang Q. Heterosis in rice seedlings: its relationship to gibberellin content and expression of gibberellins metabolism and signaling genes. Plant Physiol., 2011, 156(4): 1905-1920 ( ) DOI: 10.1104/pp.111.178046
- Hedden P., Thomas S.G. Gibberellin biosynthesis and its regulation. Biochem. J., 2012, 444: 11-25 ( ) DOI: 10.1042/BJ20120245
- Медведев С.С., Шарова Е.И. Биология развития растений. Т. 1. Начала биологии развития растений. Фитогормоны. СПб, 2011.
- Wilson R.N., Heckman J.W., Somerville C.R. Gibberellin is required for flowering in Arabidopsis thaliana under short days. Plant Physiol., 1992, 100(1): 403-408 ( ) DOI: 10.1104/pp.100.1.403
- Tyler L., Thomas S.G., Hu J., Dill A., Alonso J.M., Ecker J.R., Sun T. DELLA proteins and gibberellin-regulated seed germination and floral development in Arabidopsis. Plant Physiol., 2004, 135(2): 1008-1019 ( ) DOI: 10.1104/pp.104.039578
- Gao X.-H., Xiao S.-L., Yao Q.-F., Wang Y.-J., Fu X.-D. An updated GA signaling «Relief of repression» regulatory model. Mol. Plant., 2011, 4(4): 601-606 ( ) DOI: 10.1093/mp/ssr046
- Sasaki A., Ashikari M., Ueguchi-Tanaka M., Itoh H., Nishimura A., Swapan D., Ishiyama K., Saito T., Kobayashi M., Khush G.S. Green revolution: a mutant gibberellin-synthesis gene in rice. Nature, 2002, 416(6882): 701-702 ( ) DOI: 10.1038/416701a
- Huang Y., Wang X., Ge S., Rao G.-Y. Divergence and adaptive evolution of the gibberellin oxidase genes in plants. BMC Evol. Biol., 2015, 15: 207 ( ) DOI: 10.1186/s12862-015-0490-2
- Claeys H., De Bodt S., Inze D. Gibberellins and DELLAs: central nodes in growth regulatory networks. Trends in Plant Science, 2014, 19(4): 231-239 ( ) DOI: 10.1016/j.tplants.2013.10.001
- Varbanova M., Yamaguchi S., Yang Y., McKelvey K., Hanada A., Borochov R., Yu F., Jikumaru Y., Ross J., Cortes D., Ma C.J., Noel J.P., Mander L., Shulaev V., Kamiya Y., Rodermel S., Weiss D., Pichersky E. Methylation of gibberellins by Arabidopsis GAMT1 and GAMT2, 2007, 19(1): 32-45 ( ) DOI: 10.1105/tpc.106.044602
- Zentella R., Zhang Z.L., Park M., Thomas S.G., Endo A., Murase K., Fleet C.M., Jikumaru Y., Nambara E., Kamiya Y., Sun T.P. Global analysis of DELLA direct targets in Arabidopsis. Plant Cell, 2007, 19(10): 3037-3057 ( ) DOI: 10.1105/tpc.107.054999
- Weston D.E., Elliott R.C., Lester D.R., Rameau C., Reid J.B., Murfet I.C., Ross J.J. The pea (Pisum sativum) DELLA proteins LA and CRY are important regulators of gibberellin synthesis and root growth. Plant Physiol., 2008, 147(1): 199-205 ( ) DOI: 10.1104/pp.108.115808
- Zhang Z.-L., Ogawab M., Fleeta C.M., Zentella R., Hua J., Heoc J.-O., Limc J., Kamiyab Y., Yamaguchib S., Sun T. SCARECROW-LIKE 3 promotes gibberellins signaling by antagonizing master growth repressor DELLA in Arabidopsis. PNAS USA, 2011, 108(5): 2160-2165 ( ) DOI: 10.1073/pnas.1012232108
- Hooley R., Beale M.H., Smith S.J. Gibberellin perception at the plasma membrane of Avena fatua aleurone protoplasts. Planta, 1991, 183(2): 274-280 ( ) DOI: 10.1007/BF00197799
- Taddese B., Upton G.J.G., Bailey G.R., Jordan S.R.D., Abdulla N.Y., Reeves P.J., Reynolds C.A. Do plants contain G protein-coupled receptors? Plant Physiol., 2014, 164: 287-307 ( ) DOI: 10.1104/pp.113.228874
- Urano D., Chen J.-G., Botella J.R., Jones A.M. Heterotrimeric G protein signaling in the plant kingdom. Open Biol., 2013, 3: 120186 ( ) DOI: 10.1098/rsob.120186
- Hedden P., Sponsel V. Century of gibberellin research. J. Plant Growth Regul., 2015, 34: 740-760 ( ) DOI: 10.1007/s00344-015-9546-1
- Hirano K., Asano K., Tsuji H., Kawamura M., Mori H., Kitano H., Ueguchi-Tanaka M., Matsuoka M. Characterization of the molecular mechanism underlying gibberellin perception complex formation in rice. Plant Cell, 2010, 22(8): 2680-2696 ( ) DOI: 10.1105/tpc.110.075549
- Li H., Wang Y., Li X., Gao Y., Wang Z., Zhao Y., Wang M. A GA-insensitive dwarf mutant of Brassica napus L. correlated with mutation in pyrimidine box in the promoter of GID1. Mol. Biol. Rep., 2011, 38(1): 191-197 ( ) DOI: 10.1007/s11033-010-0094-2
- Griffiths J., Murase K., Rieu I., Zentella R., Zhang Z.L., Powers S.J., Gong F., Phillips A.L., Hedden P., Sun T.P., Thomas S.G. Genetic characterization and functional analysis of the GID1 gibberellin receptors in Arabidopsis. Plant Cell, 2006, 18(12): 3399-3414 ( ) DOI: 10.1105/tpc.106.047415
- Nakajima M., Shimada A., Takashi Y., Kim Y.C., Park S.H., Ueguchi-Tanaka M., Suzuki H., Katoh E., Iuchi S., Kobayashi M., Maeda T., Matsuoka M., Yamaguchi I. Identification and characterization of Arabidopsis gibberellin receptors. Plant J., 2006, 46(5): 880-889 ( ) DOI: 10.1111/j.1365-313X.2006.02748.x
- Sun T.-P. The molecular mechanism and evolution of the review GA-GID1-DELLA signaling module in plants. Cur. Biol., 2011, 21(9): R338-R345 ( ) DOI: 10.1016/j.cub.2011.02.036
- Ueguchi-Tanaka M., Nakajima M., Motoyuki A., Matsuoka M. Gibberellin receptor and its role in gibberellin signaling in plants. Annu. Rev. Plant Biol., 2007, 58(1): 183-198 (doi: 10.1146/annurev.arplant.58.032806.103830).
- Murase K., Hirano Y., Sun T.-P., Hakoshima T. Gibberellin induced DELLA recognition by the gibberellin receptor GID1. Nature, 2008, 456(7221): 459-463 ( ) DOI: 10.1038/nature07519
- Hidden P. Plant biology: gibberellins close the lid. Nature, 2008, 456(7221): 455-456 ( ) DOI: 10.1038/456455a
- Bolle C. The role of GRAS proteins in plant signal transduction and development. Planta, 2004, 218: 683-692 ( ) DOI: 10.1007/s00425-004-1203-z
- Dill A., Thomas S.G., Hu J., Steber C.M., Sun T.P. The Arabidopsis F-box protein SLEEPY1 targets gibberellin signaling repressors for gibberellin-induced degradation. Plant Cell, 2004, 16(6): 1392-1405 ( 10.1105/tpc. 020958) DOI: 10.1105/tpc.?020958
- Sasaki A., Itoh H., Gomi K., Ueguchi-Tanaka M., Ishiyama K., Kobayashi M., Jeong D.H., An G., Kitano H., Ashikari M., Matsuoka M. Accumulation of phosphorylated repressor for gibberellin signaling in an F-box mutant. Science, 2003, 299(5614): 1896-1898 ( ) DOI: 10.1126/science.1081077
- Hauvermale A.L., Ariizumi T., Steber C.M. Gibberellin signaling: A theme and variations on DELLA repression. Plant Physiol., 2012, 160: 83-92 ( ) DOI: 10.1104/pp.112.200956
- De Lucas M., Daviere J.-M., Rodriguez-Falcon M., Pontin M., Iglesias-Pedraz J.M., Lorrain S., Fankhause C., Blazquez M.A., Titarenko E., Prat S. A molecular framework for light and gibberellin control of cell elongation. Nature, 2008, 451(7177): 480-484 ( ) DOI: 10.1038/nature06520
- Feng S., Martinez C., Gusmaroli G., Wang Y., Zhou J., Wang F., Chen L.Y., Yu L., Iglesias-Pedraz J.M., Kircher S., Schafer E., Fu X.D., Fan L.M., Deng X.W. Coordinated regulation of Arabidopsis thaliana development by light and gibberellins. Nature, 2008, 451(7177): 475-479 ( ) DOI: 10.1038/nature06448
- Ariizumi T., Murase K., Sun T.P., Steber C.M. Proteolysis-independent downregulation of DELLA repression in Arabidopsis by the gibberellin receptor GIBBERELLIN INSENSITIVE DWARF1. Plant Cell., 2008, 20(9): 2447-2459 ( ) DOI: 10.1105/tpc.108.058487
- McGinnis K.M., Thomas S.G., Soule J.D., Strader L.C., Zale J.M., Sun T., Steber C.M. The Arabidopsis SLEEPY1 gene encodes a putative F-box subunit of an SCF E3 ubiquitin ligase. Plant Cell, 2003, 15(5): 1120-1130 ( ) DOI: 10.1105/tpc.010827
- Gagne J.M., Downes B.P., Shin-Han S., Durski A.M., Vierstra R.D. The F-box subunit of the SCF E3 complex is encoded by a diverse superfamily of genes in Arabidopsis. Proc. Natl. Acad. Sci. USA, 2002, 99(17): 11519-11524 ( ) DOI: 10.1073/pnas.162339999
- Bjorklund S., Antti H., Uddestrand I., Moritz T., Sundberg B. Cross-talk between gibberellin and auxin in development of Populus wood: gibberellin stimulates polar auxin transport and has a common transcriptome with auxin. Plant J., 2007, 52(3): 499-511 ( ) DOI: 10.1111/j.1365-313X.2007.03250.x
- Hay A., Kaur H., Phillips A., Hedden P., Hake S., Tsiantis M. The gibberellin pathway mediates KNOTTED1-type homeobox function in plants with different body plans. Curr. Biol., 2002, 12(18): 1557-1565 ( ) DOI: 10.1016/S0960-9822(02)01125-9
- Achard P., Vriezen W.H., Van Der Straeten D., Harberd N.P. Ethylene regulates Arabidopsis development via the modulation of DELLA protein growth repressor function. Plant Cell, 2003, 15(12): 2816-2825 ( ) DOI: 10.1105/tpc.015685
- Tanimoto E. Tall or short? Slender or thick? A plant strategy for regulating elongation growth of roots by low concentrations of gibberellin. Ann. Bot., 2012, 110: 373-381 ( ) DOI: 10.1093/aob/mcs049
- Cecconi F., Gaetani M., Lenzi C., Durante M. The sunflower dwarf mutant dw1: effects of gibberellic acid treatment. Helia, 2002, 25(36): 161-166 ( ) DOI: 10.2298/HEL0236161C
- Gavrilova V.A., Rozhkova V.T., Anisimova I.N. Sunflower genetic collection at the Vavilov Institute of Plant Industry. Helia, 2014, 37(60): 1-16 ( ) DOI: 10.1515/helia-2014-0001


