Молекулярные показатели, связанные с эффективностью терапии эверолимусом у больных диссеминированным раком почки
Автор: Юрмазов Захар Александрович, Спирина Людмила Викторовна, Усынин Евгений Анатольевич, Кондакова Ирина Викторовна, Слонимская Елена Михайловна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 (74), 2016 года.
Бесплатный доступ
Статья посвящена анализу молекулярных маркеров, ассоциированных с эффективностью таргетной терапии эверолимусом у больных с метастатическим почечно-клеточным раком. Цель исследования заключалась в изучении связи содержания транскрипционных факторов, сосудистого эндотелиального фактора роста, его рецептора, серин/треониновой протеинкиназы m-TOR, активности протеасом и кальпаинов с эффективностью терапии эверолимусом у больных с диссеминированным раком почки. Материал и методы. В исследование включены 18 больных с диссеминированным светлоклеточным раком почки. Содержание транскрипционных и ростовых факторов изучено методом ИФА, активность протеасом и кальпаинов - с помощью флюорометрического метода. результаты. На фоне терапии эверолимусом частичная регрессия опухоли и стабилизация были зафиксированы у 14 (78,8 %) пациентов, прогрессирование - в 4 (22,2 %) наблюдениях. Объективный ответ на лечение ингибитором m-TOR у больных раком почки наблюдается при высоких уровнях транскрипционных факторов NF-κB, HIF-1, ростового фактора VEGF, его рецептора VEGFR2, а также при повышенной активности протеасом в опухоли до лечения. Эффективность лечения также ассоциирована с низкой экспрессией протеинкиназы phospho-m-TOR. Заключение. Выявлены дополнительные молекулярные критерии, предсказывающие эффективность таргетной терапии эверолимусом.
Эверолимус, транскрипционный фактор hif-1, транскрипционный фактор nf-κb, протеасомы, кальпаины, рак почки
Короткий адрес: https://sciup.org/14056669
IDR: 14056669 | УДК: 616.61-006.6-08:615.28:576.343:577.2 | DOI: 10.21294/1814-4861-2016-15-2-42-47
Текст научной статьи Молекулярные показатели, связанные с эффективностью терапии эверолимусом у больных диссеминированным раком почки
Рак почки в большинстве случаев представлен светлоклеточным почечноклеточным подтипом [13], ассоциированным с мутационными изменениями белка Хиппеля – Линдау, увеличением содержания ядерного фактора HIF-1, гиперэкспрессией эндотелиального фактора роста (VEGF), активацией тирозинкиназных путей [16] и ключевой серин/ треониновой протеинкиназы m-TOR [9]. Наиболее эффективным методом лечения метастатического рака почки (мПКР) в настоящее время является таргетная терапия [1, 8]. В клинической практике наряду с тирозинкиназными ингибиторами широкое применение нашли ингибиторы m-TOR, в частности эверолимус («Афинитор», Novartis).
Ведется активный поиск молекулярных маркеров, позволяющих предсказывать эффективность применения данной группы препаратов у пациентов с мПКР, так как существующие широко используемые в клинической практике шкалы Motzer и Heng, включающие в себя только клиниколабораторные параметры, в большей степени позволяют ответить на вопрос, касающийся возможного исхода заболевания [10, 11, 15]. Среди предиктивных маркеров большое значение придается внутриклеточным протеиназам: протеасомам и кальпаинам. Известно, что протеолитическая регуляция содержания молекулярных маркеров, таких как HIF-1, VEGF, m-TOR и др., являющихся основными мишенями таргетных препаратов, может определять особенности прогрессирования заболевания [22]. Активация транскрипционного фактора NF-κB также осуществляется протеасо-мами [12]. В ранее опубликованных работах нами была показана связь экспрессии транскрипционных факторов NF-κB, HIF-1 и ростового фактора VEGF с активностью и субъединичным составом протеасом у больных раком почки при развитии гематогенных метастазов [2–4, 19]. Кроме того, на культуре почечно-клеточного рака показано влияние протеасом на активацию m-TOR сигнального пути [21]. С представленных позиций поиск новых предикторных молекулярных маркеров, сопряженных с эффективностью таргетной терапии мПКР, является актуальным.
Целью работы явилось изучение динамики показателей экспрессии транскрипционных
факторов, сосудистого эндотелиального фактора роста, его рецептора, серин/треониновой проте-инкиназы m-TOR, активности протеасом и каль-паинов у больных с диссеминированным раком почки на фоне проведения таргетной терапии эверолимусом.
Материал и методы
В исследование включено 18 пациентов с гистологически верифицированным диагнозом светлоклеточного рака почки T 2 — 4 N1M1 (средний возраст – 58,6 ± 2,2 года). Все больные имели признаки гематогенной диссеминации с наличием метастазов в печень, легкие и костные структуры (табл. 1). Комбинированное лечение пациентов предполагало проведение предоперационной таргетной терапии эверолимусом в дозе 10 мг ежедневно в течение двух месяцев, с последующим выполнением паллиативной нефрэктомии. Непосредственная эффективность оценивалась на основании результатов клинического обследования, данных СКТ/МРТ по шкале RECIST. Проведение данной работы одобрено этическим комитетом Томского НИИ онкологии.
Материалом для исследования явились образцы опухолевой ткани, полученные при выполнении диагностической биопсии до начала лечения и после хирургического этапа, которые замораживались и хранились при –80°С. В опухолевом материале определяли активность протеасом и кальпаинов, а также количественное содержание VEGF, VEGFR2, HIF-1α, NF-κBp50 и NF-κBp65.
Получение гомогенатов. Замороженную ткань (100 мг) гомогенизировали в жидком азоте, затем ресуспендировали в 300 мкл 50 мМ трис-HCl буфера (pH=7,5), содержащего 2 мМ АТФ, 5 мМ хлорид магния, 1 мМ дитиотреитол, 1 мМ ЭДТА и 100 мМ хлорид натрия. Гомогенат центрифугировали 60 мин при 10000 g и 4°С.
Определение активности протеасом. Химо-трипсинподобную активность протеасом определяли в гомогенатах опухолевых тканей по гидролизу флуорогенного олигопептида N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin, утилизирующегося химотрипсинподобными центрами протеасом [6], на флуориметре «Hitachi-850» (Япония) при длине волны возбуждения 380 нм и эмиссии 440 нм. Реакционная смесь для определения активности 20S протеасом содержала 20 мМ трис-HCl (pH=7,5), 1 мМ дитиотреитол, 30 мкМ N-Succinyl-Leu-Leu-Val-Tyr-7-Amido-4-Methylcoumarin. Реакцию проводили при 37°С в течение 20 мин и останавливали 1 % додецил сульфатом натрия. Для оценки активности примесных протеаз в образцах применяли специфический ингибитор протеасом – MG132. Удельную активность протеасом выражали в единицах активности на 1 мг белка.
Определение активности кальпаинов. Активность кальпаинов определяли в гомогенатах тканей таблица 1
клиническая характеристика больных
Определение содержания VEGF, VEGFR2, HIF-1α, NF-κBp50 и NF-κBp65. Образцы осветленных гомогенатов опухолей использовались для определения содержания VEGF, VEGFR2, phospho-m-TOR (R&D Systems, DSL, США), HIF-1α, NF-κB p50 и NF-kB p65 субъединиц (Caymanchem, США) методом твердофазного иммуноферментного анализа на ИФА-анализаторе «Anthos 2020». Приготовление и очистка ядерных экстрактов тканевого гомогената проводились в соответствии с рекомендациями фирмы-производителя наборов. Уровень белка в гомогенатах и ядерных экстрактах определялся по методу Лоури. Результаты определения содержания VEGF, VEGFR2, phosphor-TOR выражали в пг/мг белка, а HIF-1α, NFκB p50 и NFκB p65 – в условных единицах на мг белка в лунке.
Статистическую обработку результатов проводили с применением пакета статистических программ Statistica 8.0. В зависимости от вида распределения результаты представлены как m ± M, где m – среднее выборочное, M – ошибка среднего или как медиана с интерквартильным размахом (25-й и 75-й процентили). Значимость различий исследовали с помощью t-критерия Стьюдента или критерия Манна – Уитни.
Результаты и обсуждение
На фоне проведения таргетной терапии клинический эффект был зафиксирован у 14 (78,8 %) пациентов (регрессия опухоли – в 4 (22,2 %), стабилизация процесса – в 10 (56,6 %) случаях. Прогрессирование заболевания зафиксировано в 4 (22,2 %) наблюдениях (табл. 2).
При анализе динамики изучаемых маркеров выявлено, что у больных с наличием ответа на таргетную терапию эверолимусом исходно в опухолевой ткани определялась высокая экспрессия транскрипционных факторов NF-κB p65, NF-κB p50, HIF-1, ростового фактора VEGF и рецептора VEGFR2 по сравнению с пациентами, у которых отмечено дальнейшее прогрессирование заболевания на фоне лечения (табл. 3). У этих же пациентов диагностировано и значимое снижение уровня вышеперечисленных параметров на фоне проводимого лечения. При этом уровень протеинкиназы phospho-m-TOR был исходно низким и оставался таковым после лечения. В 2015 г. J. Dornbusch et al. [7] выявлена прямая корреляция уровня экспрессии vEgFRI, VEGFR2, а также PDGFRa с общей выживаемостью больных, получающих терапию TKI.
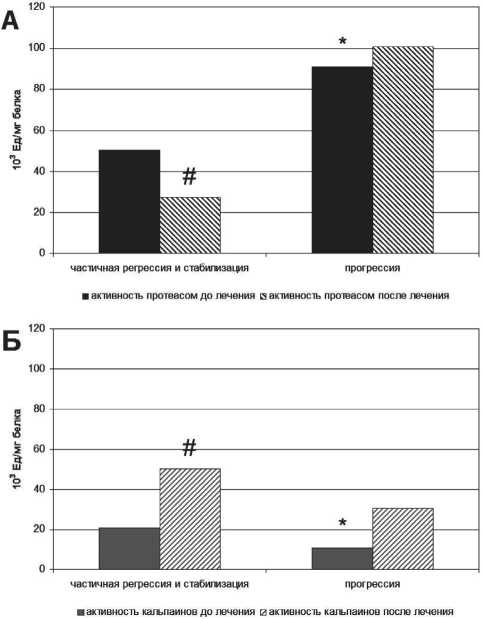
Рис. 1. Активность внутриклеточных протеиназ: протеасом (А) и кальпаинов (Б) в опухоли больных раком почки с наличием эффекта таргетной терапии эверолимусом и прогрессированием заболевания.
Примечание: * – значимость различий по сравнению с группой с наличием объективного ответа (частичная регрессия и стабилизация), р<0,05;
# – значимость различий по сравнению с группой больных до лечения, р<0,05
таблица 2 Эффективность таргетной терапии препаратом эверолимус у больных с диссеминированным раком почки
Ответ опухоли
Количество больных
Частичный Стабилизация Прогрессия
4 (22,2 %)
10 (55,6 %)
4 (22,2 %)
таблица 3
содержание транскрипционных факторов nf-κb p65, nf-κb p50, Hif-1α, vegf, vegfr2 и протеинкиназы m-tor в опухоли больных раком почки в зависимости от эффективности лечения по критерию recist
|
Эффект от лечения |
Содержание NF- κ B p65, УЕ/мг белка в лунке тотальная |
Содержание NF- κ B p50, УЕ/мг белка в лунке |
Экспрессия HIF-1 α , УЕ/мг белка в лунке |
Содержание m-TOR, пг/мг белка в лунке |
Содержание VEGF, пг/мг белка |
Содержание VEGFR2, пг/мг белка |
||||||
|
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
1 |
2 |
|
|
ЧР + |
64,7 |
5,07 |
40,6 |
4,6 |
16,2 |
0,73 |
6,25 |
7,74 |
100,5 |
11,5 |
85,2 |
22,6 |
|
стабили- |
(17,8– |
(4,4– |
(21,1– |
(3,99– |
(13,4– |
(0,23– |
(0,0– |
(4,48– |
(32,0– |
(7,57– |
(50,0– |
(13,5– |
|
зация |
159,0) |
10,88)# |
189,0) |
5,9)# |
19,11)* |
1,59)# |
12,6) |
8,6) |
344,0) |
29,2)# |
340,0) |
29,5)# |
|
Прогрес- |
8,93 |
6,93 |
8,85 |
7,9 |
4,6 |
3,56 |
15,5 |
12,37 |
16,2 |
12,3 |
41,2 |
34,0 |
|
сирова- |
(7,86– |
(3,4– |
(8,6– |
(5,18– |
(4,2– |
(2,13– |
(14,7– |
(10,89– |
(13,4– |
(8,8– |
(33,5– |
(19,1– |
|
ние |
10,0)* |
8,43) |
9,1)* |
8,8) |
4,94)* |
4,0) |
16,43)* |
15,85) |
19,11)* |
15,4) |
53,04)* |
48,9) |
Примечание: 1 – группа больных до лечения; 2 – группа больных после лечения; * – значимость различий по сравнению с группой с наличием объективного ответа (частичная регрессия (ЧР) и стабилизация), р<0,05; # – значимость различий по сравнению с группой больных до лечения, р<0,05.
Полученные результаты позволяют полагать, что существует сопряженность между эффективностью терапии эверолимусом и изучаемыми молекулярными показателями, что делает возможным рассматривать их в качестве дополнительных предсказательных критериев. Представленные данные свидетельствуют о том, что не только уровни транскрипционных факторов NF-κB p65, NF-κB p50, HIF-1, ростового фактора VEGF и рецептора VEGFR2 являются значимыми маркерами, определяющими особенности развития опухоли почки, но важным показателем является и уровень протеинкиназы phospho-m-TOR. Исходно низкое содержание данного показателя до начала лечения эверолимусом связано с более высокой его эффективностью. Аналогичные данные были представлены в работе японских ученых, которые сделали выводы о потенциальной роли phospho-m-TOR в прогнозе эффективности терапии эверо-лимусом [18].
На фоне проведения таргетной терапии также были отмечены существенные изменения в показателях внутриклеточных протеиназ (рис. 1). Так, у больных с клиническим эффектом зафиксировано снижение активности протеасом в 1,8 раза и рост активности кальпаинов в 2,4 раза по сравнению с исходными значениями. При неэффективности тар-гетной терапии эверолимусом и дальнейшем прогрессировании заболевания выявлено повышение
Список литературы Молекулярные показатели, связанные с эффективностью терапии эверолимусом у больных диссеминированным раком почки
- Алексеев Б.Я. Метастатический рак почки: выбор терапии первой линии//Онкоурология. 2014. № 3. С. 43-48.
- Кондакова И.В., Спирина Л.В., Коваль В.Д., Шашова Е.Е., Чойнзонов Е.Л., Иванова Э.В., Коломиец Л.А., Чернышова А.Л., Слонимская Е.М., Усынин Е.А., Афанасьев С.Г. Химотрипсинподобная активность и субъединичный состав протеасом в злокачественных опухолях человека//Молекулярная биология. 2014. Т. 48, № 3. С. 444-451.
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Винтизенко С.И. Регуляция ангиогенеза при злокачественных новообразованиях почки и мочевого пузыря//Сибирский онкологический журнал. 2008. № 4. С. 65-70.
- Спирина Л.В., Кондакова И.В., Усынин Е.А., Юрмазов З.А. Регуляция экспрессии транскрипционных факторов и фактора роста эндотелия сосудов протеасомной системой при метастазировании рака почки//Вестник РОНЦ им. Н.Н. Блохина РАМН. 2012. Т. 23, № 1. С. 27-32.
- Atencio I.A., Ramachandra M., Shabram P., Demers G.W. Calpain inhibitor 1 activates p53-dependent apoptosis in tumor cell lines//Cell Growth Differ. 2000. Vol. 11 (5). P. 247-253.
- Ben-Shahar S., Komlosh A., Nadav E., Shaked I., Ziv T., Admon A., DeMartino G.N., Reiss Y. 26 S proteasome-mediated production of an authentic major histocompatibility class I-restricted epitope from an intact protein substrate//J. Biol. Chem. 1999. Vol. 274 (31). P. 21963-21972.
- Dornbusch J., Zacharis A., Meinhardt M., Erdmann K., Wolff I., Froehner M., Wirth M.P., Zastrow S., Fuessel S. Analyses of Potential Predictive Markers and Survival Data for a Response to Sunitinib in Patients with Metastatic Renal Cell Carcinoma//PLoS One. 2013. 8 (9): e76386 DOI: 10.1371/journal.pone.0076386
- Fergelot P., Rioux-Leclercq N., Patard J.J. Molecular Pathways of tumour angiogenesis and new targeted therapeutic approaches in renal cancer//Prog. Urol. 2005. Vol. 15 (6). P. 1021-1029.
- Guertin D.A., Sabatini D.M. An expanding role for mTOR in cancer//Trends. Mol. Med. 2005. Vol. 11 (8). P. 353-361.
- Heng D.Y., Xie W., Regan M., Warren M.A., Golshayan A.R., Sahi C., Eigl B.J., Ruether J.D., Cheng T., North S., Venner P., Knox J.J., Chi K.N., Kollmannsberger C., McDermott D.F., Oh W.K., Atkins M.B., Bukowski R.M., Rini B.I., Choueiri T.K. Prognostic factors for overall survival (OS) in patients with metastatic renal cell carcinoma (RCC) treated with vascular endothelial growth factor (VEGF)-targeted agents: Results from a large multicenter study//J. Clin. Oncol. 2009. Vol. 27 (34). P. 5794-5799 DOI: 10.1200/JCO.2008.21.4809
- Heng D.Y., Xie W., Regan M.M., Harshman L.C., Bjarnason G.A., Vaishampayan U.N., Mackenzie M., Wood L., Donskov F., Tan M.H., Rha S.Y., Agarwal N., Kollmannsberger C., Rini B.I., Choueiri T.K. External validation and comparison with other models of the International Metastatic Renal-Cell Carcinoma Database Consortium prognostic model: a population-based study//Lancet Oncol. 2013. Vol. 14 (2). P. 141-148 DOI: 10.1016/S1470-2045(12)70559-4
- Juvekar A., Manna S., Ramaswami S., Chang T.P., Vu H.Y., Ghosh C.C., Celiker M.Y., Vancuriva I. Bortezomib induces nuclear translocation of IkBα resulting in gene-specific suppression of NF-kB-dependent transcription and induction of apoptosis in CTCL//Mol. Cancer Res. 2011. Vol. 9 (2). P. 183-194 DOI: 10.1158/1541-7786.MCR-10-0368
- Keefe S.M., Nathanson K.L., Rathmell W.K. The molecular biology of renal cell carcinoma//Semin. Oncol. 2013. Vol. 40 (4). P. 421-428 DOI: 10.1053/j.seminoncol.2013.05.006
- Kohli V., Gao W., Carlos A., Clavien P.A. Calpain is a mediator of preservation-reperfusion injury in ratliver transplantation//Proc. Natl. Acad. Sci. USA. 1997. Vol. 94 (17). P. 9354-9359.
- Motzer R.J., Bacik J., Schwartz L.H., Reuter V., Russo P., Marion S., Mazumdar M. Prognostic Factors for Survival in Previously Treated Patients With Metastatic Renal Cell Carcinoma//J. Clin. Oncology. 2004. Vol. 22 (3). P. 454-463.
- Na X., Wu G., Ryan C.K., Shoen S.R., di’Santagness P.A., Messing E.M. Overproduction of vascular endothelial growth factor related to von Hippel-Lindau tumor suppressor gene mutations and hypoxia-inducible factor-1 alpha expression in renal cell carcinomas//J. Urol. 2003. Vol. 170 (2 Pt 1). P. 588-592.
- Sandmann S., Prenzel F., Shaw L., Schauer R., Unger T. Activity profile of calpains I and II in chronically infarcted rat myocardium-influence of the calpain inhibitor CAL 9961//Br. J. Pharmacol. 2002. Vol. 135 (8). P. 1951-1958.
- Shida T., Kishimoto T., Furuya M., Nikaido T., Koda K., Takano S., Kimura F., Shimizu H., Yoshidome H., Ohtsuka M., Tanizawa T., Nakatani Y., Miyazaki M. Expression of an activated mammalian target of rapamycin (mTOR) in gastroenteropancreatic neuroendocrine tumors//Cancer Chemother. Pharmacol. 2010. Vol. 65 (5). P. 889-893. doi: 10.1007/s00280-009-1094-6.
- Spirina L.V., Kondakova I.V., Choynzonov E.L., Chigevskaya S.Y., Shishkin D.A., Kulbakin D.Y. Expression of vascular endothelial growth factor and transcription factors HIF-1 and NF-κB expression in squamous cell carcinoma of head and neck; association with proteasome and calpains activity//J. Cancer Res. Clin. Oncol. 2013. Vol. 139 (4). P. 625-633 DOI: 10.1007/s00432-012-1366-0
- Storr S.J., Carragher N.O., Frame M.C., Parr T., Martin S.G. The calpain system and cancer//Nat. Rev. Cancer. 2011. Vol. 11 (5). P. 364-374 DOI: 10.1038/nrc3050
- Wu W.K., Volta V., Cho C.H., Wu Y.C., Li H.T., Yu L., Li Z.J., Sung J.J. Repression of protein translation and mTOR signaling by protea-some inhibitor in colon cancer cells//Biochem. Biophys. Res. Commun. 2009. Vol. 386 (4). P. 598-601 DOI: 10.1016/j.bbrc.2009.06.080
- Yue C.X., Ma J., Zhou H.J., Tang Q.L., Li L.L., Bi F., Xue Y. The effect of RhoAand proteasome inhibitor MG132 on angiogenesis in tumors//Sichuan Da Xue Xue Bao Yi Xue Ban. 2011. Vol. 42 (4). P. 445-450.


