Молекулярный анализ генетического разнообразия популяций донников ( Melilotus dentatus Pers.)
Автор: Мунтян А.Н., Белова В.С., Чижевская Е.П., Румянцева М.Л., Симаров Б.В., Андронов Е.Е.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Корма и кормопроизводство: биологические основы
Статья в выпуске: 6 т.47, 2012 года.
Бесплатный доступ
Проведены молекулярно-генетические исследования популяций донника зубчатого ( Melilotus dentatus Pers.) из разных географически удаленных районов (Северный Кавказ и Казахстан). Использованный комплексный подход включал внутри- и межпопуляционный анализ по таксономически значимым молекулярным маркерам (ITS). Также выполнен анализ участка рецепторного гена nfr 5. Показано, что среди растений Melilotus dentatus Pers. имеются различия как на внутри-, так и на межпопуляционном уровне. Кроме того, наблюдается обособленность популяций донников в кластеры согласно их географическому распространению. Определено независимое распределение популяций растений донников по рецепторной части гена nfr 5 относительно кластерной структуры ITS региона.
Генетическое разнообразие, ген nfr5
Короткий адрес: https://sciup.org/142133368
IDR: 142133368 | УДК: 633.366:575.17:577.21
Текст научной статьи Молекулярный анализ генетического разнообразия популяций донников ( Melilotus dentatus Pers.)
В мировом земледелии донник как кормовая культура играет не столь большую роль в сравнении с другими бобовыми кормовыми травами. Однако к настоящему времени в результате всестороннего изучения у него выявлен комплекс хозяйственно ценных свойств. Так, донник характеризуется высокой засухоустойчивостью и одновременно повышенной зимостойкостью, а также отличается от других бобовых высокой устойчивостью к болезням и вредителям (1). Кроме того, донник зубчатый лучше поедается животными вследствие более низкого содержания кумарина (2). Способность донника произрастать на засоленных землях и солонцах позволяет использовать его для восстановления почв за счет создания солерезистентного бобово-ризобиального комплекса. Соответственно, важная задача при биорекультивационных мероприятиях — увеличение симбиотической эффективности, которая, в свою очередь, в значительной степени зависит от генотипа растения-хозяина.
Специфичность бобово-ризобиального симбиоза обеспечивается обменом сигнальными молекулами между партнерами, в результате чего запускается механизм образования специализированного органа — клубенька. В ответ на выделение корнем растения специфических индукторов — флавоноидов, азотфиксирующие бактерии начинают продуцировать сигнальные молекулы (Nod-факторы), которые инициируют процесс образования клубеньков у бобовых растений (3). Все Nod-факторы представляют собой липохитоолигосахариды. У бобовых растений имеются семь генов, предположительно участвующих в распознавании бактериальных сигналов микросимбионтов и взаимодействии (4). Особенно интересно семейство генов LYK, к которым относятся nfrl и nfr5, впервые выявленные у лядвенца японского (3, 5), SymIO и Sym2 у гороха посевного (3), а также ген NFP у диплоидной люцерны (6, 7). Продукты этих генов, кодирующих LysM-содержащую рецепторную киназу, имеют типичную для растений доменную структуру: внеклеточные LysM-домены, предположительно участвующие в рецепции Nod-фактора, трансмембранный домен и внутрикле- точный домен серин/треонин киназы.
Гены, содержащие LysM -кодирующие участки (LysM -мотивы), относятся к древней и весьма разнообразной группе, распространенной во всех царствах, кроме архей (7). Филогенетический анализ показал, что некоторые последовательности бактериальных LysM -мотивов имеют общие корни с последовательностями у грибов, растений, насекомых и животных. Это позволило предположить, что одна группа таких генов сформировалась перед дивергенцией растительного и животного миров, другая — в результате конвергентной эволюции. Структурное сходство LysM-содержа-щей протеинкиназы с пептидогликаном, представляющим собой один из компонентов клеточной стенки бактерий, служит доказательством участия рецепторных белков NFR1 и NFR5 в распознавании и передаче Nod-фактора на следующие компоненты сигнального каскада, приводящего к образованию клубеньков (7). Однако в настоящее время еще недостаточно знаний, раскрывающих происхождение и механизмы функционирования обсуждаемой группы рецепторных генов.
Существует множество молекулярно-генетических методов, позволяющих исследовать генетическое разнообразие и популяционную изменчивость сельскохозяйственных культур (8). Нашей целью был молекулярный анализ генетической изменчивости у растений донника зубчатого ( Melilotus dentatus Pers.), отобранных в разных географически удаленных районах (Приаралье и Северный Кавказ).
Методика . Семенной материал собирали в период созревания донника зубчатого (октябрь, 2000 год) на территории Республики Казахстан — сайты № 31 (49° 56' с.ш., 58° 92' в.д.) и № 57 (49° 59' с.ш., 57° 71' в.д.), а также в Краснодарском крае России (Северо-Кавказский регион) — сайт № 51 (43° 52’ с.ш., 39° 22 ' в.д.). Семена стерилизовали концентрированной серной кислотой 10 мин, тщательно промывали стерильной водой и проращивали в чашках Петри при температуре 4 °С в течение 2 сут. Для дальнейших исследований из каждой популяции отбирали по 20 проростков.
Геномную ДНК выделяли из 2-суточных проростков методом хлороформной экстракции с использованием CTAB-буфера (9). Растительный материал тщательно гомогенизировали, затем суспендировали в СТАВ и инкубировали при температуре 65 °С в течение 60 мин. После экстракции хлороформом надосадочную жидкость, содержащую ДНК, осаждали равным объемом изопропанола, после чего промывали 70 % этиловым спиртом. Образец ДНК ресуспендировали в 50 мкл деионизированной воды.
Для RAPD-фингерпринтинга (RAPD — random amplified polymorphic DNA) использовали десятичленный праймер FS-27 (5'-AGCCGGCCTT-3') (10). Амплификацию выполняли на термоциклере My Cycler («Bio Rad», США) (денатурация 3 мин при 95 °С; 40 циклов: денатурация — 30 с при 94 °С, отжиг праймеров — 30 с при 37 °С, элонгация — 3 мин при 68 °С; завершающий синтез — 3 мин при 72 °С). RAPD проводили в реакционной смеси объемом 20 мкл, содержащей 10* буфер (670 мМ Трис-HCl, pH 9,1; 166 мМ сульфат аммония, 20 мМ хлорид магния, 0,1 % Твин 20), dNTP (концентрация каждого 0,15 мМ), праймер (15 пМ), 1,5 ед. Taq-полимеразы (UAB «Fermentas», Литва) и 1 мкл геномной ДНК (1012 нг). Продукты амплификации разделяли в 2 % агарозном геле, содержащем бромистый этидий, с 0,5*TAE буфером.
При амплификации ITS региона растительной ДНК использовали праймеры ITS4 (5'-TCCTCCGCTTATTGATATGC-3') и ITS5 (5'-GGAA-GTAAAAGTCGTAACAAGG-3') (11). Амплификацию проводили в 20 мкл смеси, содержащей 10* буфер, dNTP (концентрация каждого 0,15 мМ), смесь праймеров ITS4 и ITS5 (15 пМ), 1,5 ед. Taq-полимеразы (5 ед/мкл) и 1 мкл геномной ДНК (10-12 нг) на термоциклере My Cycler («Bio Rad», США). Протокол ПЦР: денатурация 3 мин при 95 °C; 30 циклов — 30 с при 95 °C, 30 с при 55 °C, 1 мин при 72 °C; завершающая элонгация 4 мин при 72 °C. Полимеразную цепную реакцию для участка гена nfr5 осуществляли с помощью пары вырожденных праймеров — nfr5-for3 (5'-AAGTCT-TGGTTGTTAYTTGCCA-3') и nfr5-Grev3 (5'-TGCAGTCTCAGCTAATGAA-GTAC-3'). Протокол ПЦР: 3 мин при 95 °C; 30 циклов — 30 с при 94 °C, 30 с при 42 °C, 1 мин при 72 °C; 4 мин при 72 °C.
Для определения нуклеотидной последовательности продукты амплификации ДНК клонировали в векторе pTZ57R/T (UAB «Fermentas», Литва). Cеквенирование выполняли со стандартными праймерами М13 на автоматическом приборе CEQ™ 8000 Genetic Analysis System («Beckman Coulter, Inc.», C0A). Каждую последовательность анализировали в двух направлениях. Данные по определению нуклеотидных последовательностей участков ITS и nfr5 обрабатывали с помощью программного обеспечения секвенатора CEQ™ 8000 Genetic Analysis System. Выравнивание и сборку нуклеотидных и белковых последовательностей проводили с использованием программы Vector NTI Suit 8 (. При построении филогенетических деревьев пользовались программами ClustalX ( и FPQuest («Bio Rad», C0A).
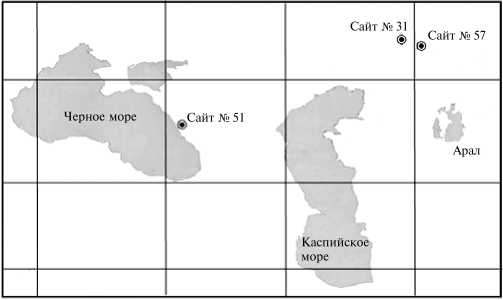
Рис. 1. Расположение мест сбора образцов семян донника Melilotus dentatus Pers., использованных в исследовании.
Результаты . Места сбора образцов донника (номера сайтов) отмечены на рисунке 1.
Для молекулярного изучения генетического разнообразия популяций донника нами использовался комплексный подход, включающий RAPD-анализ, а также определение нуклеотидной последовательности межгенных участков рибосомальной ДНК
(ITS регион). Особое внимание уделялось определению генетического разнообразия рецепторного комплекса гена nfr5 , продукты которого предположительно вовлечены в распознавании ризобиального Nod-фактора.
Начальный этап работы включал выполнение RAPD-фингерприн-тинга, а также анализ растительной ДНК с использованием таксономически значимых участков (ITS). По результатам RAPD-анализа (рис. 2) была построена дендрограмма филогенетического родства изученных образцов донника зубчатого (рис. 3), на которой проявились как внутри-, так и межпопуляционные различия. Популяции донников из Приаральского региона оказались достаточно однородными (за исключением варьирования по минорным фрагментам). При этом популяции растений из Приаралья и с Cеверного Кавказа четко различались, хотя некоторое число образцов имели идентичные RAPD-профили. Для последующего анализа ITS региона и рецепторного участка гена nfr5 из каждой популяции отобрали по три образца Melilotus dentatus Pers. с наиболее полиморфными RAPD-профилями (см. рис. 2).
A
Б
В
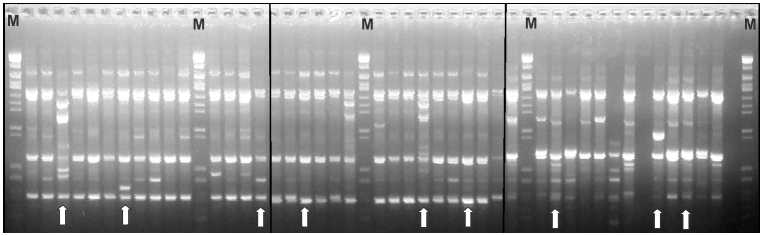
Рис. 2. RAPD-фингерпринтинг для образцов из популяций донника Melilotus dentatus Pers., отобранных в Приаралье (A и Б, соответственно сайты № 31 и № 57) и на Северном Кавказе (В, сайт № 51) . М — маркер молекулярных масс 7 /BstEII. Стрелками обозначены RAPD-профили, которые были взяты для последующего анализа ITS региона и рецепторного участка гена nfr5 .
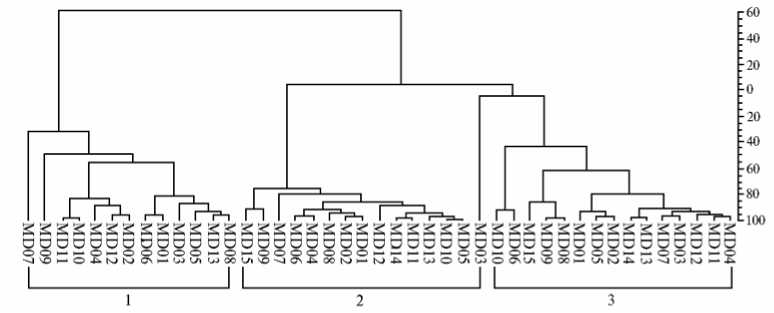
Рис. 3. Дендрограмма филогенетического родства для образцов из популяций донника Melilotus dentatus Pers. (MD) , отобранных на Северном Кавказе (1, сайт № 51) и в Приаралье (2 и 3, соответственно сайты № 31 и № 57) , по данным RAPD-фингерпринтинга.
Секвенированный внутренний транскрибируемый регион (ITS) рибосомальной ДНК включал высококонсервативную последовательность 5,8S-субъединицы РНК и два транскрибируемых участка — ITS1 и ITS2. Такие свойства, как многокопийность, небольшой размер (600-700 п.н.) и согласованная эволюция между локусами ITS1 и ITS2 (11), позволяют использовать эти спейсеры в качестве таксономически значимого молекулярного маркера в систематике высших растений (12).
У исследованных донников нуклеотидные последовательности ITS региона имели размер 687 п.н. На их основании была построена дендрограмма родства растений донника (рис. 4). При этом полученные результаты полностью совпали с данными RAPD-фингерпринтинга. В обоих случаях растения донника из Приаральского и Северо-Кавказского регионов формировали отдельные кластеры, причем степень различий соответствовала обособленности популяций.
Детальный анализ нуклеотидных последовательностей ITS региона выявил точечные замены в регионах ITS1, 5,8S и ITS2 (рис. 5). Особенно интересен участок ITS2, где все три вариабельных сайта с нуклеотидными заменами (позиции 494, 611 и 648) однозначно маркируют отличия северокавказских донников от приаральских. Согласно данным литературы, ITS1 и ITS2 регионы эволюционно сопряжены, то есть генетические изменения должны затрагивать оба спейсера. Однако наши результаты показали, что максимум полиморфных сайтов наблюдается в ITS2 (см. рис. 5).
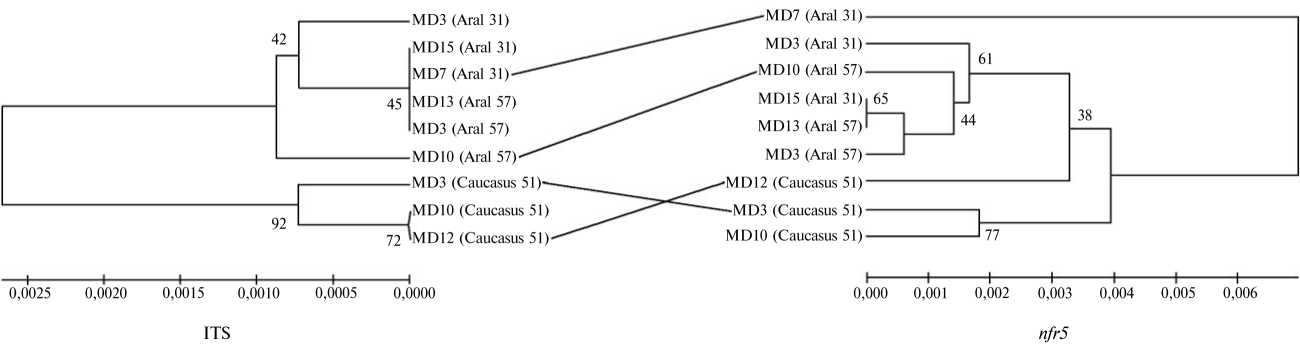
Рис. 4. Дендрограммы филогенетического родства по ITS региону (внутренний транскрибируемый регион рибосомальной ДНК) и участку гена nfr5 (рецепторный белок NFR5) для образцов из популяций донника Melilotus dentatus Pers. (MD) , отобранных на Северном Кавказе (сайт № 51 — Caucasus 51) и в Приаралье (сайты № 31 и № 57 — соответственно Aral 31 и Aral 57).
ITS1 I 5,8S ITS2
79 | 160 | 391 | 494 | 611 | 648
|
Consensus |
G |
T |
A |
T |
C |
A |
|
|
3 |
G |
T |
A |
T |
C |
A |
|
|
1 |
7 |
G |
T |
G |
T |
C |
A |
|
15 |
G |
T |
A |
T |
C |
A |
|
|
3 |
G |
C |
A |
T |
C |
A |
|
|
2 |
10 |
G |
T |
A |
T |
C |
A |
|
13 |
G |
T |
A |
T |
C |
A |
|
|
3 |
G |
T |
A |
A |
T |
T |
|
|
3 |
10 |
G |
T |
A |
A |
T |
T |
|
12 |
A |
T |
A |
A |
T |
T |
|
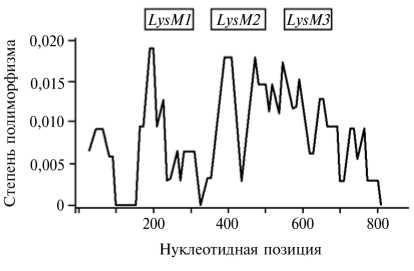
Рис. 5. Вариабельные позиции в нуклеотидных последовательностях внутреннего транскрибируемого региона ITS рибосомальной ДНК, включающего высококонсервативную последовательность 5,8S-субъединицы РНК и транскрибируемые участки ITS1 и ITS2 регионов, у образцов донника Melilotus dentatus Pers. из разных популяций: 1 и 2 —
Приаралье, сайты соответственно № 31 и № 57, 3 — Северный Кавказ, сайт № 51
(для сайтов указаны номера проанализированных образцов).
Рис. 6. Нуклеотидный полиморфизм доменной структуры рецепторного участка гена nfr5 у изученных растений донника Melilotus dentatus Pers. (независимо от их географического происхождения). LysMl , LysM2 и LysM3 — мотивы гена nfr5 , продукты которых отвечают за связывание бактериального сигнала.
На этапе молекулярногенетического анализа рецепторного гена nfr5 мы провели выравнивание полученных по следовательностей (нуклеотидной и аминокислотной) относительно рецепторного региона гена nfr5 у козлятника восточного. Для популяций донника зубчатого определили доменную структуру изучаемого участка, размер которого составил 778 п.н. Как оказалось, наибольшее число вариабельных сайтов приходятся на LysM-домены: в LysM1 и LysM2 имелись четыре, в LysM3 — три вариабельных позиции (рис. 6, 7).
LysM1 LysM2 LysM3
|
1 |
180 | |
198 |
1 235 I |
281 |
1 359 | |
402 |
\ 448 |
I 469 |
536 |
565 |
608 |
|
Consensus |
C |
C |
G |
T |
T |
A |
A |
T |
T |
A |
A |
|
3 |
C |
C |
G |
T |
T |
A |
A |
T |
T |
A |
A |
|
1 7 |
T |
T |
A |
T |
T |
G |
G |
C |
T |
G |
G |
|
15 |
C |
C |
G |
T |
T |
A |
A |
T |
T |
A |
A |
|
3 |
C |
C |
G |
T |
T |
A |
A |
T |
T |
A |
A |
|
2 10 |
C |
C |
G |
T |
C |
A |
A |
T |
T |
A |
A |
|
13 |
C |
C |
G |
T |
T |
A |
A |
T |
T |
A |
A |
|
3 |
C |
C |
G |
C |
T |
A |
A |
T |
T |
A |
A |
|
3 10 |
C |
C |
G |
T |
T |
A |
A |
T |
C |
A |
A |
|
12 |
T |
T |
G |
T |
T |
G |
A |
T |
T |
G |
A |
|
Consensus (аминокислота) |
- |
— |
Glu |
Ile |
Phe |
— |
— |
— |
Val |
Ser |
Asn |
|
Замещенная аминокислота |
— |
— |
Lys |
Thr |
Ser |
— |
— |
— |
Ala |
Gly |
Ser |
Рис. 7. Вариабельные позиции нуклеотидных последовательностей и значимые аминокислотные замены в рецепторном участке гена nfr5 у образцов донника Melilotus dentatus Pers. из разных популяций: 1 и 2 — Приаралье, сайты соответственно № 31 и № 57, 3 — Северный Кавказ, сайт № 51 (для сайтов указаны номера проанализированных образцов).
Анализ аминокислотных последовательностей показал, что в домене LysM1 число сайтов с заменами уменьшилось до 2, в LysM2 — до 1, при этом в LysM3 оно осталось прежним и равнялось 3 (см. рис. 7). Таким образом, обращает на себя внимание LysM3-домен, в котором выявлено повышение частоты несинонимичных (значимых) замен, возможно, указывающих на эволюцию анализируемого гена в рамках движущего отбора с целью создания множества модификаций растительного рецептора при взаимодействии с бактериальным сигналом.
Сопоставление дендрограмм, построенных на основании изучения нуклеотидных последовательностей в рецепторной части гена nfr5 и в ITS регионе (см. рис. 4), показало, что топология дендрограммы nfr5 уже не имеет такого однозначного сходства с RAPD- и ITS-дендрограммами, согласующимися как между собой, так и с географической приуроченностью популяций донника. Вероятно, здесь наблюдается варьирование замен в рецепторном участке гена nfr5 вне зависимости от географического происхождения растений. Возможно, это явление связано с экологической пластичностью донника в изменяющихся условиях среды, его способностью тонко реагировать на бактериальные сигналы (Nod-фактор) и адаптироваться к ним, не исключено также, что мы имеем дело с переносом генетического материала между популяциями.
Итоговые нуклеотидные последовательности участков для ITS и nfr5 у растений донника депонированы в базу данных NCBI под следую щими номерами:
(ITS_69/7-JF461307, ITS_69/2-JF461308, ITS_69/13-JF461309,
ITS_57/3-JF461310, ITS_57/14-JF461311, ITS_57/10-JF461312,
ITS_51/3-JF461313, ITS_51/16-JF461314, ITS_51/15-JF461315,
ITS_31/7-JF461316, ITS_31/3-JF461317, ITS_31/15-JF461318);
(NFR5_69/7-JF461295, NFR5_69/2-JF461296, NFR5_69/13-JF461297, NFR5_57/3-JF461298, NFR5_57/14-JF461299, NFR5_57/10-JF461300, NFR5_51/3-JF461301, NFR5_51/16-JF461302, NFR5_51/15-JF461303, NFR5_31/7-JF461304, NFR5_31/3-JF461305, NFR5_31/15-JF461306).
Итак, показано, что между растениями донника зубчатого Melilotus dentatus Pers., произрастающими в разных регионах (Приаралье и Северный Кавказ), имеются различия как на внутри-, так и на межпопуляционном уровне. Кроме того, наблюдается обособленность популяций донника в кластеры согласно их географическому распространению. При этом выявлено независимое распределение популяций по рецепторной части гена nfr5 относительно кластерной структуры по ITS региону. Примененный нами молекулярно-генетический анализ полиморфизма по симбиотическим генам позволяет получать более глубокое представление о биоразнообразии растений из этой хозяйственно значимой группы, необходимое при их использовании как генетических ресурсов в программах по биотехнологиям живых систем. Учитывая интенсивное развитие фундаментальных исследований по симбиогенетике, также интересно проследить коэволюци-онные связи между макро- и микросимбионтами.


