Молекулярный состав водоэкстрагируемого органического вещества черноземов при выращивании ячменя в условиях вегетационного опыта
Автор: Фарходов Ю.Р., Данилин И.В., Ярославцева Н.В., Зиганшина А.Р., Максимович С.В., Холодов В.А.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 124, 2025 года.
Бесплатный доступ
Целью работы была оценка влияния вегетации ячменя (Hordeum vulgare L.) на молекулярный состав водоэкстрагируемого органического вещества черноземов. В работе использовали метод вегетационного эксперимента в климатической камере с отбором проб почвы до посева и во время вегетации ячменя. Молекулярный состав водоэкстрагируемого органического вещества (ВЭОВ) изучали методом газовой хромато-масс-спектрометрии. На основе полученных данных рассчитывали индекс разнообразия Шеннона и оценивали вклад разных соединений в состав ВЭОВ. Показано, что вегетация ячменя увеличивает сложность состава ВЭОВ чернозема. Молекулярный состав ВЭОВ оказался различным для всех вариантов опыта. Доля липидов и азотсодержащих соединений ВЭОВ чернозема в условиях вегетации ячменя уменьшается по сравнению с его предпосевным состоянием, что может быть связано с их активной микробной деструкцией. При вегетации ячменя происходит значимое увеличение доли углеводов в составе ВЭОВ чернозема. Полученные данные свидетельствуют о высокой чувствительности молекулярного состава ВЭОВ черноземов к влиянию функционирования ячменя и ризосферных микроорганизмов.
Ячмень, ризосфера, ГХ/МС, лабильное ПОВ
Короткий адрес: https://sciup.org/143184852
IDR: 143184852 | УДК: 631.4 | DOI: 10.19047/0136-1694-2025-124-254-271
Текст научной статьи Молекулярный состав водоэкстрагируемого органического вещества черноземов при выращивании ячменя в условиях вегетационного опыта
Исследование выполнено при поддержке Российского научного фонда, проект № 24–26-00293,
This research was funded by the Russian Science Foundation (project No. 2426-00293),
7 Bld. 2 Pyzhevskiy per., Moscow 119017, Russian Federation, *, e-mail:
В настоящее время становится все более актуальным изучение биохимических процессов в системе “почва-растение” для решения проблем почвенной секвестрации углерода, устойчивого землепользования и обеспечения продовольственной безопасности (Соколова, 2020; Etesami, 2021; Sun et al., 2021; Zhao et al., 2022; Wang, Kuzyakov, 2024). Известно, что растительный покров играет важную роль в процессах трансформации почвенного органического вещества (ПОВ), минеральной части почвы, а также в формировании микробного сообщества. В контексте изучения трансформации ПОВ и иных процессов в системе “почва-растение” наибольший интерес представляет ризосфера – объем почвы, окружающий корни растений и характеризующийся высокой биологической активностью (Kuzyakov, Razavi, 2019). В ризосфере формируется почвенная структура, характеризующаяся высокой устойчивостью, что способствует связыванию и сохранению углерода в почве (Junya et. al., 2020; Wang, Kuzyakov, 2024). Ризосферные микроорганизмы помогают растению справляться с влиянием факторов стресса, способствуют усвоению растением питательных веществ (Etesami, 2021; Sun et al., 2021). Главным фактором изменения химических и биологических свойств почвы в ризосфере является корневые выделения, а также экзометаболиты ризосферных микроорганизмов, интенсифицирующие процессы выветривания минеральной матрицы и трансформации ПОВ. В состав корневых и микробных экссудатов входят разнообразные низкомолекулярные органические вещества, формирующие лабильный пул ПОВ (Dakora, Phillips, 2002; Sokolova, 2015; Vives-Peris et al., 2020; Dhungana et al., 2023). Данный пул выполняет ряд важнейших функций в системе “почва-растение”. Выделение экссудатов необходимо для поддержания тургора клеток (Chai, Schachtman, 2022), регуляции состава микробного сообщества ризосферы и увеличения доступности элементов питания (Chen et al., 2022; Fadiji et al., 2023), а также хемотаксиса (Feng et al., 2021). Специфичность продуктов экссудации зависит от разновидности фактора стресса, а интенсивность экссудации – от степени его выраженности (Fadiji et al., 2023). Наиболее простым и показательным подходом изучения лабильного пула ПОВ в условиях взаимодействия “почва-растение” является исследование фракции водоэкстрагируемого органического вещества (ВЭОВ). Изучение данной фракции ПОВ в основном связано с анализом их оптических свойств. В меньшей степени реализовано изучение молекулярного состава ВЭОВ, которое является ресурсоемким, однако позволяет детально изучать процессы трансформации ПОВ в условиях взаимодействия “почва-растение”.
Ячмень ( Hordeum vulgare L.) – стратегически важная сельскохозяйственная культура, высокая урожайность которой является условием, формирующим мировую продовольственную безопасность. В настоящее время молекулярный состав ВЭОВ ризосферы сельскохозяйственных культур, в том числе ячменя, мало изучен, что препятствует пониманию функционирования системы “почва-растение” и природы почвенного плодородия. В особенности ярко выражен недостаток таких данных для черноземов – одних из самых плодородных почв планеты.
Цель исследования: оценить влияние вегетации ячменя на молекулярный состав ВЭОВ черноземов.
ОБЪЕКТЫ И МЕТОДЫ
В эксперименте по созданию модельного агроценоза (микрокосма) использовали чернозем типичный (Классификация и диагностика почв СССР, 1977), Haplic Chernozem (WRB, 2015), отобранный в 2019 г. на многолетних полевых опытах ФГБНУ “Курский федеральный аграрный научный центр” (п. Черемушки Курского района Курской области). Образцы отбирали из варианта
“зерно-паро-пропашной севооборот с внесением минеральных удобрений через ротацию”. Свойства почвы: pH водной суспензии – 6.3 ± 0.1, C орг – 3.55 ± 0.06%, N общ – 0.29 ± 0.03% (среднее арифметическое ± стандартное отклонение). Образцы почвы хранились до востребования в воздушно-сухом состоянии в герметичной полимерной таре при комнатной температуре (18-25 0Q в сухом темном месте. Перед заполнением вегетационных сосудов для достижения гомогенности почву перемешивали. После этого почву помещали в пластиковые сосуды объемом примерно 30 л (30 × 40 × 25 см). Вегетационный опыт проводили в условиях климатической камеры при температуре 22 °C и относительной влажности воздуха 60%. Программа освещения состояла из двух временных сегментов: дневного (10 часов) и ночного (14 часов). Во время ночного периода освещение отсутствовало.
Влажность почвы поддерживали на уровне 70% от наименьшей влагоемкости. Пробоотбор на глубине 0–15 см проводили дважды: перед посевом и во время вегетативной фазы стеблевания ячменя. Во время вегетативной фазы отбор проб осуществляли из ризосферы и вмещающей (внекорневой) почвы. Отделение ризосферой почвы осуществляли удалением налипших на корневую систему ячменя почвенных частиц. После пробоотбора почву лиофильно высушивали и хранили при -18 °C
Изучение молекулярного состава фракции ВЭОВ проводили в соответствии с рекомендациями (Swenson et al., 2015). Для выделения ВЭОВ к средней пробе массой 2 г приливали 8 мл очищенной деионизированой воды (ASTM тип 1), полученную суспензию встряхивали на ротаторе при 4 °C в течение 1 часа, после этого надосадочную жидкость пропускали через фильтр с диаметром пор 0.45 мкм, а полученный экстракт концентрировали до сухого остатка на роторном испарителе. После концентрирования почвенной вытяжки осадок перерастворяли в 1 мл метанола, из этого объема отбирали аликвоту 500 мкл в полипропиленовую пробирку объемом 2 мл. В целях последующей дериватизации метанольный экстракт концентрировали в токе азота. Полученный осадок дери-ватизировали в два этапа: первый этап проводили с добавлением 10 мкл 98% раствора метоксиамина гидрохлорида в пиридине с концентрацией 40 мг/мл и нагреванием до 30°С в течение 90 ми- нут, второй этап – с добавлением к полученной смеси 90 мкл N-метил-N-триметилсилилтрифторацетамида с 1% триметилхлорси-ланом и нагреванием до 37 °С в течение 30 минут. В полученную реакционную смесь добавляли внутренний стандарт – метиловый эфир нонадекановой кислоты, и переносили в хроматографическую виалу. Далее экстракт анализировали на газовом хроматографе с масс-спектрометрическим детектором GCMS-QP2010 (Shimadzu, Япония). Условия хроматографирования: начальная температура колонки 60 °С с экспозицией 5 мин., температурный градиент 5 °С/мин. до 310 °С с экспозицией 7 мин., температура инжектора - 250 °С, капиллярная хроматографическая колонка GsBP-5MS (Gs-Tek, США), 30 м, масс-детектор квадрупольного типа, ионизация – электронный удар с энергией ионизации 70 эВ, диапазон детектируемых масс – 50–600 m/z. Деконволюцию хроматограмм и разметку хроматографических пиков проводили с помощью веб-сервиса Global Natural Products Social Molecular Networking (Aksenov et al., 2021), идентификацию пиков осуществляли в программе MS Search с помощью баз данных масс-спектров и индексов удерживания: NIST11 (National Institute of Standards and Technology, США), Fiehn BinBase DB (MassBank of North America). Полуколичественный анализ – методом внутренней нормализации в соответствии с рекомендациями (Misra, 2020). Ввиду того, что полученные данные являются композитными, перед их статистическим анализом проводилась преобразование. Для этого применялась центрированная логарифмическая трансформация с последующей нормализацией для устранения отрицательных значений (Aitchison, 1982). На основе данных относительного содержания идентифицированных соединений рассчитывали индекс разнообразия Шеннона (H) по формуле:
H = -Σ pi × ln (pi), где pi – относительное содержание метаболита.
Анализ данных проводили c помощью языка программирования R в среде разработки RStudio (Team, 2014). Для разведочного анализа использовали метод главных компонент. Статистический анализ проводился непараметрическими методами с исполь- зованием критерия Краскела-Уоллиса и критерия Данна при уровне значимости p = 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам анализа молекулярного состава ВЭОВ было идентифицировано 26 соединений, относящихся к органическим кислотам, многоатомным спиртам, углеводам и азотистым веществам. Наибольшее количество соединений (16) представлено простыми углеводами и их производными (далее – углеводы), 7 соединений входили в состав липидов (далее – липиды), к группе азотистых веществ принадлежало всего 3 соединения (табл. 1 Приложения). Используя данные молекулярного состава ВЭОВ, рассчитали индекс разнообразия Шеннона, характеризующий сложность (однородность) состава ВЭОВ (рис. 1).
Показано, что вегетация ячменя увеличивает сложность состава ВЭОВ чернозема, что обусловлено влиянием корневых экссудатов, экзометаболитов микробной биомассы, а также продуктов их трансформации (El Moujahid et al., 2017). В то же время различия в сложности состава ВЭОВ ризосферы и вмещающей почвы были незначимы, при этом заметна тенденция уменьшения разнообразия состава ВЭОВ в ризосфере. Такая закономерность, вероятно, связана с активной микробной трансформацией ОВ, которая в большей степени проявляется в ризосфере, чем во вмещающей почве (Kuzyakov, 2002). Известно, что сложность молекулярного состава ПОВ во многом связана с видовым разнообразием микробиоты и растительного покрова почвы (El Moujahid et al., 2017; Wang et al., 2023).
На рисунке 2 показано расположение точек, характеризующих объекты исследования, в координатах главных компонент (ГК) на основе данных о молекулярном составе ВЭОВ. Отчетливо видно, что объекты исследования разбиваются на два кластера: чернозем перед посевом ячменя и чернозем во время вегетации ячменя. Также заметна тенденция разделения объектов исследования на кластеры ризосферы и вмещающей почвы. Таким образом, каждый из вариантов опыта характеризуется собственным набором относительных содержаний низкомолекулярных компонентов ВЭОВ.
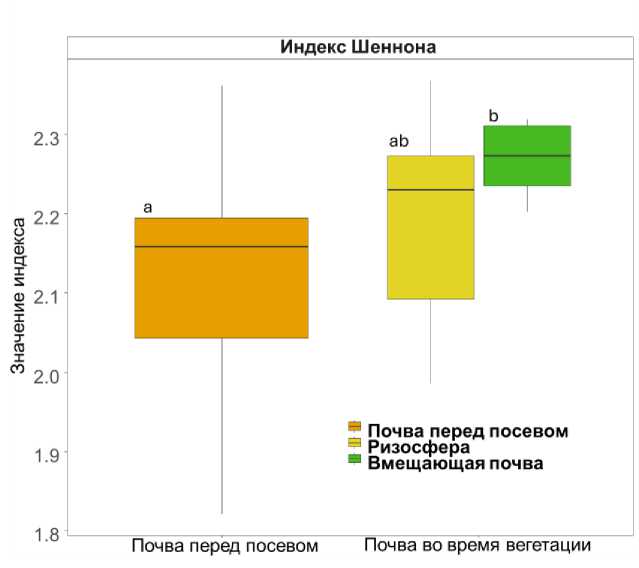
Рис. 1. Разнообразие состава ВЭОВ чернозема перед посевом и во время вегетации ячменя по индексу Шеннона.
Fig. 1. The diversity of the molecular composition of water-extractable organic matter (WEOM) in chernozem before sowing and during barley vegetation according to the Shannon index.
Компоненты ВЭОВ, показанные на рисунке 2, сгруппированы на рисунке 3 с целью выявления основных закономерностей состава ВЭОВ в разных вариантах опыта.
Показано, что доля липидов ВЭОВ чернозема в условиях вегетации ячменя уменьшается по сравнению с его предпосевным состоянием. Наименьшее относительное содержание липидов характерно для ризосферы, это показатель во вмещающей почве занимает промежуточное положение и значимо не различается между почвой перед посевом и ризосферой.
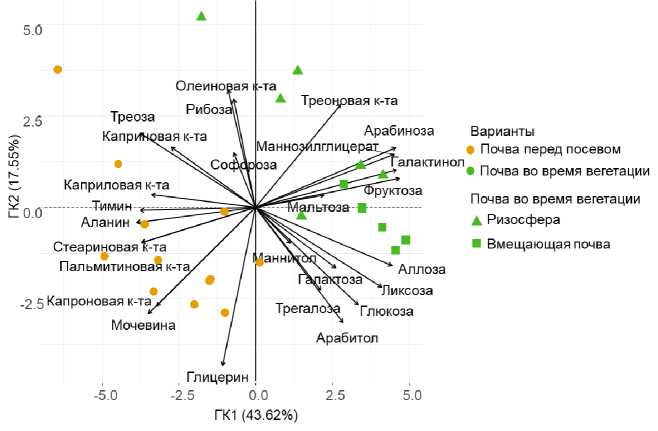
Рис.2. Расположение объектов исследования в координатах ГК в зависимости от молекулярного состава ВЭОВ.
Fig. 2. The positioning of study objects in PCA coordinates depending on the molecular composition of WEOM.
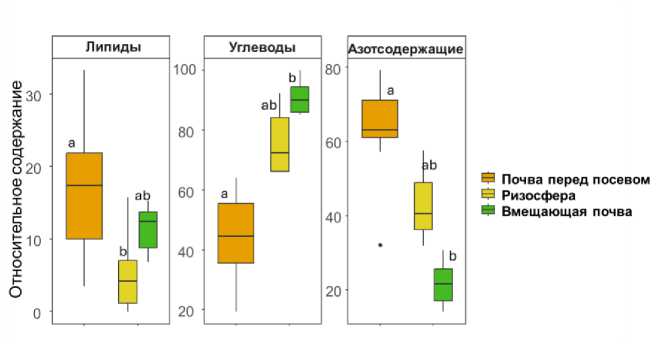
Рис. 3. Групповой молекулярный состав ВЭОВ черноземов.
Fig. 3. Group molecular composition of WEOM in chernozem soils.
Формирование состава ПОВ связано с биологической доступностью входящих в его состав компонентов, которая обусловлена их строением и свойствами (Bahadori et al., 2021). Важным свойством органических молекул, влияющих на их биодоступность, является гидрофобность (Katayama et al., 2010). В составе идентифицированных биомолекул ВЭОВ черноземов наименее гидрофобным и наиболее доступным для потребления микроорганизмами является глюкоза, для которой константа распределения в системе окта-нол/вода (pKow) равна -3.2, а наиболее гидрофобным и трудноде-градируемым – стеариновая кислота (pKow = 8.2), принадлежащая к группе липидов – наиболее гидрофобных соединений из изученных в данной работе (Sangster, 1994). Высокое обилие этих компонентов ВЭОВ чернозема в отсутствие вегетирующих растений связано дефицитом легкоусвояемых субстратов: углеводов и азотсодержащих соединений, способствующих интенсификации микробной трансформации ПОВ. Доля липидов в составе ВЭОВ ризосферы была значимо ниже, чем в почве до посева, а во вмещающей почве их доля была незначимо выше. Это можно объяснить проявлением в ризосфере прайминг-эффекта, когда в присутствии легкоусвояемого субстрата происходит деградация трудноразлага-емых субстратов (Kuzyakov, 2002; Zhang et al., 2019). Накопление олеиновой кислоты, вероятнее всего, связано с корневой эксуда-цией. Стоит подчеркнуть, что в составе корневых выделений представлены и другие свободные жирные кислоты (ЖК) (Bahadori et al., 2021). Выявленная тенденция объясняется тем, что олеиновая кислота является ненасыщенной, наличие двойной связи делает ее менее стабильной по сравнению с насыщенными ЖК (Yang et al., 2020). В связи с этим можно утверждать, что олеиновая кислота является свежеобразованным компонентом ризосферы.
Накопление азотсодержащих компонентов в составе ВЭОВ чернозема без ячменя может указать на преобладание метаболитов микробного происхождения. В период вегетации происходит снижение доли азотсодержащих компонентов в составе ВЭОВ, вызванное накоплением углеводов – основных продуктов экссудации растений (Vranova et al., 2013, Bahadori et al., 2021). Незначимое увеличение доли азотсодержащих соединений в составе ВЭОВ чернозема в ризосфере, вероятно, указывает на рост микробной биомассы по сравнению со вмещающей почвой. Об этом дополнительно свидетельствует тенденция к увеличению доли тимина (табл. 1 Приложения), входящего в состав молекулы ДНК (Нельсон, Кокс, 2022).
При вегетации ячменя происходит значимое увеличение доли углеводов в составе ВЭОВ чернозема. Относительное содержание углеводов в ризосфере и вмещающей почве значимо не различалось, при этом заметна тенденция к его уменьшению в составе ВЭОВ ризосферы. Углеводы являются экссудатами растений и микроорганизмов, помимо этого, простые углеводы могут образовываться в результате активности целлюлазы в составе ферментативного комплекса почвы. Низкое обилие углеводов в составе ВЭОВ ризосферы по сравнению со вмещающей почвой обусловлено высокой биологической активностью ризосферы (Kuzyakov, 2002; Vranova et al., 2013). Простые углеводы являются основными источниками углерода и энергии для микроорганизмов (Gunina, Kuzyakov, 2015), поэтому высокая биологическая активность ризосферы приводит к уменьшению доли углеводов в составе ВЭОВ. О высокой активности микроорганизмов ризосферы может указывать накопление рибозы – моносахарида, являющегося составной частью молекул РНК и АТФ, которые участвуют в метаболизме живых клеток (Нельсон, Кокс, 2022). Также заметна тенденция увеличения доли софорозы в составе ВЭОВ ризосферы (табл. 1 Приложения). Софороза вырабатывается в живых клетках для индуцирования активности целлюлазы – фермента, разрушающего полисахаридные цепи на мономеры (dos Santos Castro et al., 2014). Исходя из этого, мы предполагаем, что накопление софоро-зы вызвано недостатком легкоусвояемого субстрата для микробиоты ризосферы.
ЗАКЛЮЧЕНИЕ
На примере выращивания ячменя на черноземе типичном показано, что функционирование системы “почва-растение” приводит к значимому увеличению разнообразия молекулярного состава ВЭОВ, что связано с выделением экссудатов и интенсификацией трансформации ПОВ. Трансформация молекулярного со- става чернозема типичного в условиях вегетации ячменя отражается в увеличении относительного содержания простых углеводов и в уменьшении липидов, а также азотсодержащих молекул в составе ВЭОВ. Полученные результаты свидетельствуют о положительном влиянии вегетации растений на утилизацию компонентов ВЭОВ черноземов, отличающихся устойчивостью к биодеструкции.


