Монитор глубины наркоза на основе технологии биспектрального индекса (BIS)
Автор: Абдуллаев А.С.
Журнал: Экономика и социум @ekonomika-socium
Рубрика: Основной раздел
Статья в выпуске: 3-2 (94), 2022 года.
Бесплатный доступ
В данной статье освещается история развития мониторинга общей анестезии с помощью биспектрального индекса. Автор рассказывает о приборе с помощь которого снимается биспектральный индекс, какая компания и с какой целью создала этот аппарат, особенности эксплуатации этого аппарата. Даётся историческая справка о том как пришли к идее создания биспектрального мониторинга и как доказывали состоятельность этой идеи при исследованиях.
Мониторинг глубины общей анестезии, биспектральный индекс, интероперационное пробуждение, делирий
Короткий адрес: https://sciup.org/140291421
IDR: 140291421 | УДК: 617-089.166:616.831-073.96
Текст научной статьи Монитор глубины наркоза на основе технологии биспектрального индекса (BIS)
BIS был разработан компанией Aspect Medical Systems (США) в 1994 году для оценки уровня сознания во время анестезии (Sigl J.C., 1994; Singh H., 1999).
В 1996 году управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) разрешило применение индекса BIS для оценки эффекта седативных препаратов и средств для наркоза в клинической практике (монитор компании Aspect Medical Systems, Natick, MA).
Система мониторирования включает BIS датчик (одноразовый лобный электрод), кабель пациента, цифровой преобразователь сигнала (модуль), BIS процессор и монитор (рис. 1).

Рисунок 1. Система мониторирования глубины наркоза на основе технологии биспектрального индекса.
BIS система представляет собой эмпирически и статистически рассчитанные алгоритмы оценки глубины сна, основанные на анализе множества ЭЭГ. Так, в первом варианте монитора Aspect Medical Systems непрерывно регистрируемая ЭЭГ конкретного пациента сравнивалась с имеющимися в базе системы данными 5000 ЭЭГ взрослых, находившихся под наркозом со стандартными анестетиками.
ЭЭГ больного после оцифровки и удаления помех подвергается трем видам анализа, включающем временные, частотные и спектральные характеристики параметров ЭЭГ. BIS алгоритм, основанный на статистической обработке, рассчитывает вклад каждого из этих показателей, определяет их достоверную корреляцию с клиническими признаками седации, и формирует единый универсальный числовой BIS индекс.
BIS индекс ― это число от 0 до 100, которое позволяет судить о степени сознания пациента:
-
• значение BIS-индекса, равное 100, означает, что пациент в полном сознании (бодрствование);
-
• значение BIS-индекса, равное 0, означает полное отсутствие активности мозга
-
• при общей анестезии значение BIS-индекса должно находиться в интервале от 40 до 60 (средний наркоз, низкая вероятность нахождения в сознании);
-
• для седации рекомендуется уровень от 60 до 70 (низкая вероятность воспоминаний); по некоторым данным, для адекватной седации уровень BIS может превышать даже 70, но при этом повышается вероятность сохранения сознания и воспоминаний о проводимых манипуляциях.
-
• BIS-индекс ниже 40 – глубокий наркоз (рис 2).
Каждое значение BIS индекса вычисляется на основе 15-30 секундной записи ЭЭГ. Поэтому оно отражает состояние, непосредственно предшествующее вычислению. Проспективные клинические исследования показали, что поддержание BIS индекса на уровне 40-60 обеспечивает адекватный анестезиологический эффект и улучшает процесс выхода пациента из наркоза (Glass P. 1997; Lubke G. 1999; Andrade J. 2001;
Nieuwenhuijs D. 2002; Struys MM. 2002; Ekman A. 2004; Chiu CL. 2007; Ibraheim O. 2008; Anderson J. 2010; Zhang C. 2011.; Radtke FM. 2013; Shepherd J. 2013; Punjasawadwong Y. 2014; Wickham А. 2016).
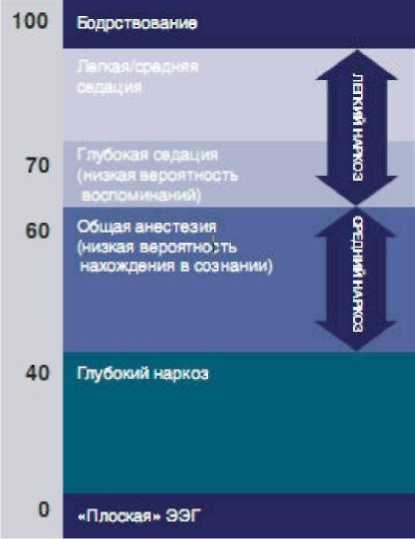
Рисунок 2. Степени сознания пациента на основание биспектрального индекса.
Известно, что ЭЭГ меняется в ответ на воздействие седативных препаратов или средств для наркоза (Flaishon R, . 1997), хотя каждый препарат может вызывать свои особенные проявления на ЭЭГ, изменения сигнала в целом весьма схожи для большинства из применяемых средств. Во время общей анестезии типичные изменения ЭЭГ включают увеличение средней амплитуды (мощности) и уменьшение средней частоты сигнала с переходом от β-диапазона к δ-диапазону, характерному для глубокого наркоза (Gan TJ 1997).
BIS снижается во время обычного сна, как и при введении анестетика. Однако снижение, связанное с физиологическим сном, происходит не в такой степени, как при воздействии тиопенталом, пропофолом или ингаляционными анестетиками. BIS отражает снижение уровня метаболизма в головном мозге, вызываемое большинством средств для наркоза. Значимая корреляция между низким BIS и низкой скоростью обменных процессов в мозге была доказана с помощью позитронно-эмиссионной томографии (Alkire MT., 1998).
Несмотря на очевидную пользу, у BIS есть ряд недостатков (Kaul H.L., 2002). BIS является показателем кортикальной функции, что непосредственно не отражает активность подкорковых структур, в том числе спинного мозга, который, прежде всего, опосредует двигательную реакцию на боль; таким образом, BIS не может надежно прогнозировать ответную реакцию на стимулы. В некоторых случаях увеличение BIS наблюдалось при анестезии оксидом азота и кетамином (Grundy BL., 1985; Thornton C., 1989). Также на BIS может повлиять инфузия эсмолола при интубации трахеи (Thornton C., 1998). Реакция BIS является менее надежной в условиях введения высоких доз опиоидов (Newton DE., 1992; Schwender D., 1994).
Снижение дозы снотворных препаратов при высоко-опиоидном методе дает менее глубокий эффект, что отражается на ЭЭГ. Таким образом, BIS индекс является наиболее точным при использовании анестетиков, включающих низкую или среднюю дозу опиоидного анальгетика и снотворного.
Несколько исследований продемонстрировали влияние гипотермии при ИК на BIS индекс ― его уменьшение по мере углубления гипотермии и его увеличение при согревании пациента по окончании ИК (Schmidlin D., 2001; Mathew JP., 2001; Honan D., 2006; Hayashida M., 2007; Mathew PJ., 2009; Ziegeler S., 2010).
Клиническая значимость применения BIS мониторинга
В клинических исследованиях показано, что применение BIS мониторинга способствует лучшему восстановлению пациентов после хирургических вмешательств, проводимых под общей анестезией, оказывая как прямое, так и опосредованное воздействие (Myles PS., 2004; Kertai MD., 2010; Avidan MS., 2011).
Первые клинические работы по оценке эффективности BIS мониторинга продемонстрировали значительное уменьшение доз используемых анестетиков, что в свою очередь сокращало время экстубации и повышало общую эффективность лечения у пациентов общехирургического профиля. Другими словами, пациенты восстанавливались быстрее на фоне применения более низких доз анестетиков (Gan TJ., 1997; Glass PSA., 1997; Song D., 1997).
Согласно последним исследованиям, удержание индекса BIS в целевом интервале от 40 до 60 единиц способствует снижению доз применяемых анестетиков до 11 – 27% (Liu SS. 2004; Punjasawadwong Y., 2007; Muralidhar K., 2008; Punjasawadwong Y., 2014).
Опосредованное положительное влияние BIS мониторинга обусловлено возможностью контроля с его помощью активности центров головного мозга и формирования промежуточных когнитивных фенотипов, что играет важную роль в определении времени экстубации в ОРИТ. Например, пациент с послеоперационным делирием будет нуждаться в отсроченной экстубации. Таким образом, интраоперационное применение BIS мониторинга способствует контролю когнитивных изменений (удержанию активности центров головного мозга на безопасном для больного уровне), формирующихся у пациента под влиянием наркоза, профилактируя развитие послеоперационного делирия и тем самым сокращая время ИВЛ в ОРИТ. И наоборот, отсутствие контроля активности головного мозга повышает риск послеоперационных психических нарушений, увеличивая как продолжительность ИВЛ, так и частоту реинтубаций.
Пожилые пациенты, доля которых ежегодно увеличивается в хирургической практике по всему миру, характеризуются исходным высоким риском периоперационных осложнений в силу физиологических особенностей и коморбидных состояний. Гипотония, наблюдаемая при общей анестезии, ассоциирована у пожилых с высоким риском фатальных осложнений в послеоперационном периоде ― инсультом, инфарктом, острой почечной недостаточностью, когнитивными нарушениями, смертностью на 30-е сутки после операции и через год после проведенного осложненного вмешательства (Bijker et al 2009; Bijker et al 2012; Yocum et al. 2009; Sun et al. 2015; Walsh et al. 2013; Monk et al 2005; Mascha et al 2015).
Опубликованные в мае 2016г результаты аудита Лондонской Академии Анестезиологии продемонстрировали высокую частоту ― 83,3% развития гипотонии у 481 пожилого пациента (из 25 госпиталей Лондона), перенесших ортопедические и общехирургические вмешательства. При этом снижение АД систолического более чем на 20% от исходного, длительностью более 20 минут, наблюдалась у 28,4% больных, ниже 70 мм рт.ст ― у 24,6%, ниже 60 мм рт.ст. у 13,5% и ниже 50 мм рт.ст. ― у 3% пациентов. Т.е. у 39% включенных в исследование больных общехирургического профиля, интраоперационное снижение давления составило более 40% от исходных значений. Мониторинг глубины наркоза использовался лишь у 9,4% больных (46 пациентов из 11 госпиталей; 29 из них получали внутривенную анестезию, остальные ― ингаляционную). При этом у 80,4 % пациентов BIS индекс регистрировался на уровне <40, что для 89,2% больных (33 человека) сопровождалось развитием гипотонии. Кроме того, у 27 человек (73%) значения BIS индекса ниже 40 единиц регистрировались в течение более 20 минут. Данная работа наглядно показала, что отсутствие мониторинга глубины анестезии ухудшает периоперационный период у пациентов одной из самых распространенных групп высокого риска ― старшей возрастной группы (65 лет и выше), получающих избыточные дозы анестезии и связанную с ними гипотонию. В заключении авторы рекомендуют повсеместное применение мониторинга глубины наркоза при операциях у пожилых людей (Wickham А., 2016).
Использование только клинических признаков в современной практике может сопровождаться как недооценкой, так и переоценкой состояния пациента и приводить к применению избыточных или недостаточных доз анестетиков, что в свою очередь повышает риски интраоперационного пробуждения пациента.
Данное состояние ― интраоперационное пробуждение больного , или незапланированное восстановление сознания, составляет от 0,1% до 0,2% от всего числа проводимых хирургических вмешательств (Sebel PS., 2004), но вместе с тем приводит к развитию серьезных психологических расстройств, так называемому посттравматическому стрессовому расстройству (ПТСР), являющемуся основной причиной тяжелой депрессии и самоубийств (Sebel PS., 2004).
К сожалению, это осложнение часто недооценивается в периоперационном периоде, что обусловлено отсутствием в рутинной практике большинства хирургических стационаров как методов объективной оценки глубины наркоза, так и специальных опросников для пациентов перед операцией для определения риска незапланированного пробуждения (НЗП), а также анкетирования после операции. В результате пациент, перенесший недиагносцированное НЗП, после выписки из хирургического стационара нуждается в дополнительном лечении, что в совокупности в ряде стран приводит к юридическим искам и финансовым потерям клиник.
Sebel PS c cоавт., изучая частоту НЗП у хирургических больных, получавших наркоз, провели проспективное исследование на базе 7 крупных медицинских центров США с привлечением 19575 пациентов. С целью выявления НЗП применялось анкетирование пациента до и после оперативного вмешательства, интраоперационно учитывались все клинические и гемодинамические параметры, а также проводился BIS-мониторинг. По результатам было выявлено 25 случаев документированного
НЗП, частота которого составила 0,13%, или 1-2 случая на 1000 пациентов, или 26 тыс случаев в год для США, где проводится 20 млн ежегодных операций с общей анестезией. Но вместе с тем, применение опросников и BIS-мониторинга позволили выявить еще 1229 случаев «неполного периоперационного бодрствования», которое потребовало дополнительного вмешательства. Среди основных факторов риска НЗП авторы выделили исходную III – V степень тяжести состояния пациента по ASA, тогда как пол и возраст в данной работе не увеличивали риск возникновения НЗП (Sebel PS. 2004).
С данными о недооценке и рисках НЗП у пациентов хирургического профиля согласуются результаты метаанализа Ghoneim М., сравнившего опубликованные с 1950 по 2005 гг. данные 271 пациента, перенесшего НЗП, с 19504 обследованных без НЗП в периоперационном периоде. В основном это были кардиохирургические вмешательства и операции Кесарева сечения. Согласно обзору, только 35% пациентов самостоятельно жаловались на НЗП в раннем послеоперационном периоде; чаще это были молодые женщины, с низкими дозами применяемых анестетиков, с эпизодами тахикардии и повышения АД в интраоперационном периоде, испытывающие чувство беспомощности и страха из-за невозможности двигаться, а также описывающие слуховые галлюцинации. Вместе с тем, 22% пациентов имели отдаленные психологические нарушения (Ghoneim М., 2009).
При невысокой, казалось бы, общей встречаемости, частота незапланированного пробуждения достигает 1% у хирургических больных с высоким риском подобных состояний, и в первую очередь это пациенты с низким сердечным выбросом и роженицы, родоразрешаемые путем операции Кесарево сечение. У данной категории пациентов возникает необходимость в применении уменьшенных до уровня «поверхностной анестезии» доз анестетиков (Mashour GA., 2012; Муles 2004; Rungreungvanich M., 2007).
Кроме этого, сохранение сознания в ходе анестезии и операции чаще отмечается у пациентов, имевших факт НЗП в анамнезе (Ghoneim M.M.
2007), пациентов более молодого возраста, включая детей (Leslie K., 2005; Blusse Van Oud-Alblas H.J., 2008; Davidson A.J., 2008; Errando C.L., 2008), у больных с более высокой оценкой физиологического статуса по классификации Американского общества анестезиологов (ASA) (Ahonen J., 2000). Среди прочих факторов риска — отказ оборудования, экстренные операции, случаи трудной интубации, ожирение (Schwender D.,1995; Ranta SO., 1998; Domino KB., 1999; Myles PS, 2000; Sandin RH, 2000; Lennmarken C., 2002), недостаточный уровень знаний о проблеме НВС (Ghoneim M.M.2007.) и, наконец, игнорирование мониторов глубины анестезии (O’Connor MF 2001; Ekman A, 2004).
Примером игнорирования мониторов глубины наркоза может служить следующее наблюдение. В 2014 году Королевский колледж анестезиологов и Ассоциация анестезиологов Великобритании и Ирландии провели 5-й национальный аудит по оценке частоты интраоперационного пробуждения во время общей анестезии. Выявленная частота «неполного бодрствования» во время седации ~ 1: 15 000 была сопоставима с таковой во время общей анестезии ~ 1: 19 000. Поразительным для исследователей открытием было то, что 75% незапланированных пробуждений длились около 5 мин, при этом 51% пациентов испытывали серьезный стресс (страх из-за осознания полного паралича всего тела, невозможность двигаться или позвать на помощь, боль, панику) и 41% из них имели отдаленные неблагоприятные последствия, что в 6% случаев привело к возникновению судебных исков против больниц. Не менее ярким результатом было признание предотвратимости интраоперационного бодрствования во время общей анестезии в 75% случаев. С учетом полученных данных Королевский колледж анестезиологов и Ассоциация анестезиологов Великобритании и Ирландии одобрили использование мониторинга глубины наркоза (Cook TM, 2014).
Однако результаты аудита Лондонской Академии Анестезиологии, проведенного в 2016г (данная работа приведена выше) показали, что мониторинг глубины наркоза, рекомендованный к применению по результатам национального исследования 2014г, использовался лишь у 9,4% больных; при этом отсутствовала своевременная реакция врачей на коррекцию доз анестетиков (у 73% пациентов, мониторируемых BIS, значения BIS индекса ниже 40 регистрировались в течение более 20 минут). Данная работа наглядно продемонстрировала, что несмотря на рекомендации, процент применения мониторинга глубины наркоза в Лондоне, даже при наличии соответствующего оборудования в клинике, остается низким, что ухудшало периоперационный период у пациентов старшей возрастной группы. В заключении авторы повторно рекомендуют использование мониторинга глубины наркоза при операциях у пожилых людей (Wickham А, 2016).
Список литературы Монитор глубины наркоза на основе технологии биспектрального индекса (BIS)
- Анестезиология. Национальное руководство. Под ред. Акад. РАМН А.А. Бунятяна, проф. В.М. Мизикова. Москва, ГЭОТАР-Медиа. 2011г. с. 278 - 279.
- Ивахненко Ю. И., Бабаев Б. Д., Острейков И. Ф. Изменения ЭЭГ и БИС индекса во время ингаляционной анестезии у детей. Общая реаниматология, 2011, VII, 3. С. 50-55.
- EDN: NYCJSN
- Келли С.Д. Мониторинг состояния сознания при проведении анестезии и седации. Руководство для врачей по использованию технологии Биспектрального Индекса. 2006г.
- Лазарев В.В., Цыпин Л.Е., Линькова Т.В., Кочкин В.С. BIS_мониторинг при индукции анестезии севофлураном у детей. Общая реаниматология 2009, V (5): 37-40.
- EDN: KYRUNF
- Ларионов И.Ю. Биспектральный индекс электроэнцефалограммы как метод контроля глубины общей анестезии у больных с термическими поражениями. Автореферат диссертации на соиск. канд. мед. наук. 2004г.
- EDN: NPXAET
- Пантеева О.Н. Динамика глубины анестезии и поддержание ее стабильности во время искусственного кровообращения. Автореферат диссертации на соиск. канд. мед. наук. 2011г.
- EDN: QFJWJX
- Патрушев А.Ю., Морозов В.В., Степанов А.В. Оценка адекватности анестезии при лапароскопических операциях с использованием биспектрального индекса // Фундаментальные исследования. - 2011. - № 11-1. - С. 86-89.
- EDN: OIGMCH
- Akçali D.T., Ozköse Z., Yardim S. Do we need bispectral index monitoring during total intravenous anesthesia for lumbar discectomies? Turk Neurosurg. 2008, 18(2): 125-33.
- Ahmad S., Yilmaz M., Marcus R.J., Glisson S., Kinsella A. Impact of bispectral index monitoring on fast tracking of gynecologic patients undergoing laparoscopic surgery. Anesthesiology. 2003, 98(4): 849-52.
- Ahonen J., Olkkola R.T., Hynynen M. et al.Comparison of alfentanil, fentanil and sufentanil for total intravenous anaesthesia with propofol in patients undergoing coronary artery bypass surgery. British Journal of Anaesthesia. 2000,85(4): 533-540.
- EDN: IMKUHR


