Морфобиологические особенности генеративных органов фертильных и стерильных растений свеклы столовой и их изменчивость в результате самоопыления (обзор)
Автор: Ветрова Светлана Александровна, Козарь Елена Георгиевна, Федорова Маргарита Ивановна
Журнал: Овощи России @vegetables
Рубрика: Селекция, семеноводство и биотехнология растений
Статья в выпуске: 3 (71), 2023 года.
Бесплатный доступ
Свекла считается сложным селекционным объектом, ввиду биологических особенностей, затрудняющих получение гибридного семенного потомства. У перекрестноопыляемых культур максимальная гибридность достигается при использовании стерильных материнских растений, которые в природе встречаются крайне редко. Одним из способов выделения из сложной гетерогенной популяции генотипов с цитоплазматической мужской стерильностью (ЦМС), которая контролируются рецессивными аллелями ядерных генов и S-фактором митохондриальной ДНК, является инбридинг. Основными отличительными признаками, позволяющими определить растения с мужской стерильностью, являются строение и окраска пыльников, и качественный состав пыльцы. Разнообразие фенотипического проявления маркерной окраски стерильных пыльников определяется соотношением различных пигментов. Разнокачественность пыльцевых зёрен фертильных и стерильных растений обусловлена отличиями их развития на поздних этапах андрогенеза. Степень стерилизации у разных генотипов варьирует, что связано со сложными регуляторными механизмами взаимодействия генетического аппарата ядра и цитоплазмы. Наряду с аномалиями микропопуляций пыльцевых зерен, при самоопылении возникают морфологические изменения в строении соцветий и числа органов цветков, что оказывает непосредственное влияние на семенную продуктивность растений. Обобщенные в данной публикации исследования актуальны и имеют существенное значение при выборе направления отбора в процессе создания новых селекционно-ценных биотипов.
Селекция, инбридинг, стерильность, самонесовместимость, репродуктивная система, микрогаметофит, гомозиготная линия
Короткий адрес: https://sciup.org/140300100
IDR: 140300100 | УДК: 635.11:631.527.51 | DOI: 10.18619/2072-9146-2023-3-16-23
Текст научной статьи Морфобиологические особенности генеративных органов фертильных и стерильных растений свеклы столовой и их изменчивость в результате самоопыления (обзор)
Forcitations:Vetrova S.A., Kozar Е.G., Fedorova M.I. Morphobiological features of generative organs of fertile and sterile table beet plants and their variability as a result of self-pollination (review). Vegetable crops of Russia. 2023;(3):16-23. (In Russ.)
Свекла столовая (Beta vulgaris L. subsp. vulgaris var. conditiva Alef.) является древнейшей традицион- ной овощной культурой в Российской Федерации и выращивается повсеместно. Не смотря на распространенность, считается сложным селекционным объектом, ввиду биологических особенностей, затрудняющих получение гибридного семенного потомства. У пере- крестноопыляемых культур, в том числе и у свеклы, максимальная гибридность достигается при использовании стерильных материнских растений, которые могут встречаться с различной частотой (0,03-6%) как в сортовых, так и в гибридных популяциях [1, 2].
Основным путём получения исходных стерильных форм является метод инбридинга, позволяющий получать гомозиготные линии и выявлять ценные признаки, имеющие рецессивные аллели [3-6]. Появление мужски стерильных растений свеклы при самоопылении, происходит в результате перехода ядерных генов XxZz в гомозиготное рецессивное состояние и их взаимодействия с S-цитоплазмой. Впервые стерильные растения на культуре сахарной свеклы обнаружил и описал Ф. Оуэн. Он показал, что растения со стерильной цитоплазмой в потомстве от самоопыления дают расщепление на полностью стерильные, частично стерильные и фертильные [7]. Намного позже, данное явление отмечено и на свекле столовой [2, 8]. Признак ЦМС на семенных растениях свеклы может проявляться по-разному: от отдельных стерильных пыльников в цветке до полностью стерильных растений, что обусловлено наличием двух типов митохондриальной ДНК (гетероплазмия), соответствующей N- и S-типам цитоплазмы [9]. В результате клеточных делений происходит перераспределение митохондрий и возникает разнокачественность тканей. В связи с чем, у свеклы столовой различают три типа растений, отличающихся по морфобиологическим признакам: фертильные (мф), частично-стерильные (чмс), стерильные (мс). Растения с признаком ЦМС в популяциях свеклы столовой встречаются с различной частотой в зависимости от происхождения. В условиях Московской области в сортовых популяциях отмечено от 9 до 12% частично-стерильных растений, в гибридных популяциях иностранного происхождения – 11-25%, а полную стерильность имеют только единичные растения. В инбредных потомствах наблюдается различный характер наследования и фенотипического проявления признака ЦМС, изменяется диапазон варьирования основных признаков и степени стерильности семенных растений, появляются мс-формы, увеличивается или снижается их доля [8]. Главными отличительными признаками, позволяющими определить в популяциях свеклы столовой растения с мужской стерильностью, является строение и окраска пыльников, и качественный состав пыльцы.
Особенности развития мужского гаметофита инбредных растений свеклы столовой с разной степенью стерильности
Формирование мужского гаметофита свеклы происходит в результате дифференциации и специализации тканей микроспорангия, пыльника и тычинок. В начале своего развития пыльник у свеклы одногнездный, состоящий из меристематической ткани, покрытой эпидермисом. Позднее формируется связник, разделяющий пыльник на две теки, каждая из которых содержит по два гнезда - микроспорангия [10, 11]. Перед цветением пыльники видоизменяются: становятся двугнёздными, на границе бывших гнезд образуются замковые клетки, соединенные тонкой перемычкой. В этом месте пыльник растрескивается в момент цветения [12].
В цветках типичных фертильных растений пыльники крупные (h=0,7-1,0мм), выпуклой формы, от бледно- до ярко-желтых, быстро растрескивающиеся при созревании, и продуцирующие большое количество жизнеспособной пыльцы (рис. 1 А). В соцветиях частично-стерильных растений наряду с фертильными в различном соотношении присутствуют цветки с полностью или фрагментально-окрашенными пыльниками (преимущественно бордовыми или розовыми), содержащие большое количество стерильной пыльцы диаметром 15-18мкм. А также пыльники, окрашенные только в зоне связника, в которых наряду со стерильными, в небольшом количестве встречаются жизнеспособные пыльцевые зерна (рис. 1 В). Соотношение стерильной и фертильной пыльцы может меняться под влиянием условий среды. При этом с увеличением степени стерильности растений уменьшаются диаметр и жизнеспособность фертильной пыльцы мф-цветков (r = -0,84 и r = -0,88 соответственно), снижается скорость роста пыльцевой трубки (r = -0,85). Пыльники в цветках полностью сте-

Рис. 1. Фертильные (мф) (А), частично-стерильные (чмс) (В) и стерильные (мс) соцветия и пыльники (С) свёклы столовой (авторский)
Fig. 1. Fertile (mf) (A), partially sterile (hms) (B) and sterile (ms) inflorescences and anthers (C) of table beets
рильных растений обычно щуплые, часто вогнутой формы, прозрачные или полностью окрашенные (от розового до коричневого цвета), в большинстве случаев пустые, иногда с малым количеством смятой, деформированной пыльцы, в виде обрывков оболочек пыльцевых зерен (рис. 1 С). В период цветения пыльники не растрескиваются [13].
У свеклы, как и у многих покрытосеменных растений, процесс формирования пыльника состоит из трех этапов: премейотический, мейотический и постмейотиче-ский [10, 14]. Разнокачественность пыльцевых зёрен мф- и мс-пыльников свёклы столовой определяется поздними этапами их развития. У фертильных растений, в результате развития мужского гаметофита, формируются трёхклеточные пыльцевые зерна ярко-желтой окраски, диаметром 20-23 мкм, с хорошо развитой экзиной и большим количеством пор для выхода пыльцевых трубок. Микроспоры содержат питательные вещества, ферменты, каротиноиды и т.д.
У растений с признаком ЦМС, как и у фертильных, на ранних этапах развития стенки пыльника состоят из эпидермиса, эндотеция, двух средних слоёв и тапетума. Затем, в период мейоза, клетки тапетума увеличиваются, формируются многоядерные клетки или наблюдается появление вакуолей. При выходе микроспор из тетрад происходит отслоение тапетума от остальных клеток пыльника, с дальнейшим образованием периплазмодия с большим числом крупных ядер [15-18]. В результате неспособности периплазмодия поставлять питательные вещества, необходимые для нормального развития пыльцы, и механического воздействия на микроспоры, происходит их дегенерация [18, 19]. Разрушение периплазмодия наблюдается после начала дегенерации микроспор, сопровождается сильной вакуолизацией, и приводит к постепенному сжатию содержимого пыльника. В последствии, у стерильных форм наблюдается резкое отставание роста микроспор сразу после окончания мейоза. Величина их обычно не превышает 9-10мк. Они не формируют экзины, их оболочка остается тонкой и прозрачной (рис. 2 А). При нарушении формирования пыльцевых зерен на более поздних стадиях развития, в стерильных микроспорах видны следы дегенерации: вакуолизация, сжатие цитоплазмы, деформация ядра (рис. 2 В). При этом, степень стерилизации у разных генотипов варьирует, что связано с регуляторными механизмами генетического аппарата [20].
Фенотипическое многообразие проявления ЦМС у мс-пыльников свеклы столовой обусловлено, в том числе, и соотношением различных пигментов: беталаинов (БТН), бетаксантинов (БКС), каротиноидов (КР) и хлорофиллов (ХЛ). В равномерно окрашенных мс-пыль-никах содержание БТН почти в четыре раза выше, чем в мф-пыльниках и сравнимо с уровнем его накопления в корнеплодах. Содержание БКС, напротив, в таких пыльниках снижено, по сравнению с фрагментально-окра-шенными, в которых уровень накопления БКС сравним с фертильными пыльниками, и вдвое выше, чем в корнеплодах. Суммарное содержание КР в мс-пыльниках в два раза меньше относительно мф-пыльников, причем наиболее низкое их количество зафиксировано в пыльниках с бордовым связником. Содержание суммы ХЛ в мс-пыльниках свеклы столовой в несколько раз выше, чем в мф-пыльниках, хотя отношение хлорофиллов «а» к «b» такое же, и близко 1:1. То есть, оттенок и интенсивность окрашивания отдельных частей мс-пыльника в момент раскрытия цветка, по-видимому, обусловлены стадией нарушения гаметогенеза, на которой происходит перенастройка биохимических процессов синтеза и накопления пигментов [21].
С другой стороны, причиной появления растений с окрашенными пыльниками может являться модификационная изменчивость, возникающая в результате реакции генотипов на стрессовые условия [22-25]. В частности, нетипичные условия (высокая температура и влажность воздуха) в изоляторах, при получении инбредных потомств [1]. Под воздействием этих факторов, растение «перестраивается», становится однополым, функционально-женским, хорошо воспринимающим пыльцу. Изменение условий приводит к восстановлению фертильности таких растений и, хотя большинство растений свёклы склонны к самонесовместимости, при самоопылении они способны завязывать семена. Еще одним фактором изменчивости является инбредная депрессия, которая имеет разную степень выраженности, и так же зависит от условий окружающей среды [26, 27, 28, 29].
В связи с этим обязательным условием при создании мс- и мф-линий для селекции свеклы столовой является регулярный визуальный мониторинг развития репродуктивных органов семенных растений и проверка пыльцы на фертильность-стерильность в динамике, чтобы исключить из работы формы с проявлением мужской стерильности, обусловленной модификационной изменчивостью под влиянием внешних факторов.
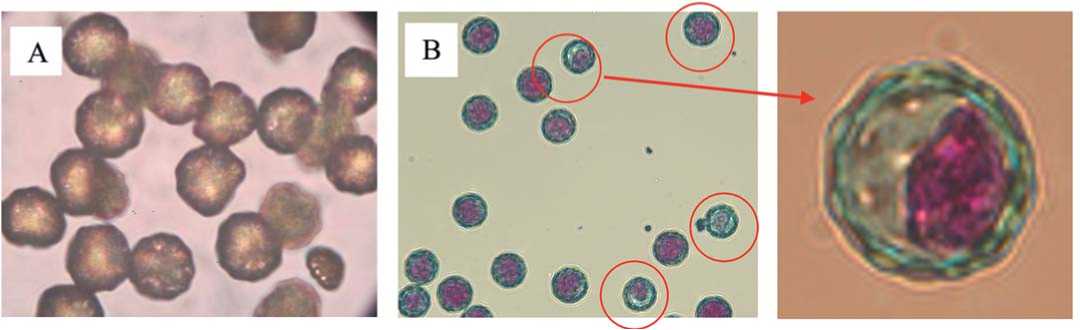
Рис. 2. Стерильные пыльцевые зерна свеклы столовой:
А - мелкие, с тонкой оболочкой; В - обедненные цитоплазмой (авторский)
Fig. 2. Sterile pollen grains of table beet: A - small, with thin shell; B - depleted in cytoplasm
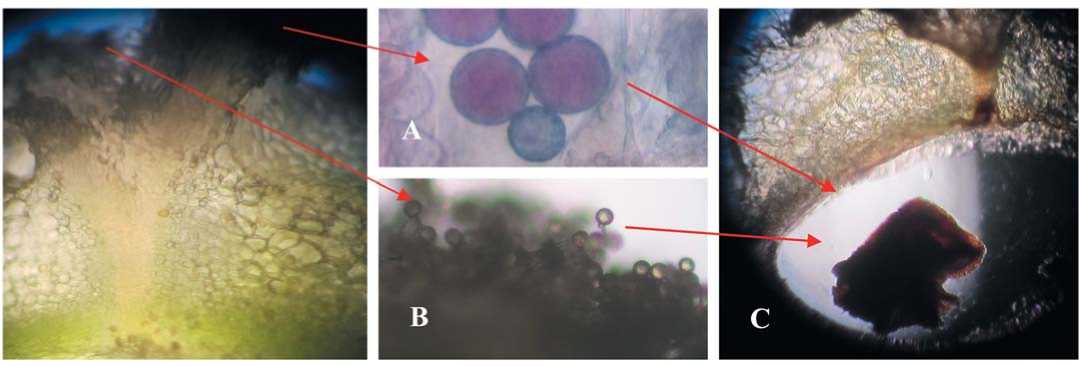
Рис. 3. Продольный срез цветка самонесовместимого растения свеклы столовой:
А - отсутствие прорастания пыльцевых зерен на поверхности рыльца;
В - пыльцевые зерна, формирующие укороченные деформированные пыльцевые трубки; С - неоплодотворенный семязачаток (авторский)
Fig. 3. Longitudinal section of the flower of a self-incompatible table beet plant:
A - absence of germination of pollen grains on the surface of stigma;
B - pollen grains forming shortened deformed pollen tubes; C - unfertilized ovule
Самонесовместимость и изменчивость репродуктивных органов растений свеклы столовой при инбридинге
Свекла – однодомное растение, формирующее на цветоносных побегах гермафродитные цветки, которые репродуцируют семенное потомство в результате перекрестного или самооплодотворения. Однако ввиду того, что самооплодотворение в обоеполых цветках свеклы предотвращается системой генов самоне-совместимости, эту культуру считают типичным пере-крестником [30]. В результате изучения роста пыльцевых трубок в тканях пестика при самоопылении показано, что реакция несовместимости у растений свеклы локализована в тканях рыльца, либо в паренхимном слое завязи, в зоне отложения кристаллов оксалата кальция, что характерно для видов с гаметофитным контролем несовместимости.
В этом случае ингибитор роста активируется при совпадении мономеров собственной пыльцы и пестика непосредственно на рыльце, что вызывает торможение прорастания пыльцевых зерен в течение первых суток, либо образование коротких утолщенных пыльцевых трубок со вздутиями на конце (рис. 3 А, В). Иногда наблюдаются очень тонкие пыльцевые трубки, часто растущие только до слоя кристаллов оксалата кальция, а затем продолжают свой рост в обратном направлении [31-34].
Реакция несовместимости у свеклы проявляется длительно, даже на восьмой день вся поверхность рыльца бывает покрыта многочисленными изогнутыми пыльцевыми трубками. Аномалии при прорастании пыльцы и росте пыльцевых трубок при принудительном самоопылении, напоминают таковое при межвидовой гибридизации. Отдельные пыльцевые трубки, растущие по направлению к завязи, часто образуют боковые выросты, булавовидные утолщения, изгибы, и достигнув семязачатка поворачивают в обратном направлении. В связи с отсутствием оплодотворения отмечается отставание в развитии и дальнейшая гибель семязачатка (рис. 3 С). Сравнительное изучение эмбриогенеза и формирования семени при самоопылении показало, что дегенерация зародышей и семян у самостерильных линий может наблюдаться на разных стадиях развития [33, 35].
В популяциях свеклы наряду с самонесовместимыми растениями, доля которых может достигать 50% и более, присутствуют и самосовместимые, пыльцевые зерна которых при самоопылении прорастают в массовом количестве. При этом пыльцевые трубки растут сначала в направлении прохода в завязь, а затем вдоль семязачатка. Около микропилярного отверстия семязачатка пыльцевые трубки часто скручиваются, после чего одна из них проникает в зародышевый мешок (рис. 4) [36, 37].
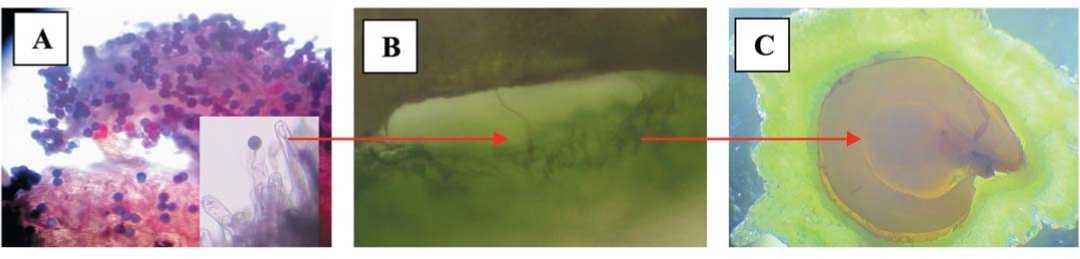
Рис. 4. Проросшие пыльцевые зерна на рыльце пестика самосовместимых растений свеклы столовой (А); проникновение пыльцевой трубки в зародышевый мешок (В); нормально развитый зародыш семени (С) (авторский)
Fig. 4.Germinated pollen grains on the stigma of self-compatible table beet plants (A); penetration of pollen tube into the germinal sac (B); normally developed seed embryo (C)
Последовательное самоопыление оказывает негативное влияние на фертильность пыльцевых зерен инбредных потомств, которая в свою очередь зависит от генотипа инбредных растений [2, 8, 13, 37]. Фертильность пыльцы самосовместимых растений в первых поколениях инбридинга снижается значительно медленнее, чем в потомствах самонесовме-стимых растений, у которых в процессе гаметогенеза резко возрастает число аномалий при развитии пыльцевых зерен, ведущих к стерилизации микрогаметофита. Наряду с тетрадами микроспор формируются монады, диады, триады, пентады. Микроспороциты диад и триад включают в себя по два, а иногда по три ядра, что приводит в дальнейшем к формированию пыльцевых зерен намного крупнее обычных.В тех случаях,когда цитокинез не заканчивается, происходит формирование стерильных микроспор [1].
Помимо стерилизации пыльцы в процессе инбред-ного размножения фертильных растений в пыльниках наряду с нормальными пыльцевыми зернами встречаются микроспоры, обедненные цитоплазмой, сильно вакуолизированные и часто имеющие несколько ядер, не дифференцированных на вегетативные и генеративные. Также в популяциях микроспор отмечено присутствие конгломератов и цепочек из соединенных 2-4 пыльцевых зерен, по-видимому, образованных в результате отсутствия процесса распада тетрад на отдельные микроспоры. Данное явление охарактеризовано как своеобразная цитологиче- ская мутация, получившая название «accreting pollen», т.е. сросшаяся пыльца [38].
В результате самоопыления наряду с аномалиями микропопуляций пыльцевых зерен, наблюдаются морфологические изменения в строении соцветий и изменчивость числа органов цветков.На отдельных растениях свеклы столовой зафиксировано увеличение числа чашелистиков и тычинок до 6-7 штук, лопастей рыльца до 4-6 с различной степенью опушения. Кроме этого,отмечено срастание пыльников,как в стерильных, так и в фертильных цветках (рис. 5 А, В). В инбредных потомствах присутствуют растения с фасциированными стеблями соцветий,на которых формируются единичные бутоны в пазухах густо расположенных прицветников. На ветвях соцветия отдельных частично-стерильных растений, полученных в результате самоопыления, в пазухах прицветников вместо сидячих цветков могут формироваться дополнительные боковые веточки с редкими стерильными или фертильными цветками (рис. 5 С). В результате, как в первом, так и во втором случае растения имеют очень низкую семенную продуктивность.
Изменчивость морфобиологических признаков семенных растений свеклы при инбридинге
Семенные растения свеклы столовой разнообразны и сложны по архитектонике. Фертильные семенные растения свеклы столовой составляют большую часть

Рис. 5. Возможные изменения морфологических признаков цветка (А);
пестика (В); стеблей соцветия (С) свеклы столовой при самоопылении (авторский)
Fig. 5. Possible changes in morphological features of flower (A);
pistil (B); inflorescence stems (C) of table beet during self-pollination
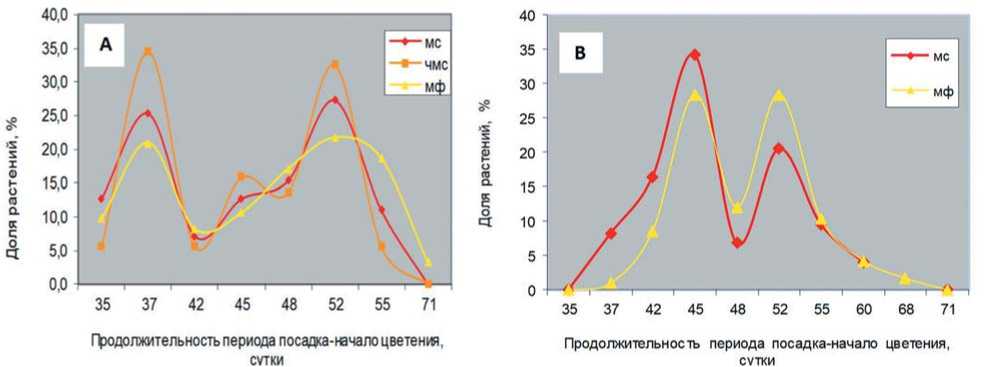
Рис. 6. Структура отдельных выборок фертильных, частично-стерильных, полностью стерильных растений по продолжительности периода «посадка маточников – бутонизация» (А - исходные популяции; В – инбредные потомства) (авторский)
Fig. 6. Structure of individual samples of fertile, partially sterile, and completely sterile plants by duration of "planting of uteri - budding" period (A - initial populations; B - inbred progenies)
исходных популяций, и могут быть маловетвистыми с ярко выраженным центральным побегом и многоветвистыми, имеющими побеги замещения с различной силой роста и развития. Изменчивость растений в пределах потомств по данному признаку, не зависимо от поколения инбридинга,значительная и составляет более 50%, при этом большинство растений формируют от 6 до 10 стеблей диаметром 1,4-1,6см, и лишь небольшая часть (около 30%) более 10 стеблей. В зависимости от угла отхождения ветвей первого и второго порядка по отношению к центральному стеблю семенные растения могут быть компактными (прямостоячими) или раскидистыми. Строение куста определяет его высоту, которая в пределах популяции варьирует от 90 до 175 см. По строению семенного куста частично-стерильные растения практически не отличаются от фертильных. Полностью стерильные растения в равных соотношениях формируют 6-10 и более 10 стеблей, диаметром 1,0-1,3 см [39].
Габитус семенного куста свеклы столовой во многом определяется скороспелостью, размером маточников и их строением,режимом зимнего хранения и в меньшей степени наследственностью. Есть мнение, что наиболее скороспелые растения характеризуются компактным строением куста [40]. В результате фенологических наблюдений показано, что в исходных популяциях свеклы столовой большинство растений с различным проявлением признака ЦМС вступают в фазу «начало цветения» на 38 и 52 сутки после посадки (рис. 6 А).
Среди фертильных, встречаются отдельные, наиболее позднеспелые растения, вступившие в фазу «начало цветения» на 71 сутки. Такие растения отличаются крупным габитусом куста и формируют большое число (до 20) сильнооблиственных стеблей. При дальнейшем инбридинге, как у стерильных, так и у фертильных растений, наблюдается также два пика начала цветения, но с меньшей разницей между ними: на 45 и 52 сутки (рис. 6 В). При этом, как и в исходных популяциях, наиболее позднеспелые биотипы встречаются в группе фертильных растений (зацветают на 68 сутки) [39, 41].
Заключение
Таким образом, в процессе инбридинга перекрест-ноопыляемых культур, в частности свеклы столовой, селекционер имеет дело с различной изменчивостью, обусловленной рядом факторов. В результате, появляются новые формы, отличные от типичных, изучение которых дает возможность оценить их ценность в зависимости от направления использования в селекционном процессе при создании сортов и гибридов. Это полностью стерильные ЦМС-формы и само-совместимые фертильные формы, продуцирующие большое количество жизнеспособной пыльцы и завязывающие семена при самоопылении.При выделении стерильных форм помимо использования маркерной окраски пыльников важно проводить лабораторный анализ пыльцы на фертильность-стерильность в динамике и исключать из работы формы с проявлением модификационной мужской стерильности под влиянием внешних факторов.
Использование метода рекуррентной селекции по способности завязывать семена при самоопылении повышает выход форм с потенциально высокой само-совместимостью в потомстве. Тем не менее, у фертильных форм репродуктивная способность при самоопылении зависит также от уровня инбредной депрессии, которая влияет на формирование микрогаметофита и зародыша семени, вызывает появление форм с аномалиями в развитии репродуктивных органов, которые исключаются из селекционного процесса.
В настоящее время в «Федеральном научном центре овощеводства» создана коллекция линейного материала свёклы столовой с различной степенью стерильности и сочетанием хозяйственно-значимых признаков. Однако, учитывая сложность получения константных линий для селекции на гетерозис, и ввиду того, что исследования на культуре свеклы столовой в данном направлении немногочисленны, существует необходимость разработки и включения современных молекулярных методов, для поиска форм с требуемым сочетанием генов ядра и цитоплазмы для ускорения и повышения результативности селекционного процесса.
Об авторах:
Светлана Александровна Ветрова – кандидат с.-х. наук, старший научный сотрудник лаборатории молекулярно-иммунологических исследований, , автор ля переписки, HYPERLINK ""
Aboutthe Authors:
Svetlana A. Vetrova – Cand. Sci. (Agriculture),
Senior Researcher of the Laboratory molecular immunological research, ,
Еlena G. Kozar – Cand. Sci. (Agriculture),
leading researcher head of the laboratory molecular immunological research, ,
MargaritaI. Fedorova – Dr. Sci. (Agriculture), professor,
Principal Scientist of the laboratory of breeding and seed production of table root crops, ,
Список литературы Морфобиологические особенности генеративных органов фертильных и стерильных растений свеклы столовой и их изменчивость в результате самоопыления (обзор)
- Балков И.Я. Селекция сахарной свеклы на гетерозис. Москва: 1990.
- Заячковский В.А., Старцев В.И., Балашова Н.Н. Разработка элементов гетерозисной селекции столовой свеклы. Гавриш. 1999;(3):24-25.
- Вавилов Н.И. Ботанико-географические основы селекции. Москва: Государственное издательство сельскохозяйственной литературы;1935.
- Budar F., Berthomé R. Cytoplasmic male sterilities and mitochondrial gene mutations in plants. Plant Mitochondria. 2007;(31):278–307. DOI:10.1002/9780470986592.ch9
- Буренин В.И. Использование инбридинга у свеклы. Сахарная свекла. 2015;(1):11-14. EDN UGALVV.
- McGrath J.M., Panella L. Sugar Beet Breeding. In: Goldman I. Plant Breeding Reviews. 2018;(42):167-218. DOI: 10.1002/9781119521358.ch5
- Owen F.V. Intheritance of cross- and self-sterility and self-fertility in Beta vulgaris L. Journal of Agricuitural Research. 1942;(64):679-698.
- Федорова М.И., Ветрова С.А., Козарь Е.Г. Особенности фенотипического проявления признака ЦМС семенных растений свёклы столовой. Овощи России. 2011;(3):18-23. https://doi.org/10.18619/2072-9146-2011-3-18-23. EDN OZMDRD.
- Малецкий С.И. Варьирование цитоплaзматически контролируемой стерильности пыльцы у сахарной свеклы (Bets vulgaris L.) и ее связь с гетероплазмией митохондрий в клетках. Генетика. 1995;31(11):1461-1467.
- Жужжалова Т.П., Знаменская В.В., Подвигина О.А., Ярмолюк Г.И. Репродуктивная биология сахарной свеклы. Воронеж: 2007.
- Зайковская Н.Э. Биология цветения, цитология и эмбриология сахарной свеклы. Биология и селекция сахарной свеклы. Москва; Колос: 1968.
- Жужжалова Т.П. Репродуктивная биология свеклы (цитология и эмбриология). Эмбриология сахарной свёклы. Развитие мужского гаметофита. В: Малецкий С.И., редактор. Энциклопедия рода Beta: биология, генетика и селекция свеклы. Новосибирск: ООО «Издательство Сова»; 2010: 87.
- Fedorova M.I., Kozar E.G., Vetrova S.A., Zayachkovskyi V.A., Stepanov V.A. Factors to affect inbred beet plants while developing material for linear selection. Vavilov Journal of Genetics and Breeding. 2019;4(23):439-447. DOI 10.18699/VJ19.512. EDN KFNMAT.
- Купцов Н.С. Ультраструктура клеток тычинки фертильной и стерильной (ЦМС) форм сахарной свеклы разного уровня плоидности. Исследования по теоретической и прикладной генетике. Минск: Наука и техника; 1975.
- Artschwager E. Pollen degeneration in male sterile sugar beet with special reference to the tapetal plasmodium. Journal of Agricultural Research. 1947;75(7/8):191-197.
- Brooks J., Brooks M., Chien L. The anther tapetum in cytoplasmicgenetic male sterile Sorghum. American Journal of Botany.1966;53(9):902-907. DOI:10.2307/2439813
- Зайковская Н.Э., Жужжалова Т.П. Развитие пыльцевых трубок у самофертильных и самостерильных линий сахарной свеклы при изоляции. Цитология и генетика. 1976;10(1):57-61.
- Голубева Е.А. Развитие пыльников фертильных и стерильных растений сахарной свеклы. Труды по прикладной ботанике генетике и селекции. 1983;(74):56-64.
- Rohrbach U. Beiträge zum Problem der Pollensterilität bei B. vulgaris L. I. Untersuchungen űber die Ontogenese des Phänotyps. Pflancenzűcht. 1965;53(2):105-124.
- Matsuhira H., Shinada H., YuiKurino R., Hamato N., Umeda M., Mikami T. at al. An anther-specific lipid transfer protein gene in sugar beet: its expression is strongly reduced in male-sterile plants with Owen cytoplasm. Physiologia Plantarum. 2007;(129):407–414. DOI:10.1111/j.1399-3054.2006.00813.x
- Козарь Е.Г., Фёдорова М.И., Ветрова С.А., Заячковский В.А. Связь пигментного состава с маркерной окраской стерильных пыльников ЦМС растений свеклы столовой. Новые и нетрадиционные растения и перспективы их использования. 2015;(11):221-225.
- Norman J. K., Sakai A.K., Weller S.G., Dawson T. E. Inbreeding depression in morphological and physiological traits of Schiedea lydgatei (Caryophyllaceae) in two environments. Evolution. 1995;(49):297–306. DOI:10.2307/2410340
- 23.Crnokrak P, Roff D. A. Inbreeding depression in the wild. Heredity. 1999;(83):260-270. DOI:10.1038/sj.hdy.6885530
- Kristensen T. N., Dahlgaard J., Loeschcke V. Effects of inbreeding and environmental stress on fitness - using Drosophila buzzatii as a model organism. Conservation Genetics. 2003;(4):453–465. DOI:10.1023/A:1024763013798
- Armbruster P., Reed D. Inbreeding depression in benign and stressful environments. Heredity. 2005;(95):235-242. DOI:10.1038/sj.hdy.6800721
- Souza C.L., Fernandes J.S. Predicting the range of inbreeding depression of inbred lines in cross-pollinated populations. Brazilian Journal of Genetics. 1997;20(1):e3790. DOI:10.1590/S0100-84551997000100007
- Cheptou P., Donohue K. Environment-dependent inbreeding depression: its ecological and evolutionary significance. New Phytologist. 2011;189(2):395–407. DOI:10.1111/j.1469-8137.2010.03541.x
- Angeloni F., Ouborg N., Leimu R. Meta-analysis on the association of population size and life history with inbreeding depression in plants. Biological Conservation. 2011;(144):35-43. DOI:10.1016/j.biocon.2010.08.016
- Cheptou P.O., Imbert E., Lepart J., Escarre J. Effects of competition on lifetime estimates of inbreeding depression in the outcrossing plant Crepis sancta (Asteraceae). Journal of Evolutionary Biology. 2000;13(3):522-531.
- Малецкий С.И. Репродуктивная биология свеклы (цитология и эмбриология). Семенное размножение сахарной свеклы. В: Малецкий С.И., редактор. Энциклопедия рода Beta: биология, генетика и селекция свеклы. Новосибирск: ООО «Издательство Сова»; 2010: 52 с.
- Жужжалова Т.П. Репродуктивная биология свеклы (цитология и эмбриология). Влияние инбридинга на формирование генеративных органов сахарной свеклы. В: Малецкий С.И., редактор. Энциклопедия рода Beta: биология, генетика и селекция свеклы. Новосибирск: ООО «Издательство Сова»; 2010: 164 с.
- Entani T., Iwano M., Shiba H., Che FS, Isogai A., Takayama S. Comparative analysis of the self-incompatibility (S-) locus region of Prunus mume: identification of a pollen-expressed F-box gene with allelic diversity. Genes Cells. 2003;8(3):203-213. DOI: 10.1046/j.1365-2443.2003.00626.x
- Yamane H., Ikeda K., Ushijima K., Sassa H., Tao R. A pollenexpressed gene for a novel protein with an F-box motif that is very tightly linked to a gene for S-RNase in two species of cherry, Prunus cerasus and P. avium. Plant and Cell Physiology. 2003;44(7):764-769. DOI:10.1093/pcp/pcg088
- Kubo KI, Entani T., Takara A, Wang N., Fields AM, Hua Z. et al. Collaborative non-self recognition system in S-RNase-based self-incompatibility. Science. 2010;330(6005):796-799. DOI:10.1126/science.1195243
- Малецкий С.И., Коновалов А.А. Внутривидовая само- и перекрестная несовместимость. Генетический контроль размножения сахарной свеклы. Новосибирск: Наука; 1991.
- Логвинов В.А., Красильников Е.А., Волгин В.В., Логвинова А.П., Кудрявцева Н.В. Самосовместимость сахарной свеклы в процессе инбридинга. Сельскохозяйственная биология растений. 1993;(3):22-25.
- Корнеева М.А., Власюк Н.В. Влияние инбридинга на качество пыльцы опылителей сахарной свеклы разной степени гетерозиготности. Актуальные проблемы генетики. 2003;(1):106-107.
- Сеилова Л.Б., Абдурахманов А.А., Бияшев Т.З. Мутация, приводящая к образованию тетрад пыльцевых зерен у сахарной свеклы. Цитология и генетика. 1986;22(5):62-63.
- Ветрова С.А. Оценка и отбор исходного материала для селекции на гетерозис свёклы столовой (Beta vulgaris L.). Автореферат диссертации канд. с.-х. наук. Москва, 2011.
- Еременко Л.Л. Морфологические особенности овощных растений в связи с семенной продуктивностью. Новосибирск: Наука; 1975.
- Ветрова С.А., Козарь Е.Г., Федорова М.И. Ускорение селекционного процесса для создания линейного материала свеклы столовой. Овощи России. 2019;(1):29-36. https://doi.org/10.18619/2072-9146-2019-1-29-36. EDN FHKSEP.


