Морфофизиологические изменения у пшеницы (Triticum vulgare L.) под влиянием наночастиц металлов (Fe, Cu, Ni) и их оксидов (Fe3O4, CuO, NiO)
Автор: Короткова А.М., Лебедев С.В., Каюмов Ф.Г., Сизова Е.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Биоэффекты металлов и их форм
Статья в выпуске: 1 т.52, 2017 года.
Бесплатный доступ
В последние десятилетия развитие нанотехнологий привело к необходимости тщательно исследовать безопасность ультрадисперсных металлов. Известно, что многие из них обладают прооксидантными и токсическими эффектами в отношении различных организмов. В то же время данные по сравнению биологической активности наночастиц металлов и их оксидов на растения отсутствуют. Нами впервые комплексно изучено воздействие сферических наночастиц (НЧ) железа Fe0, магнетита Fe3O4, меди Cu0 и оксида меди CuO, никеля Ni0 и оксида никеля NiO в различных концентрациях на рост, содержание пигментов и перекисное окисление липидов у проростков пшеницы обыкновенной ( Triticumvulgarе L.). Семена пшеницы дезинфицировали, промывали и помещали на подложку из фильтровальной бумаги в пластиковые чашки Петри по 20 шт. на расстоянии не менее 0,5-1,5 см друг от друга. На 3-и сут в чашки вносили по 5 мл наночастиц металлов и их оксидов (концентрации по металлу от 0,0125 до 1,0 М). На 5-е сут после прорыва колеоптиля оценивали физиолого-биохимические показатели. У 10 проростков измеряли длину 1-го листа (от основания до апекса главного листа) и главного корня (от корневой шейки до кончика главного корня). По 3 растения из каждого варианта отбирали для определения содержания фотосинтетических пигментов (ФП) и оценки окислительного стресса. Анализ метрических характеристик показал, что чувствительность проростков пшеницы к наночастицам чистых металлов Cu0 и Ni0 была гораздо выше, чем к наночастицам их оксидов (CuO, NiO). В изучаемом диапазоне концентраций наночастицы CuO и NiO не вызывали летального эффекта, несмотря на существенное (более чем в 2 раза) снижение большинства ростовых показателей. В низких концентрациях (менее 0,05 М) наночастицы Fe0 и Fe3O4 достоверно стимулировали рост проростков по сравнению с контролем. Напротив, в присутствии наночастиц Cu0 и CuO, Ni0 и NiO развивался токсический эффект, который усиливался с возрастанием концентрации металла. У корневой системы как первой мишени обнаружена высокая чувствительность к НЧ металлов. Добавление наночастиц Cu0, CuO, Ni0 и NiO подавляло рост корня соответственно в 19,0; 7,4; 4,8 и 2,2 раза. По возрастанию способности ингибировать рост главного корня и 1-го листа наночастицы расположили в следующем порядке: Fe3O4→Fe0→NiO→CuO→Ni0→Cu0. Положительное воздействие НЧ Fe0 и НЧ Fe3O4 на содержание пигментов было в целом сильнее и стабильнее, чем у наноматериалов на основе Сu и Ni. После инкубации с металлами в концентрации менее 0,05 М зеленая окраска проростков не только сохранялась, но даже отмечался стимулирующий эффект. На содержание хлорофилла a наиболее сильное отрицательное влияние оказывали НЧ Cu0 (снижение относительно контроля на 22,0-33,0 %), хлорофилла b - НЧ Ni0 (на 16,0-68,0 %). Эффект от воздействия НЧ CuO на состояние пигментного комплекса был дозозависимым: статистически значимое снижение содержания хлорофилла а отмечали в вариантах 0,054; 0,1 и 0,5 М (на 9,0-21,5 %), хлорофилла b - в вариантах 0,0125 и 0,025 М (на 4,0-15,0 %). НЧ NiО не оказывали существенного угнетающего действия на хлорофиллы (снижение содержания всего на 8,7 %). Каротиноиды в листьях проростков T. vulgare оказались менее чувствительными к наночастицам металлов по сравнению с хлорофиллами. В присутствии наночастиц содержание МДА изменялось в корнях в большей степени, чем в листьях. Влияние некоторых наночастиц, особенно Ni0, Сu0 и CuO, способствовало достоверному повышению количества МДА в корневой части растений - соответственно на 17,0, 25,0 и 18,7 %. Действие наночастиц Fe0, Fe3O4 и NiО практически не приводило к изменению этого показателя, а НЧ Fe3O4 снижали его на 30,0 %. Таким образом, наночастицы металлов и их оксидов избирательно влияют на метаболические реакции и проявляют различную биологическую активность в зависимости от состава металлов и используемой концентрации.
Наночастицы металлов, показатели роста, фотосинтетические пигменты, малоновый диальдегид, перекисное окисление липидов
Короткий адрес: https://sciup.org/142214008
IDR: 142214008 | УДК: 633.11:581.1:546.30-022.532 | DOI: 10.15389/agrobiology.2017.1.172rus
Текст научной статьи Морфофизиологические изменения у пшеницы (Triticum vulgare L.) под влиянием наночастиц металлов (Fe, Cu, Ni) и их оксидов (Fe3O4, CuO, NiO)
Несмотря на многоуровневую внутриклеточную защиту клеток от стресса, под действием неблагоприятных факторов повышается концен-
∗ Исследования выполнены при финансовой поддержке Российского научного фонда (проект ¹ 14-36-00023).
трация активных форм кислорода (АФК) и запускается каскадный механизм окислительного стресса, приводящего к деструкции жизненно важных клеточных компонентов и к гибели клеток. Растения постоянно подвергаются воздействию АФК, особенно в присутствии наночастиц (НЧ) металлов (1). Большинство видов обладают способностью адаптироваться к НЧ металлов, используя различные механизмы (2). Однако их недостаточно для того, чтобы предотвратить окислительный стресс и проявление цито- и генотоксических эффектов.
Показано, что наночастицы Cu0 в высокой концентрации (1000 мг/л) отрицательно влияют на рост проростков фасоли, проникают через клеточную мембрану и образуют агрегаты с клеточными компонентами (3). Наночастицы, содержащие Cu0 и Cu2O, могут блокировать водные каналы посредством адсорбции и увеличивать поступление АФК в корни лука, что, в свою очередь, нарушает деление и клеточный метаболизм (4). В тесте с Triticum aestivum было описано ингибирование роста побегов после воздействия разыми концентрациями НЧ Cu0 (5). При этом отмечалось, что по мере повышения концентрации НЧ Cu0 и их агломератов скорость биоаккумуляции этого элемента в растениях возрастала.
Ранее мы сравнили влияние НЧ Fe0 (диаметр 80±5 нм), НЧ Fe3O4 (ширина 50-80 нм, высота 4-10 нм) и раствора FeSO4 (II) на растения пшеницы обыкновенной ( Triticum vulgare L.) (6). При этом наибольшую чувствительность (снижение всхожести семян, подавление роста листьев и уменьшение количества пигментов у проростков) регистрировали при увеличении концентрации сульфата железа (II) в среде, а между эффектами наночастиц отмечались различия: на всхожесть сильнее влияли НЧ Fe0, а на длину листьев и сумму пигментов — НЧ Fe3О4.
Токсичность водорастворимых наночастиц металлов связывают прежде всего с высоким редокс-потенциалом ионов и окислением биологических молекул. Наиболее важным фактором служит способность наночастиц индуцировать окислительный стресс, то есть генерировать АФК (7). При изучении окислительных повреждений клеток растений после обработки НЧ CuO было установлено, что эффект проявляется не у ионов меди, а именно у ее оксида из-за его ограниченной растворимости в питательной среде (8). В корнях растений томата после инкубации с НЧ NiO обнаружили высокий пул АФК и усиление перекисного окисления липидов (на 39,3-49,5 % относительно контроля) в протопласте (9). При этом не удалось различить окислительную индукцию оксидом NiO и ионами никеля, поскольку в клетках корня присутствовали оба эти вещества. Было высказано предположение, что у растений ионы Ni2+ генерируют HO •- радикал через цикл Хабера-Вейса.
В последние годы установлено, что окислительный стресс могут вызвать наночастицы многих металлов (серебра, золота, железа), ферритов, а также оксидов цинка, никеля, меди, железа, титана и кремния. При этом основное внимание сосредоточено на изучении поглощения нанометаллов и показателях роста растений после воздействия наночастиц металлов и их оксидов. Комплексных исследований, раскрывающих механизмы фитоток-сических свойств наночастиц переходных металлов (железа, меди и никеля) в сопоставлении с их оксидными формами, ранее не проводили.
В настоящей работе впервые представлен подход к сравнительной оценке токсичности наноформ на основе Fe, Cu и Ni с учетом не только морфологических признаков растений, но и таких важных физиологических маркеров стресса, как активность фотосинтетического аппарата и степень перекисного окисления липидов мембран.
Целью работы было изучение морфофизиологических показателей у проростков пшеницы в ответ на воздействие наночастиц железа, меди, никеля и оксидов этих металлов в различных концентрациях.
Методика. В исследованиях использовали коммерчески доступные сферические наночастицы железа Fe0, меди Cu0, никеля Ni0 и их оксидов Fe3О4, CuО и NiО, полученные методом электрического взрыва проводника в атмосфере аргона. Материаловедческая аттестация препаратов (размер частиц, полидисперсность, объемность, количественное содержание фракций, площадь поверхности) включала электронную сканирующую, просвечивающую и атомно-силовую микроскопию на LEX T OLS4100, JSM 7401F, JEM-2000FX («JEOL», Япония). Распределение частиц по размеру исследовали на анализаторе наночастиц Brookhaven 90Plus/BIMAS ZetaPALS и Photocor Compact («Фотокор», Россия) в лиозо-лях, полученных при обработке на ультразвуковом диспергаторе УЗДН-2Т («НПП Академприбор», Россия) в течение 30 мин (35 кГц, 300 Вт, амплитуда колебаний 10 мкА).
Семена пшеницы ( Triticum vulgare L.) дезинфицировали 0,01 % раствором KMnO4 в течение 5 мин и после 3-кратного промывания дистиллированной водой помещали на подложку из фильтровальной бумаги в пластиковые чашки Петри (диаметр 9 см) по 20 шт. на расстоянии не менее 0,5-1,5 см друг от друга. Для относительной синхронизации роста отбирали одинаково проклюнувшиеся семена и переносили их на влажную фильтровальную бумагу в отдельные пластиковые чашки. В течение 1 сут растения находились в новых условиях без дополнительных воздействий. На 3-и сут в чашки с проростками вносили по 5 мл суспензии наночастиц Fe0, Cu0, Ni0 и оксидов Fe3О4, CuО и NiО в разведениях до концентрации по металлу от 0,0125 до 1,0 М. Суспензии предварительно обрабатывали ультразвуком с частотой 35 кГц в источнике ванного типа Сапфир ТТЦ (ЗАО ПКФ «Сапфир», Россия) в течение 30 мин. Группу контрольных растений выдерживали в дистиллированной воде. При такой постановке эксперимента побеги не контактировали с наночастицами, которые могли поступить в растение только через корни. После добавления суспензии наночастиц для их равномерного распределения в среде чашки Петри встряхивали в термошейкере ST-3M («Elmi», Латвия) в течение 5 мин. Подготовленные таким образом контрольные и опытные образцы оставляли в климатической камере («Agilent», США) при 12-часовом освещении, температуре 22±1 ° С и влажности 80±5 % на 3 сут, не допуская высыхания (6).
На 5-е сут после прорыва колеоптиля оценивали физиолого-биохимические показатели. У 10 проростков линейкой измеряли длину 1-го листа (от основания до апекса главного листа) и главного корня (от корневой шейки до кончика главного корня) с точностью до миллиметра. По 3 растения из каждого варианта отбирали для определения содержания фотосинтетических пигментов (ФП) и показателей окислительного стресса.
Количество ФП измеряли в этанольных экстрактах спектрофотометрическим методом по стандартной методике (10). Листья проростков (по одному листу от 10 проростков каждой пробы) массой 30 г быстро измельчали ножницами и растирали в охлажденной ступке с CaCO3, прокаленным кварцевым песком и небольшим количеством (2-3 мл) 96 % этилового спирта. После осаждения (центрифуга K-23, ГДР) к полученной взвеси повторно добавляли около 20 мл 96 % этилового спирта и вновь растирали. Для максимального извлечения пигментов эту процедуру повторяли 2-4 раза (до почти полной прозрачности экстрагента) и объединя-174
ли экстракты, полученные для каждой пробы. Нерастворимые частицы отделяли центрифугированием. К экстракту добавляли 96 % этанол до установленного конечного объема. Оптическую плотность вытяжек определяли на однолучевом автоматизированном фотометре КФК-3 (Россия) при разных длинах волн (665 нм, 649 нм и 450,5 нм), соответствующих максимумам поглощения хлорофилла а, хлорофилла b и каротиноидов.
О степени перекисного окисления липидов (ПОЛ) судили по накоплению продукта реакции малонового диальдегида (МДА) с тиобарбитуро-вой кислотой (ТБК) («Ленреактив», Россия). Оценку проводили по методике, основанной на измерении окрашенного триметинового комплекса с трихлоруксусной кислотой (ТХУ, «Реахим», Россия) при λ = 532 нм (11). Для этого 100 мг ткани пшеницы растирали с 200 мкл 20 % ТХУ. Полученный гомогенат центрифугировали в течение 5 мин при 12 000 g. Супернатант использовали в качестве образца для анализа. В две плотно закрывающиеся пробирки вносили по 100 мкл супернатанта. К одной из проб добавляли 100 мкл 20 % ТХУ, она служила контролем при спектрофотометрических измерениях. К другой пробе добавляли 100 мкл 0,5 % раствора ТБК. Пробы инкубировали на кипящей водяной бане (100 ° С) в течение 30 мин, затем охлаждали при комнатной температуре.
Лабораторные опыты проводили в 3-кратной биологической повторности, аналитическое определение для каждой пробы — в трех повторностях. Достоверность экспериментальных данных оценивали методами математической статистики с привлечением пакета прикладных программ Statistica 10.0 («StatSoft, Inc.», США). Приведены значения среднего арифметического ( M ) со стандартной ошибкой среднего ( m ).
Результаты. Итоги аттестации наночастиц представлены в таблице 1.
1. Характеристика металлсодержащих нанопо- Линейный рост рас- рошков, используемых в исследовании ( M ± m ) тений — важная косвенная
|
Препарат |
Средний |
Удельная поверх- |
ζ -потенциал, |
характеристика интенсивно- |
|
наночастиц |
размер, нм |
ность (S уд. ), м2/г |
мВ |
сти деления или растяжения |
|
Fe 0 1 |
70±4,12 |
7,7 |
13±0,5 |
клеток. Мы проанализиро- |
|
Fe 3 О 4 1 Cu 0 2 |
76±3,11 54±2,06 |
10,1 12,5 |
19±0,5 31±0,1 |
вали метрические показате- |
|
CuО2 |
65±2,45 |
14 |
47±0,1 |
ли у проростков после 2 сут |
|
Ni 0 1 NiО2 |
57±1,15 68±2,21 |
4,5-6,0 12 |
25±0,5 29±0,5 |
воздействия разными концентрациями НЧ металлов |
|
П р и м е ч а н и е. Производители: 1 — ООО «Плазмотерм» (Рос- |
||||
|
сия), 2 — ООО «Порошковые передовые технологии» (Россия). |
и их оксидов (рис. 1). |
|||
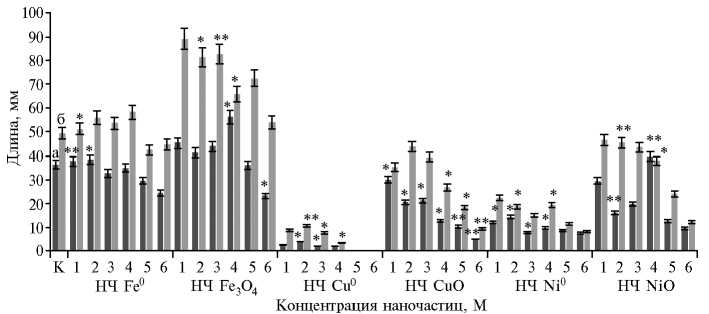
Рис. 1. Длина главного корня (а) и 1-го листа (б) у проростков пшеницы ( Triticum vulgare L.) после 2 сут инкубации с наночастицами металлов и их оксидов в разных концентрациях: 1 — 0,0125 М, 2 — 0,025 М, 3 — 0,05 М, 4 — 0,1 М, 5 — 0,5 М, 6 — 1,0 М; К — контроль.
*, ** Различия с контролем статистически значимы соответственно при p < 0,05 и p < 0,01.
Высокую устойчивость растений наблюдали при действии железосодержащих наночастиц, что выражалось в достоверной стимуляции роста проростков по сравнению с контролем. Так, в присутствии 0,0125 М НЧ Fe0 длина 1-го листа и главного корня превышала значения в контроле соответственно на 3,5 (p < 0,01) и 3,6 % (p < 0,05). Кроме того, наночастицы стимулировали рост корня (на 5,7 %, p < 0,05). В то же время на фоне НЧ Fe3O4 в концентрациях 0,025 и 0,05 М наблюдалось достоверное увеличение длины 1-го листа относительно контроля — соответственно на 39,0 (p < 0,05) и 40,0 % (p < 0,01). Повышение концентрации металла в 2 раза (0,1 М) стимулировало рост корня и листа (соответственно на 35,0 и 25,0 %, p < 0,05). При максимальной концентрации НЧ Fe3O4 (1,0 М) длина корня уменьшалась на 56,0 % (p = 0,05).
Напротив, при применении наночастиц Cu0 и CuO, Ni0 и NiO развивался токсический эффект, который усиливался с возрастанием количества металла в растворе.
Присутствие в водной фазе НЧ Cu0 в концентрациях 0,5 и 1,0 М полностью подавляло рост побега и корня и даже в минимальных разведениях заметно снижало этот показатель. Достоверное подавление роста 1-го листа отмечали в вариантах с 0,025; 0,05 и 0,1 М НЧ Cu0 — соответственно в 4,7 (p < 0,01), 6,5 и 14,5 раза (p < 0,05) по сравнению с контролем, корня — при 0,025 и 0,05 М Cu0 НЧ в 9,8 и 19,0 раза (p ≤ 0,05). Добавление 0,05; 0,1 и 1,0 М НЧ CuO приводило к достоверному уменьшению длины листа соответственно в 1,8; 2,7 (p < 0,05) и 5,3 раза (p < 0,01) относительно контрольных образцов. Длина главного корня оказалась в 1,2-7,4 раза (p < 0,05) меньше контроля при всех разведениях наночастиц.
Наночастицы Ni0 в дозах 0,025 и 0,1 М вызывали достоверное уменьшение длины листа в 2,6 и 2,5 раза (p < 0,05). Корень растений слабо развивался при всех исследованных концентрациях НЧ Ni0 и был в 2,54,8 раза короче, чем в контроле (p < 0,05). Эффект наночастиц оксида никеля оказался слабее и был неоднозначным: НЧ NiO в концентрациях 0,025 и 0,1 М подавляли рост надземной части на 8,0 (p = 0,01) и 3,4 % (p < 0,05), в концентрациях 0,025 и 0,05 М замедляли рост корневой части в 2,2 и 1,8 раза, тогда как концентрация 0,1 М, наоборот, приводила к увеличению длины корня на 7,0 %.
Содержание ФП в растениях может быть более информативным индикатором токсичности НЧ по сравнению с показателями роста. В наших опытах количество ФП изменялось в зависимости от вида и концентрации наночастиц и не всегда было взаимосвязано с динамикой длины 1-го листа.
После 2 сут воздействия на проростки наноформами Fe0 и Fe3O4 эффект в отношении содержания пигментов был в целом более благоприятным и стабильным, чем при применении наноматериалов на основе меди и никеля. Так, после инкубации с НЧ Fe0 и НЧ Fe3O4 в концентрации менее 0,05 М зеленая окраска проростков сохранялась и даже происходило усиление синтеза пигментов. Содержание хлорофиллов а и b статистически значимо увеличивалось относительно контроля: при воздействии 0,01250,05 М НЧ Fe0 — на 1,5-7,6 и 2,6-16,5 % (p ≤ 0,05), 0,0125 и 0,05 М НЧ Fe3O4 — на 2,0-11,7 (p < 0,05) и 1,0 % (p = 0,001) (табл. 2). Сумма хлорофиллов под влиянием обеих форм наночастиц повышалась на 1,9-7,0 %. При разведениях 0,5 и 1 М количество хлорофилла а снижалось для НЧ Fe0 и Fe3O4 в среднем на 13,0-17,0 и 2,0 % (р ≤ 0,05), содержание хлорофилла b достоверно не менялось.
При аналогичном воздействии НЧ Cu0 наряду с существенным по- давлением ростовых показателей и появлением темно-бурой окраски листьев регистрировали снижение содержания зеленых пигментов в среднем на 19,0 % (p < 0,05). НЧ Cu0 вызывали уменьшение содержания хлорофилла a на 22,0-33,0 % даже в концентрации, которая была в 4 раза меньшей максимальной сублетальной дозы (0,0125 М) (см. табл. 2). При этом количество хлорофилла b оставалось близким к контрольному или изменялось недостоверно.
2. Содержание фотосинтетических пигментов (мг/г сырой массы) в листьях пшеницы ( Triticum vulgare L.) после 2 сут инкубации проростков с наночастицами металлов и их оксидов в разных концентрациях ( M ± m )
|
Вариант |
Концентрация НЧ, М |
Хлорофилл а |
Хлорофилл b |
Каротиноиды |
|
Контроль |
1,585±0,14 |
0,591±0,16 |
0,278±0,04 |
|
|
Fe0 |
0,0125 |
1,611±0,04* |
0,607±0,03* |
0,281±0,01* |
|
0,025 |
1,609±0,01*** |
0,708±0,01* |
0,397±0,05* |
|
|
0,05 |
1,716±0,05* |
0,622±0,02** |
0,304±0,11 |
|
|
0,1 |
1,244±0,22 |
0,473±0,21 |
0,296±0,04* |
|
|
0,5 |
1,402±0,21* |
0,441±0,18 |
0,273±0,05* |
|
|
1,0 |
1,352±0,18* |
0,463±0,12 |
0,268±0,12 |
|
|
Cu0 |
0,0125 |
1,295±0,10* |
0,569±0,22 |
0,369±0,08 |
|
0,025 |
1,209±0,03* |
0,595±0,09 |
0,372±0,12 |
|
|
0,05 |
1,192±0,02* |
0,586±0,04* |
0,281±0,05* |
|
|
0,1 |
1,284±0,06* |
0,579±0,09 |
0,299±0,02* |
|
|
Ni0 |
0,0125 |
1,581±0,20 |
0,588±0,02** |
0,275±0,13 |
|
0,025 |
1,448±0,03* |
0,508±0,07 |
0,269±0,01* |
|
|
0,05 |
1,452±0,14* |
0,406±0,04* |
0,276±0,04* |
|
|
0,1 |
1,434±0,05** |
0,383±0,03*** |
0,273±0,05* |
|
|
0,5 |
1,394±0,94 |
0,397±0,15 |
0,254±0,03** |
|
|
1,0 |
1,398±0,18 |
0,352±0,01* |
0,272±0,04* |
|
|
Fe 3 O 4 |
0,0125 |
1,621±0,04* |
0,597±0,07 |
0,288±0,19 |
|
0,025 |
1,796±0,03** |
0,548±0,08 |
0,281±0,13 |
|
|
0,05 |
1,583±0,23 |
0,552±0,12 |
0,289±0,16 |
|
|
0,1 |
1,534±0,12 |
0,581±0,14 |
0,273±0,14 |
|
|
0,5 |
1,564±0,01** |
0,563±0,06 |
0,286±0,05** |
|
|
1,0 |
1,552±0,02* |
0,534±0,08 |
0,292±0,03* |
|
|
CuО |
0,0125 |
1,524±0,09 |
0,567±0,04** |
0,285±0,15 |
|
0,025 |
1,548±0,31 |
0,512±0,03* |
0,251±0,12 |
|
|
0,05 |
1,452±0,05* |
0,476±0,05** |
0,259±0,02** |
|
|
0,1 |
1,434±0,02** |
0,453±0,07 |
0,243±0,01* |
|
|
0,5 |
1,304±0,05* |
0,491±0,18 |
0,254±0,03* |
|
|
1,0 |
1,352±0,14 |
0,483±0,12 |
0,255±0,04* |
|
|
NiО |
0,0125 |
1,581±0,10 |
0,590±0,03* |
0,273±0,12 |
|
0,025 |
1,579±0,38 |
0,568±0,02* |
0,251±0,01* |
|
|
0,05 |
1,452±0,30 |
0,646±0,15 |
0,269±0,03* |
|
|
0,1 |
1,374±0,16 |
0,583±0,05** |
0,263±0,05* |
|
|
0,5 |
1,396±0,09 |
0,521±0,18 |
0,274±0,16 |
|
|
1,0 |
1,162±0,19 |
0,613±0,15 |
0,252±0,03* |
|
|
*, **, *** Различия между средними значениями в контроле и соответственно при p ≤ 0,05; p < 0,01; p < 0,001. |
в варианте опыта статистически значимы |
|||
В варианте с НЧ CuO общее снижение суммы пигментов даже при обработке невысокими концентрациями (менее 0,05 М) доходило до 11,8 % по отношению к контролю. Следует отметить, что НЧ CuO в большей степени, чем НЧ Cu0, влияли на количество хлорофилла b (4,0-30,0 %). Статистически значимое снижение содержания хлорофилла а отмечалось в вариантах 0,05; 0,1 и 0,5 М — соответственно на 9,0 % (p < 0,05), 10,5 % (p = 0,01) и 21,5 % (p = 0,05); хлорофилла b — при 0,0125 и 0,025 М на 4,0 % (p < 0,05) и 15,0 % (p = 0,05) по отношению к контролю.
Наночастицы Ni0 оказывали сопоставимое с НЧ CuО влияние на содержание обеих форм хлорофилла (а + b) в растениях T. vulgare : в среднем показатель снижался на 18,5 %, и с увеличением концентрации металла в среде эффект усиливался. Выяснилось, что к НЧ Ni0 более чувствителен хлорофилл b. В эксперименте отмечали резкое уменьшение его количества (на 16,0-68,0 %): при минимальной концентрации (0,0125 М)
НЧ Ni0 показатели были сходными с контролем (р = 0,01) с последующим дозозависимым снижением на 45,5 % (p < 0,05), 54,0 % (р = 0,001) и 68,0 % (p < 0,05) в присутствии 0,05, 0,1 и 1,0 М НЧ Ni0. Содержание хлорофилла а снижалось не более чем на 10,0 % относительно контроля (до 1,4341,452 мг/г сырой массы против 1,585±0,04 мг/г в контроле) (см. табл. 2). Наночастицы NiО оказывали несущественное угнетающее воздействие, что проявлялось в снижении содержания хлорофиллов а + b на 8,7 % относительно контроля. При этом количество хлорофилла b было сходно с таковым в контроле не только при начальных концентрациях оксида никеля (0,0125 и 0,025 М, p ≤ 0,05), но и в концентрации 0,1 М (p < 0,01). В то же время снижение количества хлорофилла а доходило до 36,0 % по сравнению с контролем. Возможно, одной из причин этого был ограниченный транспорт НЧ NiО в побег из корней.
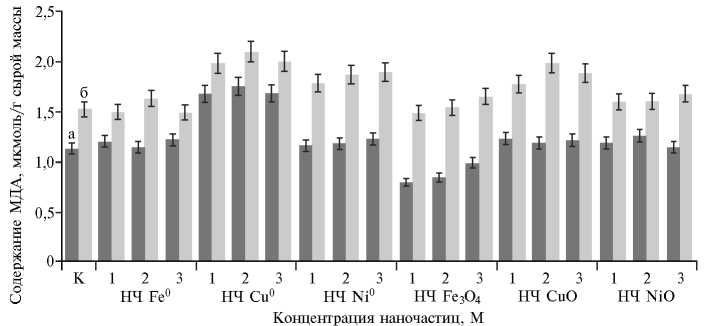
Рис. 2. Содержание малонового диальдегида (МДА) в листьях (а) и корнях (б) после 2 сут инкубации проростков пшеницы ( Triticum vulgare L.) с наночастицами металлов и их оксидов в разных концентрациях: 1 — 0,025 М; 2 — 0,05 М; 3 — 0,1 М; К — контроль ( р ≤ 0,05).
Вместе с тем каротиноиды в листьях проростков T. vulgare оказались менее чувствительны к НЧ металлов по сравнению с хлорофиллами (см. табл. 2). Так, наблюдалось накопление желтых пигментов в пределах нормы (0,1-0,5 мг/г сырой массы), и лишь в некоторых случаях было выявлено незначительное изменение этого показателя. В варианте с НЧ Cu0 растения отличались от контрольных повышенным содержанием каротиноидов (на 14,5 %). Напротив, относительно небольшое (менее чем на 10,0 %), но стабильное снижение показателя в проростках выявили при концентрациях 0,05 М НЧ CuО и НЧ Ni0, а также 0,5 М НЧ Fe0 — соответственно на 10,0, 3,5 и 3,0 %.
Полученные данные свидетельствуют о том, что весьма вероятной причиной меньшей устойчивости к большинству исследованных наночастиц (Ni0, Сu0 и CuO) становится увеличивающаяся интенсивность окислительного стресса, который испытывают растения на фоне действия металлов. По результатам оценки, содержание МДА в листьях и корнях контрольных растений находилось в пределах соответственно от 0,79±1,01 до 1,75±0,14 и от 1,48±0,22 до 2,11±1,5 мкмоль/г сырой массы. В присутствии наночастиц показатель в большей степени изменялся в корнях, чем в листьях. Действие наночастиц Fe0, Fe3O4 и NiО практически не приводило к увеличению содержания МДА в корнях пшеницы (рис. 2). Напротив, влияние некоторых наночастиц, особенно Ni0, Сu0 и CuO, способствовало достоверному накоплению МДА в корневой части растений с ростом анализируемого показателя соответственно на 17,0, 25,0 и 18,7 % (р < 0,05).
Достоверное усиление ПОЛ (на 33,0 % по сравнению с контролем) в листьях наблюдали при действии НЧ Cu0 (см. рис. 2), что коррелировало с увеличением содержания каротиноидов (см. табл. 2), которые в условиях нашего эксперимента, вероятно, не участвовали в предотвращении окисления жирных кислот липидов в клеточных мембранах. В тех же условиях образование МДА при обработке НЧ Fe3O4 имело лишь небольшую тенденцию к снижению — на 30,0 % относительно контроля. Отсутствие значимых изменений ПОЛ в листьях после воздействия наночастиц Ni0, CuO и NiО может быть также обусловлено снижением пула каротиноидов (см. табл. 2).
Таким образом, полученные результаты позволяют констатировать, что в проростках пшеницы, выдержанных в течение 2 сут в среде с наночастицами, происходило изменение сразу нескольких показателей.
Чувствительность проростков к наночастицам чистых металлов Cu0 и Ni0 оказалась гораздо выше, чем к их оксидам (CuO, NiO). Интересно отметить, что ни одна из концентраций НЧ CuO и NiO не вызывала летального эффекта. Все растения пшеницы под воздействием наибольших концентраций (0,5 и 1,0 М) этих наноформ оставались жизнеспособными, несмотря на существенное (более чем в 2 раза) снижение большинства ростовых показателей. К тому же проведенный анализ выявил более высокую чувствительность к наночастицам у корневой системы как первой мишени для токсического действия металлов. НЧ металлов и оксидов можно расположить по возрастанию их токсического действия на рост главного корня и 1-го листа проростков T. vulgare в следующем порядке: Fe 3 O 4 → Fe0 → NiO → CuO → Ni0 → Cu0.
Анализ ФП показал, что наиболее сильное негативное влияние на содержание хлорофилла a имели НЧ Cu0 (22,0-33,0 %), хлорофилла b — НЧ Ni0 (16,0-68,0 %), каротиноидов — НЧ CuO (10,5 %). Эти же наночастицы вызывали снижение суммарного количества хлорофиллов в проростках, что могло иметь общую причину, связанную с развитием окислительного стресса, поскольку хлоропласты служат основным источником генерации АФК в условиях стресса. По-видимому, медьсодержащие наночастицы могли непосредственно участвовать в генерации гидроксильных радикалов (в реакциях Фентона и Хабера-Вейса) и синглетного кислорода в клетках (12), что приводило к окислительной деструкции пигментов, или высвобождать ионы меди и тем самым вызывать метаболические эффекты — нарушать строму и граны мембран хлоропластов (13). Полученные данные согласуются с выводами исследований, в которых отмечалось общее снижение суммы ФП после обработки наночастицами оксида меди (14-16). Уменьшение содержания хлорофилла а без влияния на хлорофилл b также было показано ранее (16). Наблюдаемое снижение количества хлорофилла b после воздействия НЧ Ni0, вероятно, вызвано ионами никеля, вовлеченными в опосредованное повреждение светособирающего комплекса (8, 17).
По-видимому, изменение количества каротиноидов в наших опытах было связано с меньшей чувствительностью ферментов их синтеза к наночастицам, а также с активной ролью указанных пигментов в нейтрализации АФК.
Анализируя количественные изменения продуктов ПОЛ, можно заключить, что процессы липидной пероксидации под влиянием железосодержащих наночастиц незначительны и мало отличаются от таковых в интактных растениях, что свидетельствует о незначительном развитии 179
окислительного стресса (9, 18). Это можно объяснить первичной неспецифической реакцией на стресс как одной из составляющих пассивной адаптации растения. Накопление окисленных продуктов жирных кислот было обнаружено в корнях при действии наночастиц Сu0, Ni0 и CuO. Другие исследователи получили похожие данные с НЧ Cu0 и CuО и считают ПОЛ одним из наиболее важных механизмов токсичности, связанных с воздействием нанометаллов (15, 16).
Известно, что у растений размеры пор клеточной стенки варьируют от 2 до 30 нм (20), в то время как размер ионов и молекул воды составляет около 0,28 нм. Поэтому изученные нами НЧ металлов, вероятно, остаются на поверхности и действуют опосредованно. В работе M. Whitby с соавт. (21) показано, что повреждение клеток у растений связано с агрегацией НЧ на их поверхности, создающей препятствие для апопластического транспорта. Однако во многих исследованиях отмечается возможность проникновения НЧ даже крупных размеров внутрь клеток, а также появление новых пор для транспортировки металлов. Так, Т.Д. Дерябиной (22) доказано, что сферические НЧ Cu0 размером 80±15 нм преодолевают плазмалемму и накапливаются в вакуолях.
Ранее сообщалось, что наночастицы могут проникать через клеточную мембрану и образовывать агрегаты с клеточными компонентами (3), а их оксиды — блокировать водные каналы посредством адсорбции и увеличивать проникновение АФК (4). Обнаружен высокий пул АФК и повышение ПОЛ в протопласте при воздействии NiO и высказано предположение, что ионы Ni2+ генерируют HO •- радикал в клетках растений через цикл Хабера-Вейса (12). Выявлена токсичность как наноформ Cu0 и CuO, так и высвобожденных из них ионов Cu2+/Cu+ (5). Но несмотря на все эти факты, не удалось точно дифференцировать эффекты окислительной индукции металлами, их оксидами и ионами. Окислительные свойства НЧ CuO, вероятно, объясняются хорошей растворимостью этого оксида до ионов Cu2+ и Cu+ (23, 24). Более высокая токсичность НЧ Cu0 по сравнению с CuO, возможно, вызвана их меньшей мобильностью в среде (13, 24). Кроме того, необходимо учитывать вероятное взаимодействие НЧ с биомолекулами, в том числе с ДНК (25).
Итак, изучение процессов роста, состава пигментов и продуктов перекисного окисления липидов показало, что у пшеницы Triticum vulgare L. метаболические изменения в присутствии нанометаллов и их оксидов зависели как от химической природы металла, так и от используемой концентрации нанопрепарата. Полученные результаты служат дополнительным доказательством избирательности при активации той или иной метаболической реакции, определяемой свойствами наноматериала. В то же время смещение окислительно-восстановительного баланса в присутствии Ni0, Сu0 и CuO можно отнести к неспецифической реакции растений, поскольку подобные изменения характерны для разнообразных видов стрессов.
Список литературы Морфофизиологические изменения у пшеницы (Triticum vulgare L.) под влиянием наночастиц металлов (Fe, Cu, Ni) и их оксидов (Fe3O4, CuO, NiO)
- Karkone A., Kuchitsu K. Reactive oxygen species in cell wall metabolism and development in plants. Phytochemistry, 2015, 112: 22-32 ( ) DOI: 10.1016/j.phytochem.2014.09.016
- Liu Y., Tourbin M., Lachaize S., Guiraud P. Nanoparticles in waste waters: hazards, fate and remediation. Powder Technol., 2014, 255: 149-156 ( ) DOI: 10.1016/j.powtec.2013.08.025
- Lee W.M., An Y.J., Yoon H., Kweon H.S. Toxicity and bioavailability of copper nanoparticles to the terrestrial plants mung bean (Phaseolus radiatus) and wheat (Triticum aestivum): plant agar test for water-insoluble nanoparticles. Environ. Toxicol. Chem., 2008, 27: 1915-1921 ( ) DOI: 10.1897/07-481.1
- Geremias R., Fattorini D., Favere V.T.D., Pedrosa R.C. Bioaccumulation and toxic effects of copper in common onion Allium cepa L. Chemistry and Ecology, 2010, 26(1): 19-26 ( ) DOI: 10.1080/02757540903468144
- Chandra R., Bharagava R.N., Yadav S., Mohan D. Accumulation and distribution of toxic metals in wheat (Triticum aestivum L.) and Indian mustard (Brassica campestris L.) irrigated with distillery and tannery effluents. Journal of Hazardous Materials, 2009, 162(2-3): 1514-1521 ( ) DOI: 10.1016/j.jhazmat.2008.06.040
- Lebedev S.V., Korotkova A.M., Osipova E.A. Influence of Fe0 nanoparticles, magnetite Fe3O4 nanoparticles, and iron (II) sulfate (FeSO4) solutions on the content of photosynthetic pigments in Triticum vulgare. Russ. J. Plant Physiol., 2014, 61(4): 564-569 ( ) DOI: 10.1134/S1021443714040128
- Zhao L., Peng B., Hernandez-Viezcas J.A., Rico C., Sun Y., Peralta-Videa J.R. Tang X., Niu G., Jin L., Varela-Ramirez A., Zhang J.Y., Gardea-Torresdey J.L. Stress response and tolerance of Zea mays to CeO2 nanoparticles: cross talk among H2O2, heat shock protein, and lipid peroxidation. ACS Nano, 2012, 6(11): 9615-9622 ( ) DOI: 10.1021/nn302975u
- Rico C.M., Peralta-Videa J.R., Gardea-Torresdey J.L. Chemistry, biochemistry of nanoparticles, and their role in antioxidant defense system in plants. In: Nanotechnology and plant sciences: nanoparticles and their impact on plants/M.H. Siddiqui, M.H. Al-Whaibi, F. Mohammad (eds.). Springer, NY, 2015: 1-17 ( ) DOI: 10.1007/978-3-319-14502-0_1
- Faisal M., Saquibb Q., Alatara A.А., Al-Khedhairyb A.A., Hegazya A.K., Musarratd J. Phytotoxic hazards of NiO-nanoparticles in tomato: a study on mechanism of cell death. Journal of Hazardous Materials, 2013, 250-251: 318-332 ( ) DOI: 10.1016/j.jhazmat.2013.01.063
- Шлык А.А. О спектрофотометрическом определении хлорофиллов а и б. Биохимия, 1968, 33(2): 275-285.
- Сибгатуллина Г.В., Хаертдинова Л.Р., Гумерова Е.А., Акулов А.Н., Костюкова Ю.А., Никонорова Н.А., Румянцева Н.И. Методы определения редокс-статуса культивируемых клеток растений. Казань, 2011. Режим доступа: http://old.kpfu.ru/f1/docs/genetic1.pdf. Без даты.
- Полесская О.Г. Растительная клетка и активные формы кислорода. М., 2007 (ISBN 978-5-98227-252-2).
- Pokhrel L.R., Dubey B. Early developmental responses of plants exposed to metals and oxides nanoparticles. In: Nanotechnology and plant sciences: nanoparticles and their impact on plants/M.H. Siddiqui, M.H. Al-Whaibi, F. Mohammad (eds.). Springer, NY, 2015: 153-165 ( ) DOI: 10.1007/978-3-319-14502-0_8
- Shi J., Abid A.D., Kennedy I.M., Hristova K.R., Silk W.K. To duckweeds (Landoltia punctata), nanoparticulate copper oxide is more inhibitory than the soluble copper in the bulk solution. Environ Pollut., 2011, 159: 1277-1282 ( ) DOI: 10.1016/j.envpol.2011.01.028
- Dimkpa C.O., McLean J.E., Latta D.E., Manango E., Britt D.W., Johnson W.P., Boyanov M.I., Anderson A.J. CuO and ZnO nanoparticles: phytotoxicity, metal speciation, and induction of oxidative stress in sand-grown wheat. J. Nanopart. Res., 2012, 814(9): 1125-1129 ( ) DOI: 10.1007/s11051-012-1125-9
- Nair P.M., Chung I.M. Impact of copper oxide nanoparticles exposure on Arabidopsis thaliana growth, root system development, root lignificaion, and molecular level changes. Environ. Sci. Pollut. Res. Int., 2014, 21: 12709-127022 ( ) DOI: 10.1007/s11356-014-3210-3
- Aslani F., Bagheri S., Julkapli N.M., Juraimi A.S., Hashemi F.S.G., Baghdadi A. Effects of engineered nanomaterials on plants growth: an overview. Scientific World Journal, 2014, 28: 75 ( ) DOI: 10.1155/2014/641759
- Ouzounidou G. The use of photoacoastic spectroscopy in assessing leaf photosynthesis under copper stress: correlation of energy storage to photosystem II fluorescence parameters and redox change of P700. Plant Sci., 1996, 113: 229-237 ( ) DOI: 10.1016/0168-9452(95)04297-0
- Held P. An introduction to reactive oxygen species -measurement of ROS in cells. BioTek Instruments, Inc., 2015. Режим доступа: http://www.biotek.com/resources/articles/reactive-oxygen-species.html. Без даты.
- Carpita N.С. Limiting diameters of pores and the surface structure of plant cell walls. Science, 1982, 218: 813-814 ( ) DOI: 10.1126/science.218.4574.813
- Whitby M., Quirke N. Fluid flow in carbon nanotubes and nanopipes. Nature Nanotechnology, 2007, 2: 87-94 ( ) DOI: 10.1038/nnano.2006.175
- Дерябина Т.Д. Адаптивные реакции и пределы толерантности Triticum aestivum L. и Allium cepa L. к наночастицам меди и железа. Автореф. канд. дис. Оренбург, 2015.
- Kasemets K., Ivask A., Dubourguier H., Kahru A. Toxicity of nanoparticles of ZnO, CuO and TiO2 to yeast Saccharomyces cerevisiae. Toxicology in Vitro, 2009, 23: 1116-1122 ( ) DOI: 10.1016/j.tiv.2009.05.015
- Wang Z., Xie X., Zhao J., Liu X., Feng W., White J.C., Xing B. Xylem-and phloem-based transport of CuO nanoparticles in maize (Zea mays L.). Environ. Sci. Technol., 2012, 46(8): 4434-4441 ( ) DOI: 10.1021/es204212z
- Korotkova A., Sizova Е., Lebedev S. Influence of iron nanoparticles on induction of oxidative damage in Triticum vulgare. Ecology, Environment and Conservation Paper, 2015, 21: 101-111.


