Морфофизиологические особенности проростков пшеницы (Triticum aestivum L.) при воздействии наночастиц никеля
Автор: Зотикова А.П., Астафурова Т.П., Буренина А.А., Сучкова С.А., Моргалев Ю.Н.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Физиология адаптации
Статья в выпуске: 3 т.53, 2018 года.
Бесплатный доступ
Интенсивное развитие нанотехнологий обусловливает актуальность исследований по выявлению закономерностей воздействия техногенных наноматериалов на биообъекты. Степень проявления токсичности наносоединений при их воздействии на растения зависит от физических свойств наночастиц (размерность, форма, каталитическая активность, концентрация). При этом мало изучены их взаимодействие с растительной клеткой и концентрационная зависимость эффектов для наночастиц разной химической природы и различных биообъектов. Цель настоящей работы состояла в комплексном изучении воздействия наночастиц никеля (НЧ Ni0) размером Δ50 = 5 нм в разной концентрации на рост, содержание пигментов, флавоноидов и пролина, интенсивность фотосинтеза и транспирации у проростков пшеницы ( Triticum aestivum L.). Откалиброванные семена мягкой яровой пшеницы сорта Новосибирская 29 предварительно проращивали в течение 2-3 сут (до появления корешков) в чашках Петри на фильтровальной бумаге, пропитанной суспензиями наночастиц Ni0 в концентрациях 0,01; 0,1; 1 и 10 мг/л...
Наночастицы никеля, накопление наночастиц, фотосинтетические пигменты, фотосинтез, транспирация, флавоноиды, пролин
Короткий адрес: https://sciup.org/142216560
IDR: 142216560 | УДК: 633.11:581.1:57.044:546.74:541.18 | DOI: 10.15389/agrobiology.2018.3.578rus
Текст научной статьи Морфофизиологические особенности проростков пшеницы (Triticum aestivum L.) при воздействии наночастиц никеля
Нанотехнологии находят широкое применение в промышленности, медицине и сельском хозяйстве. Однако некоторые компоненты нанотехнологических производств потенциально опасны для окружающей среды, а их влияние на биологические объекты недостаточно изучено (1). Вопрос о воздействии наночастиц на живые организмы связан с исследованием механизмов их токсического эффекта и круговорота в природе. По современным представлениям, сложность взаимодействия зависит как от физико-химических свойств, способа получения, размеров, структуры наночастиц, так и от особенностей биологических объектов, в том числе видов растений (2).
Показано, что вещества в форме наночастиц имеют иные свойства и способность проникновения в растения, чем те же вещества в ионной форме (3). Наночастицы металлов характеризуются избыточной поверхностной энергией и высокой реакционной способностью, активно вступают в процессы агрегации и реакции с другими химическими соединениями (4). Кроме того, взаимодействуя с различными структурами клетки и обладая пролонгированным действием, наночастицы могут выступать в роли катализаторов в реакциях с образованием как стимуляторов роста и развития, так и ингибиторов (5, 6). То есть растительные организмы дают возможность оценить специфичность воздействия наночастиц и их дозозависимые эффекты.
К настоящему времени в большей степени изучено влияние на растительные объекты наночастиц Аg, TiO2, Al2O3, Fe2O3, ZnO и CeO2 (7). Сведений о действии наночастиц никеля существенно меньше (8-10). Вместе с тем имеется достаточное количество публикаций по влиянию ионов никеля на рост, развитие и физиолого-биохимические параметры растений (11, 12). По объему производства однородных порошков металлов с высокой степенью чистоты, наряду с наночастицами железа, алюминия, меди и титана, к пятерке лидеров относятся наночастицы никеля (13). Они широко используются в медицине и биологии (14, 15), входят в состав магнитных жидкостей и катализаторов, применяются для создания высокоскоростных оптических устройств (16, 17), а также могут попадать в окружающую среду в процессе производства, использования и утилизации (18).
Никель считают необходимым для высших растений ультрамикроэлементом, поскольку от его содержания зависит активность ферментов различных путей метаболизма, например уреазы. Низкие концентрации солей никеля, внесенные в питательный раствор, оказывают положительное влияние на рост и развитие растений, в том числе пшеницы (19). Среди тяжелых металлов никель выделяется высокой токсичностью и вызывает значительные нарушения структуры и функционирования клеток (20).
В настоящей работе впервые показано, что действие даже низких концентраций наночастиц никеля ( Δ 50 = 5 нм) в диапазоне 0,01-10 мг/л вызывает заметные изменения структурных и функциональных показателей проростков пшеницы и имеет в основном дозовую зависимость.
Цель нашей работы состояла в выявлении морфологических и физиолого-биохимических особенностей у проростков пшеницы под влиянием наночастиц никеля (НЧ Ni0) разной концентрации.
Методика. В качестве объекта исследования использовали 10-суточные проростки мягкой яровой пшеницы (Triticum aestivum L.) сорта Новосибирская 29. Растения выращивали в лабораторных условиях в климатической камере («Labline Scientific Instruments», Польша) при 12-часовом фотопериоде, температуре 23-24 °С и освещенности 60 Вт/м2. В опыте использовали семена, всхожесть которых была определена предварительно по ГОСТ 12038-84 и составляла не менее 95 %. Откалиброванные семена предварительно проращивали в течение 2-3 сут (до появления корешков) в одноразовых пластмассовых чашках Петри с двумя слоями увлажненной фильтровальной бумаги, в опыте использовали суспензии наночастиц Ni0 в концентрации 0,01; 0,1; 1 и 10 мг/л, в контрольном варианте — дистилли- рованную воду. Проросшие семена переносили в вегетационные сосуды объемом 500 мл, которые помещали в климатическую камеру, где проростки выращивали до 10-суточного возраста. В опытных вариантах для выращивания использовали суспензии наночастиц никеля указанных выше концентраций, в контроле — дистиллированную воду. В связи с агрегацией наночастиц и снижением их концентрации в свободной форме ежедневно заменяли все дисперсные системы в сосудах. В каждом сосуде было 25 растений, эксперимент проводили в 4 повторностях для каждого варианта опыта.
Наночастицы Ni0 получали методом лазерной абляции в дистиллированной воде из брусков никеля (чистота 99,95 мас.%, марка Ni 3N5) («Гирмет», Россия). При воздействии на брусок излучением импульсного Nd-YAG-лазера LS-2134UTF («Lotis Tii», Белоруссия, Япония) происходила абляция и разбрызгивание материала мишени в окружающую среду. Толщина удаляемого за импульс слоя была мала и не превышала нескольких десятков нанометров. Вне мишени удаляемый материал организовывался в наночастицы (21). По данным просвечивающей электронной микроскопии (Philips CM-12, «Koninklijke Philips N.V.», Нидерланды), диаметр частиц составлял 2-12 нм со средним размером Δ 50 = 5 нм и удельной поверхностью 30 м2/г. Необходимые концентрации дисперсных систем НЧ Ni0 получали разведением исходной дисперсионной среды (ДС) дистиллированной водой и последующей 45-минутной обработкой ультразвуком с частотой 35 кГц в ультразвуковой ванне (УЗВ-5,7/1 ТТЦ, ЗАО ПКФ «Сапфир», Россия). Количественные характеристики поглощения наночастиц из ДС определяли методом масс-спектрометрии с индуктивно связанной плазмой по содержанию Ni в образцах тканей из корней и надземной части (листья + стебель) растений (22). Корни перед высушиванием дважды промывали 0,01 % раствором Na-EDТА, затем трижды дистиллированной водой для удаления частиц, сорбированных на поверхности. Образцы корней и листьев, высушенные до постоянной массы, растирали в фарфоровой ступке, для анализа брали навеску массой 0,1 г. Пробы озоляли в микроволновой системе разложения Speedwave TM MWS-3+ («BERGHOF Products + Instruments GmbH», Германия) и анализировали на масс-спектрометре ELAN DRC-e («PerkinElmer, Inc.», США).
Морфометрические параметры оценивали по длине корневой системы и проростков, массе корневой и надземной частей растений. Сырую массу определяли стандартным весовым методом. Для оценки содержания фотосинтетических пигментов формировали среднюю пробу из 10 растений (масса навески 0,4 г). Количество хлорофиллов и каротиноидов определяли спектрофотометрически (спектрометр UV-1601PC, «Shimadzu Corp.», Япония) в спиртовых вытяжках (23). Для измерения интенсивности фотосинтеза и транспирации использовали портативный инфракрасный газоанализатор Li-6400 («LI-COR Biosciences», США) с открытой системой, где в качестве искусственного источника света применяли систему фотодиодов (6400-02B LED), обеспечивающую освещенность 1000 мкмоль^м - 2^с - 1. В листовой камере поддерживалась температура 24 °С, скорость потока СО2 составляла 400 мкмоль/с, его содержание — 400 мкмоль/моль. Интенсивность фотосинтеза и транспирации измеряли в листьях 10-суточных проростков. Содержание флавоноидов оценивали спектрофотометрическим методом по реакции с хлоридом алюминия. Оптическую плотность раствора определяли при X = 415 нм на спектрофотометре UV-1601PC («Shi-madzu Corp.», Япония). Количество флавоноидов рассчитывали по калибровочной кривой, построенной по рутину («Sigma», Великобритания) (24).
Содержание свободного пролина в побегах оценивали с помощью кислого нингидринового реактива по методу L.S. Bates с соавт. (25).
Статистическую обработку данных проводили с помощью пакета Statistica 8 («StatSoft, Inc.», США). В таблицах и на рисунках представлены средние арифметические значения ( M ) и их стандартные ошибки (±SEM) по морфологическим параметрам из 100, по физиолого-биохимическим показателям и накоплению никеля — из 4 биологических повторностей. Достоверными считали различия с вероятностью ошибки р ≤ 0,05.
Результаты. При 10-суточном выращивании пшеницы на дисперсионной среде, содержащей НЧ Ni0 в концентрации 10 мг/л, происходило значительное накопление наночастиц в органах растений, особенно в корневой системе. Так, в опытном варианте содержание никеля в корнях составляло 50,89±1,67 мкг/г сухой массы, в контроле — всего 3,8±0,15 мкг/г сухой массы. В надземной части содержание никеля было на порядок ниже: в опыте — 14,20±2,38, в контроле — 0,87±0,025 мкг/г сухой массы.
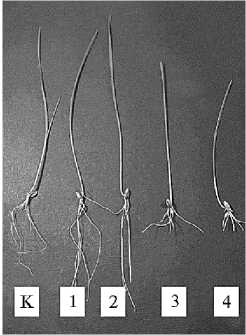
Рис. 1. 10-Суточные проростки мягкой яровой пшеницы ( Triti-cum aestivum L.) сорта Новосибирская 29 при действии наночастиц Ni0 в разной концентрации: К — контроль; 1 — 0,01; 2 — 0,1; 3 — 1; 4 — 10 мг/л в дисперсионной среде (лабораторный опыт).
Аккумулированные наночастицы вызывали видимые изменения морфометрических параметров корневой системы и надземной части проростков пшеницы (рис. 1). Если НЧ Ni0 в концентрациях 0,01 и 0,1 мг/л не изменяли или даже стимулировали ростовые процессы, то НЧ Ni0 в более высоких дозах (1 мг/л и особенно 10 мг/л) значительно угнетали рост корней и надземной части (табл. 1). Так, длина корневой системы при концентрации НЧ Ni0 1 мг/л уменьшилась примерно в 2 раза, а при 10 мг/л — в 3 раза, сырая масса — соответственно в 1,9 и 2,7 раза, длина проростков — в 1,3 и 1,9 раза.
D.F. Piccini с соавт. (11) также показали, что внесение в почву наночастиц никеля размером менее 100 нм в концентрации 100 мг/кг оказывало токсическое влияние на рост корней Le-pidium sativum L. В опытах на Solanum lycopersic-um L. выявлено, что наночастицы никеля размером 28 и 62 нм накапливаются в основном в корнях, уменьшают надземную сухую массу и влияют на содержание Ca и К в листьях (9).
1. Морфометрические параметры проростков мягкой яровой пшеницы ( Triticum aestivum L.) сорта Новосибирская 29, выращенных на дисперсионной среде, которая содержала наночастицы никеля в различной концентрации ( M ± m ; лабораторный опыт)
|
Концентрация наночастиц, мг/л |
Корень |
Надземная часть |
||
|
длина, см |
сырая масса, мг |
высота, см |
сырая масса, мг |
|
|
Контроль |
7,79±0,22 |
98,6±4,2 |
16,83±0,39 |
221,5±8,5 |
|
0,01 |
9,73±0,23* |
129,7±6,4* |
17,35±0,21 |
255,1±7,3* |
|
0,1 |
8,33±0,16 |
112,6±8,2 |
17,02±0,19 |
233,1±10,2 |
|
1 |
4,12±0,07* |
52,8±5,1* |
12,89±0,28* |
171,8±9,3* |
|
10 |
2,56±0,07* |
36,0±7,2* |
8,03±0,34* |
121,6±10,3* |
|
*р ≤ 0,05 по сравнению с контролем. |
||||
Ингибирование роста корня — одна из наиболее ранних ответных реакций на действие тяжелых металлов (26). Эта особенность широко используется для оценки степени их токсичности в различных концентрациях (27). Защитные механизмы и барьеры, функционирующие на уровне клеток и тканей корня, уменьшают попадание тяжелых металлов в побеги, в результате чего корни накапливают их в значительных количествах, что сказывается на развитии и формировании корневой системы (28, 29).
Аккумулированные НЧ Ni0 оказывали влияние не только на ростовые параметры, но и на физиолого-биохимические показатели листового аппарата проростков пшеницы. В частности, при культивировании проростков на дисперсионной среде, содержащей НЧ Ni0, количество хлорофиллов а и b при концентрации НЧ Ni0 0,01 мг/л незначительно увеличивалось. С повышением концентрации наночастиц наблюдали снижение этого показателя. Статистически достоверно (p < 0,05) содержание хлорофиллов уменьшалось только при концентрации НЧ Ni0 10 мг/л: — на 30 % относительно контроля (рис. 2). Подобные изменения были обнаружены нами ранее при воздействии на пигментный комплекс пшеницы наночастиц платины (30). Количество каротиноидов при дозах НЧ Ni0 0,1 и 1 мг/л снижалось на 19-20 %, при 10 мг/л — на 35 % (см. рис. 2).
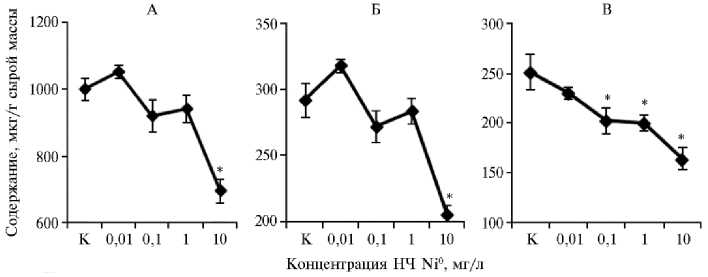
Рис. 2. Содержание хлорофиллов a (А) и b (Б) , а также суммы каротиноидов (В) в листьях мягкой яровой пшеницы ( Triticum aestivum L.) сорта Новосибирская 29 в зависимости от концентрации наночастиц (НЧ) Ni0 в дисперсионной среде (лабораторный опыт) .
* Различия с контролем статистически значимы при р ≤ 0,05.
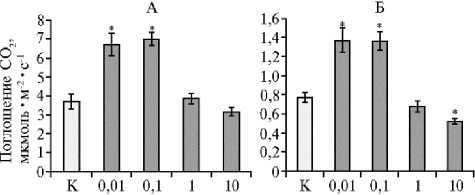
Концентрация НЧ Ni°, мг/л
Рис. 3. Интенсивность фотосинтеза (А) и транспирации (Б) листьев у мягкой яровой пшеницы ( Triticum aestivum L.) сорта Новосибирская 29 в зависимости от концентрации наночастиц (НЧ) Ni0 в дисперсионной среде (лабораторный опыт) .
* Различия с контролем статистически значимы при р ≤ 0,05.
Показано, что содержание фотосинтетических пигментов уменьшается при действии большинства стрессовых факторов (19, 31). Например, обработка семян T. vulga-re L. наночастицами никеля диаметром 57 нм и последующая 48-часовая инкубация с использованием их растворов в концентрациях 0,0125-1 М вызы- вали резкое уменьшение количества хлорофилла b в листьях и приводили к увеличению содержания малонового диальдегида в корневой системе растений. Это свидетельствует о развитии цитогенетических повреждений за счет окисления липидов клеточных мембран. Наблюдалась также дозовая зависимость (10).
Особенности накопления фотосинтетических пигментов под воздействием НЧ Ni0 в целом были сходны с закономерностями роста проростков (см. табл. 1). Это, вероятно, обусловлено тесной взаимосвязью между фотосинтезом и ростовыми процессами, которые регулируются метаболическими и гормональными механизмами (32).
Исследование интегральных функциональных характеристик листового аппарата — фотосинтеза и транспирации также выявило дозозависимый эффект. Наночастицы никеля в низкой концентрации (0,01 и 0,1 мг/л) достоверно (p < 0,001) повышали интенсивность фотосинтеза, в концентрации 1 мг/л не изменяли этот показатель, и только при 10 мг/л он снижался на 15 % относительно контроля (рис. 3, А). При измерении интенсивности транспирации обнаружили аналогичную зависимость (см. рис. 3, Б).
2. Биохимические показатели у проростков мягкой яровой пшеницы ( Triticum aestivum L.) сорта Новосибирская 29, выращенных на дисперсионной среде, содержащей наночастицы никеля в разной концентрации ( M ±SEM; лабораторный опыт)
Концентрация Сумма флавоноидов Содержание пролина
|
наночастиц, мг/л |
мкг/г сухой массы |
к контролю, % |
мг/г сухой массы |
к контролю, % |
|
Контроль |
28,11±0,11 |
100 |
0,77±0,12 |
100 |
|
0,01 |
17,24±0,13* |
61 |
0,95±0,09* |
123 |
|
0,1 |
7,03±0,01* |
25 |
1,15±0,21* |
149 |
|
1 |
21,22±0,01* |
75 |
1,28±0,25* |
166 |
|
10 |
10,17±0,03* |
36 |
1,79±0,26* |
232 |
* Различия с контролем статистически значимы при р ≤ 0,05.
Известно, что при неблагоприятных воздействиях стрес-протекторную функцию выполняют флавоноиды (33) и пролин (34, 35), которые способны связывать ионы металлов с переменной валентностью и тем самым ограничивать неферментативные свободнорадикальные процессы.
В наших экспериментах сумма флавоноидов снижалась с повышением концентрации НЧ Ni0, однако четкой дозовой зави- симости не наблюдалось (табл. 2). Данные литературы относительно изменения содержания флавоноидов при воздействии наночастиц на растения довольно противоречивы. Так, при выращивании Raphanus sativus L. в почве, обработанной наночастицами оксида цезия разной концентрации, отмечали значительный разброс данных в вариантах опыта, поэтому различия были недостоверны (36). Под влиянием наночастиц серебра у Calendula officinalis L. обнаружено снижение количества флавоноидов в разных органах (37). В работе C. Krishnaraj (38), наоборот, показан сдвиг в сторону вторичного метаболизма и увеличение содержания флавоноидов у растений Bacopa monnieri L. под влиянием наночастиц серебра.
В то же время воздействие наночастиц никеля обусловило повышение (p < 0,05) количества пролина в листьях пшеницы относительно контроля, при этом наблюдалась дозовая зависимость от концентрации наночастиц (см. табл. 2), что согласуется с существующими представлениями о протекторной роли пролина при стрессе (34).
Таким образом, выявлены морфофизиологические особенности проростков пшеницы при их выращивании на водных дисперсных системах, содержащих наночастицы никеля (Δ50 = 5 нм). При этом для большинства изученных показателей (морфометрических параметров, содержания хлорофиллов, интенсивности фотосинтеза и транспирации) наблюдалась сходная зависимость: увеличение при малых и отчетливое снижение при более высоких концентрациях НЧ Ni0. Среди соединений, выполняющих защитную функцию, прямо пропорциональное увеличение содержания при возрастании концентрации НЧ Ni0 наблюдалось только по пролину, в то время как для каротиноидов и флавоноидов было показано уменьшение количества. Это позволяет предположить, что в зависимости от концентрации НЧ Ni0 оказывают избирательное действие на различные звенья метаболизма. Полученные результаты могут дополнить данные об обосновании допустимых уровней загрязнения наночастицами металлов растительных организмов и агроценозов, а также использоваться
для разработки практических рекомендаций по диагностированию негативного воздействия НЧ Ni0 на растения.
Список литературы Морфофизиологические особенности проростков пшеницы (Triticum aestivum L.) при воздействии наночастиц никеля
- Viswanath B., Kim S. Influence of nanotoxicity on human health and environment: The alternative strategies. In: Reviews of environmental contamination and toxicology. Vol. 242/P. de Voogt (ed.). Springer, Cham, 2016 ( ) DOI: 10.1007/398_2016_12
- Chichiriccò G., Poma A. Penetration and toxicity of Nanomaterials in higher plants. Nanomaterials, 2015, 5(2): 851-873 ( ) DOI: 10.3390/nano5020851
- Jiang J., Oberdörster G., Elder A., Gelein R., Mercer P., Biswas P. Does nanoparticle activity depend upon size and crystal phase? Nanotoxicology, 2008, 2(1): 33-42 ( ) DOI: 10.1080/17435390701882478
- Altavilla C., Ciliberto E. Inorganic nanoparticles: synthesis, applications and perspectives -an overview. In: Inorganic nanopartikles: synthesis, applications and perspectives/C. Altavilla, E. Ciliberto (eds). CRC Press, Boca Raton, 2011: 1-17.
- Райкова А.П., Паничкин Л.А., Райкова Н.Н. Исследование влияния ультрадисперсных порошков металлов, полученных различными способами, на рост и развитие растений. Мат. Межд. науч.-прак. конф. «Нанотехнологии и информационные технологии -технологии XXI века». М., 2006: 108-111.
- Lin D., Xing B. Phytotoxicity of nanoparticles: inhibition of seed germination and root growth. Environ. Pollut., 2007, 150(2): 243-250 ( ) DOI: 10.1016/j.envpol.2007.01.016
- Aslani F., Bagheri S., Julkapli N.M., Juraimi A.S., Hashemi F.S.G., Baghdadi A. Effects of engineered nanomaterials on plants growth: an overview. The Scientific World Journal, 2014, 2014: article ID 641759 ( ) DOI: 10.1155/2014/641759
- Josko I., Oleszczuk P. Phytotoxicity of nanoparticles -problems with bioassay choosing and sample preparation. Environ. Sci. Pollut. R., 2014, 21: 10215-10224 ( ) DOI: 10.1007/s11356-014-2865-0
- Antisari L.V., Carbona S., Gatti A., Vionello G., Nannipieri P. Uptake and translocation of metals and nutrients in tomato grown in soil polluted with metal oxide (CeO2, Fe3O4, SnO2, TiO2) or metallic (Ag, Co, Ni) engineered nanoparticles. Environ. Sci. Pollut. R, 2015, 22(3): 1841-1853 ( ) DOI: 10.1007/s11356-014-3509-0
- Короткова А.М., Лебедев С.В., Каюмов Ф.Г., Сизова Е.А. Морфофизиологические изменения у пшеницы (Triticum vulgare L.) под влиянием наночастиц металлов (Fe, Cu, Ni) и их оксидов (Fe3O4, CuO, NiO). Сельскохозяйственная биология, 2017, 52(1): 172-182 ( ) DOI: 10.15389/agrobiology.2017.1.172rus
- Piccini D.F., Malavolta E. Effect of nickel on two common bean cultivars. J. Plant Nutr., 1992, 15: 2343-2350 ( ) DOI: 10.1080/01904169209364478
- Shevyakova N.I., Il’ina E.N., Stetsenko L.A., Kyznetsov Vl.V. Nikel accumulation in rape shoots (Brassica napus L.) increased by putrescine. Int. J. Phytoremediat., 2011, 13: 345-356.
- Фельдблюм В. «Нано» на стыке наук: нанообъекты, нанотехнологии, нанобудущее. Ярославль, 2013. Режим доступа: http://narfu.ru/university/library/books/0706.pdf. Дата обращения 12.06.2017.
- Rui H., Xing R., Xu Z., Hou Y., Goo S., Sun S. Synthesis, functionalization, and biomedical applications of multifunctional magnetic nanoparticles. Adv. Mater., 2010, 22(25): 2729-2742 ( ) DOI: 10.1002/adma.201000260
- Tee B.C.-K., Wang C., Allen R., Bao Z. An electrically and mechanically self-healing composite with pressure-and flexion-sensitive properties for electronic skin applications. Nat. Nanotechnol., 2012, 7: 825-832 ( ) DOI: 10.1038/nnano.2012.192
- Aleshin A.N., Shcherbakov I.P., Fedichkin F.S. Photosensitive field-effect transistor based on a composite film of polyvinylcarbazole with nickel nanoparticles. Physics of the Solid State, 2012, 54: 1693-1698 ( ) DOI: 10.1134/S1063783412080033
- Osipova I.V., Vnukova N.G., Glushchenko G.A., Krylov A.S., Tomashevich E.V., Zharkov S.M., Churilov G.N. Nickel-containing carbon nanotubes and nanoparticles prepared in a high-frequency arc plasma. Physics of the Solid State, 2009, 51: 1972-1975 ( ) DOI: 10.1134/S1063783409090339
- Моргалев Ю.Н., Хоч Н.С., Моргалева Т.Г. Анализ безопасности нанопродукции для здоровья человека с позиций экотоксикологии: проблемы и перспективы. Нанотехника, 2010, 4: 74-79.
- Серегин И.В., Кожевникова А.Д. Физиологическая роль никеля и его токсическое действие на высшие растения. Физиология растений, 2006, 53: 285-308.
- Демченко Н.П., Калимова И.Б. Динамика роста, пролиферация и дифференциация клеток корней пшеницы под воздействием никеля в высокой концентрации. Физиология растений, 2008, 55: 874-885.
- Светличный В.А., Изаак Т.И., Бабкина О.В., Шабалина А.В. Синтез наночастиц металлов при лазерной абляции твердых тел в жидкостях наносекундным излучением 2-й гармоники ND-YAG лазера. Известия высших учебных заведений. Физика, 2009, 12(2): 110-115.
- Методика определения микроэлементов в диагностирующих биосубстратах атомной спектрометрией с индуктивно связанной аргоновой плазмой. Методические рекомендации. М., 2003.
- Биохимические методы в физиологии растений/Под ред. О.А. Павлиновой. М., 1971.
- Государственная фармакопея ХI. Вып. 2. М., 1990.
- Bates L.S., Waldren R.P., Teare I.D. Rapid determination of free proline for water-stress studies. Plant Soil, 1973, 39: 205-207.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Петрозаводск, 2007.
- Wilkins D.A. The measurement of tolerance to edaphic factors by means of root growth. New Phytol., 1978, 86: 623-633.
- Wagner G.J. Accumulation of cadmium in crop plants and consequences to human health. Adv. Agron., 1993, 51: 173-212.
- Grant C.A., Buckley W.T., Bailey L.D., Selles F. Cadmium accumulation in crops. Can. J. Plant Sci., 1998, 78: 1-17.
- Астафурова Т.П., Моргалев Ю.Н., Боровикова Г.В., Зотикова А.П., Верхотурова Г.С., Зайцева Т.А., Постовалова В.М., Моргалева Т.А. Особенности концентрационной зависимости развития проростков пшеницы в водных дисперсных системах наночастиц платины. Физиология растений и генетика, 2013, 45(6): 544-549.
- Жиров В.К., Хаитбаев А.Х., Говорова А.Ф., Гонтарь О.Б. Взаимодействия структур различных уровней организации и адаптационные стратегии растений. Вестник МГТУ, 2006, 5: 725-728.
- Мокроносов А.Т. Интеграция функций роста и фотосинтеза. Физиология растений, 1983, 30(5): 868-880.
- Макаренко О.А., Левицкий А.П. Физиологические функции флавоноидов в растении. Физиология и биохимия культурных растений, 2013, 45(2): 100-112.
- Кузнецов В.В., Шевякова Н.И. Пролин при стрессе: биологическая роль, метаболизм, регуляция. Физиология растений, 1999, 46(2): 321-336.
- Liang X., Zhang L., Natarajan S.K., Becker D.F. Proline mechanisms of stress survival. Antioxid. Redox Signal, 2013, 19(9): 998-1011 ( ) DOI: 10.1089/ars.2012.5074
- Corral-Diaz B., Peralta-Videa J.R., Alvarez-Parrilla E., Rodrigo-García J., Morales M.I., Osuna-Avila P., Niu G., Hernandez-Viezcas J.A., Gardea-Torresdey J.L. Cerium oxide nanoparticles alter the antioxidant capacity but do not impact tuber ionome in Raphanus sativus (L). Plant Physiol. Bioch., 2014, 84: 277-285 ( ) DOI: 10.1016/j.plaphy.2014.09.018
- Ghanati F., Bakhtiarian S. Effect of methyl jasmonate and silver nanoparticles on production of secondary metabolites by Calendula officinalis L. (Asteraceae). Trop. J. Pharm. Res., 2014, 13(11): 1783-1789 ( ) DOI: 10.4314/tjpr.v13i11.2
- Krishnaraj C., Jagan E.G., Ramachandran R., Abirami S.M., Mohan N., Kalaichelvan P.T. Effect of biologically synthesized silver nanoparticles on Bacopa monnieri (Linn.) Wettst. plant growth metabolism. Process Biochem., 2012, 47(4): 651-658 ( ) DOI: 10.1016/j.procbio.2012.01.006


