Морфофункциональная характеристика гемопоэтической ткани больных лимфомами
Автор: Новослова К.А., Владимирова Л.Ю., Лысенко И.Б., Абрамова Н.А., Сторожакова А.Э., Попова И.Л., Тихановская Н.М., Рядинская Л.А., Льянова А.А., Снежко Т.А., Саламов Г.В.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Фундаментальная онкология и экспериментальная медицина
Статья в выпуске: 2 т.8, 2018 года.
Бесплатный доступ
Методом проточной цитофлюориметрии исследованы параметры плоидности и кинетики клеточного цикла в образцах костного мозга больных лимфомами. Проведено сопоставление данных параметров с известными прогностическими критериями лимфом, такими как: возраст, стадия заболевания, уровень ЛДГ, СОЭ, В-симптомы, Bcl-2, Ki-67 и т. д. Анализ полученных результатов свидетельствует о том, что опухолевое поражение костного мозга при первичном процессе характеризуется статистически значимым увеличением доли клеток, экспрессирующих Bcl2, доли клеток в фазе покоя G0-1, снижением клеток в фазах G2М и S, доли клеток пролиферативного пула S+G2M, (G2M+S) / G0-1 по сравнению с непораженными гемопоэтическими клетками. Для первичных и рецидивных лимфом с поражением костного мозга характерна значительная вариабельность параметров клеточного цикла, характеризующих пролиферативную активность мононуклеаров, что сочетается с неэффективностью кроветворения. Установлены маркерные цитокинетические параметры, которые в комплексе с клинико-гематологическими, цитологическими и другими показателями могут служить прогностическими критериями общей и беспрогрессивной выживаемости больных лимфомами. Цель исследования: Определить значение некоторых иммуноморфологических и биологических факторов в прогрессии лимфом.
Злокачественные лимфомы, проточная цитофлюориметрия, костный мозг, клеточный цикл
Короткий адрес: https://sciup.org/140243787
IDR: 140243787 | DOI: 10.18027/2224-5057-2018-8-2-5-11
Текст научной статьи Морфофункциональная характеристика гемопоэтической ткани больных лимфомами
Понятие лимфома объединяет широкий спектр новообразований, характеризующихся злокачественной пролиферацией лимфоидных клеток. В течение последнего десятилетия заболеваемость злокачественными лимфомами имеет неуклонную тенденцию к росту во всем мире. В возрасте до 30 лет среди больных онкологическими образованиями лимфомы прочно занимают первое место, составляя 32%. В возрастной группе 30–59 лет удельный вес злокачественных новообразований кроветворной и лимфатической ткани составляет 5,1%. В целом в России с 2005 по 2015 г. уровень заболеваемости лимфомами вырос на 17,28% [1–4].
Ведущие направления поиска молекулярно-биологических критериев прогностической оценки опухолевой прогрессии тесно связаны с изучением апоптоза и жизненного цикла клетки (КЦ) [5, 6]. Однако связь между плоидностью, процентным содержанием клеток пролиферативного пула (S+G2M) и риском прогрессирования или рецидива заболевания остается не в полной мере доказанной. Данных об изучении плоидности и кинетики КЦ клеток гемопоэтической ткани при гемобластозах крайне мало. Известно, что при исследовании КЦ клеток костного мозга (КМ) практически здоровых лиц кинетические показатели гемопоэтических клеток имели достаточно высокую устойчивость, что свидетельствовало о стабильности процессов нормального кроветворения. Исследование КМ, проведенное больным различными видами анемий, миелодиспластическим синдромом и острым лейкозом, выявило существенный разброс индивидуальных параметров КЦ, что отражало, прежде всего, неэффективную природу гемопоэза и доказало, что параметры плоидности и кинетики КЦ гемопоэтической ткани могут служить маркерами степени злокачественности заболевания, а также иметь прогностическое значение для оценки выживаемости больных [7–9]. Противоречивые данные о прогностической роли показателей плоидности и кинетики КЦ, ограниченность информации в литературе об изучении этих показателей у больных лимфомами обусловливают актуальность проведенного нами научного анализа.
Материалы и методы
Проведено исследование биологического материала 80 больных злокачественными лимфомами (В-кле-точные неходжкинские лимфомы – НХЛ, лимфома Ходжкина – ЛХ) de novo. Первую группу (I) составили 40 пациентов с впервые установленным диагнозом с поражением КМ и без. Во вторую группу (II) вошли 40 пациентов с рецидивом заболевания. Пациенты обеих групп были распределены на подгруппы в зависимости от наличия или отсутствия поражения КМ. Морфологический диагноз устанавливался в соответствии с классификацией REAL (1994) и ВОЗ (2008) на основании гистологического и иммунологического исследования опухолевой ткани. Клиническое стадирование осуществлялось согласно классификации Ann Arbor (The Ann Arbor classification) [10], дополненной в Costwald [11] для пациентов с ЛХ и адаптированной для пациентов с НХЛ.
Для анализа иммунофенотипического (ИФТ) профиля субстратных клеток применяли метод прямого иммуно-флюоресцентного окрашивания с использованием моноклональных антител. Флюоресцентную метку обнаруживали с помощью проточного цитофлюориметра FACS Canto II (Becton Dickinson, США). Мониторинг стабильности работы прибора осуществлялся с помощью калибровочной системы 7-color Setup Beads (Becton Dickinson, США). Для оценки ДНК использовали Cycle TESTTMPLUS DNA Reagent Kit (Cat. No. 340242, Becton Dickinson, США). Образцы (не менее 10000 клеток) после окрашивания пропидиум йодидом анализировались на проточном ци-тофлюориметре BD FACS Canto II, оборудованном модулем дискриминации дуплетов. Для тестирования и подтверждения оптимальной работы проточного цитометра использовали универсальные биологические частицы DNA QC Particles (Becton Dickinson, Cat. No. 349523). Для количественной и качественной оценки состояния гемопоэза больных лимфомами проводили подсчет гемограммы и миелограмы.
Статистическую обработку полученных данных проводили с использованием пакета программ Statsoft Statistica V 8.0–10.0 (США). Достоверность различий между показателями в группах оценивали с помощью параметрического критерия Стьюдента для несвязанных совокупностей и непараметрического критерия Манна – Уитни для распределений, отличных от нормального. При малом количестве пациентов для сравнении долей использовали критерий Фишера. Во всех процедурах статистического анализа рассчитывали достигнутый уровень значимости (р), критический уровень значимости принимался равным 0,05 [12]. Для определения наличия корреляций между отдельными показателями использовали непараметрический коэффициент ранговой корреляции Спирмена ( р ) и Гамма ( Y ). Для установки взаимосвязи основных исследуемых показателей с показателями выживаемости больных был проведен регрессионный анализ по Коксу (Cox Proportional Hazards Model). Выживаемость оценивалась методом Каплана – Мейера (Kaplan – Meier) с использованием критериев Log-Rank и Gehan’s Wilcoxon [11].
Результаты и обсуждение
В результате проведенного ИФТ КМ установлено, что у пациентов I группы процент опухолевых клеток варьировал в диапазоне 26,7–99% со средними значениями 83,5±1,7%. У пациентов II группы он варьировал от 50 до 94%, в среднем – 85,3±2,4%. Процент опухолевого поражения КМ при агрессивных НХЛ в I группе составил 85,6±3,2%, тогда как при индолентных – 75,25±2,7%, p<0,05. Во II группе процент опухолевых клеток КМ при агрессивных НХЛ был 78,6±3,5%, оказавшись ниже, чем при индолентных НХЛ – 85±2,3%, р<0,05.
Диплоидный тип гистограмм в I группе определялся в 78% случаев (31 из 40 больных), анеуплоидный – в 22% (9 из 40 больных). Во II группе отмечена тенденция к увеличению доли гистограмм с содержанием ДНК, отличного от 1,0. Анеуплоидия у данной группы пациентов выявлена в 25% случаев (10 из 40 больных). У больных без поражения КМ диплоидного типа гистограммы определялись: в I группе – в 90% случаев (18 пациентов из 20), во II группе – в 89% (23 из 26). У больных с поражением КМ отмечено снижение доли диплоидного клона до 50% (7 пациентов из 14) и 65% (13 из 20) во II и I группах соответственно. Доля анеуплоидного клона увеличилась с 10 до 35% и с 12 до 50% в гистограммах первичных и рецидивных больных с поражением КМ соответственно. В I группе без поражения КМ, также как и во II группе с поражением и без, индекс ДНК в среднем составил 1,11±0,01 (в пределах митотического цикла). Во II группе с поражением КМ этот показатель был несколько выше, составив в среднем 1,13±0,02 (р>0,05).
В группах пациентов с анеуплоидными гистограммами (19 образцов) доля анеуплоидных клеток составила: 20% – в 16% случаев (3 пациента); от 20 до 40% – в 63% случаев (12 пациентов) и от 40 до 50% – в 21% случаев (4 пациента). Содержание анеуплоидных клеток в КМ пациентов I группы без его поражения в среднем составило 24,4±2,9%, тогда как с поражением процент несколько больше – 28,3±2,8%. Среднее значение анеуплоидных клеток в пробах больных II группы без поражения КМ составило 27,6±3,1%, с поражением – 31,5±4,5%. Статистически значимой разницы показателей среднего содержания анеуплоидных клеток в КМ у пациентов I и II групп нами не получено.
Наибольшей вариабельностью как в I, так и во II группе обладали показатели, характеризующие пролиферативную активность мононуклеаров: доля клеток в фазе синтеза, премитотической и митотической фазах (S и G2M); показатель отношения уровня митотической активности к полиплоидизации (G2M/S); показатель, отражающий пролиферацию клона в целом (S+G2M); цитокинетический индекс – ЦКИ ((S+G2M)/G0-1), не только отражающий процент клеток клона, вступивших в пролиферативные стадии, но и позволяющий
Таблица 1. Коэффициент вариации (СV, %), средняя взвешенная (х ), медиана (Ме) и стандартное отклонение (а) параметров КЦ у лиц I группы с поражением КМ, n=20
|
Показатель |
X |
Ме |
σ |
Нижний квартиль 25% |
Верхний квартиль 75% |
Сv |
|
G0–1 (%) |
94,9 |
98,8 |
5,5 |
91,3 |
99,1 |
5,8 |
|
S+G2M (%) |
5,2 |
3,7 |
5,9 |
0,9 |
9,9 |
114,7 |
|
G2M/S |
42 |
21 |
47,7 |
0,9 |
83,5 |
113,5 |
|
S+G2M/G0-1 |
5,9 |
3,8 |
7 |
0,9 |
11,0 |
119,7 |
|
S (%) |
4,7 |
3,4 |
5,7 |
0,3 |
8,4 |
121,2 |
|
G2M (%) |
0,5 |
0,3 |
0,7 |
0,1 |
0,41 |
99,9 |
Таблица 2. Коэффициент вариации (СV, %), средняя взвешенная (х ), медиана (Ме) и стандартное отклонение ( о ), параметров КЦ у лиц II группы с поражением КМ, n=14
|
Показатель |
X |
Ме |
6 |
Нижний квартиль 25% |
Верхний квартиль 75% |
Cv |
|
G0–1 (%) |
94,3 |
95,8 |
5,3 |
88,5 |
99,11 |
5,6 |
|
S+G2M (%) |
5,7 |
5,1 |
5,3 |
0,89 |
11,52 |
93 |
|
G2M/S |
30,2 |
9,4 |
35,1 |
2,7 |
60 |
116 |
|
(S+G2M)/G0-1 |
6,4 |
4,4 |
6,2 |
0,90 |
13,0 |
96 |
|
S (%) |
5,3 |
3,6 |
5,3 |
0,45 |
11,1 |
100 |
|
G2M (%) |
0,4 |
0,4 |
0,3 |
0,23 |
0,6 |
73 |
судить о количестве клеток, находящихся в неактивной фазе КЦ (G0).
Значения медианы и средней взвешенной позволяют сделать вывод об отличии распределения от нормального. Коэффициент вариации значительно превышает пороговое значение в 33%, что исключает возможность нормального распределения и подтверждает большой разброс значений (табл. 1, 2).
При оценке индивидуальных и средних показателей КЦ больных с отсутствием поражения КМ наблюдалась достаточно высокая стойкость и более низкая вариабельность значений всех параметров по сравнению с пациентами с поражением КМ. Как при ЛХ, так и при ВНХЛ в I и II группах СV показателей пролиферации незначительно превышал пороговое значение, равное 33%, таким образом, разброс индивидуальных значений исследуемых параметров был невысок.
Как в I, так и во II группе не выявлено статистически значимых различий в параметрах содержания клеток в различных фазах КЦ диплоидного и анеуплоидного клонов между индолентными и агрессивными НХЛ.
Сравнительный анализ параметров КЦ у больных I группы с поражением КМ выявил статистически значимое увеличение доли клеток в фазах G0-1 (U=25, р=0,004), G2М (U=16, р=0,0005) и S (U=34, р=0,02). Доля клеток пролиферативного пула (S+G2M U=28, р=0,007), соответственно, также была выше у данной когорты больных. Поражение КМ влекло за собой статистически значимое повышение цитокинетического индекса (ЦКИ) (G2M+S)/G0-1 (U=27, р=0,006). Сравнительный анализ параметров КЦ мононуклеаров КМ больных II группы с поражением КМ и без выявил статистически значимое увеличение доли клеток в фазах G2М (U=29,5, р=0,0003) у больных без поражения КМ.
Изучение особенностей кинетики КЦ мононуклеаров непораженного КМ больных I и II групп показало отсутствие статистически значимых различий данных параметров у пациентов с НХЛ. У больных с рецидивом ЛХ выявлено статистически значимое увеличение доли клеток в фазе G0-1 (90,9±3,4%) по сравнению с первичными пациентами (86,4±5,9 F=3,1 рдисперсий=0,1). Количество клеток в пролиферативном пуле в целом (S+G2M), напротив, было выше у больных I группы (13,6±5,9% > 9,1±3,4% F=3,1 р =0,1).
дисперсий
Проведенное исследование выявило слабую экспрессию белка Bcl2 в пробах КМ больных лимфомами вне его поражения как при ЛХ (уровень положительных клеток 2,0±1,0% в I группе и 3,6±1,8% во II группе), так и при НХЛ (уровень положительных клеток 2,7±1,8% в I группе и 4,9±2,8% во II группе), а также прогрессивное увеличение данного показателя в КМ с опухолевой экспансией (уровень положительных клеток 28,9±4% в I группе и 39,4±9,4% во II группе).
Экспрессия маркера Ki67 в КМ больных лимфомами вне его поражения составила: при ЛХ в I группе – 2,4±1,0%, во II группе – 1,6±1,8%; при НХЛ в I группе – 4,2±2,7%, во II группе – 3,0±2,3%, что было ниже по сравнению с пробами пораженного КМ. В пробах КМ с опухолевым поражением отмечено повышение доли клеток, экспрессирующих Ki67: в I группе – до 5,18±2,3%, во II группе – до 6,69±1,6%.
Том / Vol. 8 № 2 /2018

Malignant Tumours
Злокачественные опухоли
Том / Vol. 8 № 2 /2018

Проведенный в исследовании корреляционный анализ выявил, что наличие анеуплоидии в КМ (p<0,05) прямо коррелировало: с показателем процентного содержания бластных клеток (БК) в периферической крови (ПК) (|5=0,5); показателем содержания ЛДГ крови (^=0,5); повышением клеток, экспрессирующих Bcl2 (^=0,5), и, что закономерно, с повышением процента БК в ПК (f)=0,5). Повышение экспрессии Bcl2 коррелировало: с повышением процентного содержания БК в КМ (^=0,7) и ПК (р=0,6); наличием анеуплоилии в КМ (^=0,5); повышением доли клеток в фазах G0-1 (£ =0,5), S (р=0,5), пролиферативного пула в целом S+G2M (£=0,6), ЦКИ (р=0,6); повышением экспрессии Ki67 (^=0,5), а также лейкоцитов в ПК (^=0,5). Повышение экспрессии Bcl2 высоко и весьма высоко отрицательно коррелировало с показателями общей (|5=–0,8) и беспро-грессивной ( ^=–0,9) выживаемости больных. Экспрессия маркера Ki67 прямо коррелировала с показателями общей (^=0,5) и беспрогрессивной (₽=0,6) выживаемости, а также с показателями кинетики КЦ (G0-1, S+G2M, (S+G2M)/G0-1, S, G2M).
Анализ гамма-корреляции выявил, что повышение отношения G2M/S ассоциировалось с наличием В-симптомов ( γ =0,9) и в большей степени было характерно для лиц женского пола (p<0,05). Возникновение «отрицательного события» заметно коррелировало с наличием анеуплоидии ( γ =0,7). Риск возникновения прогрессирования заболевания был выше у лиц мужского пола.
У пациентов II группы с поражением КМ выявлен ряд статистически значимых корреляций. Показатель доли клеток в G0-1 фазе отрицательно коррелировал с уровнем экспрессии Ki67 (^=–0,6) и Bcl2 (^ =–0,8). Повышение процента клеток в фазе G2M КЦ было сопряжено с повышением ЛДГ ( ^=0,7) в биохимическом
Кумулятивная доля выживших (Kaplan-Meier)
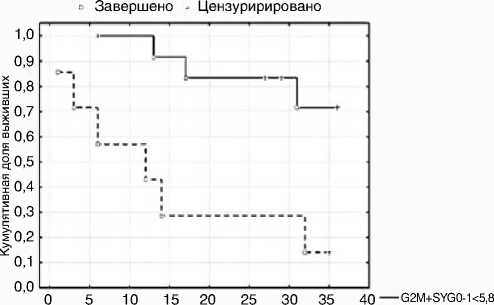
G2M+SYG0-1>5,8
Время наблюдения, месяцы
Рисунок 1. Беспрогрессивная выживаемость в группе первичных пациентов с поражением КМ в зависимости от критического уровня ЦКИ (Log-Rank p=0,008; Gehan’s Wilcoxon p=0,005)
Кумулятивная доля выживших (Kaplan-Meier) Завершено Цензуририровано
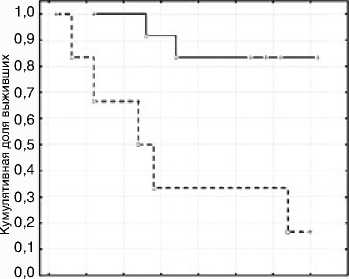
Время наблюдения, месяцы
S+G2/MYG0-1<5,8
0 5 10 15 20 25 30 35 40 S+G2/MYG0-1>5,8
Рисунок 2. Общая выживаемость в группе первичных пациентов с поражением КМ в зависимости от уровня ЦКИ (Log-Rank p=0,007; Gehan’s Wilcoxon p=0,009)
анализе крови. Повышение экспрессии Ki67 и Bcl2 коррелировало положительно с повышением доли клеток пролиферативного пула S+G2M и повышением ЦКИ. Данное обстоятельство отражало степень активности злокачественного процесса. Повышение G2M/S коррелировало положительно с классическими клиникоморфологических факторами прогноза, такими как ЛДГ и СОЭ ( ₽=0,7), и было сопряжено с более низкой экспрессией Bcl2 (^=–0,8). Наличие анеуплоидного клона в КМ больных II группы коррелировало статистически значимо с повышением ЛДГ и СОЭ (р=0,6), а также показателя G2M/S (|5=0,7) и отмечалось преимущественно у лиц женского пола. Гамма-анализ выявил дополнительные заметные положительные корреляции ( γ =0,5) между процентным содержанием мононуклеаров в фазе G2M КЦ и процентным содержанием БК в миелограмме.
Для пациентов I и II групп с отсутствием поражения КМ не выявлено значимых корреляций. Наблюдались корреляции между общеизвестными классическими клинико-морфологическими факторами прогноза, такими как СОЭ, ЛДГ, уровень гемоглобина крови. Данные показатели обладали автокорреляцией, ассоциировались с распространенностью процесса и в достоверной степени не были сопряжены с риском возникновения «отрицательного события».
Для установления взаимосвязи основных показателей апоптоза и кинетики КЦ с показателями выживаемости больных, а также характера этой взаимосвязи проведен регрессионный анализ по Коксу. Для каждого из факторов на основании критерия χ2 было сформировано пороговое значение признака, что позволило рассчитать беспрогрессивную и общую выживаемость по методу Каплана – Майера соответственно найденным пороговым значениям. Так, при повышении экспрессии Bcl2 ≥28%, Ki67 ≥5,21%, показателей (S+G2M)/ G0–1 ≥5,8%, S+G2M ≥2%, увеличении клеток в фазе S ≥4,7% и снижении параметра G2M/S ≤42% отмечалось статистически значимое снижение показателей не только беспрогрессивной, но и общей выживаемости пациентов. Наличие анеуплоидии, бластно-лимфоидного типа поражения КМ, БК в ПК ≥5% и лейкоцитоза ≥15 × 109/л также статистически значимо снижало показатели беспрогрес-сивной и общей выживаемости больных (р<0,05). Например, при оценке зависимости выживаемости от уровня ЦКИ выявлено статистически значимое увеличение общей и беспрогрессивной выживаемости пациентов с показателями (G2М+S)/G0-1<5,8 (рис. 1 и 2).
Список литературы Морфофункциональная характеристика гемопоэтической ткани больных лимфомами
- Архипова О. Е., Черногубова Е. А., Лихтанская Н. В., Тарасов В. А., Кит О. И., Матишов Д. Г. Анализ встречаемости онкологических заболеваний в ростовской области. Пространственно-временная статистика//Фундаментальные исследования. 2013. № 7-3. С. 504-510.
- Arkhipova O. E., Chernogubova E. A., Likhtanskaya N. V., Tarasov V. A., Kit O. I., Matishov D. G. Analiz vstrechaemosti onkologicheskikh zabolevanii v rostovskoi oblasti. Prostranstvenno-vremennaya statistika. Fundamental’nye issledovaniya. 2013. No. 7-3. P. 504-510 (In Russ.)
- Каприн А. Д. Злокачественные новообразования в России в 2012 году (заболеваемость и смертность)/под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. М.: ФГБУ «МНИОИ им. П. А. Герцена» Минздрава России, 2014. 249 c.
- Kaprin A. D. Zlokachestvennye novoobrazovaniya v Rossii v 2012 godu (zabolevaemost’ i smertnost’). Eds. A. D. Kaprin, V. V. Starinskii, G. V. Petrova. Moscow: FGBU "MNIOI im. P. A. Gertsena" Minzdrava Rossii, 2014. 249 p. (In Russ.)
- Поддубная И. В. Российские клинические рекомендации по диагностике и лечению лимфопролиферативных заболеваний. Под руководством профессора И. В. Поддубной, профессора В. Г. Савченко//Современная онкология. М.: Медиа Медика, 2013. 104 с.
- Kaprin A. D. Zlokachestvennye novoobrazovaniya v Rossii v 2012 godu (zabolevaemost’ i smertnost’). Eds. A. D. Kaprin, V. V. Starinskii, G. V. Petrova. Moscow: FGBU "MNIOI im. P. A. Gertsena" Minzdrava Rossii, 2014. 249 p. (In Russ.)
- Каприн А. Д. Злокачественные новообразования в России в 2015 году (заболеваемость и смертность)/под ред. А. Д. Каприна, В. В. Старинского, Г. В. Петровой. М.: ФГБУ «МНИОИ им. П. А. Герцена» филиал ФГБУ «НМИРЦ» Минздрава России, 2017. 250 с.
- Kaprin A. D. Zlokachestvennye novoobrazovaniya v Rossii v 2015 godu (zabolevaemost’ i smertnost’). Eds. A. D. Kaprin, V. V. Starinskii, G. V. Petrova. Moscow: FGBU "MNIOI im. P. A. Gertsena" filial FGBU "NMIRTs" Minzdrava Rossii, 2017. 250 p. (In Russ.)
- Кит О. И., Шатова Ю. С., Новикова И. А., Владимирова Л. Ю., Ульянова Е. П., Комова Е. А., Кечеджиева Э. Э. Экспрессия P53 и BCL2 при различных подтипах рака молочной железы//Фундаментальные исследования. 2014. № 10-1. С. 85-88.
- Kit O. I., Shatova Yu. S., Novikova I. A., Vladimirova L. Yu., Ul’yanova E. P., Komova E. A., Kechedzhieva E. E. Ekspressiya P53 i BCL2 pri razlichnykh podtipakh raka molochnoi zhelezy. Fundamental’nye issledovaniya. 2014. No. 10-1. P. 85-88. (In Russ.)
- Brunelle J. K., Ryan J., Yecies D., Opferman J. T., Letai A. MCL-1-dependent leukemia cells are more sensitive to chemotherapy than BCL-2-dependent counterparts. J. Cell Biology. 2009. Vol. 187. Р. 429-442.
- Odenike O., Onida F., Padron E. Myelodysplastic syndromes and myelodysplastic/myeloproliferative neoplasms: an update on risk stratification, molecular genetics, and therapeutic approaches including allogeneic hematopoietic stem cell transplantation. Am. Soc. Clin. Oncol. Educ. Book. 2015. P. e398-412.
- Greenberg P. L., Stone R. M., Al-Kali A., Bejar R., Bennett J. M., Bloomfield C. D. et al. NCCN (National Comprehensive Cancer Network) Clinical Practice Guidelines in Oncology. Myelodysplastic syndromes. Version 1. 2016.
- Della Porta M. G., Tuechler H., Malcovati L., Schanz J., Sanz G., Garcia-Manero G. et al. Validation of WHO classification-based Prognostic Scoring System (WPSS) for myelodysplastic syndromes and comparison with the revised International Prognostic Scoring System (IPSS-R). A study of the International Working Group for Prognosis in Myelodysplasia (IWG-PM). Leukemia. 2015. Vol. 29 (7). P. 1502-1513.
- Carbone P. P., Kaplan H. S., Musshoff K., Smithers D.W., Tubiana M. Report of the Committee on Hodgkin’s Disease Staging Classification. 1971. Cancer Res. Vol. 31 (11). P. 1860-1861.
- Lister T. A., Crowther D., Sutcliffe S. B., Glatstein E., Canellos G. P. et al. Report of a committee convened to discuss the evaluation and staging of patients with Hodgkin’s disease: Cotswolds meeting. J. Clin. Oncol. 1989. Vol. 7 (11). P. 1630-1636.
- Ланг Т. А., Сесик М. Как описывать статистику в медицине. Руководство для авторов, редакторов и рецензентов: перевод с англ./под ред. В. П. Леонова. Москва: Практическая медицина, 2011. 480 с.
- Lang T. A., Sesik M. Kak opisyvat’ statistiku v meditsine. Rukovodstvo dlya avtorov, redaktorov i retsenzentov: perevod s angl. Ed. V. P. Leonov. Moscow: Prakticheskaya meditsina, 2011. 480 p. (In Russ.)
- Royston P., Parmar M. K., Altman D. G. Visualizing of survival in time-to-event studies: acompliment to Kaplan-Meier Plots. J. Natl. Cancer Inst. 2008. Vol. 100. Р. 92-97.


