Морфофункциональная характеристика поджелудочной железы крыс при экспериментальной гипергликемии пищевым сахаром
Автор: Шидаков Юсуф Махмудович, Шарова Елена Валерьевна, Абдумаликова Иннобатхон Абдусаттаровна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 5 т.6, 2020 года.
Бесплатный доступ
Экспериментальное моделирование сахарного диабета, вызванное воздействием аллоксана, стрептозотоцина, дитизона в различной дозировке и кратности введения не совсем эквивалентно по этиопатогенетическим механизмам развитию данной патологии у человека. Большой интерес представляют диет-индуцированное моделирование патологического процесса. Одним из самых важных и доступных донаторов глюкозы является пищевой сахар (сахароза). С целью изучения развития сахарного диабета у крыс пищевым сахаром, были сформированы 2 группы животных: контрольную (стандартный корм) и опытную (пищевой сахар, 30 г), у которых через 2 недели взяли кровь для биохимических исследований, а через месяц провели отбор гистологических препаратов поджелудочной железы. При систематическом приеме избыточного количества пищевого сахара через 2 недели произошел рост глюкозы в крови на 25%, в то же время уровень холестерина повысился в 3 раза. Через месяц исследования наблюдается углеводная дистрофия поджелудочной железы, сочетающаяся с вакуольной дистрофией органа и развитием очагов некроза и склероза. Кормление крыс в течение месяца пищевым сахаром может служить экспериментальной моделью углеводной дистрофии поджелудочной железы.
Поджелудочная железа, сахарный диабет, морфология, апоптоз, некроз, гипергликемия, холестерин
Короткий адрес: https://sciup.org/14116261
IDR: 14116261 | УДК: 616.37-008.-092.9-092:612.345:61:577.12 | DOI: 10.33619/2414-2948/54/11
Текст научной статьи Морфофункциональная характеристика поджелудочной железы крыс при экспериментальной гипергликемии пищевым сахаром
Бюллетень науки и практики / Bulletin of Science and Practice
УДК 616.37-008.-092.9-092:612.345:61:577.12
Изучению состояния поджелудочной железы (ПЖ) при экспериментальных диабетах посвящено большое количество морфологических исследований [1–7].
Экспериментальное химическое моделирование сахарного диабета обычно вызывается воздействием аллоксана, стрептозотоцина, дитизона в различной дозировке и кратности введения [2, с. 13; 6, с. 46–49]. Механизм действия этих веществ заключается в деструкции β-клеток островков Лангерганса. При использовании аллоксан-стрептозотоциновых моделей, как правило, формируется СД 1 или смешанного типа. При аллоксан-индуцированном диабете Г. Н. Снигур с соавторами выявили некроз β-эндокриноцитов [4, с. 109]. Развитие стрептозотоцин-индуцированного диабета сопровождаются как «некробиотическими процессами, так и апоптозом β-клеток островков Лангерганса разной выраженности» [4, с. 109]. В большинстве случаев в основе этих методов лежит острое разрушение или значительные метаболические нарушения β-клеток островков поджелудочной железы.
Гораздо больший интерес представляют диет-индуцированное моделирование патологического процесса. В естественной среде, чаще всего, развитие сахарного диабета 2 типа вызывается хроническим избытком углеводного питания. Эндокринологи значительную роль в развитии сахарного диабета 2 типа отводят простым углеводам, поставляющим значительные количества глюкозы в процессе их распада при переваривании в ЖКТ. Одним из самых важных и доступных донаторов глюкозы является пищевой сахар (сахароза), который в эволюционном процессе развития жизни стал повсеместно использоваться человеком в недалеком прошлом.
Избыток сахара вызывает нарушение углеводного обмена и развитие гипергликемии, способной инициировать биохимические и структурные изменения, характерные для СД 2 типа. Гипергликемия стимулирует уровень секреторной активности бета-клеток, приводя к истощению продукции инсулина, индуцирует процессы гликозилирования протеинов и липидов [2, с. 8; 8, с. 23; 9]. В результате нарушений углеводного обмена в клетках поджелудочной железы развиваются изменения липидного и белкового метаболизма. Повышение уровня глюкозы в крови усиливает инсулинорезистентность и приводит к снижению чувствительности β-клеток, вызывая нарушение секреции инсулина. Развивается порочный круг: повышение уровня глюкозы усиливает инсулинорезистентность, что способствует развитию еще более выраженной гипергликемии [10, с. 34; 11–14]. Гипергликемия сопровождается активацией процессов перекисного окисления, которые приводят к избыточному образованию свободных радикалов, оказывающих цитотоксическое действие на клетки и ткани [2, с. 8].
Модель внутрибрюшинного введения глюкозы характеризуется отсутствием прямого повреждения островков Лангерганса поджелудочной железы, однако при высоких дозах внутрибрюшинного введения глюкозы вызывает расстройство водно-электролитного баланса, развитие обезвоживания и появление кристаллурии и камнеобразования в почках [2, с. 13–14].
Всасывание глюкозы из ЖКТ приводит к наибольшей стимуляции В-клеток и высвобождению инсулина, чем при поступлении глюкозы в кровь, минуя желудочнокишечный тракт, что способствует созданию более продолжительной гипергликемии. Мы индуцировали гипергликемию у крыс путем естественного ежедневного перорального введения глюкозы несбалансированным углеводным рационом питания преимущественно сахаром в течение месяца.
Цель исследования : Изучить характер биохимических и структурных изменений поджелудочной железы крыс при несбалансированной углеводной диете пищевым сахаром.
Материалы и методы исследования
Работа выполнена на 14 белых беспородных крысах–самцах, весом 180–250 г, которые составили 2 группы: первую группу (n=7) кормили углеводами (пищевым сахаром 30 г), а вторую (n=7) — стандартным кормом (контроль). Пероральный прием несбалансированной диеты с пищевым сахаром позволил нам создать стойкую гипергликемию достаточно продолжительное время без прямого повреждающего действия на β-клетки поджелудочной железы.
Через 15 дней собрали кровь и отделили сыворотку. В сыворотке крови определили уровень холестерина и глюкозы энзиматическим колорометрическим методом с использованием тест–систем Vital (Россия). Полученные результаты обработали в программе SPSS16.0, достоверность различий определяли по t-критерию Стьюдента, при Р<0,05. Через месяц эксперимента провели отбор гистологических образцов. Кусочки поджелудочной железы фиксировали в 10% нейтральном формалине с последующим обезвоживанием в спиртах возрастающей концентрации, заливались парафином и готовили гистологические срезы толщиной 5-7 мкм. Готовые препараты окрашивали гематоксилин-эозином и изучали под микроскопом Olympus В×40 (Япония) с одновременной фотосъемкой и описанием обнаруженных изменений.
Содержание и использование лабораторных животных при проведении исследования соответствовало международным и национальным правилам по этическому обращению с животными.
Результаты и их обсуждение.
Биохимические исследования показали рост концентрации глюкозы в крови крыс через 2 недели приема сахара на 25,7% (Р <0,05) в опытной группе по сравнению с контрольной, при этом содержание глюкозы через 2 недели исследования находилось в пределах физиологической нормы (Рисунок 1). Аналогичные результаты получены С. С. Целуйко с соавторами. Содержание глюкозы крови у крыс в течение двух недель эксперимента повышалось, но показатели имели значительные колебания у разных животных. Достоверный рост и стабилизация уровня глюкозы у большинства крыс авторы отмечают на 4–5 неделе эксперимента [2, с. 15].
и опыт
3,45

глюкоза холестерин
Рисунок 1. Показатели глюкозы и холестерина (M±m) у крыс при углеводной диете (сахаром).
Таким образом, к концу 2 недели эксперимента у крыс происходит вариабельное увеличение концентрации глюкозы в крови, но при этом ее уровень остается в пределах физиологической нормы. В клетках развиваются метаболические и физиологические нарушения, компенсируемые организмом. Часть избытка глюкозы используется для синтеза гликогена. Рост концентрации глюкозы индуцирует повышенную секрецию инсулина, который обеспечивает содержание глюкозы в крови в пределах нормы и стимулирует преобразование избыточной глюкозы в нейтральный жир. Цитоплазматический ацетил-КоА, образовавшийся в результате метаболизма глюкозы, служит субстратом в синтезе высших жирных кислот (ВЖК), которые упаковываются и запасаются в форме триацилглицеридов, но наиболее активно преобразуется в холестерин.
Согласно наших исследований концентрация холестерина в течение 2 недель выросла в 2,97 раза с высокой степенью достоверности (Р<0,001). На начальном этапе несбалансированного кормления крыс пищевым сахаром концентрация глюкозы поддерживается на физиологическом уровне благодаря ее трансформации в гликоген, триглицериды и холестерин. На стадии развития гипергликемии повышение уровня глюкозы в крови на 26,7% сопровождалось ростом концентрации холестерина в 2,97 раза.
Работы, рассматривающие структурно-функциональные особенности поджелудочной железы при нарушении углеводного обмена и толерантности к глюкозе, затрагивают, в основном, эндокринную часть железы [2–4, 7, 15].
В работе Л. А. Звенигородской и Н. Э. Хачатуряни отмечается тесная взаимосвязь эндо-и экзокринной функций поджелудочной железы ПЖ [16, с. 57]. Показано, что у больных с нарушениями эндокринной функции ПЖ отмечаются выраженные изменения внешнесекреторной функции ПЖ.
При обзорном рассмотрении гистологических препаратов поджелудочной железы крыс, находившихся в течение месяца на несбалансированном питании сахаром, мы также фиксировали изменения, как эндокринного, так и экзокринного аппаратов ПЖ (Рисунок 2).
Наблюдается увеличение размеров ацинусов экзокринной части поджелудочной железы. В этих ацинусах отмечается просветление цитоплазмы ациноцитов и перемещение их ядер к периферии. При этом наблюдается уменьшение ядер ациноцитов и их гиперхромия. В отдельных случаях ациноциты теряют свои ядра и превращаются в светлые пространства, заполненные смесью гликогена и липидов. В большинстве ацинусов не удается обнаружить центр ацинозной клетки, что может свидетельствовать об облитерации истоков протоков экзокринного аппарата поджелудочной железы. Это может быть связано с уменьшением функций ациноцитов, о чем свидетельствует уменьшение, либо полное исчезновение в их цитоплазме гранул зимогена. В конечном счете ациноциты превращаются в вакуоли, заполненные гликогеном, и напоминают структуру гликогеноза. Одновременно, в отдельных ацинарных клетках обнаруживаются небольшие пустоты, четко ограниченные своеобразной мембраной, и картина напоминает гиалиноз ткани.
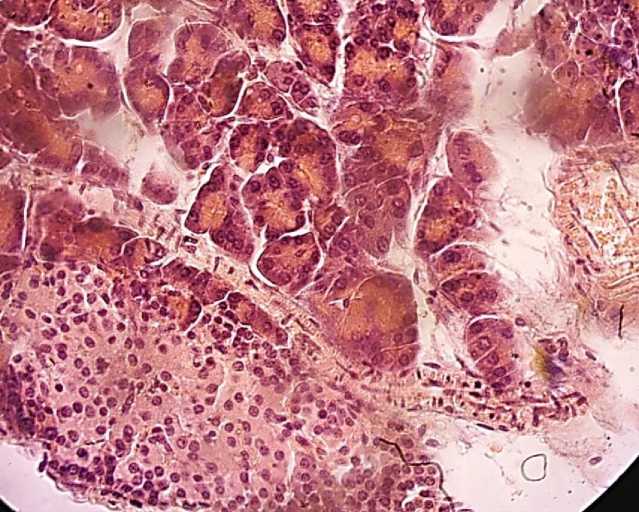
Рисунок 2. Поджелудочная железа крыс, находящихся на углеводном рационе (сахар), ув. ×400.
Характерной особенностью изменений эндокринного аппарата поджелудочной железы можно считать очаги мелких некрозов и мутного набухания со стороны эндокринного аппарата железы. Прежде всего, обращает на себя внимание резкое сокращение их количества, а также размеров в поле зрения микроскопа. Островки Лангерганса приобретают причудливую форму, подвергаются парциальному некрозу и начинают замещаться соединительной тканью (Рисунок 3). Таким образом, выраженное моделирование охватывает, как эндокринный, так и экзокринный аппарат поджелудочной железы.
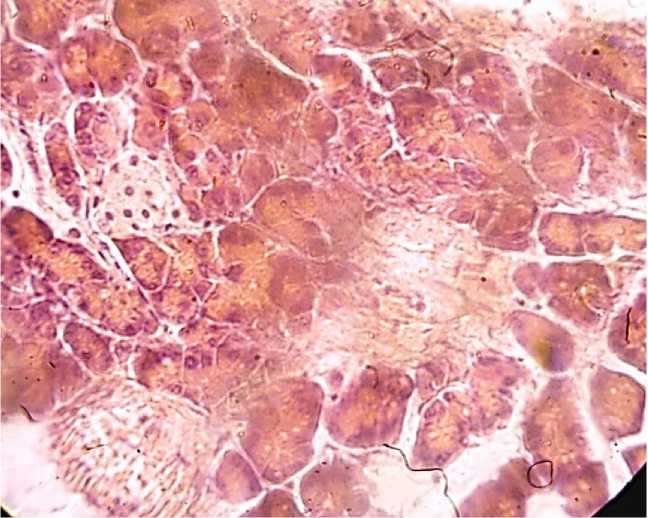
Рисунок 3. Атрофия островков Лангерганса, ув. ×400.
Наблюдаются существенные нарушения кровеносных сосудов органа, прежде всего, отмечается облитерация внутриорганных сосудов и замещение их соединительнотканными тяжами. Сохранившийся просвет сосудов наделен рыхлой стенкой, пропитанной глюкозой. Стенка сосудов выглядит набухшей, отечной, с захватом паравазального пространства.
Вывод
Кормление крыс в течение месяца пищевым сахаром вызывает изменения эндо- и экзокринного аппаратов и может служить экспериментальной моделью углеводной дистрофии поджелудочной железы.
Углеводная дистрофия поджелудочной железы сочетается с вакуольной дистрофией органа и развитием очагов некроза и склероза.
Список литературы Морфофункциональная характеристика поджелудочной железы крыс при экспериментальной гипергликемии пищевым сахаром
- Колесник Ю. М., Абрамов А. В., Василенко Г. В. Изменение эндокринной части поджелудочной железы белых лабораторных крыс при сахарном диабете, адаптации к гипоксии и их сочетании (иммуноцитохимическое исследование) // Морфология. 1996. №1. С. 91-95.
- Целуйко С. С., Красавина Н. П., Корнеева Л. С., Лашин С. В., Остронков В. С. Морфофункциональная характеристика поджелудочной железы и легкого при экспериментальной гипергликемии на фоне применения дигидрокверцетина. Благовещенск, 2017. 150 с.
- Иванова В. Ф., Пузырев А. А. Структурно-функциональные изменения в поджелудочной железе белой крысы при введении глюкозы // Морфология. 2006. №1. С. 67-71.
- Снигур Г. Л., Смирнов М. В., Шмидт М. Я., Почепцов М. П., Воронкова М. П. Сравнительные аспекты ультраструктурных изменений инсулоцитов панкреатических островков при экспериментальном диабете // Волгоградский научно-медицинский журнал. 2012. №1. С. 108-111.
- Спасов А. А., Воронкова М. П., Снигур Г. Л., Чепляева Н. И., Чепрунова М. В. Экспериментальная модель сахарного диабета 2 типа // Биомедицина. 2011. №3. С. 12-18.
- Самотруева М. А., Сергалиева М. У. Сахарный диабет: особенности экспериментального моделирования // Астраханский медицинский журнал. 2019. Т.14. №3. С. 45-57.
- Никонова Л. Г. Структурно-функциональные особенности элементов поджелудочной железы у животных с различной толерантностью к глюкозе // Медицинский альманах. 2011. №5 (18). С. 160-163.
- Древаль А. В., Мисникова И. В., Барсукова И. А. Механизмы нарушения обмена глюкозы у лиц с "предиабетом" // Ожирение и метаболизм. 2009. №4. С. 23-27.
- Кендыш И. Н. Регуляция углеводного обмена. М.: Медицина, 1985. 271 с.
- Аметов А. С. Инсулиносекреция и инсулинорезистентность: две стороны одной медали // Проблемы эндокринологии. 2002. Т. 48. №3. С. 31-37.
- Балаболкин М. И., Клебанова Е. М. Роль инсулинорезистентности в патогенезе сахарного диабета типа 2 // Терапевтический архив. 2003. №1. С. 72-77.
- Federici M., Hribal M., Perego L., Ranalli M., Caradonna Z., Perego C.,.Marlier L. N. et al. High glucose causes apoptosis in cultured human pancreatic islets of Langerhans: a potential role for regulation of specific Bcl family genes toward an apoptotic cell death program // Diabetes. 2001. V. 50. №6. P. 1290-1301.
- DOI: 10.2337/diabetes.50.6.1290
- Francini F., Del Zotto H., Gagliardino J. J. Effect of an acute glucose overload on islet cell morphology and secretory function in the toad // General and comparative endocrinology. 2001. V. 122. №2. P. 130-138.
- DOI: 10.1006/gcen.2001.7617
- Faerch K., Borch-Johnsen K., Holst J. J., Vaag A. Pathophysiology and aetiology of impaired fasting glycaemia and impaired glucose tolerance: does it matter for prevention and treatment of type 2 diabetes? // Diabetologia. 2009. V. 52. №9. P. 1714-1723.
- DOI: 10.1007/s00125-009-1443-3
- Иванова В. Ф. Цитотомия многоядерных клеток эпителия в условиях эксперимента // Морфология. 2012. Т. 141. №1. С. 56-61.
- Звенигородская Л. А., Хачатурян Н. Э. Функциональные и клинико-морфологические изменения поджелудочной железы при метаболическом синдроме // Consilium Medicum. 2016. Т. 18. №8. C. 51-58.


