Морфофункциональная оценка FAP+ и -SMA+-клеток в различные сроки токсического фиброза печени у крыс
Автор: Лебедева Е.И.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.31, 2023 года.
Бесплатный доступ
Углубленное изучение источника фиброгенной популяции клеток применительно к этиологии и стадии фиброза, а также понимание молекулярных механизмов, регулирующих изменение фенотипа печеночных фибробластов, имеют первостепенное значение при разработке фармакологических препаратов. Цель исследования - морфофункциональная оценка активированных портальных фибробластов (FAP+) и жир-накапливающих клеток (α-SMA+) печени в различные сроки токсического фиброза печени крыс. Фиброз и цирроз печени у крыс-самцов Wistar индуцировали раствором тиоацетамида в течение 17 недель. Морфологическое исследование печени проводили на парафиновых срезах, окрашенных гематоксилином и эозином, методом Маллори, иммуногистохимическое исследование производили с помощью поликлональных кроличьих антител к антигену портальных фибробластов FAP и с помощью моноклональных мышиных антител к антигену α-SMA+ клеток. До наступления стадии фиброза печени F3/F4 с 3 по 7 неделю количество FAP+ и α-SMA+-клеток увеличивалось попеременно. На этапах трансформации фиброза в цирроз с 7 по 11 неделю повышение их количества происходило незначительно. На стадии неполного (F5) и до наступления достоверного цирроза (F6) с 11 по 15 неделю количество FAP+ и α-SMA+-клеток было непостоянным и происходило попеременное увеличение и уменьшение их количества. α-SMA+-клетки до начала процесса трансформации фиброза в цирроз (F4/F5) наблюдали в синусоидах и очагах некроза. Затем они выявлялись как в синусоидах, так и в соединительнотканных трабекулах. FAP+-клетки на стадии портального фиброза (F1) локализовались около междольковых сосудов и междольковых желчных протоков портальных зон, а с периода F2/F3 их выявляли в соединительнотканных трабекулах и синусоидах. В количественном отношении на всех стадиях фиброза преобладали α-SMA+-клетки. На основании полученных результатов можно предположить, что FAP+-клетки вносят основной вклад в развитие портального и начального этапа мостовидного фиброза. Их следует рассматривать как одну из популяций миофибробластов при тиоацетамид-индуцированном фиброгенезе печени.
Печень, крысы, фиброз, fap+ клетки, α-sma+ клетки
Короткий адрес: https://sciup.org/143181181
IDR: 143181181 | DOI: 10.20340/mv-mn.2023.31(3).794
Текст научной статьи Морфофункциональная оценка FAP+ и -SMA+-клеток в различные сроки токсического фиброза печени у крыс
Lebedeva EI. The morphological and functional assessment of FAP+ and α-SMA+-cells in different times of rat toxic liver fibrosis. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(3):794. (3).794
Введение. При хронических заболеваниях печени разрастание фиброзной соединительной ткани связано с их этиологией, стадией фиброза и обусловлено гетерогенностью популяцией миофибробластов, вовлеченных в процесс, жиронакапливающих клеток, портальных фибробластов, циркулирующих фиброцитов, гемопоэтических и мезенхимальных стволовых клеток костного мозга [1-4]. Жиронакапливающие клетки (далее - ЖК) считают основной клеточной популяцией, синтезирующей межклеточное вещество [4]. В литературе они имеют разные названия: клетки Ито, липоциты печени, перисинусоидные клетки, перициты и звездчатые клетки. Эмбриональное происхождение ЖК не установлено, но известно, что они экспрессируют белки энтодермы и мезодермы. В здоровой печени ЖК располагаются в перисинусоидном пространстве, контактируя с гепатоцитами, звездчатыми макрофагами и эндотелиоцитами, проявляя не активированный фенотип [5]. В норме ЖК неправильной формы, с округлым ядром, накапливают витамин А и жиры, синтезируют цитокины, матриксные металлопротеиназы и их тканевые ингибиторы; они практически не экспрессируют гладкомышечный альфа-актин (a-SMA). ЖК регулируют кровоток в синусоидах, функционируя как перициты, обладают низкой пролиферативной активностью и способностью к секреции коллагенов [4-5]. Токсические и вирусные поражения печени стимулируют активацию и трансдифференцировку ЖК в миофибробластический фенотип [6-7]. Этот процесс сопровождается гиперплазией и гипертрофией шероховатой эндоплазматической сети, исчезновением в цитоплазме липидных капель, изменением организации цитоскелета, избыточной экспрессией a-SMA, коллагенов и цитокинов. Механизмы активации ЖК, особенно в фазу ее инициации, весьма сложны и не до конца изучены. Предполагается, что пул покоящихся и активированных ЖК пополняется также за счет клеток костного мозга [4,8].
Портальные фибробласты (далее -ПФ) или перидуктулярные мезенхимальные клетки, являются второй популяцией клеток, вырабатывающих межклеточное вещество при фиброзе печени [1]. Сведений о функциях ПФ в норме недостаточно. Расположены они в соединительной ткани портальных зон, преимущественно вокруг междольковых желчных протоков. Происхождение и роль ПФ в развитии холестатического фиброза до сих пор остаются дискуссионными. Окончательно не установлено, являются ли ПФ основной популяцией миофибробластов и на каких этапах фиброгенеза их вклад наиболее значителен, синтезируют ли ПФ фибриллярные коллагены, типичные для фиброза или они выполняют другие роли в фиброге-незе [9-10]. Одни авторы предполагают, что активированные ПФ принимают участие в секреции межклеточного вещества только при хронических холестатических заболеваниях печени [1]. В экспериментальных работах с использованием репортерных Col-GFP и Mdr2-/- мышей на начальных стадиях холестатического фиброгенеза источником миофибробластов выступали активированные ПФ. При этом дальнейшее прогрессирование фиброза приводило к трансдифференцировке ЖК в фиброгенный фенотип [10]. Научные работы последних лет указывают, что при холестатическом фиброзе одновременно идентифицировались две разные популяции миофибробластов, происходящие из ПФ и ЖК [9-10]. Вероятно, эти противоречивые данные являются результатом различий используемых экспериментальных моделей, методов исследований и как следствие отличий в интерпретации полученных результатов. Изучение фиброгенной популяции клеток применительно к этиологии и стадии фиброза печени может имеет существенное значение в разработке антифибротических препаратов [11] .
Цель исследования: морфофункциональная оценка активированных портальных фибробластов (FAP + ) и жиронакапливающих клеток (a-SMA + ) печени в различные сроки токсического фиброза печени крыс.
Материалы и методы исследования. В настоящей публикации использованы международные термины по цитологии и гистологии [12]. В экспериментах использовались крысы-самцы породы Ви-стар массой 190-210 г. Протокол исследования одобрен комиссией по биоэтике и гуманному обращению с лабораторными животными Витебского государственного медицинского университета (протокол № 6 от 03.01.2019 г.). Животных содержали в пластико-металлических клетках по 6 особей при естественном освещении и со свободным доступом к корму и воде. Температура в помещении вивария поддерживалась на уровне 21-23°С, влажность воздуха составляла около 50%. Фиброз и цирроз печени моделировали путем хронической интоксикации тиоацетамидом (далее - ТАА), (Acros Organics). Свежеприготовленный раствор ТАА вводили интрага-стрально через зонд в дозе 200 мг/кг массы тела 2 раза в неделю в течение 17 недель. Крысы контрольной группы (n=12) получали воду без ТАА в аналогичном объеме. Животных рандомизировали на 8 групп по 12 животных в каждой в зависимости от длительности воздействия ТАА: 3 недели (1-я группа), 5 недель (2-я группа), 7 недель (3-я группа), 9 недель (4-я группа), 11 недель (5-я группа), 13 недель (6-я группа), 15 недель (7-я группа), 17 недель (8-я группа).
После декапитации под кратковременным эфирным наркозом из большой левой доли печени крыс забирали образцы печени диаметром 5-10 мм, которые помещали в 10% раствор нейтрального формалина на фосфатном буфере и фиксировали в течение 24 ч. Затем проводили обработку фиксированного материала с последующей заливкой в парафин с использованием автомата для гистологической обработки ткани STP-120 (Thermo Fisher Scientific) и станции для заливки ткани парафином EC350 (Thermo Fisher Scientific). От каждого животного получали по одному блоку для каждого метода окрашивания и с помощью ротационного микротома НМ340Е (MICROM, Laborgerate GmbH) готовили по 3-4 среза толщиной 4 мкм и помещали их на предметные стекла. Для получения обзорных гистологических препаратов срезы печени окрашивали гематоксилином и эозином, а для выявления соединительной ткани – по Маллори с помощью автомата для окраски HMS70 (Thermo Fisher Scientific). Степень фиброза определяли с помощью полуколичествен-ной шкалы K.G. Ishak [13].
Иммуногистохимическое исследование проводили на парафиновых срезах [14]. В качестве маркера активированных портальных фибробластов применяли по- ликлональные кроличьи антитела FAP (FAP-alpha, пролилэндопептидаза FAP, в разведении 1:100), активированных ЖК – моноклональные мышиные антитела к α-SMA (alpha-SMA, АСТА2, в разведении 1:1000). Использовались антитела производства Wuman Elabscience Biotechnology Incorporated Company, набор 2-step plus Poly-HRP Anti Rabbit/Mouse IgG Detection System/with DAB Solution; Retrieve-All Antigen (Unmasking System Basic), буфер для разведения антител (BioLegend), Твин-20 (Glentham Life Sciences), PBS (Melford). Для лучшей ориентации в препарате и правильной идентификации клеток, содержащих искомый антиген, срезы докрашивали гематоксилином Майера в течение 1 мин. Для объективной интерпретации результатов для каждой исследуемой серии (группы животных) включали положительный и отрицательный контроли. Иммуногистохимическую окраску оценивали, как положительную, только при отсутствии окрашивания в отрицательном контроле и, наоборот, как отрицательную при окрашивании в положительном контроле.
Гистологические препараты микро-скопировали с применением компьютерных программ анализа изображений ImageScope Color и cellSens Standard. Количество FAP-позитивных клеток (FAP+-клетки) и α-SMA-позитивных клеток (α-SMA+-клетки) подсчитывали в трех полях зрения каждого гистологического среза на базе микроскопа Olympus BX51 при увеличении объектива 40×.
Полученные результаты обрабатывались статистически. Для каждой выборки определяли нормальность частотного распределения каждого признака. Выборки не являлись малыми (n=60>50), поэтому проверку осуществляли по критерию Лиллие-форса. Получали описательные статистики и описывали количественные экспериментальные данные в виде средних и их соответствующих доверительных интервалов (М (95% ДИ: j-q)), медианы и значения 15-го – 85-го процентилей (Ме (15%;85%)). Об уровне статистической значимости различий судили по t-критерию Стьюдента; в случае отличия выборок от нормального частотного распределения использовали U-критерий Манна-Уитни.
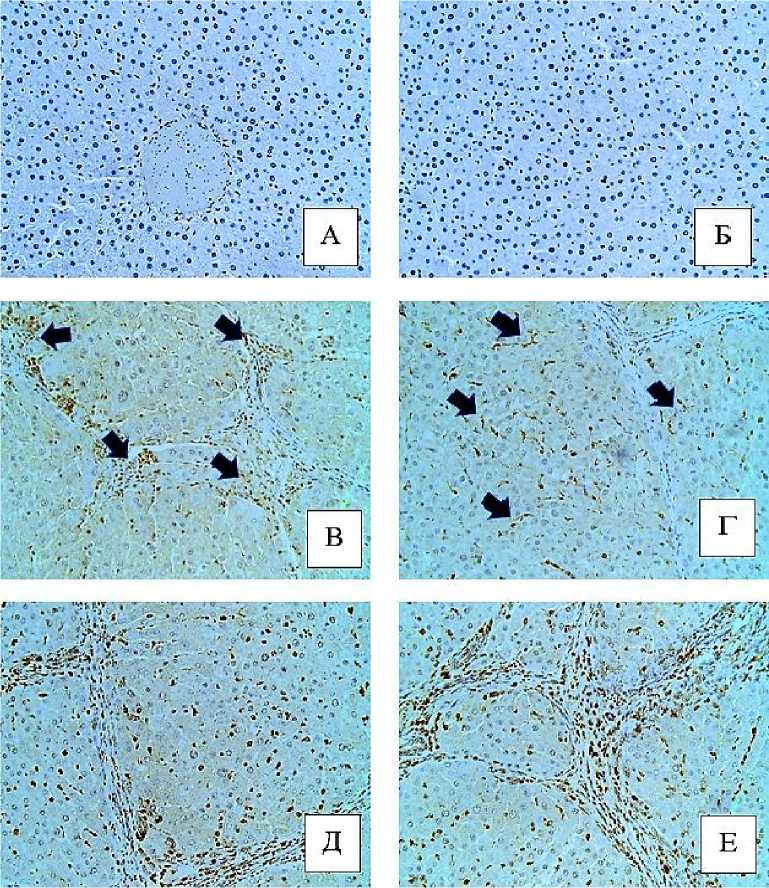
Рис. 1. Микрофото гистологических препаратов печени крыс. Окр.: иммуногистохимическое окрашивание на FAP + (А, В, Д), на a-SMA+ (Б, Г, Е), докраска гематоксилином Майера. Ув.: х400. Обозначения: А - печень крысы контрольной группы; Б - печень крысы контрольной группы; В - печень крысы с индуцированным циррозом через 9 недель после начала эксперимента; Г - печень крысы с индуцированным циррозом через 9 недель после начала эксперимента; Д - печень крысы с индуцированным циррозом через 15 недель после начала эксперимента; Е - печень крысы с индуцированным циррозом через 15
недель после начала эксперимента
Результаты исследования и обсуждение. Углубленное изучение источника миофибробластов и понимание молекулярных механизмом, регулирующих изменение фенотипа клеток печени в фиброгенную линию, имеют фундаментальное значения для разработки анти-фибротических препаратов [1-4, 11, 15]. При фиброзе органов миофибробласты преимущественно идентифицируют с помощью маркеров a-SMA (активированные ЖК) и FAP (активированные ПФ) [16-18]. В большинстве органов в условиях нормы уровни мРНК и белка FAP были низкими, за исключением молочной железы, эндометрия матки, поджелудочной железы, плаценты и кожи. В здоровой печени ЖК практически не экспрессируют маркер a-SMA [2, 4-5, 15]. Полученные в рамках настоящего исследования результаты согласуются с литературными данными. В печени контрольных крыс FAP+-клетки не определяли (рис. 1-А). В синусоидах отсутствовали a-SMA+-клетки (рис. 1-Б), однако в отдельных случаях их выявляли в стенках междольковых артерий, междольковых и поддольковых вен.
При наступлении портального фиброза печени (F1, 3 недели интоксикации) в портальных зонах наблюдали FAP+-клетки, а в синусоидах – α-SMA+-клетки. Обе популяции клеток имели округлую форму. Спустя 5 недель с появлением портального, мостовидного, местами центролобулярного и диффузного перицел- люлярного фиброза (F2/F3) количество FAP+-клеток достоверно увеличилось (р=0,0213), а α-SMA+-клеток – не изменилось (р=0,3075) по сравнению с 3 неделей. На всех последующих стадиях эксперимента установлены достоверные различия как для FAP+-клеток (р=0,00001), так и для α-SMA+-клеток (р=0,00001) по сравнению с 3 неделей эксперимента. В таблице 1 представлена динамика числа FAP+- и α-SMA+-клеток на всех этапах эксперимента.
Таблица 1
Относительная величина площади соединительной ткани и количества FAP+- и a-SMA+- клеток в различные сроки фиброза и цирроза печени крыс при интоксикации тиоацетамидом
|
Недели эксперимента/ стадии фиброза |
Площадь соединительной ткани в %, Ме (15%,'85%) |
Количество клеток, М (95% ДИ: j-q) |
|
|
FAP + |
a-SMA+ |
||
|
контроль |
1,50 (1,000;3,000) |
- |
- |
|
3 недели/F1 |
3,00 (2,000;5,000) |
5,416 (4,814;6,018) |
7,722 (6,426;9,01) |
|
5 недель/F2/F3 |
4,00 (2,000;6,500) |
9,194 (8,080;10,308) |
11,777 (10,480;13,074) |
|
7 недель/F3/F4 |
5,00 (2,000;8,000) |
11,972 (10,361;13,582) |
18,888 (17,283;20,493) |
|
9 недель/F4/F5 |
7,00 (4,000;10,000) |
14,694 (13,083;16,305) |
20,861 (18,958;22,763) |
|
11 недель/F5 |
9,00 (6,000;11,000) |
17,222 (15,979;18,465) |
25,250 (23,064;27,435) |
|
13 недель/F6 |
11,00 (7,500;14,500) |
21,944 (20,251;23,637) |
31,500 (28,381;34,618) |
|
15 недель/F6 |
16,00 (9,000;21,500) |
24,888 (22,483;27,294) |
52,722 (48,076;57,377) |
|
17 недель/F6 |
21,00 (13,000;29,000) |
29,222 (27,143;31,301) |
58,944 (54,318;63,570) |
Следует отметить, что по мере прогрессирования фиброза печени скорость разрастания соединительной ткани была не одинаковой (табл. 1). К 3-й неделе эксперимента отмечали умеренное формирование соединительной ткани в портальных зонах (рис. 2-А, рис. 2-Б). Однако, на 5-й неделе образование фиброзной соединительной ткани замедлялось, при этом ее одновременно определяли, как в портальных зонах, так и в паренхиме. К 7й неделе эксперимента интенсивность синтеза соединительной ткани сохранилась практически на прежнем уровне по сравнению с 5-й неделей (рис. 2-В). На этапе перестройки паренхимы печени и перехода от фиброза к циррозу вновь наблюдалось усиленное формирование соединительной ткани аналогичное началу эксперимента (3 неделя). На 9-й неделе происходило образование ложных печеночных долек у портальных зон (рис. 2-Г), что являлось морфологическим критерием начальной трансформации фиброза в цирроз. В период с 11-й по 17-ю неделю разрастание соединительной ткани достигало максимально значения (рис. 2-Д, рис. 2-Е). При попарном сравнении на разных стадиях эксперимента применительно к площади соединительной ткани, количеству FAP+ и α-SMA+-клеток получены отличительные результаты (табл. 2).
При анализе таблицы 2 следует, что до наступления стадии фиброза печени F3/F4 (3-й по 7-ю неделю) количество FAP+ и α-SMA+-клеток увеличивалось попеременно. На этапах трансформации фиброза в цирроз (с 7-й по 11-ю неделю) повышение их количества происходило незначительно. На стадии неполного (F5) и до наступления достоверного цирроза (F6, с 11-й по 15-ю неделю) количество FAP+ и α-SMA+-клеток было непостоянным: происходило попеременное увеличе-
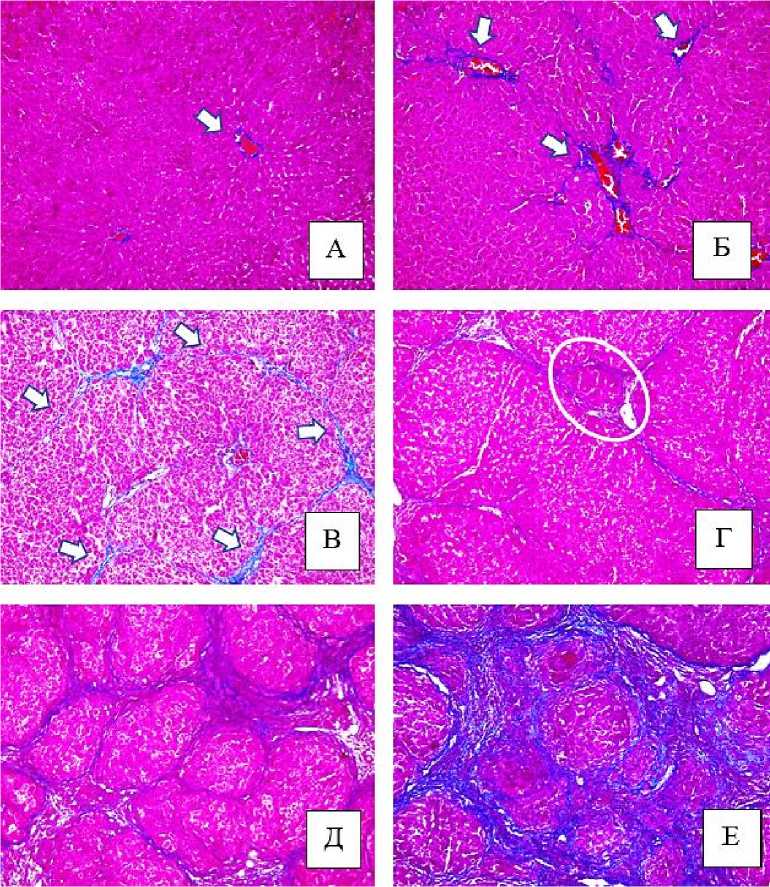
Рис. 2. Микрофото гистологических препаратов печени крыс. Окр.: по Маллори. Ув.: х200. Обозначения: А – печень крысы контрольной группы, стрелками отмечена соединительная ткань; Б – печень крысы с индуцированным циррозом через 3 недели после начала эксперимента, стрелками отмечена соединительная ткань; В – печень крысы с индуцированным циррозом через 7 недель после начала эксперимента, стрелками отмечена соединительная ткань; Г – печень крысы с индуцированным циррозом через 9 недель после начала эксперимента; Д – печень крысы с индуцированным циррозом через 13 недель; Е -печень крысы с индуцированным циррозом через 17 недель после начала эксперимента
ние и уменьшение их количества. В настоящее время объяснить такие количественные вариации не представляется возможным. Предположительно, это связано с компенсаторно-приспособительными механизмами, происходящими в печени, индуцированием/ингибировани-ем молекулярных сигналов, регулирующих пролиферацию этих клеток или другими процессами. С помощью иммуногистохимических методов было установлено, что две морфологически неоднород-
Таблица 2
Показатели значимости попарных различий площади соединительной ткани и числа FAP+ и α-SMA+-клеток
FAP+-клетки округой формы через 3 недели эксперимента располагались вокруг междольковых сосудов и вблизи междольковых желчных протоков портальных зон, а со стадии F2/F3 их выявляли в соединительнотканных септах и синусоидах (рис. 1-В, рис. 10-Д). На данном этапе рядом с желчными протоками концентрировались крупные СК19+-клетки. По морфологическим признакам они соответствуют печеночным стволовым/овальным клеткам. С 5-й недели эксперимента отмечали увеличение числа междольковых желчных протоков и к его концу вокруг одной портальной зоны можно было обнаружить более 30 их поперечных сечений (протоковая реакция) [20]. Установлено, что эпителиальные клетки протоковой реакции экспрессируют профиброгенные факторы (TGF-в, PDGF) и могут активировать ПФ [21]. На гистологических препаратах отмечалось направленное разрастание волокон соединительной ткани с FAP+-клетками от двух портальных зон через паренхиму печени навстречу друг другу, таким образом, предопределяя путь для фиброзной соединительной ткани и формирования соединительнотканных мостов - мостовидный фиброз. Важно отметить, что образование ложных печеночных долек происходило у портальных зон. Предположительно, FAP+-клетки первыми синтезируют межклеточное вещество в пор- тальных зонах и, возможно, регулируют его секрецию, участвуют в формировании соединительнотканных септ (мостов). а-БМА+-клетки выступают в роли миофибробластов позже. Вероятно, этап активации и трансдифференцировки ЖК более продолжительный или молекулярные сигналы, регулирующие смену фенотипа клеток, индуцируются с опозданием, или до определенного момента ингибируются. Не следует исключать тот факт, что на ранних стадиях фиброгенеза ЖК выполняют другие функции. На 5-й неделе количество а-БМА+-клеток не изменилось (р=0,3075) по сравнению с 3-й неделей эксперимента. При этом отмечалось повышение числа FAP+-клеток (табл. 1 и 2). Для объективной интерпретации того, какая из клеточных популяций доминирует в синтезе межклеточного вещества на ранних этапах фиброза требуются более детальные исследования.
FAP - это многофункциональный белок. Он принимает участие в регуляции энергетического и липидного обменов, стимулирует воспаление и выполняет профиброгенную функцию. Роль белка FAP в фиброзе печени остается до конца не изученной и его фармакологическое ингибирование в качестве варианта потенциальной терапии фиброза печени до сих пор не проводилось [2, 11, 22-24]. В печени крыс при тиоацетамид-индуцированном фиброзе и циррозе жировая дистрофия не диагностировалась. Лимфоидно-гистиоцитарный инфильтрат до 9-й недели был выражен незначительно, а к концу эксперимента определялись очаги с лимфоидно-гистиоцитарным инфильтратом в соединительной ткани портальных зон и соединительнотканных септ. На основании этого можно заключить, что функции белка FAP обусловлены состоянием плотности соединительной ткани, клеточным составом, активностью генов и эпигенетическими механизмами.
Заключение. Таким образом, при экспериментальном токсическом фиброзе и циррозе в печени крыс иммуногистохимическим методом одновременно были выявлены две морфологически неоднородные популяции миофибробластов, которые экспрессировали различные типы маркеров. а-БМЛ+-клетки на ранних стадиях фиброза не располагались совместно с FAP+-клетками. До начала процесса трансформации фиброза печени в цирроз (F4/F5) а-БМЛ+-клетки отмечали в синусоидах печени и очагах некроза, а затем они локализовались как в синусоидах, так и в соединительнотканных септах, вокруг ложных печеночных долек. FAP+-клетки на стадии портального фиброза располагались около междольковых сосудов и междольковых желчных протоков портальных зон, а со стадии F2/F3 их выявляли в соединительнотканных септах и синусоидах. В количественном отношении на всех стадиях фиброза преобладали а-БМЛ+-клетки.
На основании полученных результатов можно предположить, что FAP+-клетки играют главную роль в развитии портального и начального этапа мостовидного фиброза. Их следует рассматривать как одну из разновидностей популяции миофибробластов при тиоацетамид-индуцированном фиброгенезе печени. РЛГ+-клетки могут быть использованы в качестве мишени для антифибротической терапии.
Список литературы Морфофункциональная оценка FAP+ и -SMA+-клеток в различные сроки токсического фиброза печени у крыс
- Baglieri J, Brenner DA, Kisseleva T. The Role of Fibrosis and Liver-Associated Fibroblasts in the Pathogenesis of Hepatocellular Carcinoma. Int J Mol Sci. 2019;20(7). 1723.DOI. 10.3390/ijms20071723
- Lay AJ, Zhang HE, McCaughan GW et al. Fibroblast activation protein in liver fibrosis. Front Biosci (Landmark Ed). 2019;24(1).1-17. DOI.10.2741/4706
- Dhar D, Baglieri J, Kisseleva T et al. Mechanisms of liver fibrosis and its role in liver cancer. Exp Biol Med (Maywood). 2020;245(2).96-108. D0I.10.1177/1535370219898141
- Luo N, Li J, Wei Y et al. Hepatic Stellate Cell. A Double-Edged Sword in the Liver. Physiol Res. 2021;70(6).821-829. DOI. 10.33549/physiolres. 934755
- Sufletel RT, Melincovici CS, Gheban BA et al. Hepatic stellate cells - from past till present. morphology, human markers, human cell lines, behavior in normal and liver pathology. Rom J Morphol Embryol. 2020;61(3).615-642. D0I.10.47162/RJME.61.3.01
- S0rensen MD, Thiele M, Krag A et al. Stage-dependent expression of fibrogenic markers in alcohol-related liver disease. Pathol Res Pract. 2022;231.153798. DOI. 10.1016/j.prp.2022.153798
- Higashi T, Friedman SL, Hoshida Y. Hepatic stellate cells as key target in liver fibrosis. Adv Drug Deliv Rev. 2017;121.27-42. DOI. 10.1016/j .addr.2017.05.007
- Sun Y, Liu B, Xie J et al. Aspirin attenuates liver fibrosis by suppressing TGF ß1/Smad signaling. Mol Med Rep. 2022;25(5):181. DOI.10.3892/mmr.2022.12697
- Wells RG. Portal Fibroblasts in Biliary Fibrosis. Curr Pathobiol Rep. 2014;2(4).185-190. DOI. 10.1007/s40139-014-0054-y
- Fuji H, Miller G, Nishio T et al. The role of mesothelin signaling in portal fibroblasts in the pathogenesis of cholestatic liver fibrosis. Front Mol Biosci. 2021;8.790032. DOI. 10.3389/fmolb.2021.790032
- Yang AT, Kim YO, Yan XZ et al. Fibroblast Activation Protein Activates Macrophages and Promotes Parenchymal Liver Inflammation and Fibrosis. Cell Mol Gastroenterol Hepatol. 2022.S2352-345X(22)00253-3. DOI. 10.1016/j.jcmgh.2022.12.005
- Banin VV, Belousova TA, Bykov VL i dr. Terminologia Histologica. Mezhdunarodnye terminy po tsitologii i gistologii cheloveka s ofitsial'nym spiskom russkikh ekvivalentov. spravochnoe posobie. M.. GEOTAR-Media, 2009.- 272s. In Russian
- Everhart JE, Wright EC, Goodman ZD et al. HALT-C Trial Group. Prognostic value of Ishak fibrosis stage. findings from the hepatitis C antiviral long-term treatment against cirrhosis trial//Hepatology. 2010. Vol. 51, N 2. P. 585-594. DOI. 10.1002/hep.23315
- Kirik OV, Karpenklo MN, Korzhevskiy DE. Teoreticheskie osnovy i prakticheskoe primenenie metodov immunogistokhimii. Rukovodstvo. S-Pb.. SpetsLit, 2014.- 119s. In Russian
- Avery D, Govindaraju P, Jacob M et al. Extracellular matrix directs phenotypic heterogeneity of activated fibroblasts. Matrix Biol. 2018;67.90-106. DOI. 10.1016/j.matbio.2017.12.003
- Younis NS, Ghanim AMH, Elmorsy MA et al. Taurine ameliorates thioacetamide induced liver fibrosis in rats via modulation of toll like receptor 4/nuclear factor kappa B signaling pathway. Sci Rep. 2021 Jun 10;11(1).12296. DOI. 10.1038/s41598-021-91666-6
- Voutilainen SH, Kosola SK, Lohi J et al. Expression of 6 Biomarkers in Liver Grafts After Pediatric Liver Transplantation. Correlations with Histology, Biochemistry, and Outcome. Ann Transplant. 2020;25.e925980. DOI. 10.12659/AOT.925980
- Fitzgerald AA, Weiner LM. The role of fibroblast activation protein in health and malignancy. Cancer Metastasis Rev. 2020;39(3).783-803. DOI. 10.1007/s10555-020-09909-3
- Wu Y, Li Z, Xiu AY et al. Carvedilol attenuates carbon tetrachloride-induced liver fibrosis and hepatic sinusoidal capillarization in mice Drug Des Devel Ther. 2019;13.2667-2676. DOI. 10.2147/DDDT.S210797
- Lebedeva EI. The Role of CK19-Positive Portal Zone Cells in Thioacetamide Induced Rat Liver Cirrhosis. Cell and Tissue Biology. 2021;15(6).568-576. DOI. 10.1134/S1990519X21060067
- Lemoinne S, Thabut D, Housset C. Portal myofibroblasts connect angiogenesis and fibrosis in liver. Cell Tissue Res. 2016;365(3).583-589. DOI. 10.1007/s00441-016-2443-5
- Dendl K, Koerber SA, Kratochwil C et al. FAP and FAPI-PET/CT in Malignant and Non-Malignant Diseases. A Perfect Symbiosis? Cancers (Basel). 2021;13(19).4946. DOI. 10.3390/cancers13194946
- Fitzgerald AA, Weiner LM. The role of fibroblast activation protein in health and malignancy. Cancer Metastasis Rev. 2020;39(3).783-803. DOI. 10.1007/s10555-020-09909-3
- Hamson EJ, Keane FM, Tholen S et al. Understanding fibroblast activation protein (FAP). substrates, activities, expression and targeting for cancer therapy. Proteomics Clin Appl. 2014;8(5-6).454-463. DOI. 10.1002/prca.201300095


