Морфофункциональное состояние аркуатного ядра гипоталамуса крыс в динамике ожоговой травмы
Автор: Ажикова Альфия Кадыровна, Самотруева Марина Александровна, Смирнов Алексей Владимирович, Замлелов Александр Александрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.28, 2020 года.
Бесплатный доступ
В работе рассмотрены морфологические и морфометрические особенности клеток аркуатного ядра гипоталамуса в динамике термической ожоговой травмы кожи. Актуальность исследования обусловлена важной ролью реактивных изменений нейроэндокринного регуляторного комплекса в патогенезе ожоговых ран кожи. Поскольку гипоталамус является частью нейроэндокринной кооперации, в нем наблюдаются наиболее выраженные признаки повреждения нейронов. В этой связи, целью исследования явилось изучение качественных и количественных структурных изменений в дугообразном ядре среднего гипоталамуса крыс при моделировании термической ожоговой травмы кожи. Ожоговое воздействие моделировали у нелинейных крыс мужского пола массой 200-230 г. путем нанесения контактной термической травмы в межлопаточной области. Функциональную активность аркуатного ядра гипоталамуса оценивали на основе количественного анализа морфометрических параметров ядер нейроцитов, поскольку эти показатели коррелируют с интенсивностью транскрипции и могут служить инструментом оценки функционального состояния клеток. Для проведения количественного анализа гистологических препаратов гипоталамуса определялись планиметрические свойства нейронов и их структур: абсолютные показатели, такие как площадь перикарионов, площадь ядер нейронов, площадь цитоплазмы нейронов, ядерно-цитоплазматическое отношение нейронов аркуатных ядер гипоталамуса. На основании полученных данных об абсолютных показателях нейронов были рассчитаны относительные показатели - медиана площади перикарионов, медиана площади ядер, медиана площади цитоплазмы перикарионов, медиана ядерно-цитоплазматического отношения нейронов аркуатных ядер гипоталамуса. В ходе исследования выявлены деструктивные преобразования этой гипоталамической зоны головного мозга во всех стадиях воспалительно-регенеративной реакции: на 2, 4, 7, 10 сутки после ожогового воздействия. Сравнительный анализ препаратов гипоталамуса лабораторных животных показал характерные деструктивные изменения в аркуатных ядрах в условиях термической травмы кожи, которые отражали развитие процессов обратимого и необратимого повреждения нейронов. Выявленные особенности в целом соответствуют существующим представлениям о нарушении морфофункциональной организации нейронов в этой зоне за счет реализации адаптивных механизмов, характеризующихся активацией локальных и системных компенсаторновосстановительных процессов, очаговым глиозом и развитием отечных изменений нервных клеток.
Аркуатное ядро, гипоталамус, нейроциты, цитометрия, ожог кожи
Короткий адрес: https://sciup.org/143177445
IDR: 143177445 | DOI: 10.20340/mv-mn.2020.28(2)9-17
Текст научной статьи Морфофункциональное состояние аркуатного ядра гипоталамуса крыс в динамике ожоговой травмы
Ажикова А.К., Самотруева М.А., Смирнов А.В., Замлелов А.А. Морфофункциональное состояние аркуатного ядра гипоталамуса крыс в динамике ожоговой травмы// Морфологические ведомости.- 2020. - Том 28.- № 2.- С. 9-17. (2):9-17
Azhikova AK, Samotrueva MA, Smirnov AV, Zamlelov AA. The morphological and functional state of the arcuate nucleus of the hypothalamus of rats in burn injury dynamics. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(2):9-17. (2):9-17
Введение . Ожоговые травмы представляют собой повреждения кожи, репаративный процесс в условиях которых обусловлен комплексом морфологических, физиологических и биохимических нарушений. На фоне термического воздействия наряду с местными деструктивными, дистрофическими, инфекционными проявлениями, в организме наблюдаются признаки иммунного дисбаланса, дисфункции иммунокомпетентных клеток, недостаточная местная резистентность, специфические тканевые изменения. При этом происходит дезорганизация в эмоциогенных зонах головного мозга, формирование и запуск реакций стресс-адаптивного и/или стресс-дезадаптивного характера организма. В этой связи, при изучении патогенеза ожоговых ран кожи особое внимание отводится на выявление особенностей ответа иммунной и нейроэндокринной систем, обеспечивающих регуляторные механизмы активации локальных и системных компенсаторновосстановительных процессов. Подтверждением участия регуляторных систем в репаративных процессах кожи служит тот факт, что иммунокомпетентные клетки и нейроны секретируют в кровь или кожу нейромедиаторы и факторы роста, участвующие в механизмах нейрогенного и иммунологически-индуцированного воспаления кожи. Установлено, что иммунная воспалительная реакция является основным элементом и в патогенезе посттравматических осложнений, и в репарации тканей [1], обеспечивающим поддержание и восстановление гомеостаза наряду со сложными взаимосвязанными нейроэндокринными проводящими путями, гипоталамо-гипофизарно-надпочечниковой осью и симпатической нервной системой [2-6]. С учетом тесной взаимосвязи между кожей, иммунной, нервной и эндокринной системами, исследовательский интерес вызывает роль нарушений функций нейроэндокринной и иммунной систем организма в патогенезе ожоговых повреждений кожи.
В условиях эндогенной интоксикации, возникшей на фоне термической травмы, одним из органов-мишеней выступает головной мозг [8]. Наиболее интенсивнее признаки повреждения нейронов наблюдаются в гипоталамусе [9]. Поскольку гипоталамус входит в состав лимбической системы, ему присущи центральные эмоционально-болевые функции. В условиях стрессового воздействия в развитии патологических изменений гипоталамической области играет роль повышенная проницаемость стенки капилляров, способствующая проникновению в эту зону мозга токсинов, что обуславливает высокую чувствительность гипоталамуса к сдвигам постоянства внутренней среды организма [10]. По литературным данным, ожоговое воздействие вызывает структурные и гуморальные изменения в гипоталамусе, сопровождающиеся повышенными уровнями секреции соматостатина, адренокортикотропного гормона и гормона роста из аденогипофиза [11]. Поскольку гипоталамус является частью нейроэндокринной кооперации, он принимает участие в гуморальной регуляции функций организма путем выделения нейронами ядер гипоталамуса различных гормонов, координирует деятельность всех органов и систем, обеспечивает сохранение гомеостаза организма [12-13].
Одним из наиболее стрессреактивных отделов гипоталамуса является аркуатное ядро [14-16]. В этом ядре сосредоточены гипофизотропные нейроны, секретирующие кортиколиберин – центральный гормон системного ответа на стресс [17, 18]. Особые нейросекреторные клетки аркуатного ядра гипоталамуса участвуют в секреции гормонов передней долей гипофиза [11]. Известно, что аркуатное ядро гипоталамуса контролирует выделение соматотропного гормона, адренокортикотропного гормона, вазопрессина, пролактина, нейропептида Y и агути-подобного пептида [14, 16, 19]; экспрессия нейротензинов регулирует синтез лютеинизирующего гормона [15]. Дофамин, синтезирующийся в дофаминергических нейронах аркуатного ядра и экспрессирующийся из их аксонов в гипофизарный кровоток, модулирует репродуктивную функцию организма, ингибируя секрецию пролактина [8]. Кроме того, установлена способность нейронов дугообразного ядра продуцировать эндорфины (в-эндорфин) и направлять их в прилежащее ядро, тем самым активируя передачу нервного импульса [20-22]. Доказана ключевая роль этого гипоталамического ядра в увеличенной секреции в-эндорфина, определяющего реакцию на стресс на фоне отсутствия алкоголя [9]. Экспериментально показано, что в условиях этаноловой нагрузки акупунктура аркуатного ядра гипоталамуса способствует ослаблению симптомов алкогольной зависимости [17]. Данное обстоятельство подтверждает значение дугообразного ядра гипоталамуса в обеспечении физиологического и адаптационного выхода из стрессовой ситуации, снижении болевых ощущений при влиянии внешних и внутренних стресс-факторов [23].
Несмотря на наличие работ, посвященных исследованию гипоталамических нарушений при термических ожогах кожи [20-21], остается мало изученным вопрос о структурно-функциональных изменениях в аркуатных ядрах гипоталамуса на фоне ожоговой травмы кожи.
Цель исследования : изучение морфологических изменений в аркуатных ядрах гипоталамуса крыс в динамике термической ожоговой травмы кожи.
Материалы и методы исследования. Исследование проведено на белых лабораторных крысах-самцах массой 200-230 г. Содержание животных соответствовало положениям Европейской конвенции о защите позвоночных животных, используемых для экспериментальных и других научных целей (Страсбург, 1986), Хельсинкской декларацией, принятой Генеральной ассамблеей Всемирной медицинской ассоциации (1964-2013), Минздрава России №199н от 01.04.2016г. «Об утверждении правил надлежащей лабораторной практики» (GLP), требованиями комиссии Российского национального комитета по биоэтике при Российской академии наук. Лабораторные животные были разделены на 5 групп по десять животных в каждой группе: 1-я группа животных, не подвергшихся ожоговому воздействию - интактная (контроль); 2-я группа животных, подвергшихся ожоговому воздействию и выведенных из эксперимента в первую фазу воспалительно-регенеративной реакции (на 2 сутки после ожога); 3-я группа животных, подвергшихся ожоговому воздействию и выведенных из эксперимента в первую фазу воспалительно-регенеративной реакции (на 4 сутки после ожога); 4-я группа животных, подвергшихся ожоговому воздействию и выведенных из эксперимента во вторую фазу воспалительно-регенеративной реакции (на 7 сутки после ожога); 5-я группа животных, подвергшихся ожоговому воздействию и выведенных из эксперимента в третью фазу воспалительно-регенеративной реакции (на 10 сутки после ожога).
Ожоговое воздействие моделировали у всех подопытных групп путем нанесения контактной термической травмы в межлопаточной области в условиях эфирной наркотизации. На депилированный участок кожи накладывали медный предмет диаметром 1,5 см, нагретый в кипящей воде до 100° С, с экспозицией 5 с. Животных выводили из эксперимента на 2, 4, 7, 10 сутки после ожогового воздействия для сравнительной оценки изменений во всех стадиях ожогового процесса. Декапитацию проводили в условиях эфирной наркотизации, образцы головного мозга фиксировали в 10 %-м забуференном нейтральном формалине. По стандартной методике изготавливали парафиновые блоки и срезы толщиной 5–7 мкм, окрашивали толуидиновым синим по методу Ниссля. Проводили качественный и количественный анализ аркуатных ядер гипоталамуса. Исследование микропрепаратов проводилось с помощью микроскопа «Axio Lab. A1», фотодокументирование осуществляли камерой «AxioCam 105 color».
Функциональную активность аркуатных ядер гипоталамуса оценивали по количественному анализу морфометрических параметров ядер нейроцитов, поскольку эти органоиды коррелируют с интенсивностью транскрипции и могут служить инструментом оценки их функционального состояния [15]. Для проведения количественного анализа гистологических препаратов определялись планиметрические свойства нейронов и их структур: абсолютные показатели нейронов, такие как: площадь перикарионов, площадь ядер нейронов, площадь цитоплазмы нейронов, ядерно-цитоплазматическое отношение нейронов аркуатных ядер гипоталамуса. На основании полученных абсолютных показателей нейронов рассчитаны относительные показатели - медиана площади перикарионов, медиана площади ядер, медиана площади цитоплазмы перикарионов, медиана ядерно-цитоплазматического отношения нейронов аркуатных ядер гипоталамуса.
Статистическую обработку данных проводили с использованием пакетов программ Excell и Statistica 10,0. Данные представляли в виде медианы с указанием интерквартильного интервала. Различия между группами оценивали по критерию критерия Краскела-Уоллиса, и считали статистически значимыми при p<0,05.
Результаты исследования и обсуждение. Нейротопографическая организация аркуатных ядер гипоталамуса интактных животных определялась нормальным положением, формой и размерами. Тканевая организация данной области была представлена преимущественно нейронами и клетками глии. Нейроны характеризовались мономорфизмом; форма перикарионов была преимущественно неправильной и звездчатой (рис. 1).
При морфологическом исследовании аркуатных ядер у интакных животных контрольной группы нейроны характеризовались наличием пузырьковидного центрально расположенного ядра. Определялись перицеллюлярно расположенные отечные вакуоли, в единичных случаях имелась вакуолизация цитоплазмы перикариона, процессы вакуолизации были выражены слабо-умеренно, отмечалось равномерное распределение базофильной субстанции в цитоплазме ядер. Ядра наблюдались с умеренно выраженным диффузным гиперхроматозом. Расположение ядрышек преимущественно было центральное, однако встречалось и эксцентрическое положение ядрышек без вытеснения стенки ядра. Ядрышки имели одинаковую округлую форму, приблизительно одинаковый размер и равномерное распределение окраски. Нейроны характеризовались малым содержанием цитоплазмы, местами цитоплазма перикарионов не визуализировалась. Цитоплазма перикарионов имела глыбки базофильной субстанции со слабо выраженной интенсивностью окрашивания и малым содержанием хроматофильного вещества.
В менее половины случаев определялись сморщенные нейроны в разной степени выраженности. Цитоплазма таких перикарионов характеризовалась выраженным гиперхроматозом, неравномерностью распределения глыбок базофильной субстанции. Цитоплазма данных ядер характеризовалась диффузным гиперхроматозом. Количество ядрышек было преимущественно одно, в единичных случаях определялось два ядрышка, ядрышки занимали как центральное, так и эксцентрическое положение, одного размера, при этом эксцентрично расположенные ядрышки цитоплазму ядра не выпячивали.
Среди нейронов определялись неизмененные клетки глии. Глия в межклеточном пространстве характеризовалась слабо выраженным спонгиозом, сосуды визуально не определялись. По периферии глиальных клеток отмечались отечные изменения. Определялись нейроны с выраженым сморщиванием. Данные нейроны имели неправильную форму. Ядра данных нейронов не были четко очерчены из-за выраженной гиперхромности цитоплазмы. В целом данные нейроны были резко уменьшены, расценивались как в состоянии тяжелого повреждения, количеством 5-7 единиц в поле зрения (рис. 2).
При микроскопическом исследовании аркуатных ядер животных 2-й группы (2-е сутки ожога) определялись следующие характеристики, явившиеся отличительными чертами и были выражены в наибольшей степени по сравнению с интактной группой животных. Как и в интактной группе животных расположение ядрышек определялось преимущественно центральное, однако, встречались ядра с эксцентрическим положение ядрышек, а также вытеснение стенки ядра данными ядрышками в единичных случаях. Определялись нейроны, имеющие более выраженную (базофильную) окраску ядер с гиперхроматозом цитоплазмы перикарионов. Эти нейроны были сморщены в разной степени, от слабой до умеренно выраженной. Глия в межклеточном пространстве характеризовалась средне выраженным спонгиозом, определялось полнокровие сосудов в данной анатомической области (рис. 3).
При микроскопическом исследовании гистопрепаратов аркуатных ядер животных 3й группы (4-е сутки ожога) определялся умеренный и выраженный гиперхроматоз цитоплазмы. Определялись немногочисленные нейроны с двумя ядрышками в ядре. В половине общего объема нейронов, нейроны были с выраженым сморщиванием перикарионов и ядер. Глия в межклеточном пространстве характеризовалась умеренно выраженным спонгиозом. По периферии глиальных клеток отмечалось разряжение глии в виде щелей (рис. 4).
При микроскопическом исследовании гистопрепаратов аркуатных ядер животных 4й группы (7-е сутки ожога) определялись увеличения размеров ядер нейронов, немногочисленные нейроны с выраженным сморщиванием перикарионов и ядер. Глия в межклеточном пространстве характеризовалась умеренно выраженным спонгиозом, на рядах срезов отмечался выраженный спонгиоз в виде диффузно распространенных оптически пустых вакуолей размером до ядра, сосуды визуально не определялись. По периферии глиальных клеток отмечалось разряжение глии в виде щелей (рис. 5).
При микроскопическом исследовании гистопрепаратов аркуатных ядер животных 5й группы на 10-е сутки ожога определялись выраженно сморщенные нейроны, ядрышки не визуализировались, данные нейроны имели резко уменьшенный размер, определялись как в состоянии тяжелого повреждения (около 5 элементов в поле зрения). В незначительном количестве, определялись гиперхромные скопления темно-базофильных субстанций -вероятно погибшие нейроны (от 4 до 11 шт). Глия в межклеточном пространстве характеризовалась умеренно выраженным спонгиозом, на рядах срезов отмечался выраженный спонгиоз в виде диффузно распространенных оптически пустых вакуолей размером до ядра, сосуды визуально не определялись, по периферии глиальных клеток отмечалось разряжение глии в виде щелей (рис. 6).
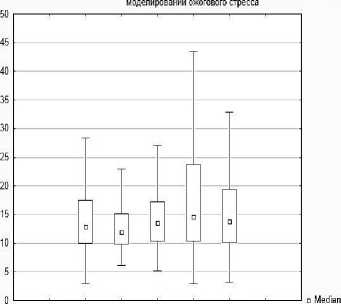
При морфометрической оценке абсолютных показателей нейронов аркуатных ядер гипоталамуса животных, подвергшихся ожоговому воздействию, было выявлено, что площадь перикарионов на 2 сутки после ожога уменьшилась на 7,02 %, р<0,05 [интактная группа - Ме=61,18 [52,75; 72,84] мкм2], 2-я группа - Ме=56,88 [50,47; 65,57] мкм2], но восстанавливалась на 4, 7, 10 сутки (Ме=9,35 [49,94; 69,23], 62,19 [51,67;80,51], 59,52 [49,22; 75,26 мкм2] соответственно, табл. 1, рис.7).
Также установлено, что площадь ядер нейронов уменьшилась во все сроки послеожогового периода: на 2 сутки - на 7,58 %, р<0,05 (Ме=44,51[38,74; 52,07] мкм2), на 4 сутки - на 5,81 %, р<0,05 (Ме=45,36 [38,57; 52,89] мкм2), на 7 сутки - на 4,28 %, р<0,05 (Ме=46,10 [40,41;57,58] мкм2), на 10 сутки - на 6,85 %, р<0,05 (Ме=44,86 [37,16; 56,01] мкм2), по сравнению с показателями интактных животных [Ме=48,16 [40,72; 56,95] мкм2].
В результате исследования выявлено, что площадь цитоплазмы нейронов на 2 сутки после ожога уменьшилась на 7 %, р<0,05 (Ме=11,95 [9,77;15,16] мкм2), однако имела тенденцию к увеличению на 4 и 10 сутки - увеличиваясь на 5,68 % на 4 сутки (Ме=13,58 [10,29; 17,26] мкм2) и на 7,16 % на 10 сутки (Ме=13,77 [10,08; 19,34] мкм2), достигая пика на 7 сутки эксперимента - увеличиваясь на 13,15 % (Ме=14,54 [10,37; 23,77] мкм2), по сравнению с показателями интактных животных [Ме=12,85 [9,95; 17,46] мкм2].
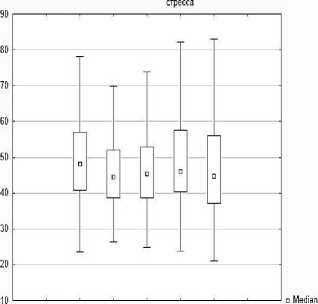
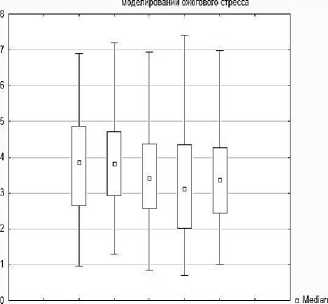
Также доказано статистически значимое уменьшение ядерно-цитоплазматического отношения нейронов аркуатных ядер гипоталамуса - на 1,3 %, р<0,05 на 2 сутки после ожога (Ме=3,81 [2,91; 2.09] мкм2), на 11,66 % на 4 сутки (Ме=3,41 [2,55; 4,36] мкм2), на 19,17 % на 7 сутки (Ме 3,12 [2,01; 4,34] мкм²), на 12,7 % на 10 сутки (Ме 3,37 [2,43; 4,26] мкм²), по сравнению с показателями интактных животных [Ме 3,86 [2,64; 4,85] мкм2].
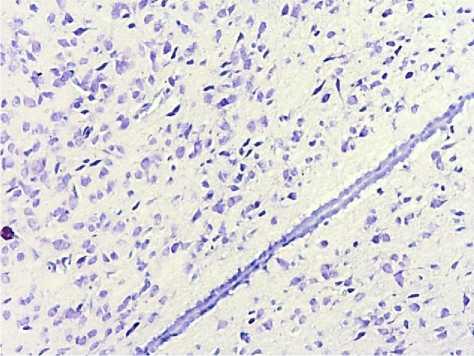
Рис. 1. Нейротопографическая организация аркуатных ядер гипоталамуса интактных животных. Окр.: толуидиновым синим по методу Ниссля. Ув.: х100.
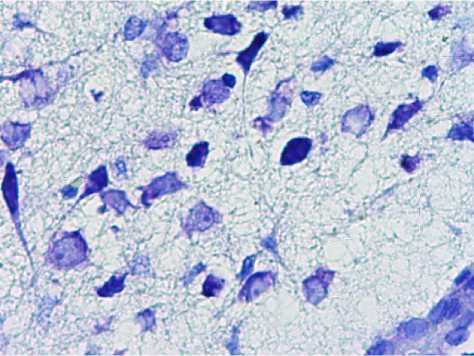
Рис. 2. Нейроны аркуатных ядер гипоталамуса интактных животных., Окр.: толуидиновым синим по методу Ниссля. Ув.: х400.
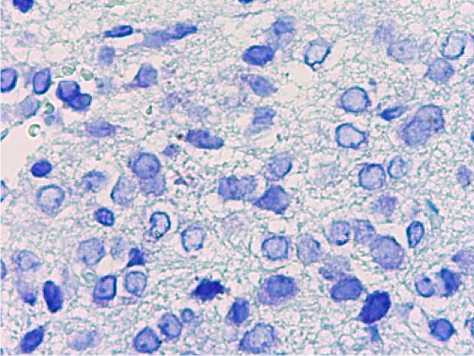
Рис. 3. Нейроны аркуатных ядер гипоталамуса животных 2-й группы. Окр.: толуидиновым синим по методу Ниссля. Ув.: х400.
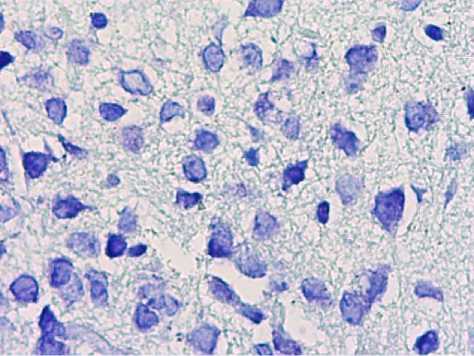
Рис. 4. Нейроны аркуатных ядер гипоталамуса животных 3-й группы. Окр.: толуидиновым синим по методу Ниссля. Ув.: х400.
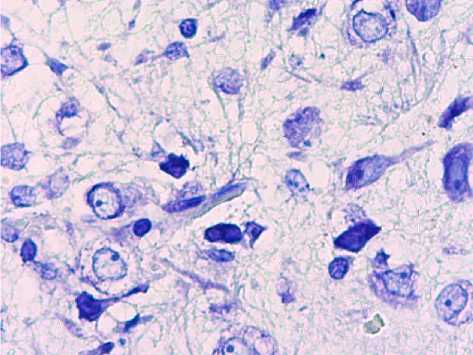
Рис. 5. Нейроны аркуатных ядер гипоталамуса животных 4-й группы. Окр.: толуидиновым синим по методу Ниссля. Ув.: х400.
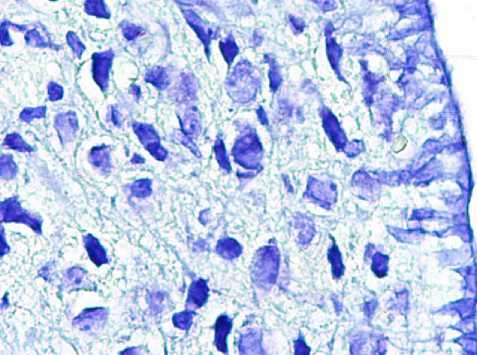
Рис. 6. Нейроны аркуатных ядер гипоталамуса животных 5-й группы. Окр.: толуидиновым синим по методу Ниссля. Ув.: х400.
Медианы площади перикарионов нейронов аркуатных ядер у интактных крыс и при моделировании
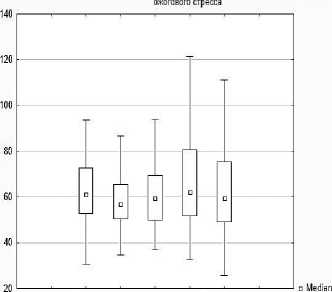
Интакт Ожог, 4 сутки Ожог, 10 сутки □ 25%-75%
Ожог, 2 сутки Ожог, 7 сутки INon-Outlier Range
Медианы площади ядер нейронов аркуатных ядер у интактных крыс и при моделировании ожогового
Интакт Ожог, 4 сутки Ожог, 10 сутки Q25%-75% Ожог, 2 сутки Ожог, 7 сутки I Non-Outlier Range
Медианы площади цитоплазмы перикаионов нейронов аркуатных ядер у интактных крыс и при
Интакт Ожог, 4 сутки Ожог, 10 сутки П25%-75%
Ожог, 2 сутки Ожог, 7 сутки I Non-Outlier Range
Рис. 7. Диаграмма изменения площади перикарионов нейронов, площади ядер нейронов, площади цитоплазмы перикарионов, ядерно-цитоплазматического отношения нейронов аркуатного ядра гипоталамуса экспериментальных животных.
Таблица 1
Ядерно-цитоплазматическое отношение нейронов аркуатных ядер у интактных крыс и при
Интакт Ожог, 4 сутки Ожог, 10 сутки □25%-75%
Ожог, 2 сутки Ожог, 7 сутки I Non-Outlier Range
Морфометрические показатели нейронов аркуатных ядер гипоталамуса
|
Медиана [нижний квартиль; верхний квартиль]) |
|||||
|
Экспериментальные группы, n=10 |
Интактная группа |
Ожог, на 2-е сутки |
Ожог, на 4 –е сутки |
Ожог, на 7-е сутки |
Ожог, на 10-е сутки |
|
Медиана площади перикарионов, мкм² |
Kruskal-Wallis test: H (4, N= 655) =9,259331, p<0,05* |
||||
|
61,18 [52,75; 72,84] |
56,88 [50,47; 65,57] |
59,35 [49,94; 69,23] |
62,19 [51,67; 80,51] |
59,52 [49,22; 75,26] |
|
|
Медиана площади ядер, мкм² |
Kruskal-Wallis test: H (4, N= 623) =6,040175, p<0,05* |
||||
|
48,16 [40,72; 56,95] |
44,51 [38,74; 52,07] |
45,36 [38,57; 52,89] |
46,10 [40,41; 57,58] |
44,86 [37,16; 56,01] |
|
|
Медиана площади цитоплазмы перикарионов, мкм² |
Kruskal-Wallis test: H (4, N= 655) =12,93823, p<0,05* |
||||
|
12,85 [9,95; 17,46] |
11,95 [9,77; 15,16] |
13,58 [10,29; 17,26] |
14,54 [10,37; 23,77] |
13,77 [10,08; 19,34] |
|
|
Медиана ядерно-цитоплазматического отношения нейронов, число |
Kruskal-Wallis test: H (4, N= 655) =17,00863, p<0,05* |
||||
|
3,86 [2,64; 4,85] |
3,81 [2,91; 2.09] |
3,41 [2,55; 4,36] |
3,12 [2,01; 4,34] |
3,37 [2,43; 4,26] |
|
Примечание* - различия между группами статистически значимы
Заключение. Исходя из полученных при качественном и количественном анализе данных, можно сделать вывод о том, что выявленные морфологические изменения гипоталамуса лабораторных животных в условиях термической травмы кожи на протяжении 10 дней отражают развитие процессов обратимого и необратимого повреждения нейронов, в аркуатных гипоталамических ядрах, что в целом соответствует существующим представлениям о выраженном повреждении нейронов в этой зоне за счет реализации компенсаторно-приспособительных процессов, характеризующихся очаговым глиозом и развитием отечных изменений нервных клеток.
Список литературы Морфофункциональное состояние аркуатного ядра гипоталамуса крыс в динамике ожоговой травмы
- Bashkina OA, Samotrueva MA, Azhikova AK, Pakhnova LR. Neyroimmunoendokrinnaya regulyatsiya fiziologicheskikh i patofiziologicheskikh protsessov v kozhe. Meditsinskaya immunologiya. 2019;21(5):807-820. https://doi.org/10.15789/1563-0625-2019-5-807-820
- Tkacheva OV, Butko YO. The dynamics of the level cytokines and inflammatory markers in rats third-degree burn trauma under influenced by wound-healing medications. Europaische Fachhochschule. 2013;3:62-65.
- Samotrueva MA, Yasenyavskaya AL, Tsibizova AA, Bashkina OA, Galimzyanov KhM, Tyurenkov IN. Neyroimmunoendokrinologiya: sovremennye predstavleniya o molekulyarnykh mekhanizmakh. Immunologiya. 2017;38(1):49-59. https://doi.org/10.18821/0206-4952-2017-38-1-49-59
- Samotrueva MA, Sergalieva MU. Study of psychomodulating properties of astragalus vulpinus willd extract against the background of informational overload. Pharmacy & pharmacology-farmatsiya i farmakologiya. 2018;6(3):255-268. https://doi.org/10.19163/2307-9266-2018-6-3-255-268
- Yasenyavskaya AL, Sergalieva MU, Samotrueva MA, Mazhitova MV. Eksperimental'noe podtverzhdenie formirovaniya sostoyaniya povyshennoy trevozhnosti v usloviyakh informatsionnogo vozdeystviya. Astrakhanskiy meditsinskiy zhurnal. 2016;11(2):92-98.
- Mamontova EV, Semenishcheva OE. Issledovanie reaktsii gipotalamo-adrenokortikal'noy sistemy na stress i korrektsiya stressornykh narusheniy antioksidantami. Sovremennye problemy nauki i obrazovaniya. 2013;2:53.
- Pakhnova LR, Samotrueva MA, Bashkina OA, Tsibizova AA, Bryntseva IA, Avdeeva ES, Bogdan'yants MV. Peloidoterapiya zabolevaniy kozhi. Astrakhanskiy meditsinskiy zhurnal. 2017;12(1):8-21.
- Volina EV, Dil'mukhametova LK, Pronina TS, Ugryumov MV. Regulyatsiya kompensatornogo sinteza dofamina v arkuatnom yadre u krys. Neyrokhimiya. 2014;31(3):207-217.
- Bryukhin GV, Kuznetsova AB. Morfofunktsional'naya kharakteristika arkuatnogo neyrosekretornogo yadra gipotalamusa potomstva samok krys s khronicheskoy alkogol'noy intoksikatsiey /V sbornike: Rol' patologii pecheni materi v narushenii razvitiya, reaktivnosti i rezistentnosti potomstva v usloviyakh kliniki i eksperimenta. Chelyabinsk. 2014:62-67.
- Smirnov AV. Morfologicheskie izmeneniya v gipotalamuse pri eksperimental'nom modelirovanii stressovogo vozdeystviya. Vestnik Volgogradskogo gosudarstvennogo meditsinskogo universiteta. 2012;5:169-170.
- Kovalchuk O, Cherkasov E., Dzevulska I., Kaminsky R., Korsak A., Sokurenko L. Dynamics of morphological changes of rats adenohypophysis in burn disease. Georgian Med News. 2017;270:104-108.
- Palkovits M. Stress-induced activation of neurons in the ventromedial arcuate nucleus: a blood-brain-CSF interface of the hypothalamus. Ann. N- Y. Acad. Sci. 2008;1(148):57-63.
- Gancheva OV. Osobennosti vozrastnoy dinamiki funktsional'noy aktivnosti neyronov arkuatnogo yadra gipotalamusa u samtsov krys linii Vistar. Ukraїns'kiy morfologіchniy al'manakh. 2009;7(4):14-17.
- Kotel'nikova SV, Kotel'nikov AV, Zaytsev VF. Vliyanie toksicheskogo stressa na morfofunktsional'noe sostoyanie arkuatnogo yadra gipotalamusa v usloviyakh izmenennogo rezhima osveshchennosti. Yug Rossii: ekologiya, razvitie. 2016;11(2):185-191.
- Muratova NR, Kotel'nikova SV. Funktsional'noe sostoyanie arkuatnogo yadra gipotalamusa v dinamike toksicheskogo stressa, vyzvannogo sol'yu kadmiya. Sovremennye problemy nauki i obrazovaniya. 2014;6.
- Kotel'nikova SV, Kotel'nikov AV. Vliyanie toksicheskogo stressa, vyzvannogo khloridom kadmiya na morfometricheskie pokazateli arkuatnogo yadra gipotalamusa krys v raznye sezony goda. Astrakhanskiy meditsinskiy zhurnal. 2012;3:74-77.
- Chang S, Kim DH, Jang EY, Yoon SS, Gwak YS, Yi YJ, Lee JY, Ahn SH, Kim JM, Ryu YH, Kim SN, Roh HS, Lee MY, Kim SC, Lee BH, Kim HY, Yang CH. Acupuncture attenuates alcohol dependence through activation of endorphinergic input to the nucleus accumbens from the arcuate nucleus. Sci Adv. 2019;5(9):1342-1342. https://doi.org/10.1126/sciadv.aax1342.
- Kubasik-Juraniec J, Кnар N. The effect of fasting on the ultrastructure of the hypothalamic arcuate nucleus in young rats. Folia Morphol. 2009;68(3):113-118.
- McConn BR, Newmyer BA, St John N, Tachibana T, Gilbert ER, Cline MA. The anorexigenic effect of neuropeptide K in chicks involves the paraventricular nucleus and arcuate nucleus of the hypothalamus. Peptides. 2019:170157. https://doi.org/10.1016/j.peptides.2019.170157.
- Chen ZY, Wang SL, Peng X, Wang FJ, Zhao Y, Wang P. Role of corticotropin releasing factor receptor 2 antisense oligodeoxynucleotide of hypothalamus in hypermetabolism in rats with severe burn. Zhonghua Shao Shang Za Zhi. PubMed PMID. 2008;24:(6)414-417.
- Emanuele NV. The impact of burn injury and ethanol on the cytokine network of the mouse hypothalamus: reproductive. PubMed PMID. 2005;30(3):109-115.
- Peixoto TC, Moura EG, Oliveira E, Younes-Rapozo V, Soares PN, Rodrigues VST, Torsoni MA, Torsoni AS, Manhães AC, Lisboa PC. Hypothalamic Neuropeptides Expression and Hypothalamic Inflammation in Adult Rats that Were Exposed to Tobacco Smoke during Breastfeeding: Sex-Related Differences. Neuroscience. 2019;418:69-81. https://doi.org/10.1016/j.neuroscience.
- Rietema SE, Hawken PAR, Scott CJ, Lehman MN, Martin GB, Smith JT. Arcuate nucleus kisspeptin response to increased nutrition in rams. Reprod Fertil. 2019. https://doi.org/10.1071/RD19063.


