Морфофункциональное состояние кишечного барьера биомодели при введении холерных вибрионов О139 серогруппы штаммов с разным набором детерминант вирулентности
Автор: Бугоркова С.А., Осина Н.А., Бугоркова Т.В., Кутырев В.В.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.19, 2011 года.
Бесплатный доступ
Представлены результаты сравнительной оценки реакции апудоцитов и клеток эффекторной зоны иммунной системы кишечника крольчат на заражение холерными вибрионами ctxA+, tcpA+ и ctxA-, tcpA- штаммов 0139 серогруппы. Показано, что реакция апудоцитов и клеток эффекторной зоны иммунной системы кишечника крольчат зависит от генотипа заражающих штаммов и коррелирует с характером и выраженностью морфологических изменений в кишечнике и внутренних органах животных.
Vibrio cholerae о139 се- рогруппы, эффекторная зона иммунной системы, апудоциты
Короткий адрес: https://sciup.org/143176990
IDR: 143176990
Текст краткого сообщения Морфофункциональное состояние кишечного барьера биомодели при введении холерных вибрионов О139 серогруппы штаммов с разным набором детерминант вирулентности
Морфологическими эквивалентами проявления функционирования тех или иных генов холерного вибриона в макроорганизме являются нарушения, возникающие в ответ на инокуляцию микроба, в виде развития различных патологических или адаптационно-компенсаторных реакций. При моделировании холерной инфекции желудочно-кишечный тракт (ЖКТ) биомоделей обеспечивает первую линию защиты макроорганизма, выступая местом тесного взаимодействия патогена с его функциональными системами и, в первую очередь, индуктивной и эффекторной зонами иммунной [6] и нейроэндокринной системами.
В силу высокого эпидемического потенциала и склонности к быстрому распространению, холерные вибрионы О139 серогруппы долгое время признавались в качестве второго этиологического агента эпидемической холеры. Как и представители О1 серогруппы, холерные вибрионы О139 серогруппы неоднозначны в отношении эпидемического потенциала, определяемого наличием хромосомного «острова патогенности» [2]. В реализации холерного инфекционного процесса в макроорганизме ключевая роль отводится следующим детерминантам вирулентности патогена – токсин-корегулируемым пилям адгезии и холерному токсину, синтез которых кодируют соответствующие гены tcpА-F и ctxAB [10].
Цель исследования - сравнительная морфофункциональная характеристика реакции апудоцитов и клеток эффекторной зоны иммунной системы кишечника у крольчат, зараженных холерными вибрионами О139 серогруппы ctxA+, tcpA+ и ctxA-, tcpA- штаммов.
Материалы и методы исследования. В работе использовали 5 штаммов холерных вибрионов О139 серогруппы, выделенных из различных источников (табл. 1). Для выявления tcpА гена в полиимеразной цепной реакции (ПЦР) использовали олигонуклеотидные праймеры, предложенные S.P. Keasler, R.H. Hall [9], проводя амплификацию фрагмента tcpА гена с данным праймером в соответствии с авторскими рекомендациями. Идентификацию штаммов Vibrio cholerae (ctxA+) проводили с использованием тест-системы «ГенХол - для выявления ДНК V.cholerae (ctxA+) методом ПЦР» (ТУ 8895-00601898109-2007, производства ФГУЗ РосНИПЧИ «Микроб»). Работу выполняли в соответствии с инструкцией к препарату.
Экспериментальную холеру воспроизводили на крольчатах (16 особей) 7-8 дневного воз-
Таблица 1
Характеристика штаммов V. cholerae О139 серогруппы, используемых в работе
|
Штамм V.cholerae O139 |
Место выделения культуры |
Наличие основных генов, связанных с вирулентностью |
Количество животных: |
||
|
Зараженных |
Павших до: |
||||
|
36 ч |
48 ч |
||||
|
62 |
внешняя среда (река Москва), 1998 г. |
ctxA-, tcpA- |
2 |
0 |
0 |
|
МО 45 |
больной (Индия), 1992 г. |
ctxA+, tcpA+ |
4 |
4 |
0 |
|
Р16064 |
больной (г. Азов), 1993 г. |
ctxA+, tcpA+ |
4 |
3 |
1 |
|
170 |
внешняя среда (река Москва), 1999 г. |
ctxA-, tcpA- |
2 |
0 |
0 |
|
РО7 |
больной (Индия), 1992 г. |
ctxA+, tcpA+ |
4 |
2 |
1 |
% опустошен, апудоцитов + % гистохимически активных апудоцит Иан = ---------—------------------;----------------------------- % клеток в состоянии функционального покоя
раста, массой 130-150 г [8], заражая животных культурой V.cholerae О139 в дозе 1х107 КОЕ. Животных разделили на группы: 1-я группа – для заражения использовали штаммы, в геноме которых присутствовали гены ctxA, tcpA; 2-я группа – заражали культурами штаммов с отсутствующими генами ctxA, tcpA. Контрольным животным (3 особи) в аналогичных опытным условиях внутрикишечно вводили 0,2 мл 0,9 % раствора натрия хлорида. Павших и через 48 ч наблюдения усыпленных хлороформом животных вскрывали, оценивая патоморфологические изменения. Кусочки органов фиксировали в 10% водном нейтральном растворе формалина и обрабатывали по общепринятой в гистологии схеме обезвоживания и заливки материала в парафин [3]. Полутонкие парафиновые срезы кишечника и внутренних органов окрашивали гематоксилином и эозином, импрегнировали серебром по Гримелиусу, применяли сочетанную окраску альциановым синим и Шифф-реактивом [5]. Эффекторную зону иммунной системы ЖКТ, представленную лимфоидными клетками Lamina propria (собственная пластинка слизистой оболочки - СПС) и межэпителиальными лимфоцитами (МЭЛ), характеризовали, подсчитывая количество клеток на 1000 ядер энтероцитов при увеличении Х 200. Количество бокаловидных клеток (БК) и апудоцитов определяли в 10 полях зрения правильно ориентированных срезов кишечника в 10 повторах при увеличении Х 200. Секреторный профиль БК оценивали по количеству клеток, дающих голубую (кислые мукополисахариды - КМПС), красную (нейтральные мукополисахариды - НМПС) или фиолетовую (смешанные формы) окраску на 100 секреторных клеток. Морфофункциональное состояние апудоцитов определяли по изменению интенсивности окрашивания и зоне распределения продукта секреции в клетке. Индекс активности апудоцитов (Иап) вычисляли по формуле [1]:
Исследования проводили с помощью программы ДММ (версия 2.1.0.0) аппаратнопрограммного комплекса МЕКОС-Ц. Статистическую обработку данных проводили в программе Microsoft Office Excel 2003.
Результаты исследований и их обсуждение. Животные 1-ой группы в 75 % случаев пали в течение 36 ч после заражения. У них отмечали типичные для холерной инфекции изменения в подвздошной кишке и начальных отделах толстого кишечника в виде перерастяжения петель прозрачной, бесцветной, слегка опалесцирующей жидкостью (рис.).
В отличие от заражения холерными вибрионами О1 серогруппы, при гистологическом исследовании в кишечнике крольчат наблюдали проявления воспалительного характера с превалированием пролиферативно-инфильтративных процессов над явлениями отека и дистрофического поражения энтероцитов. Эти изменения в ЖКТ протекали на фоне выраженных токсических повреждений паренхиматозных органов. Не исключено, что такие особенности развития патологического процесса в макроорганизме на введение холерных вибрионов 0139 серогруппы ctxA+, tcpA+ штаммов, обусловлены особенностями строения самого микроорганизма [7]. СПС оболочки была инфильтрирована полиморфонуклеарами (ПМЯЛ) и лимфоцитами. Количество последних достигало 6,9±0,97 клеток в поле зрения среза (в контроле – 4,2±1,17). Для эффекторной зоны иммунной системы кишечника характерным было снижение в 2-2,5 раза количества МЭЛ во всех отделах кишечника на фоне почти двукратного уменьшения количества апудоцитов (табл.2), особенно в тонком кишечнике и изменение их функциональной активности, обусловленной опустошением кле- ток. Так, Иап для тонкого кишечника на введение холерных вибрионов ctxA+, tcpA+ штаммов в среднем в 10 раз превышал аналогичный показатель у контрольных животных. Бокаловидные клетки были гипертрофированы, их число на единицу площади среза увеличивалось по сравнению с контролем, характер секрета в них чаще обусловливали КМПС. Известно, что защитные функции кишечного барьера связывают с НМПС [4], а описанные изменения свидетельствуют о нарушении процессов обновления секрета в клетках.
Крольчата 2-ой группы были умерщвлены через 48 ч наблюдения. При макроскопическом исследовании у них отмечали умеренное полнокровие паренхиматозных органов, гиперемию сосудов серозной оболочки тонкого кишечника. В кишечнике регистрировали умеренное количество слизистого желтоватого содержимого с газом. При гистологическом исследовании у крольчат этой группы регистрировали признаки функционального напряжения клеток паренхимы органов. В тонкой кишке животных наблюдали умеренный отек и полнокровие сосудов подслизистой оболочки, инфильтрацию СПС оболочки и стромы ворсин ПМЯЛ и лимфоцитами. Количество последних достигало 9,6±0,94 клеток в поле зрения среза (в контроле – 4,2±1,17). Количество МЭЛ при этом умеренно повышалось, а реакция апудоцитов заключалась в некотором уменьшении числа клеток без выраженного изменения их функциональной активности (табл.). Увеличивалось количество бокаловидных клеток на единицу площади среза по сравнению с контролем, менялся характер секрета в них, чаще, чем в контроле встречались клетки со смешанным продуктом секреции.
Таким образом, изменения морфофунк-
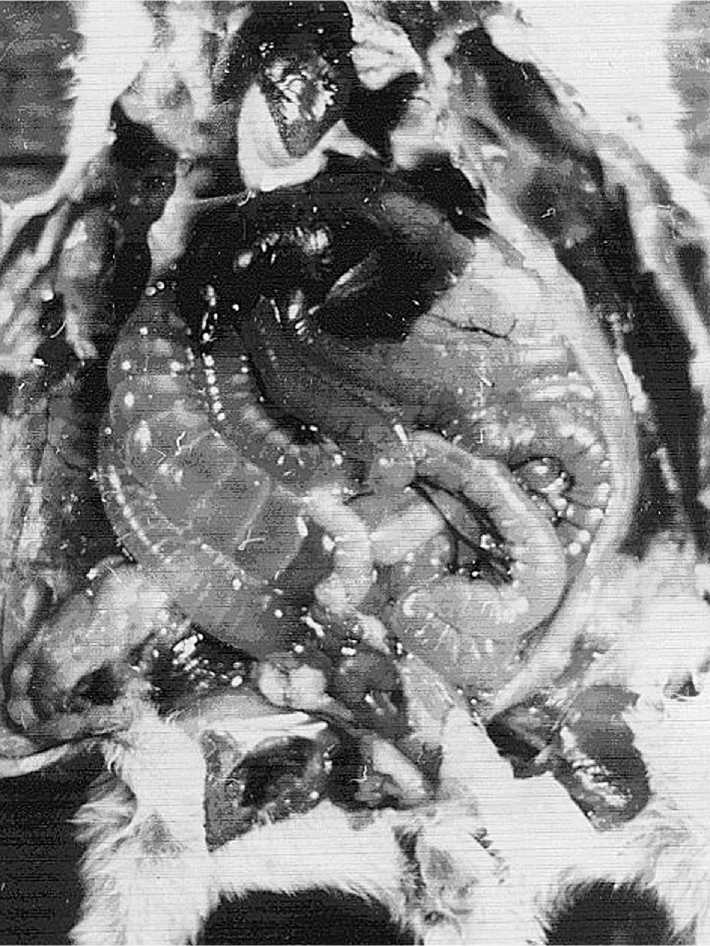
Рис. Крольчонок-сосунок. Внутрикишечное заражение холерными вибрионами О139 серогруппы ctxA+, tcpA+ штамма. 36 ч после заражения. Выраженный холерогенный эффект.
ционального состояния бокаловидных клеток, апудоцитов и элементов эффекторной зоны иммунной системы кишечника, выполняющих в макроорганизме барьерные функции, при моделировании холерной инфекции, отражали уровень повреждающего действия на эти структуры вибрионов О139 серогруппы штаммов с генотипом ctxA+, tcpA+ и направленность адаптационнокомпенсаторных реакций на введение ctxA- , tcpA- культур. Количественная характеристика барьерных структур биомодели, повышая инфор- мативность исследования, позволяет уточнять роль отдельных детерминант вирулентности в патогенезе патологического процесса.
Таблица 2
Характеристика клеток кишечного барьера крольчат-сосунков, зараженных холерными вибрионами О139 серогруппы
|
Определяемый показатель (М±m) |
Группа |
Двенадцатиперстная кишка |
Тощая кишка |
Подвздошная кишка |
Толстый кишечник |
|
Количество апу-доцитов Иап |
1-я |
4,43±0,8* 4,03 |
5,53±0,59 2,08 |
3,23±0,89* 3,41 |
2,5±0,62* 0,63 |
|
2-я |
6,2±0,69 0,95 |
6,6±1,2 0,68 |
4,7±0,91 0,94 |
3,75±0,55 0,43 |
|
|
Контроль |
8,0±1,45 0,29 |
7,8±0,39 0,46 |
6,3±0,89 0,32 |
5,4±0,56 0,35 |
|
|
Количество МЭЛ |
1-я |
- |
3,7±0,64* |
5,08±1,3* |
2,2±0,14 |
|
2-я |
- |
5,9±0,89 |
7,45±1,5 |
3,9±0,13 |
|
|
Контроль |
- |
9,4±1,32 |
12,0±2,4 |
4,2±1,17 |
|
|
Количество бокаловидных клеток |
1-я |
- |
3,7±2,14 |
7,4±1,9 |
9,3±1,44 |
|
2-я |
- |
3,4±0,19 |
5,2±0,89 |
6,7±0,32 |
|
|
Контроль |
- |
3,1±0,9 |
6,1±2,4 |
7,9±1,92 |
Примечание: * Уровень значимости различий результатов по отношению к контролю p<0,05.
Список литературы Морфофункциональное состояние кишечного барьера биомодели при введении холерных вибрионов О139 серогруппы штаммов с разным набором детерминант вирулентности
- Бугоркова С.А., Кутырев В.В., Бугоркова Т.В., Куличенко А.Н. Способ оценки качества вак цинных препаратов против холеры//Патент РФ №2301075. -Опуб. Бюл. №17, 20.06.07.
- Ерошенко Г.А. Vibrio cholerae O139: генетика и молекулярные механизмы образования возбуди теля холеры не О1 серогруппы/Г.А. Ерошенко//Проблемы особо опасных инфекций. 2006. №2 (92). -С.1518.
- Меркулов Г.А. Курс патогистологической техни ки. М.: «Медицина», 1969.367 с.
- Писарев В.Б. Бактериальный эндотоксикоз: взгляд патолога: монография/В.Б. Писарев, Н.В. Богомолова, В.В.Новочадов -Волгоград: Издво ВолГМУ, 2008.308 с.
- Саркисов Д.С. Микроскопическая техника: руководство/Д.С. Саркисов, Ю.Л. Перов. М.: «Медицина», 1996. -544 с.
- Хаитов Р.М. Иммунная система желудочно кишечного тракта: особенности строения и функ ционирования в норме и при патологии/Р.М. Хаитов, Б.В. Пинегин//Иммунология. 1997. №5. с. 47.
- Щелканова Е.Ю Новые гены Vibrio cholerae 0139 и их роль в патогенности/Е.Ю. Щелканова, Н.И. Смирнова//Проблемы особо опасных инфекций.1998. №1 (92). С. 3137.
- Dutta N.K. Experimental cholera in infant rabbit: a method for chemotherapeutic investigation/N.K. Dutta, M.K. Habbu//Brit. J. Pharmacol.1955. -V.10. P. 153159.
- Keasler S.P. Detection and biotyping Vibrio cholerae O1 with multiplex polymerase chain reaction/S.P. Keasler, R.H. Hall//Lancet.1993. V.341.P. 1661.
- Reidl J. Vibrio cholerae and cholerae:out of the water and into the host/J. Reidl, K. Klose//FEMS Microbiol. Rev. -2002. -V.26. -P. 125139.


