Морфофункциональное состояние пинеалоцитов на фоне темновой депривации
Автор: Л.И. Кондакова, С.А. Калашникова
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 4, 2024 года.
Бесплатный доступ
Цель исследования – изучение влияния темновой депривации на изменение морфометрических параметров пинеалоцитов у крыс. Материалы и методы. Эксперимент проводился на самцах крыс (n=36). Животные контрольной группы (n=12) содержались при стандартном свето-темновом режиме (12/12 ч), животные экспериментальных групп 1 (n=12) и 2 (n=12) – в условиях круглосуточной темновой депривации (24/0 ч). Длительность темновой депривации составила 30 сут. Далее крысы экспериментальной группы 2 содержались при стандартном свето-темновом режиме (12/12 ч). По окончании эксперимента образцы шишковидной железы были помещены в 10 % раствор забуференного формалина и подвергнуты автоматизированной гистологической обработке, приготовленные срезы окрашены гематоксилином и эозином. Проведено иммуногистохимическое исследование на антитела к каспазе-3 и белку Клото в соответствии с рекомендациями производителей. С помощью программы компьютерного анализа LAS Software Version 4.7.1. осуществляли морфомет-рию пинеалоцитов и глиоцитов. Результаты. Установлено, что 30-суточная темновая депривация вызывает снижение количества светлых пинеалоцитов на 23,2 %, их гипертрофию на 12,7 % и увеличение размеров ядер на 20,5 %. Через 14 сут после отмены темновой депривации количество светлых пинеалоцитов увеличилось на 5,5 %. Морфометрические показатели светлых пинеалоцитов шишковидной железы возвращались к исходному уровню: объем светлых пинеалоцитов и их ядер уменьшился на 2,8 % и 5,8 % соответственно. На фоне морфофункционального истощения появляются признаки апоптоза: снижение активности белка Клото и повышение активности каспазы-3. Выводы. Темновую депривацию следует рассматривать как фактор, способствующий ускоренному старению шишковидной железы.
Шишковидная железа, мелатонин, белок Клото, темновая депривация, пинеалоциты
Короткий адрес: https://sciup.org/14132313
IDR: 14132313 | DOI: 10.34014/2227-1848-2024-4-144-156
Текст научной статьи Морфофункциональное состояние пинеалоцитов на фоне темновой депривации
Введение. Шишковидная железа, содержащая глиальные клетки и пинеалоциты, является не только одним из регуляторов физиологической системы, но и светочувствительным органом, который участвует в циркадных и сезонных ритмах и играет жизненно важную роль в регуляции многих поведенческих и физиологических явлений [1], а также основным местом выработки мелатонина (МТ), синтез и секреция которого подавляются светом и усиливаются темнотой. В шишковидной железе доминируют синаптические пути, берущие начало в супрахиазматическом ядре (СХЯ) гипоталамуса [2]. Выработка МТ пинеалоци-тами контролируется циркадным сигналом от СХЯ, который связан с фотопериодом. Мелатонин обладает антиоксидантной активностью, удаляет избыточные свободные ради- калы, образующиеся в организме, оказывает иммуномодулирующее и антиапоптотическое действие, а также осуществляет поддержание хронобиологического гомеостаза [3–7]. Активация нейронов СХЯ светом, воспринимаемым сетчаткой, подавляет синтез МТ [8]. МТ в свою очередь может заметно ослаблять активность СХЯ. Это дополнительно стимулирует секрецию МТ в ночное время и способствует общему увеличению амплитуды циркадных ритмов. Являясь эндокринным мессенджером, МТ передает световой сигнал другим тканям, экспрессируя собственные рецепторы и тем самым доставляя в организм информацию, связанную со временем [9].
В целом шишковидная железа является ключевым органом, который обеспечивает связь между внешней средой, циркадными ритмами и организмом. Ее функции и влияние на здоровье человека являются объектом активного изучения.
Взаимодействие между МТ и СХЯ играет ключевую роль в синхронизации циркадных ритмов организма с изменениями окружающей среды. Паравентрикулярные ядра гипоталамуса выступают важным звеном в этом процессе, связывая СХЯ с синтезом мелатонина в шишковидной железе. Мелатонин обеспечивает стабильную регуляцию активности шишковидной железы, стимулируя ее в ночное время и подавляя днем за счет гамма-аминомаслянной кислоты, высвобождаемой гипоталамусом. Шишковидная железа имеет ключевое значение для регуляции сезонных ритмов, метаболизма, иммунитета, репродукции и других физиологических процессов [10–11].
Мелатонин играет важную роль в репродуктивной функции, контролируя выработку пролактина, фолликулостимулирующего и лютеинизирующего гормонов [12]. Синтез мелатонина в яичниках и яичках отражает значение этого гормона для регуляции репродуктивной физиологии через аутокринные и паракринные пути, обеспечивая высокое качество яйцеклеток и сперматозоидов [13–14].
Дефицит мелатонина связан с возникновением нейродегенеративных и неврологических расстройств, диабета, гипертонии, рака предстательной железы, аутоиммунных заболеваний, патологии репродуктивной системы [15]. Результаты как экспериментальных, так и клинических исследований подтверждают значимость своевременной диагностики нарушений функции шишковидной железы и экс-трапинеальной продукции мелатонина, которые могут служить важными нейроиммуноэн-докринными маркерами различных заболеваний [16].
Цель исследования. Изучение влияния темновой депривации на изменение морфометрических параметров пинеалоцитов у крыс.
Материалы и методы. Работа выполнена на 36 самцах беспородных крыс (возраст – 4 мес., масса тела – 369,29±5,65 г). Животные были получены из питомника ФГБУН
НЦБМТ ФМБА России «Столбовая». Все крысы содержались в клетках для лабораторных животных по 3–5 особей. Первоначально животных содержали при естественном освещении, температуре 22–24 °С и относительной влажности воздуха 40–50 %. Крысы имели свободный доступ к питьевой воде и стандартному гранулированному корму (ЗАО «Тосненский комбикормовый завод», Ленинградская область, Россия). Все процедуры проводились в соответствии с Директивой Европейского парламента 2010/63/ЕС «О защите животных, используемых в экспериментальных целях» (от 22.09.2010). На проведение исследования получено разрешение локального этического комитета ФГБОУ ВО ВолгГМУ Минздрава России (протокол № 222/164 от 25.11.2022).
Крысы были случайным образом разделены на группы: контрольную (n=12) – самцы, содержавшиеся при фиксированном световом режиме (свет/темнота – 12/12 ч с включением света в 8:00 и выключением в 20:00), экспериментальную 1 (n=12) и экспериментальную 2 (n=12) – самцы, содержавшиеся при постоянном освещении (свет/темнота – 24/0 ч).
Критерием отбора крыс в исследование было отсутствие видимых отклонений в поведении и внешнем виде животного (состоянии шерстного покрова, глаз, конечностей).
Длительность первой части исследования составила 30 сут. На 31-е сут крыс контрольной группы и экспериментальной группы 1 выводили из эксперимента после анестезии хлоралгидратом (400 мг/кг) (лаборатория токсикологии, НЦИЛС ВолгГМУ). Крысы экспериментальной группы 2 были переведены на 14 сут в фиксированный световой режим (свет/темнота – 12/12 ч с включением света в 8:00 и выключением в 20:00) с последующим выведением из эксперимента.
Для изучения морфологических изменений структурных компонентов шишковидной железы использовались общепринятые процедуры гистологического метода исследования. Для проведения морфологических, морфометрических и иммуногистохимических исследований орган был удален, гисто- логические образцы ткани были получены с помощью оригинальной методики, разработанной авторами [17].
Образцы были помещены в 10 % раствор забуференного формалина и подвергнуты автоматизированной гистологической обработке с использованием Leica TP1020 по стандартной методике. Из полученных парафиновых блоков с помощью ротационного микротома HM340E (MICROM, Германия) были изготовлены серийные срезы толщиной 3–5 мкм, которые затем были помещены на предметные стекла с адгезивным покрытием (Menzel, Германия). Следующим этапом было окрашивание гематоксилином Майера и эозином.
В целях определения экспрессии биологических маркеров, связанных с программированной гибелью и старением пинеалоцитов, было проведено иммуногистохимическое исследование. Антитела к каспазе-3 (Cloud-Clone Corp., США, разведение 1:100; PAA626Ra01) и белку Клото (Cloud-Clone Corp., США; разведение 1:100; DF10309) использовались в соответствии с рекомендациями производителей.
Для визуализации применялся набор реагентов IS086 (Cloud-Clone Corp., США) с последующим докрашиванием гематоксилином Майера. Позитивными контролями для каспазы-3 и белка Клото служили ткани почки крысы и рака поджелудочной железы человека соответственно. Негативным контролем выступали срезы с экспериментальным материалом без инкубации с первичными антителами при полном соблюдении остальных этапов протокола. Отрицательный контроль был создан путем исключения первичного антитела.
Для определения пинеалоцитарно-нейро-нального индекса использовали отношение плотности расположения глиоцитов к плотности расположения пинеалоцитов. Для оценки плотности расположения пинеалоцитов и нейроглии в шишковидной железе подсчиты- вали их абсолютное количество в 10 полях зрения [18]. Учитывались только жизнеспособные пинеалоциты.
Фотофиксацию препаратов осуществляли с использованием цифровой камеры Leica ICC 50 HD (Leica MicrosystemsGmbH, Германия) на бинокулярном микроскопе Leica DM 1000 при различных увеличениях.
Для морфометрического анализа использовалась программа компьютерного анализа LAS Software Version 4.7.1. (Leica Micro-systemsGmbH, Германия).
Обработка цифровых результатов проводилась прикладными статистическими методами с использованием программы Graphpad prizm 8.0.1. Достоверность различий между экспериментальными и контрольными данными оценивали с помощью t-критерия Стьюдента, вероятность ошибки менее 5 % (р≤0,05) считали достаточной.
Результаты и обсуждение. Гистологическое исследование препаратов шишковидной железы контрольной группы крыс показало, что орган окружен капсулой, от которой идут соединительные перегородки, разделяющие паренхиму на дольки. В перегородках обнаружены кровеносные сосуды – структурные элементы стромы шишковидной железы. Дольки железы имеют в основном округлую форму и состоят из пинеалоцитов и глиоцитов. Пинеалоциты подразделяются на светлые и темные.
Светлые пинеалоциты имеют округлую или овальную форму (рис. 1 А). Их средняя площадь составляет 62,71±2,06 мкм2, объем – 537,8±12,78 мкм3, периметр – 31,63±0,37 мкм. Ядро крупное, округлой формы, располагается центрально. Средняя площадь ядер составляет 25,8±0,99 мкм2, объем – 115,7±3,33 мкм3, периметр – 19,08±0,33 мкм (табл. 1). Цитоплазма занимает узкое пространство между ядром и цитоплазматической мембраной.
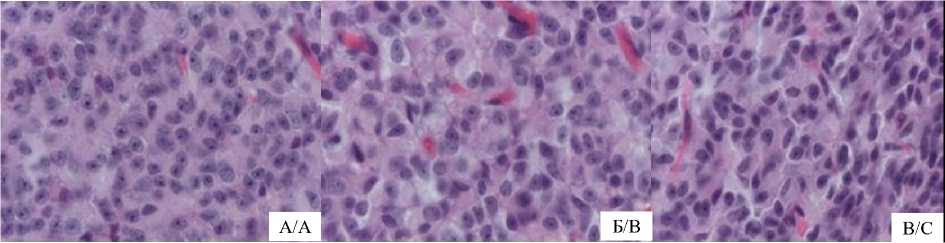
Рис. 1. Морфологические характеристики пинеалоцитов и глиоцитов шишковидной железы половозрелых самцов крыс на фоне 30-суточной темновой депривации: А – контрольная группа, Б – экспериментальная группа 1, В – экспериментальная группа 2. Окраска гематоксилин-эозином, ок. ×10, об. ×100
Fig. 1. Morphological characteristics of pinealocytes and gliocytes of pineal gland of mature male rats during 30-day dark deprivation: A – control group, B – experimental group 1, C – experimental group 2.
Hematoxylin and eosin stain, ocular ×10, lens ×100
Таблица 1
Table 1
Морфометрические показатели светлых пинеалоцитов
Morphometric parameters of light pinealocytes
|
Показатель Parameter |
Контрольная группа Control group |
Экспериментальная группа 1 Experimental group 1 |
Экспериментальная группа 2 Experimental group 2 |
|
Средняя площадь, мкм2 Average area, µm2 |
62,71±2,06 |
88,69±1,75** |
74,33±1,17# |
|
Средний объем, мкм3 Average volume, µm3 |
537,8±12,78 |
615,9±21,39* |
599,4±15,31# |
|
Средний периметр, мкм Average perimeter, µm |
31,63±0,37 |
35,36±0,34** |
31,95±0,9 |
|
Средняя площадь ядер, мкм2 Average area of nuclei, µm2 |
25,8±0,99 |
32,23±0,84** |
30,11±0,7# |
|
Средний объем ядер, мкм3 Average volume of nuclei, µm3 |
115,7±3,33 |
145,6±3,36** |
137,6±6,23## |
|
Средний периметр ядер, мкм Average perimeter of nuclei, µm |
19,08±0,33 |
21,08±0,3** |
19,4±0,25 |
Примечание. * – p≤0,05, ** – p≤0.001 по отношению к контрольной группе, # – p≤0,05, ## – p≤0,001 по отношению к экспериментальной группе 1.
Note. *p≤0.05, ** p≤0.001 – the differences are significant compared with the control group, #p≤0.05, ##p≤0.001 – the differences are significant compared with the experimental group 1.
Темные пинеалоциты по размерам меньше светлых. Цитоплазма также занимает узкое пространство между ядром и цитоплазматической мембраной. Средняя площадь темных пинеало-цитов составляет 27,61±1,31 мкм2, объем – 106,4±8,54 мкм3, периметр – 19,41±0,46 мкм. Ядро имеет овальную форму. Средняя площадь ядер – 13,88±0,57 мкм2, объем – 38,29±2,51 мкм3, периметр – 12,07±0,6 мкм.
Через 30 сут эксперимента в структуре шишковидной железы выявлены следующие особенности (рис. 1 Б). Светлые пинеалоциты имели неправильную форму, округлые крупные ядра и были расположены разреженно. Отмечалось уве- личение средней площади и объема светлых пи-неалоцитов на 29,3 % (p<0,001) и 12,7 % (p<0,05) соответственно. Средняя площадь и объем ядер светлых пинеалоцитов увеличились соответственно на 20,0 % и 20,5 % (p<0,001) (табл. 1).
Плотность пинеалоцитов у животных после 30-суточной темновой депривации (экспериментальная группа 1) была достоверно снижена на 23,2 % (р≤0,05) по сравнению с конт- рольной группой. В то же время плотность глиальных элементов в шишковидной железе в данной группе животных была значительно – в 2 раза (p≤0,001) – увеличена по сравнению с контрольной группой. Пинеалоци-тарно-нейрональный индекс в шишковидной железе животных экспериментальной группы 1 увеличился в 2,6 раза (р≥0,05) по сравнению с таковым в контроле (табл. 2).
Таблица 2
Table 2
Количественные показатели пинеалоцитов и астроцитарной глии шишковидной железы
Morphometric parameters of pinealocytes and astrocytic glia of the pineal gland
|
Показатель Parameter |
Контрольная группа Control group |
Экспериментальная группа 1 Experimental group 1 |
Экспериментальная группа 2 Experimental group 2 |
|
Абсолютное число пинеалоцитов Absolute number of pinealocytes |
95,52±7,21 |
73,32±6,87* |
77,58±6,98*, # |
|
Абсолютное число астроцитов Absolute number of astrocytes |
27,37±4,29 |
54,8±5,16** |
48,41±4,81*,# |
|
Пинеалоцитарно-нейрональный индекс Pinealocytic neuronal index |
0,287±0,23 |
0,747±0,31 |
0,624±0,24 |
Примечание. * – p≤0,05, ** – p≤0,001 по отношению к контрольной группе, # – p≤0,05 по отношению к экспериментальной группе 1.
Note. *p≤0.05, ** p≤0.001 – the differences are significant compared with the control group, #p≤0.05 – the differences are significant compared with the experimental group 1.
Через 14 сут после отмены темновой депривации светлые пинеалоциты имели овальные ядра (рис. 1 В). Площадь и объем пинеалоцитов уменьшились на 19,3 % и 2,8 % (p<0,05) соответственно. Выявлено уменьшение площади и объема ядер – на 7,04 % (p<0,05) и 5,8 % (p<0,001) соответственно (табл. 1). Средняя площадь темных пинеалоцитов уменьшилась незначительно – на 5,02 % (p>0,05), что заметно меньше по сравнению со светлыми пинеалоцитами.
Кроме того, на 14-е сут после отмены темновой депривации отмечается достоверное повышение плотности пинеалоцитов на 5,8 % (р≤0,05), однако данный показатель не достигает значений контрольной группы, сохранив снижение на 18,8 % (р≤0,05). Плотность астроцитарной глии снизилась на 11,7 % (р≤0,05), не достигнув показателя контрольной группы и превысив его в 1,8 раза (р≤0,05). Пинеалоци-тарно-нейрональный индекс снизился на 16,5 %, сохранив превышение показателя контрольной группы в 2,2 раза (табл. 2).
При иммуногистохимическом исследовании в группе с темновой депривацией отмечается увеличение экспрессии каспазы-3 в клетках эпифиза на 23,7 % (p<0,05) по сравнению с контрольной группой (табл. 3, рис. 2). Через 14 сут после отмены темновой депривации экспрессия каспазы-3 в клетках эпифиза позитивных клеток снизилась на 11,8 % (p<0,05) (табл. 3, рис. 2).
Таблица 3
Table 3
Удельная площадь (%) каспаза-3- и белок Клото-позитивных клеток в пинеалоцитах
Specific area (%) of caspase-3 and Klotho protein in pinealocytes of the epiphysis
|
Показатель Parameter |
Контрольная группа Control group |
Экспериментальная группа 1 Experimental group 1 |
Экспериментальная группа 2 Experimental group 2 |
|
Каспаза-3 Caspase-3 |
4,05±0,76 |
5,01±0,65* |
4,42±0,45# |
|
Белок Клото Klotho protein |
0,25±0,01 |
0,16±0,01* |
0,19±0,01# |
Примечание. * – p<0,05 по отношению к показателю животных контрольной группы, # – p≤0,05 по отношению к экспериментальной группе 1 (ранговый однофакторный анализ Краскела – Уоллиса, критерий Данна).
Note. *p<0.05 – the differences are significant compared with the control group, #p≤0.05 – the differences are significant compared with the experimental group 1 (Kruskal–Wallis test, Dunn’s test).
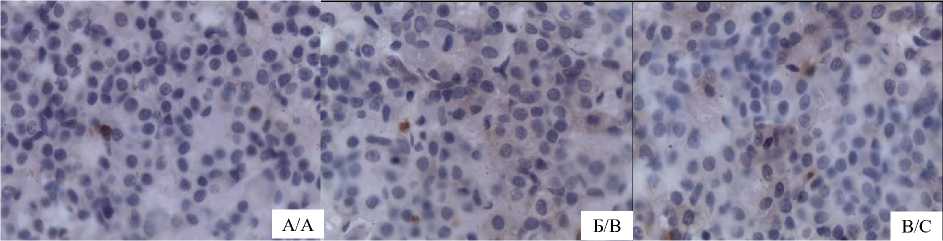
Рис. 2. Экспрессия каспазы-3 пинеалоцитами шишковидной железы половозрелых самцов крыс на фоне 30-суточной темновой депривации: А – контрольная группа, Б – экспериментальная группа 1, В – экспериментальная группа 2. Ок. ×10, об. ×100
Fig. 2. Expression of caspase-3 by pinealocytes of the pineal gland of mature male rats against during 30-day dark deprivation: A – control group, B – experimental group 1, C – experimental group 2.
Ocular ×10, lens ×100
При иммуногистохимическом исследовании экспрессии белка Клото в группе с моделируемой темновой депривацией в пинеало-цитах удельная площадь иммунопозитивных клеток уменьшилась на 36 % (p<0,05). Через 14 сут после отмены темновой депривации данный показатель увеличился на 18,8 % (p<0,05).
Темновая депривация вызывает морфологические изменения в пинеалоцитах эпифиза, которые заключаются в увеличении светлых пинеалоцитов и их ядер, и снижение функциональной активности органа. Повышение активности каспазы-3 в светлых пинеалоцитах свидетельствует об активации апоптотиче-ских процессов в ответ на стресс, вызванный темновой депривацией. Гибель некоторых пи-неалоцитов от апоптоза может быть вызвана активацией свободнорадикального окисления, что приводит к перекисному окислению белков и липидов, а также к развитию окислительного стресса [17]. Инициация перекисного окисления белков и липидов также может стать причиной повреждения клеток. Перекисное окисление приводит к образованию перекисных радикалов, которые могут разрушать структуру белков и липидов, нарушая нормальное функционирование клеток. Эти процессы могут быть вызваны различными факторами, такими как воздействие окружающей среды, стресс, плохая диета, неадекватное освещение (недостаток или избыток света), патологические состояния и др. Изучение этих механизмов позволяет лучше понять причины гибели пинеалоцитов и может помочь в разработке стратегий для их защиты и сохранения здоровья. Снижение активности белка Клото в светлых пинеалоцитах свидетельствует об ускоренном клеточном старении и апоптозе. Полученные данные указывают на то, что в шишковидной железе происходит развитие сложных компенсаторно-приспособительных процессов, которые сопровождаются негативными изменениями. Вероятно, длительное воздействие темновой депривации привело к увеличению уровня окислительного стресса в большинстве клеток шишковидной железы. По данным литературы, изменение плотности клеток в паренхиме, а также преобладание светлых пинеало-цитов свидетельствуют о морфологических проявлениях функциональной активности эпифиза [5, 8].
Таким образом, 30-суточная темновая депривация сопровождалась уменьшением плотности светлых пинеалоцитов, что свидетельствует о снижении функциональной активности шишковидной железы. Полученные данные подтверждаются ранее проведенными исследованиями, которые показали снижение уровня мелатонина в сыворотке крови при воздействии постоянного освещения в течение 30 сут [19].
Такие морфологические изменения шишковидной железы, как уменьшение количества светлых пинеалоцитов и их гипертрофия, увеличение содержания малоактивных темных клеток, характерны для старения и свидетельствуют об ослаблении эпифизарных секреторных процессов [1]. Нарушения могут быть следствием ослабления региональной гемодинамики из-за ухудшения проходимости мозговых сосудов либо изменения реологических свойств крови, а также результатом дефектов нормальной иннервации эпифиза. Они отрицательно сказываются как на масштабах, так и временной динамике выработки железой биологически активных соединений, в первую очередь – мелатонина.
Заключение. Таким образом, постоянный световой режим в течение 30 сут десинхронизирует морфофункциональную активность светлых пинеалоцитов. Морфологические перестройки носят неспецифический полиморфный характер. Отмена темновой депривации на 14 сут стабилизирует морфометрические показатели клеток шишковидной железы за счет компенсаторно-приспособительных механизмов и активации синтетических процессов в некоторых пинеалоцитах.
Список литературы Морфофункциональное состояние пинеалоцитов на фоне темновой депривации
- Carlomagno G., Minini M., Tilotta M., Unfer V. From Implantation to Birth: Insight into Molecular Melatonin Functions. Int. J. Mol. Sci. 2018; 19: 2802. DOI: 10.3390/ijms19092802.
- Ivanov D.O., Evsyukova I.I., Mironova E.S., Polyakova V.O., Kvetnoy I.M., Nasyrov R.A. Maternal Mel-atonin Deficiency Leads to Endocrine Pathologies in Children in Early Ontogenesis. Int. J. Mol. Sci. 2021; 22: 2058. DOI: 10.3390/ijms22042058.
- Opie L.H., Lecour S. Melatonin Has Multiorgan Effects. Eur. Heart J. Cardiovasc. Pharm. 2016; 2: 258265. DOI: 10.1093/ehjcvp/pvv037.
- Yang C.H., Xu J.H., Ren Q.C., Duan T., Mo F., Zhang W. Melatonin Promotes Secondary Hair Follicle Development of Early Postnatal Cashmere Goat and Improves Cashmere Quantity and Quality by Enhancing Antioxidant Capacity and Suppressing Apoptosis. J. Pineal Res. 2019; 67: e12569. DOI: 10.1111/jpi.12569.
- Yang Y., Wang P., ZhengX., Du X. Therapeutic Strategies of Melatonin in Cancer Patients: A Systematic Review and Meta-Analysis. Oncol. Targets. 2018; 11: 7895-7908.
- Laudon M., Frydman-Marom A. Therapeutic Eects of Melatonin Receptor Agonists on Sleep and Comor-bid Disorders. Int. J. Mol. Sci. 2014; 15: 15924-15950. DOI: 10.3390/ijms150915924.
- Barinaga M. How the brain's clock gets daily enlightenment. Science. 2002; 295: 955-957. DOI: 10.1126/science.295.5557.955.
- Bartsch C., Bartsch H., Seebald E., Küpper H., Mecke D. Modulation of pineal activity during the 23rd sunspot cycle: Melatonin rise during the ascending phase of the cycle is accompanied by an increase of the sympathetic tone. Indian J. Exp. Biol. 2014; 52: 438-447.
- Boden M.J., Varcoe T.J., Kennaway D.J. Circadian regulation of reproduction: From gamete to offspring. Prog. Biophys. Mol. Biol. 2013; 113: 387-397. DOI: 10.1016/j.pbiomolbio.2013.01.003.
- Zisapel N. New perspectives on the role of melatonin in human sleep, circadian rhythms and their regulation. Br. J. Pharm. 2018; 175: 3190-3199. DOI: 10.1111/bph.14116.
- Ferlazzo N., Andolina G., Cannata A., Costanzo M.G., Rizzo V., Curró M., Ientile R., Caccamo D. Is Melatonin the Cornucopia of the 21st Century? Antioxidants. 2020; 9: 1088. DOI: 10.3390/an-tiox9111088.
- Acuña-Castroviejo D., López L.C., Escames G., López A., García J.A., Reiter R.J. Melatonin-mitochon-dria interplay in health and disease. Curr. Top. Med. Chem. 2011; 11: 221-240. DOI: 10.2174/ 156802611794863517.
- Tamura H., Takasaki A., Miwa I., Taniguchi K., Maekawa R., Asada H., Taketani T., Matsuoka A., Yam-agatam Y., Shimamuram K. Oxidative stress impairs oocyte quality and Melatonin protects oocytes from free radical damage and improves fertilization rate. J. Pineal Res. 2008; 44: 280-287. DOI: 10.1111/ j.1600-079X.2007.00524.x.
- De Almeida Chuffa L.G., Lupi L.A., Cucielo M.S., Silveira H.S., Reiter R.J., Seiva F.R.F. Melatonin Promotes Uterine and Placental Health: Potential Molecular Mechanisms. Int. J. Mol. Sci. 2020; 21: 300. DOI: 10.3390/ijms21010300.
- Ahmad S.B., Ali A., Bilal M., Rashid S.M., Wani A.B., Bhat R.R., Rehman M.U. Melatonin and Health: Insights of Melatonin Action, Biological Functions, and Associated Disorders. Cellular and molecular neurobiology. 2023; 43 (6): 2437-2458. DOI: https://doi.org/10.1007/s10571-023-01324-w.
- Kvetnoy I.M., Sinitskaya N.S., Kvetnaya T.V. Extrapineal Melatonin Location and Role in Pathological Processes. In: Pandi-Peruumal S.R., Cardinali D.P., editors. Melatonin: Biological Basis of its Function in Health and Disease. Boca Raton, FL, USA: CRC Press; 2005: 148-161.
- MuhammadShahid, Abdul Basit2, Mirza Ali Khan. Prevalence of Brucellosis among the Hospital Patients of Peshawar, Khyber Pakhtunkhwa Journal of Infection and Molecular Biology. 2014; 2 (2): 19-21. DOI: http://dx.doi.org/10.14737/jimb.2307-5465/2.2.19.21
- Hryntsova N., Hodorová I., Mikhaylik J., Romanyuk A. A Response of the Pineal Gland in Sexually Mature Rats under Long-term Exposure to Heavy Metal Salts. Prague medical report. 2022; 123 (4): 225242. DOI: https://doi.org/10.14712/23362936.2022.21.
- Кондакова Л.И., Багметова В.В., Сиротенко В.С., Доника А.Д. Влияние мелатонина на динамику массы тела и уровень белка Клото в крови у животных с преждевременным старением, вызванным темновой депривацией. Вестник Волгоградского государственного медицинского университета. 2022; 19 (4): 110-117. DOI: 10.19163/1994-9480-2022-19-4-110-117.


