Морфофункциональное состояние сосудистого компонента органов кроветворения в разные сроки моделируемой гипоксии в эксперименте
Автор: Наумов Александр Валентинович, Никитюк Дмитрий Борисович, Овсянникова Ольга Александровна, Шишкина Татьяна Александровна, Наумова Любовь Ивановна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.30, 2022 года.
Бесплатный доступ
В условиях гипоксии изменение морфофункционального состояния компонентов микроциркуляторного русла будет сопровождаться изменением адекватности и полноценности иммунного ответа и гемопоэза. Цель исследования - определение морфофункционального состояния сосудистого компонента красного костного мозга и селезенки в различные сроки моделируемой гипоксии и выявлении степени влияния на это состояние CD68-позитивных клеток. Хроническая гипоксия моделировалась на 246 белых беспородных крысах мужского пола с использованием специальных затравочных камер и природного газа Астраханского газового месторождения (Россия) в концентрации, не превышающей предельно допустимой. Эксперимент длился в течение 120 суток, ингаляция проводилась пять дней в неделю в течение четырех часов в день, выведение животных из эксперимента проводилось каждые 30 суток. Функциональную активность сосудистого компонента красного костного мозга определяли с помощью метода лазерной допплеровской флоуметрии. Иммуногистохимическим методом определяли степень экспрессии индуцибельной (iNOS) и эндотелиальной (eNOS) NO-синтаз и распределение CD68-позитивных клеток в структурах селезенки. Исследование показало, что по мере увеличения срока хронической моделируемой гипоксии происходит уменьшение показателя микроциркуляции, нарастание миогенного тонуса и показателя шунтирования, что, в совокупности, указывает на ухудшение перфузии органа и подтверждает формирование гипоксического состояния. Анализ функциональной активности, проведенный с помощью иммуногистохимического исследования экспрессии iNOS и eNOS в структурах селезенки, показал, что по мере увеличения срока эксперимента происходит снижение уровня эндотелиальной и нарастание уровня индуцибельной синтазы. Возможно, это связано с влиянием биологически активных веществ, выделяемых активированными при гипоксии макрофагами. Это подтверждается увеличением присутствия CD68-позитивных клеток в красной пульпе и по ходу соединительнотканных трабекул по мере увеличения экспериментального воздействия.
Красный костный мозг, селезенка, гипоксия, микроокружение, кровеносные сосуды
Короткий адрес: https://sciup.org/143179725
IDR: 143179725 | DOI: 10.20340/mv-mn.2022.30(4).747
Текст научной статьи Морфофункциональное состояние сосудистого компонента органов кроветворения в разные сроки моделируемой гипоксии в эксперименте
Наумов А.В., Никитюк Д.Б., Овсянникова О.А., Шишкина Т.А., Наумова Л.И. Морфофункциональное состояние сосудистого компонента органов кроветворения в разные сроки моделируемой гипоксии в эксперименте. Морфологические ведомости. 2022;30(4):747. (4).747
Naumov AV, Nikityuk DB, Ovsyannikova OA, Shishkina TA, Naumova LI. Morphological and functional state of the vascular component of hematopoiesis organs in different times of simulated hypoxia in the experiment. Morfologicheskie Vedomosti – Morphological newsletter. 2022;30(4):747. (4).747
Введение. Органы кроветворения, как центральные, так и периферические, играют важную роль в поддержании постоянства количественного и качественного состава в каждом клеточном звене системы крови, в том числе иммунном звене. При этом красный костный мозг является универсальным кроветворным органом, в котором происходит как процесс деления, такпроцесс частичной дифференцировки клеточных элементов, а периферические органы кроветворения осуществляют окончательную дифференцировку и модулируют условия для полноценного взаимодействия иммунокомпетентных клеток и антигенов с последующей элиминацией повреждающих факторов.
Основным связующим звеном между центральным и периферическим компонентами системы кроветворения является сосудистая система, представляющая одновременно сосудистый компонент гемопоэзиндуцирующего микроокружения для гемопоэтических клеточных элементов [1-2]. От ее состояния зависит адекватность и полноценность реализуемых функций каждого конкретного кроветворного органа. Сосудистый компонент органов кроветворения представлен эндотелиальными клетками синусоидальных капилляров и периваскулярными стромальными элементами. Эндотелиальные клетки красного костного мозга могут поддерживать пролиферацию и дифференцировку гемопоэтических и иммунокомпетентных клеток [3], а также контролировать их перемещение и выход в кровоток [4-6].
Среди периваскулярных стромальных элементов особое внимание стоит уделить макрофагам, которые в условиях гипоксии претерпевают значительные морфофункциональные изменения и способны, в свою очередь, оказывать влияние на функциональную активность сосудистого компонента [7-10]. Межклеточные взаимодействия в условиях формирующейся хронической гипоксии сопровождаются высвобождением значительного числа медиаторов эндогенной интоксикации, таких как продукты свободнорадикального окисления, цитокины, острофазные белки, оказывающие отрицательные эффекты в т.ч. и на сосудистый компонент органов кроветворения и иммуногенеза [11-13].
Материалы и методы исследования. Экспериментальное моделирование гипоксии было проведено на 246 белых беспородных крысах-самцах, которые находились в условиях стандартного сертифицированного вивария в соответствии с нормами и правилами обращения с лабораторными животными. Манипуляции в ходе эксперимента были выполнены в соответствии со стандартами Хельсинской декларации и Правилами лабораторной практики в РФ (приказ МЗ РФ от 19.06.2003 № 267), подтвержденные заключением локального этического комитета № 3 от 27.12.202 [14-15]. Моделировали гипоксию с помощью затравочных камер производства Московского института профзаболеваний и гигиены труда им. Ф.Ф. Эрисмана объемом 200 литров, в которых использовалась обедненная по кислороду воздушная смесь с добавлением природного газа Астраханского месторождения в концентрации 3 мг/м³. Изначально подаваемая воздушная смесь содержала 17,5% кислорода, что соответствует рО 2 – 133,2 мм. рт. ст. [16]. В качестве контролирующих приборов были использованы газоанализаторы фирмы «Анкат». Животные помещались в описанные условия четыре часа в день в течение пяти дней в неделю. Эксперимент длился четыре месяца, выведение животных осуществлялось кратностью один раз в месяц – через 30, 60, 90 и 120 суток. Также была выделена контрольная группа животных, которую помещали в камеру в аналогичном временном режиме, но с обычным составом воздуха.
Для оценки функционального состояния микроциркуляторного русла красного костного мозга использовался метод лазерной доплеровской флоумет-рии [17-19]. Изучали функциональную активность сосудистого компонента красного костного мозга в условиях острого опыта. Внутрибрюшинно вводили раствора этаминала натрия (4 мг на 100 г массы тела животного), после чего производился доступ к проксимальному метафизу бедренной кости, которая щадяще фенестрировалась с формированием отверстия диаметром в 1,5 мм для оценки микроциркуляции костного мозга. Для получения данных о микроциркуляции использовалось оборудование НПП «Лазма» – ЛАКК-02 (Россия). Результаты лазерной допплеровской флоуметрии регистрировали в относительных единицах, которые отражали степень перфузии за единицу времени.
Морфологическую оценку сосудистого компонента проводили на срезах селезенки, окрашенных гематоксилином и эозином и по Ван-Гизон. Иммуногистохимический анализ проводили на парафиновых гистологических срезах, изготовленных на микротоме LEICA RM 2255 (Германия) толщиной 4 мкм и окрашенных с помощью иммуногистостейнера Leica Microsystems Bond™ (Германия). Применяли панели моноклональных антител: CD68 (Ready-to-Use, клон 514H12, Leica Biosystems Bond™, Германия), AntieNOS antibody (разведение 1:200, клон EPR19296, Abcam, Великобритания), AntiiNOS antibody (разведение 1:200, Abcam, Великобритания). Была использована непрямая стрептавидин-биотиновая система детекции Leica BOND (Novocastra™, Германия). Исследование, визуализацию, фотографирование и последующий анализ препаратов проводили с использованием микроскопа Zeiss Axio Scope A1 (Германия) и цифрового сканера микропрепаратов Leica Aperio CS2 со специализированным программным обеспечением управления настройками и захвата изображения. Для оценки результатов производили подсчет индексов экспрессии CD68, iNOS и eNOS в процентах на 1000 клеток в 10 случайным образом отобранных полях зрения с учетом умеренного и выраженного иммуногистохимического окрашивания.
Результаты исследования и обсуждение. Исследование показателя микроциркуляции на фоне моделируемой гипоксии с использованием сероводородсодержащего газа дало следующие результаты. По сравнению с группой контроля, в которой было зарегистрировано наибольшее значение, исследованный параметр уменьшается по мере увеличения срока эксперимента. Подобное изменение свидетельствует об уменьшении притока крови в исследуемую область. Для уточнения состояния различных звеньев микроциркуляции проводился анализ вейвлет-преобразования амплитудночастотного спектра динамики перфузии. Были изучены активные механизмы регуляции просвета и тонуса сосудов - мио-генный, нейрогенный и эндотелиальный. Миогенные колебания отображают локальную регуляцию мышечного тонуса, определяемую состоянием гладких миоцитов в составе средней оболочки прекапилляров [20-21]. Чем выше амплитуда миогенных движений по стенке сосуда, тем она более расслаблена и раздута, подобно парусу, и тем, соответственно, ниже миогенный тонус сосуда [22]. На фоне гипоксии, вызванной действием сероводородсодержащего газа, амплитуда миоген-ных колебаний статистически достоверно уменьшилась на всех сроках эксперимента, и, таким образом, миогенный тонус сосудов возрос. Амплитуда нейрогенных колебаний, также как и нейрогенный компонент тонуса, статистически достоверных изменений не продемонстрировала, что, возможно, связано с низким воздействием серосодержащего газа на симпатическую иннервацию сосудов.
Эндотелиальный компонент тонуса реализуется эндотелиоцитами, синтезирующими и выделяющими в кровь биологически активные вещества, способные влиять на тонус и диаметр сосудов, в частности NO [23-25]. Первые два месяца эксперимента достоверного изменения данного компонента тонуса выявлено не было, а к 90 и 120 суткам было выявлено снижение амплитуды и повышение тонуса, что свидетельствует об увеличении выделения эндотелиальными клетками оксида азота. Скорее всего, это связано с увеличением активности индуцибельной синтазы.
Совокупность всех флаксмоций (максимальных амплитуд колебаний кровотока) представляет такой параметр микроциркуляции, как показатель шунтирования, определяющий эффективность ка- пиллярного кровотока [22]. Наименьший показатель шунтирования регистрировался в контрольной группе животных, что свидетельствует о максимальном поступлении крови в нутритивное звено. Максимальный показатель выявляется в группе животных, находившихся в условиях гипоксии в сочетании с ингаляцией природного газа в течение 120 суток. Это свидетельствует о значительном сбросе артериальной крови через шунты в венозную часть русла, минуя капилляры, что, в свою очередь, ведет к формированию смешанной гипоксии. Нарушения регуляции сосудистого тонуса мы подтвердили с помощью иммуногистохимических исследований, дополнительно исследовав роль макрофагов (CD68-позитивных) клеток. В качестве модели была выбрана селезенка тех же животных, находившихся в условиях ингаляции природного газа в течение 120 суток. Маркер CD68+ в структурах селезенки контрольной группы животных локализовался в красной пульпе, в белой пульпе CD68-позитивные клетки были выявлены в маргинальной зоне, в небольшом количестве в В-зависимых зонах лимфоидных узелков. В Т-зависимых участках CD68–позитивные клетки присутствовали единично. К 60 суткам экспериментального воздействия число CD68-позитивные клетки уменьшается в структурах белой пульпы, и они перемещаются в красную пульпу. К концу 90 суток эксперимента они отмечены в субкапсулярной зоне и соединительнотканных трабекулах, где наблюдается их увеличение (рис. 1).
По результатам иммуногистохимического окрашивания максимальная экспрессия eNOS была обнаружена в контрольной группе животных (рис. 2-а), по мере увеличения срока эксперимента концентрация этого фермента прогрессивно снижалась. При этом пропорционально уменьшению eNOS происходило увеличение iNOS, достигая максимума к 120 суткам (рис 2-б). Активное перемещение CD68-позитивных клеток по ходу кровеносных сосудов связано с их стимуляцией продуктами распада клеток и другими антигенами в результате хронической гипоксии.
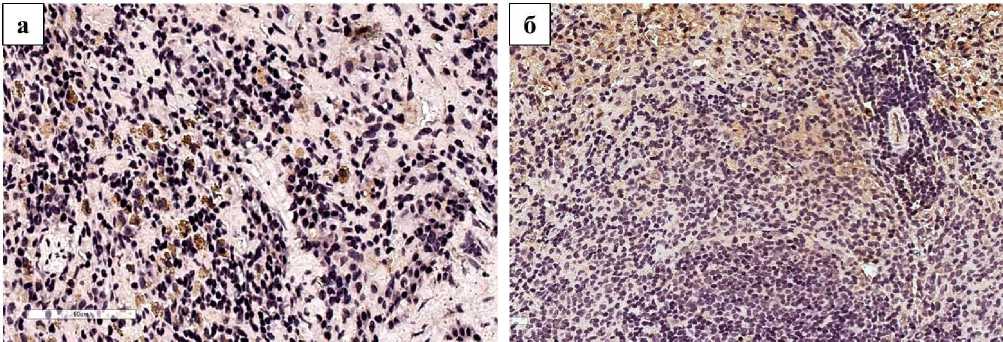
Рис. 2. Микрофото препарата селезенки. 120-е сутки эксперимента; а - экспрессия eNOS в структурах красной пульпы контрольной группы животных (а); б - экспрессия iNOS в структурах белой пульпы экспериментальной группы животных. Локализация маркеров – коричневые гранулы. Окр. иммуногистохимическим методом с докраской ядер гематоксилином. Ув.: а - х500, б - х240
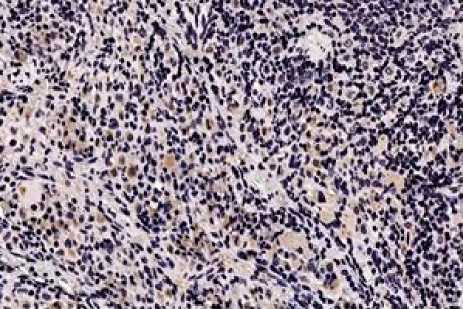
Рис. 1. Микрофото препарата селезенки. CD68-позитивные клетки (коричневый цвет) в красной пульпе. Окр. иммуногистохимическим методом с докраской ядер гематоксилином. Ув.: х600
Этот процесс сопровождается повышением функциональной активности макрофагов с последующей продукцией биологически активных веществ и цитокинов. Результатом совокупного действия этих факторов становится изменение функциональной активности эндотелия, а также последующее переключение активности с эндотелиальной NO-синтазы на индуцибельную.
Заключение. Таким образом, проведенные в настоящем исследовании эксперименты по моделированию хронической гипоксии на лабораторных крысах-самцах с использованием образцов природного газа Астраханского месторождения показали, что индуцибельная синтаза инициирует образование оксида азота в цитотоксических дозах в структурах селезенки животных под воздействием гипоксии. Нарастание концентрации оксида азота сопровождается изменением его биодоступности и реализацией цитотоксических эффектов. При повышении функциональной активности эндотелиальных клеток сосудистого компонента кроветворных органов происходит не усиление микроциркуляции, а реализация токсических эффектов по отношению к иммунокомпетентным клеткам. Как видно из полученных результатов далеко не последнюю роль в этом играют макрофаги.
Список литературы Морфофункциональное состояние сосудистого компонента органов кроветворения в разные сроки моделируемой гипоксии в эксперименте
- Petrenko VM. Limfoidnye ili krovetvornye organy? Uspekhi sovremennogo estestvoznaniya. 2011;(1):142-143. In Russian
- Mateva EV, Panteleeva NI. Reaktsiya serdechno-sosudistoy i dykhatel'noy sistem cheloveka na normobaricheskuyu gipoksiyu do i posle kursa interval'nykh gipoksicheskikh vozdeystvy. Fundamental'nye issledovaniya. 2014;(6-7):1406-1411. In Russian
- Rafi IS, Mohle R, Shapiro F et al. Regulation of hematopoiesis by microvascular endothelium. Leuk. Lymphoma. 1997;27(5-6):375-386
- Jacobsen K, Kravitz J, Kincade PW, Osmond DG. Adhesion receptor on bone marrow stromal cells: in vivo expression of vascular cell adhesion molecule - 1 by reti cular cells and sinusoidal endothelium in normal and γ-ir radiated mice. Blood. 1996;87(1):73-82
- Ponomaryov T, Peled A, Petit I. et al. Induction of the chemokine stromal-derived factor-1 following DNA damage improves human stem cell function. J. Clin. Invest. 2000;106(11):1331-1339
- Payushina OV. Krovetvornoe mikrookruzhenie i rol' mezenkhimnykh stromal'nykh kletok v ego organizatsii. Uspekhi sovremennoy biologii. 2015;135(1):52-63. In Russan
- Titova ON, Kuzubova NA, Lebedeva ES. Rol' gipoksiynogo signal'nogo puti v adaptatsii kletok k gipoksii. RMZH. Meditsinskoe obozrenie. 2020;4(4):207-213. In Russain. https://doi.org/10.32364/2587-6821-2020-4-4-207-213
- Prihod'ko VA, Selizarova NO, Okovity SV. Molekulyarnye mekhanizmy razvitiya gipoksii i adaptatsii k ney. Chast' I. Arkhiv patologii. 2021;83(2):52 61. In Russian. https://doi.org/10.17116/patol20218302152
- Taylor CT, Doherty G, Fallon PG, Cummins EP. Hypoxia-dependent regulation of inflammatory pathways in immune cells. J Clin Invest. 2016;126(10):3716-3724. https://doi.org/10.1172/JCI84433
- Taylor CT, Colgan SP. Regulation of immunity and inflammation by hypoxia in immunological niches. Nat Rev Immunol. 2017;17(12):774-785. https://doi.org/10.1038/nri.2017.103
- Petrishchev NN, Vlasov TD. Fiziologiya i patofiziologiya endoteliya. V kn.: Disfunktsiya endoteliya. Prichiny, mekhanizmy, farmakologicheskaya korrektsiya. Pod red. N.N. Petrishcheva. S-Pb: Izd-vo SPbGMU, 2003.- S. 4-39. In Russian
- Karoli NA, Rebrov AP. Endotelial'naya disfunktsiya i ee klinicheskoe znachenie u bol'nykh khronicheskimi obstruktivnymi zabolevaniyami legkih. Klinicheskaya meditsina. 2005;(9):10-16. In Russian
- Ketlinsky SA, Simbirtsev AS. Citokiny. Sankt-Peterburg: OOO «Izdatel'stvo Foliant», 2008.- 552s. In Russian
- Zapadnyuk VI, Zapadnyuk IP, Zakhariya EA. Laboratornye zhivotnye. Kiiv: Vishcha shkola, 1983.- 383s. In Russian
- Guide for the Care and Use of Laboratory Animals. Washington DC: The national academies press, 2011.- 243pp. URL: http://www.nap.edu/catalog/12910.html (Date: 05.07.18)
- Nikolaeva AG. Ispol'zovanie adaptatsii k gipoksii v meditsine i sporte. Vitebsk: VGMU, 2015.- 150s. In Russian
- Chuyan OM, Tribrat NS. Metodichnі aspekti zastosuvannya metodu lazernoy doplerіvs'koy floumetrii. Vchenі zapiski Tavrіys'kogo natsіonal'nogo unіversitetu іmeni V.І. Vernads'kogo. Serіya «Bіologіya, khіmіya». 2008;21(2):156-171. In Ukranian
- Barkhatov IV. Primenenie lazernoy dopplerovskoy floumetrii dlya otsenki narusheny sistemy mikrotsirkulyatsii krovi cheloveka. Kazansky meditsinskiy zhurnal. 2014;95(1):63-69. In Russian
- Chernyago TYu, Fomina VS, Feduyk OV, Yashkin MN. Metody otsenki funktsional'nogo sostoyaniya endoteliya u patsientov s varikoznoy bolezn'yu ven nizhnikh konechnostey: perspektivy lechebnoy taktiki. Vestnik natsional'nogo mediko-hirurgicheskogo tsentra imeni N.I. Pirogova. 2021;16(1):145-150. In Russian. https://doi.org/10.25881/BPNMSC.2021.17.48.028
- Stefanovska A, Bracic M, Kvernmo HD. Wavelet analysis of oscillations in the peripheral blood circulation measured by laser Doppler technique. IEEE Trans. Biomed. Eng. 1999;46(10):1230-1239
- Meyer MF, Rose CJ, Hulsmann JO et al. Impaired 0.1-Hz vasomotion assessed by laser Doppler anemometry as an early index of peripheral sympathetic neuropathy in diabetes. Micro vase. Res. 2003;65(2):88-95
- Krupatkin AI. Klinicheskaya neyroangiofiziologiya konechnostey (perivaskulyarnaya innervatsiya i nervnaya trofika). M.: Nauchny mir, 2003.- 328s. In Russian
- Popova AA, Berezikova EN, Mayanskaya SD. Endotelial'naya disfunktsiya i mekhanizmy ee formirovaniya. Sibirskoe meditsinskoe obozrenie. 2010;64(4):7-11. In Russian
- Pizov AV, Pizov NA, Skachkova OA, Pizova NV. Endotelial'naya funktsiya v norme i pri patologii. Meditinsky sovet. 2019;(6):154-159. In Russian
- Dorofienko NN. Rol' sosudistogo endoteliya v organizme i universal'nye mekhanizmy izmeneniya ego aktivnosti (obzor literatury). Byull. fiz. i pat. dykh. 2018;(68):107-116. In Russian


