Морфофункциональные изменения гепатоцитов и холангиоцитов при экспериментальном перитоните
Автор: Сафронова Галина Михайловна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 4 т.29, 2021 года.
Бесплатный доступ
Гнойный перитонит вызывает изменения структуры и функции органов нейроэндокринной, кроветворной, сердечно-сосудистой и других функциональных систем. Выраженные структурные изменения наблюдаются в печени и органах желудочно-кишечного тракта. Проблема лечения острого перитонита и вопрос о компенсаторно-приспособительных реакциях органов брюшной полости остаются в настоящее время актуальными. Целью исследования было изучение морфофункциональных изменений гепатоцитов и холангиоцитов междольковых выводных желчных протоков в условиях развития экспериментального перитонита, который воспроизводился путем создания очага некротического повреждения в вентральной брюшной стенке и разлитого септического воспаления в брюшной полости. В эксперименте на белых мышах (n=35) создавали модель острого серозно-гнойного перитонита. Животным под эфирным наркозом производили лапаротомию и контаминировали брюшную полость смесью, содержащей 10 мл аутопунктата терминального отдела тонкой кишки и крови из расчета 10 мл на 1 кг массы тела. Перитонит воспроизводили путем создания очага некротического повреждения в вентральной брюшной стенке и разлитого септического воспаления в брюшной полости, такая модель перитонита чаще всего используется в экспериментальной гастроэнтерологии. Использован комплекс морфологических методов исследования, включая гистохимические и электронно-микроскопические. Полученные данные показали, что в ходе развития экспериментального перитонита вначале наблюдается клеточно-ядерный полиморфизм гепатоцитов и усиление их белоксинтезирующей функции, затем гепатоциты подвергаются дистрофии, сопровождающейся изменениями биохимических показателей (нуклеопротеидов, активности фосфатаз, нейтрального жира, гликозоаминогликанов, гликогена), появлением мелкоочаговых некрозов, в дальнейшем, по мере затухания процесса, ткань печени восстанавливается. Изменения желчных протоков были менее выражены, в них наблюдались лейкоцитарная инфильтрация, гиперсекреция слизи, холангиофиброз. Полученные данные расширяют диапазон представлений об органоспецифических изменениях гепатоцитов, холангиоцитов, соединительной ткани портальных трактов и междольковых прослоек, клеточной выстилки печеночных синусоидов, элементов перисинусоидного пространства и мезотелия висцеральной брюшины при экспериментальном гнойном перитоните.
Печень, гепатоциты, холангиоциты, мышь, перитонит
Короткий адрес: https://sciup.org/143178011
IDR: 143178011 | DOI: 10.20340/mv-mn.2021.29(4).548
Текст научной статьи Морфофункциональные изменения гепатоцитов и холангиоцитов при экспериментальном перитоните
Сафронова Г.М. Морфофункциональные изменения гепатоцитов и холангиоцитов при экспериментальном перитоните// Морфологические ведомости.- 2021;29(4):548. (4):548
Safronova GM. The morphological and functional changes in hepatocytes and cholangiocytes at the experimental peritonitis. Mor-fologicheskie Vedomosti – Morphological Newsletter. 2021;29(4):548. (4):548
Введение . Несмотря на то, что методы лечения перитонита совершенствуются, летальность при этой патологии не уменьшается. Исключительно важно выяснить морфофункциональные изменения печени, как основного органа, обеспечивающего гомеостазис организма и содержащего большинство компонентов иммунной системы – натуральные киллеры, дендритные клетки, макрофаги и другие, а также определенную часть эффекторов специфического иммунитета в патогенезе перитонита, изучить реактивность клеток печени, их компенсаторноприспособительные реакции, ибо они во многом определяют течение и исход этого процесса.
Цель исследования : изучить морфологические, реактивные изменения гепатоцитов и холангиоцитов в динамике развития острого экспериментального перитонита.
Материалы и методы исследования. В эксперименте на белых мышах (n=35) создавали модель острого серозногнойного перитонита. Животным под эфирным наркозом производили лапаротомию и контаминировали брюшную полость смесью, содержащей 10 мл ауто-пунктата терминального отдела тонкой кишки и крови из расчета 10 мл на 1 кг массы тела. После контаминации брюшной полости рану послойно зашивали. Перитонит воспроизводили путем создания очага некротического повреждения в вентральной брюшной стенке и разлитого септического воспаления в брюшной полости. Эта модель перитонита чаще всего используется в экспериментальной гастроэнтерологии. Опытные животные были разделены на 7 групп (по 5 мышей в каждой). Контрольной группой служили 15 мышей, которым под эфирным наркозом с соблюдением правил асептики и антисептики инсулиновым шприцем в брюшную полость вводили физиологический раствор. Животных по группам выводили из опыта в соответствии с «Методическими рекомендациями по эвтаназии экспериментальных животных» [1] через 3, 6, 12, 24 часов, 3 суток, 1, 2, 3 и 4 недели после введения смеси (опыт) и физиологического раствора (контроль). Материалом исследования служила печень мышей опытных и контрольной групп. Использован комплекс морфологических методов исследования.
Для гистологического исследования, кусочки печени фиксировали в 10% нейтральном забуференном формалине. Использовали обзорную окраску депарафинированных гистологических срезов гематоксилин-эозином, а также элективную методику изготовления пленочных препаратов глиссоновой капсулы. Для этого капсулу препарировали, расправляли и закрепляли на парафиновых пластинах. При этом мезотелий смачивали 5% раствором сахарозы для предотвращения его высыхания. Затем фиксировали в 12% нейтральном формалине и изготовляли пленочные препараты. Для выявления клеточных границ мезотелиоцитов пленку перед фиксацией импрегнировали 0,2% раствором азотнокислого серебра в течение одной минуты и облучали ультрафиолетовыми лучами. Для окраски ядер ме-зотелиоцитов применяли гематоксилин по Гейденгайну. В полученных гистологических препаратах проведены морфометрические исследования. Определяли ядерно-цитоплазматические отношения (по величине объемов и площадей поперечного сечения) гепатоцитов. Для вычисления ядерно-цитоплазматического отношения гепатоцитов сначала измеряли линейные размеры клеток и их ядер. В каждом случае было измерено не менее 100 клеток. Статистическую обработку полученных данных проводили с использованием ме- тодов параметрической и непараметрической статистики. Для оценки межгрупповых различий применяли при сравнении 2 групп - t-критерий Стъюдента, в случаях множественных сопоставлений групп – критерии Стъюдента-Ньюмена-Коулза. Парафиновые срезы использовали также для гистохимических реакций (окраски нуклеопротеидов по Унна-Паппенгейму; выявления гликогена, гликозаминогликанов и гликопротеидов с помощью ШИК – реакции; окраски нейтрального жира су-даном-III и фосфолипидов - суданом черным), на замороженных срезах выявляли активность гидролитических ферментов -щелочной и кислой фосфатаз.
Для электронно-микроскопического изучения кусочки печени фиксировали в 2% глютаральдегиде, далее в 1% растворе четыре окиси осмия по методу Колфильда и заливали в смесь эпон812-аралдит. Ультратонкие срезы получены на ультратоме ЛКБ-3, контрастировали цитратом свинца и просматривали на электронном микроскопе УЕМ-100. Электронно-микроскопические исследования проведены в лаборатории электронной микроскопии (заведующая - доктор медицин- ских наук, профессор В.Ф. Иванова ЦНИЛ СЗГМУ имени И.И. Мечникова).
Результаты исследования и обсуждение . На всех стадиях развития экспериментального перитонита возникают морфофункциональные и реактивные изменения тканей и клеток печени, однако в разные сроки опыта они выражены неодинаково. В ранние сроки эксперимента (1-3 сутки наблюдения) преобладают морфофункциональные изменения и компенсаторно-приспособительные реакции тканей печени, но на 7-е сутки опыта, когда интоксикация организма становится максимальной, развиваются дистрофические и деструктивные процессы, интенсивность которых затем через 2-3 недели постепенно снижается так, что через 4 недели ткани печени опытных мышей мало отличаются от таковых у контрольных интактных мышей. Нами установлено, что выраженность развития отмеченных выше изменений разных тканей и клеток печени различна. Гепатоциты печеночных балок более чувствительны к интоксикации, чем холангиоциты междольковых выводных желчных протоков, фибробласты соединительной ткани и мезотелиоциты капсулы железы.
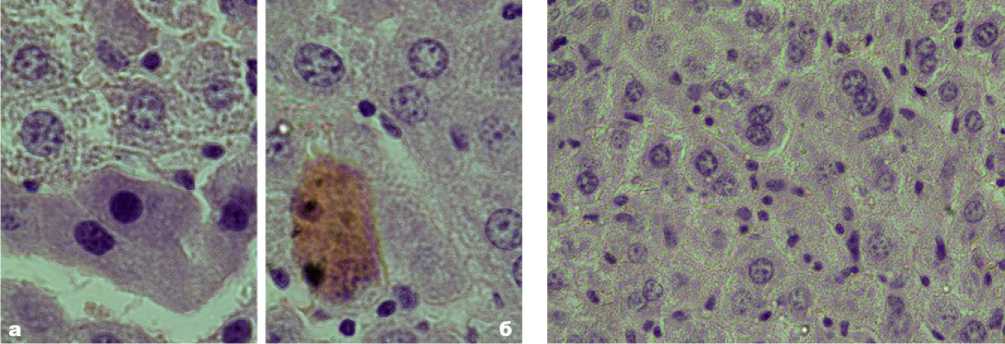
Рис. 1. Микрофото гистологического препарата печени. Дистрофические изменения гепатоцитов и холангиоцитов мышей на 7-е сутки эксперимента. Обозначения: а - микроочаг базофильной дистрофии, состоящий из 3-х гепатоцитов; б - эозинофильная дистрофия гепатоцитов. Окр. гематоксилином-эозином. Ув.: х1000.
Рис. 2. Микрофото гистологического препарата печени. Множественные двуядерные гепатоциты печени мышей через 4 недели после введения микробной взвеси. Окр. гематоксилином-эозином. Ув.: х400.
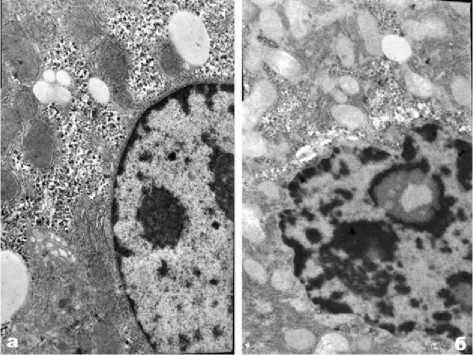
Рис. 3. Электронное микрофото реактивных изменений гепатоцитов мыши; а -функциональная гипертрофия гепатоцита на 1-3 сутки (ув. Х11000); б - дистрофически измененный гепатоцит на 57 сутки (ув.: х10000).
Морфофункциональные и реактивные изменения гепатоцитов при экспериментальном перитоните через 1-3 сутки опыта характеризуются полиморфизмом по размерам, гипер- и гипохрома-тозу их ядер и цитоплазмы, базо- и эозинофилии клеток. На 5-7 сутки эксперимента появляются дистрофически измененные гепатоциты, претерпевающие преимущественно базофильную и эозинофильную белковые дистрофии (рис. 1-а, 1-б). Реже встречаются гепатоциты в со- стоянии водянистой и жировой дистрофиях. По мере затухания перитонита интенсивность дистрофических изменений гепатоцитов, экссудация и лейкоцитарная инфильтрация печеночных балок снижаются. Одновременно увеличивается количество двухядерных и многоядерных гепатоцитов как результат незавершенных митозов (рис. 2). Гистохимические исследования гепатоцитов в разные стадии перитонита показали существенные изменения содержания нуклеопротеидов, гликогена, гликозаминогликанов, нейтрального жира, а также активности щелочной и кислой фосфатаз. Электронно-микроскопические исследования гепатоцитов в 1-3 сутки эксперимента выявили разнообразные изменения их структуры: гипертрофию канальцев шероховатой и гладкой эндоплазматической сети, накопление включений гликогена и жира (рис. 3). На 5-7 сутки опыта электроннограммы печени показывают дистрофически измененные гепатоциты с нарушением ядерного аппарата, органелл и включений цитоплазмы, повреждением межклеточных контактов (рис. 3). Данные морфометрического анализа динамики изменения объемов ядер, цитоплазмы и ядерно-цитоплазматичес-кого отношения гепатоцитов в разные сроки эксперимента отражены на рис. 4.
0.25
0.20
■ 0.20
♦ 0.18
0 20
0.21
0.21
• 0.21
♦ 0.17
♦ 0.17
0.15 я/ц

опыт контроль
1-с сутки 3-ссутки 5-е сутки 7-с сутки 14-с сутки время наблюдения
р < 0.05
Рис. 4. Изменения ядерно-цитоплазматического отношения (я/ц) гепатоцитов в условных единицах опытных и контрольных животных в разные сроки наблюдения.
При экспериментальном перито- междольковых желчных протоков секре- ните в ранние сроки опыта холангиоциты тируют слизь. В последующие сроки экс-
перимента отмечается лейкоцитарная инфильтрация эпителия протоков и пониженное муцино-образование. Характерные изменения претерпевает люме-нальная и контактная поверхности холан-гиоцитов. Межклеточные контакты холан-гиоцитов подвергаются дезинтеграции (рис. 5). В поздние сроки опыта гистохимические реакции ультрамикроскопиче-ская структура холангиоцитов и их межклеточные контакты восстанавливаются.
Гнойный перитонит вызывает изменения структуры и функции органов нейроэндокринной, кроветворной, сердечно-сосудистой и других функциональных систем организма. Выраженные структурные изменения наблюдаются также в печени и органах желудочнокишечного тракта [2-3]. Исследованиями последних лет установлено, что уже через 6 часов после инициации перитонита наблюдаются системные нарушения структуры и гемодинамики брюшины, тонкой и толстой кишки, а также печени, характеризующиеся выраженными дистрофическими и некробиотическими изменениями, гиперемией сосудов, интерстициальным отеком, воспалительной лейкоцитарной инфильтрацией, агрегацией эритроцитов, феноменом «сладжа» форменных элементов крови и гемостаза в сосудах гемомикроциркуляторного русла, а также геморрагическим пропитыванием параваскулярной соединительной ткани [4]. Использованная нами модель экспериментального перитонита воспроизводит серозно-гнойное воспаление брюшины, вызванное микробной взвесью аэробных и анаэробных бактерий из расчета 0,6 миллиардов микроорганизмов на 100 грамм массы тела мыши с характерной фазностью процесса и различной интенсивностью его течения на ранних и последующих сроках эксперимента.
В цитоплазме гепатоцитов увеличивается содержание включений гликогена, гликозаминогликанов и других ШИК-положительных веществ. Вышеотмечен-ные данные согласуются с результатами авторов, отмечавших структурнофункциональный полиморфизм гепатоцитов, сопровождающийся активацией синтетических процессов, как инициаль- ную компенсаторную реакцию печеночных клеток при воздействии на организм различных экзо- и эндогенных факторов [5-6].
Однако через неделю опыта, когда общая интоксикация организма при перитоните становится выраженной, гепатоциты претерпевают дистрофические изменения, выражающиеся появлением в жизнеспособной паренхиме одиночных или собранных в островки клеток, подвер-
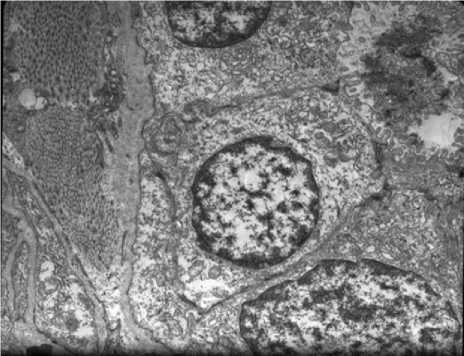
Рис. 5. Электронное микрофото желчного капилляра мыши через 4 недели после введения микробной взвеси. Ув.: х10000.
гающихся дистрофии. Чаще отмечается белковая дистрофия («мутное» зернистое набухание гепатоцитов и эозинофильная дистрофия), нежели чем жировая и водяночная дистрофии или сочетанные их варианты.
Морфофункциональные изменения холангиоцитов выводных желчных протоков на ранних сроках эксперимента сопровождаются незначительным увеличением содержания нуклеопротеидов, усилением ШИК - реакции на гликоген и гликозаминогликаны на фоне слабовыра-женного полиморфизма холангиоцитов [7-8]. С нарастанием общей интоксикации на 5-7-е сутки опыта эпителий междольковых протоков претерпевает дистрофические изменения, в его составе обнаруживаются очаги холангиоцитов с мутным набуханием их цитоплазмы и лейкоцитарной инфильтрацией. Однако в дальнейшем по мере затухания перитонита через 2-4 недели опыта дистрофические процессы эпителия желчных протоков ослабевают и постепенно их структура восстанавливается, что подтверждается также электронно-микроскопическими исследованиями холангиоцитов.
Заключение. Таким образом, морфофункциональные изменения гепатоцитов в динамике развития экспериментального перитонита в разные сроки опыта выражены неодинаково. В ранние сроки преобладают экссудативные реакции, а морфофункциональные изменения гепатоцитов носят компенсаторно-приспособительный характер, выражающийся развитием ядерного и клеточного полиморфизма, гипер- и гипохроматозом ядер и цитоплазмы клеток. По мере снижения интоксикации электронно-микроскопическая структура функциональных аппаратов гепатоцитов постепенно восстанавливается. Морфофункциональные изменения эпителия междольковых желчных протоков в динамике экспериментального перитонита в сравнении с изменениями гепатоцитов выражены слабее. На ранних стадиях воспаления отмечается гиперсекреция холангиоцитами слизи и незначительная диффузная лейкоцитарная инфильтрация. Затем лейкоцитарная инфильтрация становится мелкоочаговой и постепенно затухает.
Список литературы Морфофункциональные изменения гепатоцитов и холангиоцитов при экспериментальном перитоните
- Metodicheskie rekomendatsii po evtanazii eksperimental'nykh zhivotnykh. M.: Nauka, 1985.- 32s. In Russian
- Verin VK, Gamzatov HA, Safronova GM. Morfofunkcional'nye izmeneniya pecheni zhivotnykh v dinamike razvitiya eksperimental'nogo peritonita/ V kn.: Mater. conf. «Mediko-social'nye problemy profilaktiki, diagnostiki i lecheniya zabolevanij» 12-14 maya 2003 g.- S-Pb.: S-PbGMA, 2003.- 152s. In Russian
- Verin VK, Gamzatov HA, Safronova GM. Reaktivnye izmeneniya tkani pecheni zhivotnykh v dinamike razvitiya u nikh peritonita/ V kn.: Mater. conf. «Fundamental'nye i prikladnye problemy gistologii: gistogenez i regeneraciya tkanej» 20-21 maya 2004 g. S-Pb.: VMA, 2004.- S. 95-96. In Russian
- Safronova GM. Morfofunkcional'nye izmeneniya pechenochnykh sinusoidov v raznye sroki eksperimental'nogo peritonita/ V kn.: Mater. conf. «Aktual'nye voprosy sovremennoj morfologii» 17-19 maya 2011 g. S-Pb.: S-PbGMA, 2011.- S. 11-12. In Russian
- Burnstock G, Vaughn B, Robson SC. Purinergic signaling in the liver in health and disease. Purinergic Signal. 2014;10(1):51-70. DOI: 10.1007/s11302-013-9398-8
- Singh R. Autophagy and regulation of lipid metabolism. Results and Probl. Cell Differ. 2010;52:35-46. DOI: 10.1007/978-3-642-14426-4_4
- Verin VK, Gamzatov HA, Safronova GM. Adaptacionno-kompensatornye reaktsii tkanej pecheni zhivotnykh v dinamike razvitiya eksperimental'nogo peritonita. Morfologija. 2005;2:63. In Russian
- Verin VK, Safronova GM. Reaktivnye izmeneniya tkanej pecheni v usloviyakh eksperimental'nogo peritonita/ V kn.: Mater. conf. «Aktual'nye voprosy sovremennoj morfologii», 17-19 maya 2008 g. S-Pb.: S-PbGMA, 2008.- S. 180-183. In Russian


