Морфофункциональные образы растения (на примере многоклеточных водорослей)
Автор: Празукин Александр Васильевич
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Материалы лекций и устных докладов
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
На примере многоклеточных водорослей рассматриваются три морфо-функциональных образа растения: растение как система «открытого роста», открытого «питания» и как система популятивного множества.
Открытого роста, морфо-функциональных образа, питания, популятивного
Короткий адрес: https://sciup.org/146116181
IDR: 146116181 | УДК: 581.4:582.26/.27
Текст научной статьи Морфофункциональные образы растения (на примере многоклеточных водорослей)
Рост как основной феномен фитобиологии также обнаруживал в себе новые дополнительные аспекты. Наиболее заметный, чисто морфологический аспект роста – размножение (полимеризация) осевых гомологов изучается давно. Наиболее скрыт и позже других стал изучаться термодинамический аспект роста (потоки веществ и энергии в фитосистамх разного уровня организации).
В соответствии с такой научной эволюцией сложились и существуют совершенно различные приемы описания растений. Морфология (аспект особи) стала переходить на уровень «над особью» (крона, растительный полог). Сам этот факт является интересной проблемой с точки зрения теоретической морфологии – морфологии чего? Растений? Да, но приходится говорить шире – теоретической морфологии фитосистем разного уровня и организации. На физиологическом и экологическом уровнях стали важны не свойственные ботанике характеристики фитосистем: объем, масса, площадь поверхности тела растения и их соотношения; скорости и интенсивности поступления и выведения веществ через поверхность тела растения и их групповых совокупностей. В лаборатории Экологического метаболизма (ИнБЮМ) в течение многих лет изучаются вопросы, связанные с обменом веществ в прибрежных экосистемах моря [1; 4; 17; 18; 27], где важными фотосинтезирующими компонентами являются многоклеточные водоросли. В соответствии с функциональными задачами в лаборатории решались различные подходы в изучении макроморфологии многоклеточных водорослей [4; 7 – 9; 16 – 18; 21; 24; 26], что и отражается в излагаемом ниже материале.
Общий образ растения складывается из отдельных образов, где какая-то из сторон его жизни становится объединяющей, а вместе они формируют общее представление об объекте. В настоящей статье рассмотрим три возможных обобщающих варианта описания морфофункциональной организации многоклеточных водорослей, построенных на существенных признаках, присущих растениям [12; 13; 23] и в частности: 1) способность растений к постоянному росту и циклическому морфогенезу; 2) потребление энергии и вещества через внешнюю поверхность; 3)
Вестник ТвГУ, серия «Биология и экология», вып. 9, 2008 полимерность в строении тела. В последнем случае, важно то, что элементы растения слабо скоррелированны между собой, а это значит, что растение можно рассматривать как популятивное множество.
Морфологический образ растения как системы открытого роста. Открытый рост и прикрепленный образ жизни существенным образом отражаются в формообразовательном процессе растений. Наиболее наглядно это можно увидеть, описав онтогенетические изменения макроморфологической структуры слоевищ многолетней многоклеточной водоросли цистозиры косматой ( Cystoseira crinita (Desf.) Bory) параметрами численности и масс ее элементов [2; 4; 17; 18].
Основной онтогенетический цикл. Цистозира косматая имеет кустистую форму слоевища [2], от общей «подошвы» отходят до 20 вертикальных «побегов» (рис. 1, а). Каждый «побег» в отдельности рассматривается нами как самостоятельная единица, обладающая свойствами отдельной особи и имеющая модульный тип строения (рис.1, б – г). В структуре «побега» морфологически вычленяется многолетний «ствол» (ось нулевого порядка, K 0 ), в апикальной части которого c регулярной частотой появляются осевые структуры первого порядка (K01), являющиеся основой верхушечной ветви – модуля, ветви первого порядка (рис. 1, в, е). Ветви после примерно семимесячного цикла развития [5; 7; 14; 15 ] (рис. 3) опадают. В ходе параллельно идущих процессов роста и отмирания верхушечные ветви сменяют друг друга, и за год проходит примерно два полных цикла развития. Одномоментно, начиная примерно с 3-летнего возраста и до конца жизни «побега», на стволе обнаруживается примерно постоянное (12 – 13) число верхушечных ветвей (рис. 2,а), при этом их индивидуальная средняя масса (W b ) сильно изменяется (рис. 2, б). В начале она увеличивается, достигая максимума в возрасте 6 лет, а затем снижается. Таким образом, у «побега», начиная с 6-летнего возраста, каждая последующая генерация ветвей имеет меньшую индивидуальную среднюю массу, и с этого же возраста их общая масса (^W b ) снижается (рис. 2, в). Другими словами, каждое следующее поколение ветвей не способно воссоздать (удерживать) ранее сформированный уровень поглощающей поверхности.
Начиная с 3-летнего, но чаще с 5-летнего возраста в нижней части «ствола» начинают активизироваться точки роста, появляются адвентивные ветви, по структуре сходные с верхушечными ветвями, но сильно проигрывающие им по индивидуальной массе (рис. 2, б). Но они превосходили их по численности (рис. 2, а) и по общей массе (рис. 2, в), и особенно во второй половине онтогенеза «побега». Также в нижней части «ствола», но с шестилетнего возраста, начинают формироваться боковые, «дочерние» «побеги» – клоны, по морфологической структуре полностью идентичные вертикальному «побегу» (рис. 1, г). В структуре клона четко выделяется верхушечная зона, постоянно генерирующая ветви, и нижняя, где непредсказуемым образом появляются адвентивные ветви. В случае гибели основного «побега» один из боковых «побегов» (клонов) может занять его место. Обратим внимание, что в первой половине онтогенеза основная масса и соответственно поглощающая поверхность растения формируются за счет верхушечных ветвей, во второй половине – за счет структур адвентивного комплекса (рис. 1, б – г, рис. 2, в, г). Другими словами, имеет место пространственная и временная локализация формообразовательных процессов. Её целесообразность рассмотрим на модели (рис. 2, д).
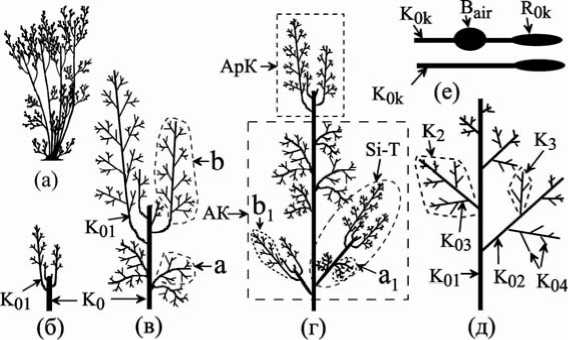
Рис.1. Макроморфоструктурная организация слоевища цистозиры косматой ( Cystoseira crinita (Desf.) Bory)
а – вертикальные «побеги» образующие куст; в – г – морфоструктурная организация вертикальных «побегов» разного возраста ( K0 – вертикальный ствол (осевая структура нулевого порядка), верхушечные (b) и адвентивные (a) ветви вертикального ствола, Si-T – боковой «побега», апикальный (ApK) и адвентивный (AK) комплексы ); д – схема осевой структуры ветви первого порядка (K01 – K04 – осевые структуры первого – четвертого порядков, K2 – K3 – ветви второго, третьего порядков); е – схема осевой структуры
(Bair – воздушный пузырь, R0k – рецептакула)
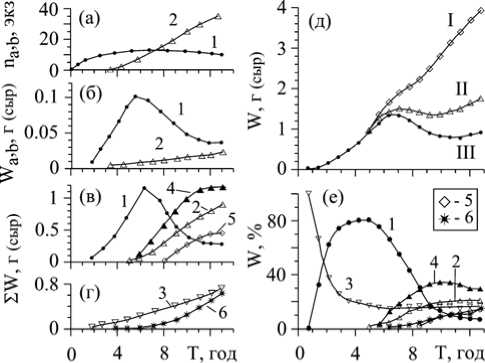
Рис. 2. Изменение численности (а), индивидуальной (б) и общей (в, г) массы отделов вертикального «побега» C. crinita в его онтогенезе. Процесс «сборки» растущего «побега» C. сrinita , выраженный в абсолютных (д) и относительных (е) величинах
-
1- верхушечные и 2 – адвентивные ветви основного ствола; 3 – основной «ствол»; 4 – верхушечные и 5 – адвентивные ветви всех боковых «стволов»; 6 – боковые «стволы».
На рис. 2, д представлены кривые, отражающие этапы модельной «сборки» вертикального «побега» и позволяющие понять стратегию формирования его структуры, а также уникальную роль и необходимость каждого класса элементов в онтогенезе. Кривая I отражает изменение общей массы «побега», как если бы он был образован только стволом и верхушечными ветвями. У такого «побега» в 7-летнем возрасте был бы максимум биомассы, вызванный максимумом ΣWb. Но уже в 9 лет вклад ветвей в общую массу слоевища сильно сократился бы, и в 12-летнем возрасте масса ствола в 2,6 раза превысила бы массу ветвей, основного фотосинтезирующвго аппарата слоевища. Однако у большинства растений, начиная с 5-летнего возраста, отмечается появление адвентивных ветвей главного ствола, и с возрастом их количество быстро растёт (рис. 2, а). Кривая II (рис. 2, д) отражает изменение массы слоевища, дополненное адвентивными ветвями главного ствола. Адвентивные ветви, дополняя верхушечную группу ветвей, приводят к тому, что кривая роста «побега» не снижается, а принимает примерно S–образную форму. Таким образом, наличие у «побега» двух типов ветвей позволяет даже к концу его онтогенеза сохранять достаточно большой фотосинтетический аппарат. В 6-летнем возрасте на стволе появляются «дочерние» «побеги», что значительно увеличивает массу слоевища (кривая Ш, рис. 2, д) и его продолжительность жизни. Однако участие тех и других групп ветвей в жизни «побега» может существенным образом изменяться в зависимости от условий окружающей среды [4].
«Малый цикл», онтогенетический цикл ветвей первого порядка . Ветвь в нашем понимании [2; 4; 5; 7 – 9; 14; 15; 17; 18,] – это самостоятельный сложноразветвленный элемент слоевища, обладающий собственной морфофункциональной организацией, закономерно меняющейся во времени. В структуре слоевища цистозиры выделяются ветви трех порядков. Ветвь первого порядка (K 1 , рис. 1, д) – это осевая структура первого порядка (K 01 ) со всеми осевыми структурами следующих порядков (K 02 , K 03 , K 04 ). Ветвь второго порядка (K 2 ) состоит из оси второго порядка и осевых структур третьего и четвертого порядков. И наконец, ветвь третьего порядка (K 3 ) формируется из оси K 03 и осей K 04 . Все выше названные порядки ветвей выстраиваются в онтогенетические ряды. Ниже подробно пойдет речь о ветвях первого порядка.
На протяжении всей жизни осевой структуры первого порядка в её апикальной части с постоянной частотой образуются осевые структуры второго порядка, которые являются основой ветвей второго порядка, а это значит, что изменчивость ветвей K1 связана с онтогенетической динамикой ветвей K 2 [7; 14; 17].
Ветвь нами рассматривается как популятивный объект, а это значит, что её морфофункциональные свойства определяются с одной стороны параметрами множества (численностью (рис. 3, а) и размерным составом структур (рис. 3, б), а с другой – индивидуальными свойствами отдельно взятой структуры. Наложение этих характеристик определяет индивидуальные свойства ветви.
В онтогенезе ветви K 1 выделяются пять периодов, каждый из которых характеризуется определенными структурно-функциональными особенностями [5; 7; 14; 17; 26]. Масса и поверхность ветви, а также её скорость и интенсивность фотосинтеза изменяются в онтогенезе ветви по одновершинным кривым (рис. 3, г – е). Максимум интенсивности фотосинтеза наблюдается в возрасте 2 – 2,5 месяцев, а максимальной массы и поверхности ветви достигают в зрелом возрасте – 4 – 5 месяцев. В двухмесячном возрасте полностью складывается архитектоника осевого аппарата, и после этого численные и весовые соотношения осевых структур (K 01 – K 04 ) сохраняются на протяжении всего онтогенеза ветви. На этом же участке онтогенеза остается относительно постоянной удельная поверхность ветви (рис. 3, д). Начиная с четырех и особенно с 5,5-месячного возраста происходит интенсивный спад осевых структур второго-четвертого порядков, в результате масса ветви (рис. 3, г) и общий поток углерода через ветвь (рис. 3, е) снижаются.
Обратим внимание на иерархическое соподчинение циклов, которое имеет место при росте и формообразовании вертикального «побега» цистозиры. Это общий онтогенетический цикл развития всего растения и онтогенетические изменения его структурных элементов, в частности ветвей первого порядка, что свойственно большинству растений [23].
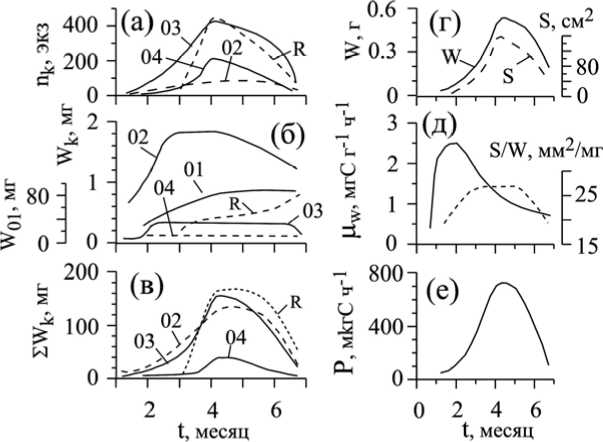
Рис. 3. Изменение численности (а), средней индивидуальной (б) и общей (в) массы осевых структур первого – четвертого порядков (K 01 – K 04 ) и рецептакул (R) в онтогенезе ветви C. barbata (по [5], с изменениями). Изменение индивидуальной массы (W), общей (S) и удельной (S/W) поверхности, скорости (P) (по [5], с изменениями) и интенсивности фотосинтеза ( µ w ) (по [14] с изменениями) ветви в её онтогенезе.
Морфологический образ растения как системы открытого «питания». В основе эволюции живой природы лежат законы термодинамики, определяющие невозможность уклонений от основных направлений эволюции, и прежде всего уклонение от процесса полимеризации живых систем и интенсификации их жизнедеятельности [22]. Применительно к растениям, у которых поглощение энергии и питательных веществ осуществляется через наружную поверхность тела, соотношение площади поглощающей поверхности (S) и объёма (V) или массы (W) тела является определяющим в формировании морфологической структуры тела растения на протяжении всей эволюции растительного мира.
Особенностью строения водорослей, независимо от уровня их качественной полимеризации, является то, что они полностью состоят из элементов, приспособленных к материально-энергетическому обмену с окружающей средой. Увеличение любым образом размеров тела растения автоматически ведет к расширению площади поглощающей поверхности и к возможному изменению соотношения между объемом и поверхностью. Формирование максимально возможной поглощающей поверхности при незначительном уменьшении удельной поверхности (S/V, S/W) может считаться важной целью, достигаемой в ходе онтогенеза отдельно взятого растения или его структурных единиц.
Как показывают расчеты, величина удельной поверхности тесно связана с формой и размером объекта [18]. У тел равного объема, но разной формы обеспеченность границами единицы массы в ряду «шар, цилиндр, пластина увеличивается». Это означает, что метаболически невыгодной формой растения является шар. Метаболическая невыгодность этой формы усиливается еще и тем, что с увеличением размеров шара интенсивность его обмена в расчете на единицу массы (µW = µS (S/W)шар = µS const. W-0,33; µS – интенсивность обмена, рассчитанная на единицу поверхности, или удельная плотность потока веществ, мг * см-2*час-1), судя по значению абсолютной величины степенного коэффициента (0,33), снижается весьма значительно.
Слоевища, структурные элементы которых имеют цилиндрическую (осевую) форму, типичны для морских растений. Поскольку рост осевых структур происходит по преимуществу в длину ( l ) и отношение радиуса (r) оси к ее длине намного меньше единицы, то
µ W (мг * г-1 * час-1) = µ S (S/W) цилиндр = µ S (2/ρr) = µ S const, (1) где ρ – удельный вес.
Из выражения (1) следует, что теоретически у форм осевого строения рост массы не должен сопровождаться снижением µ W , а это значит, что осевые формы в кинетическом отношении значительно более выгодны, чем шарообразные.
Увеличение массы у слоевищ пластинчатого типа практически происходит за счет их роста в длину или в ширину и меньше всего за счет их утолщения (h), поэтому
µ W = µ S (S/W) пластина = µ S (2/h ρ) = µ S const, (2) где h – толщина пластины, мм.
Как следует из выражений (1) и (2), у осевых форм и у пластинчатых структур интенсивность внешнего обмена в расчете на единицу массы должна изменяться по мере роста только в сторону утолщения (соответственно с увеличением R или h), неизбежного у реальных растений.
Вышесказанное является прямой причиной того, что большая часть видов многоклеточных водорослей сочетает осевые и пластинчатые элементы или состоит из осевых структур. Меньшее число видов имеет пластинчатое строение. Растения с преобладанием осевых элементов имеют особое преимущество в водной среде также и потому, что лучше приспособлены к рассеянному свету подводного мира, тогда как пластины в большей мере требуют ориентации по отношению к источнику света. Другими словами, тела многоклеточных и сифоновых водорослей формируются из элементов, имеющих метаболически выгодную форму (форму цилиндра и пластины). Причем рост у осевых структур осуществляется преимущественно за счет их удлинения, а у пластинчатых – за счет увеличения длины и ширины, при этом их толщина (соответственно R и h) меняется мало, в отдельных случаях даже сохраняется на относительно постоянном уровне [18]. Это позволяет растениям избежать быстрого снижения удельной поверхности с увеличением их массы.
На рис. 4, а, б представлена графическая модель осевой структуры цистозиры -цилиндр длиной l (см) и радиусом r (с)м. L/R >> 1 , поэтому величина скорости входного потока углерода (P, мкг C ч-1) определяется главным образо, размерами боковой поверхности оси и ее фотосинтетической активностью:
P = µ S ∗ S. (3)
Величина интенсивности углеродного обмена в расчете на единицу массы осевой структуры (µW), согласно уравнению (1), прямо пропорциональна µS и обратно пропорциональна радиусу оси. В свою очередь, µ S , помимо прочих факторов, контролируется количеством, качественным составом и активностью хлорофилла, а также внешними условиями среды.
На рис. 4, б показаны высечки с одинаковой площадью внешней поверхности (S) из осевых структур разного размера, визуально отражающие соотношение между поверхностью, массой и объемом, и пропорции между различными видами тканей – фотосинтезирующей (fo) и паренхимальной (pr). Поперечные срезы осевых структур черноморских цистозир [2] показывают, что независимо от порядка их ветвления соотношение Vfo / Vpr всегда намного меньше единицы, а это значит, что между µW и S/W может существовать прямо пропорциональная зависимость, например, в случае, когда в процессе роста растения его удельная поверхность не изменяется (или меняется мало) (S/W = const). Реально это наблюдается при росте осевых структур цистозиры [24], у которых прирост массы связан в основном с их удлинением, при этом диаметр изменяется незначительно. В таком случае величина интенсивности углеродного обмена в расчете на единицу массы в пределах каждого порядка структур зависит исключительно только от фотосинтетической активности, ассимилируемой поверхности, между µS и µW существует прямая зависимость (на рис. 4, в точки располагаются вдоль каждой линии регрессии). И в то же время осевые структуры разных порядков, имеющие одинаковую µS, но разную S/W, отличаются по µW в соответствии с величиной их удельной поверхности, что на рис. 4, в выражается разным углом наклона регрессий. Чем выше удельная поверхность, тем выше интенсивность углеродного обмена в расчете на единицу массы [4; 17; 18)].
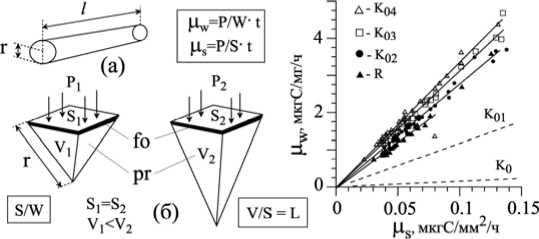
Рис. 4. Графическая модель «единичной оси» цистозиры (а) и высечек из неё (б)
Связь интенсивности поступления углерода на единицу поглощающей поверхности (µs) и интенсивности поступления углерода на единицу массы (µw) у структурных элементов цистозиры бородатой (по [6]): длина ( l ) и радиус сечения (r) оси; объёмы (V1, V2) высечек и площади (S1, S2) их внешних поверхностей; P1, P2 – потоки углерода через поверхности S1 и S2; фотосинтезирующие (fo) и паренхимальные (pr) ткани; t – отрезок времени, за который протекает процесс, остальные обозначения, как на рис. 1 и в тексте
Связь интенсивности фотосинтеза µ W с удельной поверхностью осевых структур цистозиры косматой (рис. 1) описывается уравнением [18]:
log µW(мг * г-1* час-1) = -1,020 + 1,170 log(S/W). (4)
В уравнении (4), обобщающем связь µW (S/W) в совокупности порядков, коэффициент b практически равен единице. При b = 1 справедливо равенство
µW ∗ W/S = P/(W ∗ t) ∗ W/S =P/(S ∗ t) = µS = const . (5)
Смысл выражения (5) состоит в том, что во всем осевом ансамбле, от «ствола» с массой 200 – 300 мг сухой массы до структур четвертого порядка с минимальной массой 0,035 мг, интенсивность поступления карбонатного углерода на единицу живой поверхности при данных условиях (при b = 1) постоянна или стремится к постоянной величине.
Понятно, что при других условиях освещения, концентрации питательных веществ, температуре и т.д. µ S стабилизируется на каком-то другом уровне. «Метаболическая цена» удельной поверхности существенно зависит от коэффициента b в уравнении (4).
В других экспериментах [4] было обнаружено снижение поверхностной плотности потока углерода через поверхность цистозиры (µS) с увеличением S/W осевых структур. В этом случае µW и µS связаны обратной зависимостью, что противоречит вышесказанному.
Однако эти противоречия отражают лишь частные случаи более общей картины, которая обнаруживается при одновременном рассмотрении изменений, µW и µS в индивидуальном развитии растения.
На рис. 5 а S/W, µW и µS отложены как функция индивидуальной массы структур птилоты, т. е. в порядке их укрупнения и усложнения [1]. Выявляется общеизвестная закономерность: в начале онтогенеза названные параметры сильно изменяются, а в зрелом возрасте относительно стабилизируются. В начале онтогенеза µW и µS связаны с удельной поверхностью обратной зависимостью (рис. 5, б), а между собой – прямо пропорциональной (рис. 5, в). Тогда как в зрелом возрасте между µW и µS обнаруживается обратная зависимость при относительно небольших изменениях значений µS (рис. 5, д), и µW связана с удельной поверхностью прямой зависимостью, а µS с S/W – обратной (рис. 5, г). В размерном ряду зрелых растений на фоне незначительных изменений удельной поверхности наблюдается заметное снижение µW и относительное постоянство µS (рис. 5, а). Другими словами, в зрелом возрасте за счет стабилизации S/W и µS сдерживается снижение µW на фоне постоянного увеличивающейся индивидуальной массы растения. В целом, обобщая информацию представленную на рис. 5, а – д можно заключить, что форма связи названных параметров зависит от того, находится система в стационарном или нестационарном состоянии.
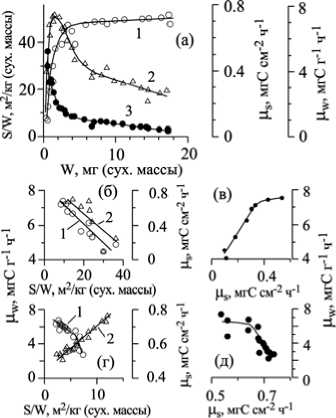
Рис. 5. Связь с индивидуальной массой (W) удельной поверхности (S/W) и интенсивности фотосинтеза ( µ W , µ S ) птилоты папоротниковидной (а). Соотношение между µ W и S/W и между µ W и µ S при индивидуальной массе растения < 2,5 мг (б, в) и > 2,5 мг сухой массы (г, д) (по [1] с дополнениями).
-
1 – интенсивность фотосинтеза в расчете на единицу поверхности ( µ S); 2 – то же в расчете на единицу массы ( µ W); 3 – удельная поверхность (S/W)
Остановимся на рассмотрении ещё одной важной морфофункциональной характеристики растения – длине метаболического пути [7 – 9; 11; 16; 19; 20; 21], формально она рассчитывается как отношение объёма растения к площади его внешней поверхности (V/S = L, см). L интерпретируется как характерная длина метаболического пути, которую проходят атомы и молекулы питательных веществ на пути от всех точек на поверхности S объекта во все точки внутри его объема V или обратно. Понятно, что при одном и том же объёме тела в метаболически выгодном положении находятся растения с меньшей длиной метаболического пути, а это значит, что растение в процессе роста должны сдерживать увеличение длины метаболического пути. И одним из таких механизмов является процесс полимеризации, и в частности ветвление.
По отношению к телу растения введем понятие «обитаемого пространства» [7 – 9; 16; 21] – пространство в границах тела. Таким образом, физический объём тела растения – это и есть объём обитаемого пространства. У осевых структур цистозиры увеличение объёма обитаемого пространства связано в основном с их удлинением. Как было сказано выше, в процессе роста d изменяется незначительно, и у подавляющего числа структур d/ l << 1. Это значит, что характерная длина метаболического пути преимущественно определяется размерами диаметра оси (L = V/S БОК = d/4, где S БОК – боковая поверхность оси) и мало изменяется с ростом структур в длину (рис. 6), но уменьшается в ряду порядков ветвления. Крайние значения L структур нулевого и четвертого порядков различаются на порядок величин (рис. 6, обобщающая линия A ). В то же время примерно в том же диапазоне значений V характерная длина метаболического пути в пределах телесного пространства в ряду разветвленных объектов: ветви второго и первого порядков, вертикальные «побеги» удерживается в узком интервале значений (рис. 6, обобщающая линия B ). Другими словами, благодаря ветвлению растение сохраняет относительно небольшие величины характерной длины метаболического пути при существенном увеличении его телесного объема. Угол между обобщающими линиями A и B характеризует цену ветвления и отражает метаболический выигрыш, получаемый растением за счет ветвления. Понятно, что при прочих равных условиях в метаболически выигрышном положении оказываются системы с наименьшей, характерной длиной метаболического пути. Выигрыш от ветвления еще и в том, что в относительно небольшом объёме надтелесного пространства при относительно небольшом телесном объёме (V) укладывается (размещается) относительно большая поверхность растения (S).
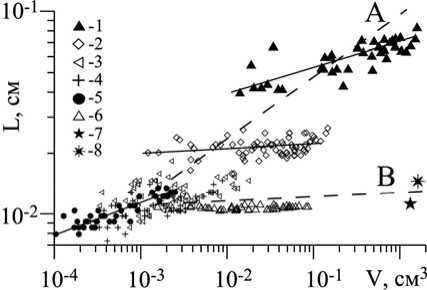
Рис. 6. Соотношение объема телесного пространства (V) и характерной длины метаболического пути (L) в телесном пространстве осевых структур (нулевого – четвертого (1 – 5) порядков ветвления), ветвей второго (6) и первого (7) порядков, и вертикальных побегов (8) C. crinita
Популятивный образ растения. Растения, находящиеся на любом из уровней их морфологической организации и характеризующиеся разными ступенями качественной полимеризации, могут рассматриваться как популятивное множество элементарных единиц. В каждом конкретном случае элементарная единица множества 214
может быть различной. Например, это отдельная клетка в колониях одноклеточных водорослей или в тканях отдельного органа многоклеточного растения. У нитчатых водорослей используются как отдельные клетки, так и группы клеток, формирующих нити разного порядка ветвления. Например, у растений с побеговым уровнем полимеризации вся совокупность листьев растения рассматривается как популятивное множество.
К любому множеству можно применить метод, используемый в анализе популяций, – разложение в размерный ряд. Разложение биологического множества в ряд напоминает спектральное разложение волновых излучений. Поэтому в биоэкологической литературе такие отображения получили название размерных спектров [3; 9; 10; 18; 25]. В биологических размерных спектрах каждой индивидуальной массе соответствует то или иное свойство (структурный или функциональный параметр). Разложенное в размерный спектр биологическое множество характеризуется не средними значениями его параметров, а статистическими распределениями, которые могут иметь различную форму. Форма распределения, широта размерного диапазона и другие показатели позволяют сравнивать друг с другом различные множества, в частности разные виды растений.
В качестве примера рассмотрим размерные спектры, составленные по однолетнему слоевищу бурой водоросли цистозиры косматой. Как говорилось выше, слоевище этого вида состоит из набора «элементарных» цилиндрических структур – «осей» разных порядков (рис. 1, е), соподчиненных в ветви (рис. 1, д), совокупность которых образует целое слоевище (рис. 1, б – г). Весь ансамбль осей легко расчленяется и может быть представлен в виде непрерывного ряда гомологов разной массы (рис. 7 а – в).
Начиная с размерного спектра, отражающего численность (n i , рис. 7, а) осевых структур, отметим особенность, которая повторяется в спектрах по другим параметрам: распределения характеризуются сильной правосторонней скошенностью. Однако если провести анализ с более дробным шагом, то распределение приобретает лог-нормальный вид [10] с круто скошенным левым краем. То же лог-нормальное распределение наблюдается на размерных спектрах по массе Wi (рис. 7, б) и по скорости фотосинтеза Р i (рис. 7, в).
Общая особенность всех спектров состоит в том, что с увеличением номера порядка (от K 01 к K 04 ) размерный диапазон смещается влево. Вследствие этой важной особенности полный размерный спектр слоевища по всем перечисленным параметрам оказывается целиком заполненным. Это означает, что в осевом ансамбле слоевища каждый класс осей занимает собственную нишу, эквивалентную, по-видимому, многомерной экологической нише.
Размерные спектры отдельных порядков можно соединить в один ряд, характеризующий весь осевой ансамбль слоевища, и исследовать ряд с учетом свойств каждого порядка и их вклада в суммарный размерный спектр. Разделим размерный ряд на три участка с логарифмически кратными диапазонами масс: 0,01 – 1; 1 – 10 и 10 – 100 мг сухого веса. Для каждого участка рассчитаны значения n i , W i и P i . Понятно, что каждый диапазон заполнен осями тех порядков, которые в нем встречаются, но представлены они неравномерно. Свойства каждого участка размерного спектра слоевища обобщены на рис. 7, г.
Функциональные особенности наименьшего размерного диапазона определяются осями высших порядков. Высокий уровень метаболизма обусловливает их значительный (33%) вклад в общий фотосинтез, а большие скорости образования осей K04 и K03 по сравнению даже с K02 (рис. 7, д) позволяют значительно быстрее реагировать на изменение условий внешней среды, чем могут реагировать оси второго и первого порядков (рис. 7, е). Другая важная особенность осей высших порядков состоит в том, что их метаболизм весьма неэкономичен, открыт во внешнюю среду (рис. 7, ж).
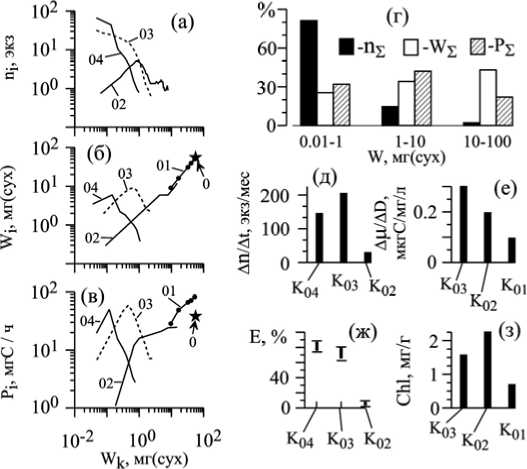
Рис. 7. Распределение численности (а), суммарной массы (б) и скорости фотосинтеза (в) в размерных рядах осевых структур разных порядков (K 0 , K 01 – K 04 ) цистозиры косматой (по [10] с изменениями)
г – долевое (в %) распределение вклада параметров ni, WI и Pi на участках размерного спектра (0,01 – 1; 1 – 10; 10 – 100 мг сухой массы) всего слоевища цистозиры; д – з – функциональные характеристики осевых структур (д – скорость образования осевых структур у ветвей С. barbata в возрасте от 3 до 4 мес.; е – метаболическая «оплата » расхода воды у осевых структур С. crinita , рассчитанная на единицу массы (по [4]); ж – доля выделенного углерода (Е, %) у осевых структур второго – четвертого порядков С. barbata от количества углерода, накопленного за счет фотосинтеза (по [17]); з – содержание хлорофилла «a» в осевых структурах С. barbata (по [15])
Метаболизм осей K 04 и K 03 невыгоден еще и потому, что с увеличением их индивидуальной массы интенсивность фотосинтеза снижается значительно быстрее, чем у осей низших порядков [4, 6]. Поэтому одновершинные кривые распределения осей этих порядков (рис. 7 а - в) круты, а диапазоны массы малы. Тем не менее в общем ансамбле осей слоевища цистозиры этот размерный диапазон чрезвычайно важен, адаптивно наиболее динамичен.
Совсем другими свойствами обладают оси максимального размерного класса (в нашем случае 10 – 60 мг; рис. 5). Их численность сравнительно мала (2% общей), а суммарная масса велика (45 %). В соответствии с большой индивидуальной массой осей K 01 и K 0 интенсивность их фотосинтеза низка. Но, с другой стороны, их углеродный обмен очень экономичен (рис. 7, ж).
Сопоставляя свойства осей самого мелкого и самого крупного диапазонов, можно отметить, что они взаимно дополняют друг друга, выполняя в структуре слоевища разные, но одинаково необходимые функции, т. е. занимают в «слоевище-сообществе» разные ниши. Их равноважность четко проявляется в том, что по общей скорости фотосинтеза PΣ они различаются незначительно (рис. 7 г).
Обращаясь к среднему размерному диапазону осевого ансамбля слоевища (масса 1 – 10 мг), заметим, что по структурно-функциональным параметрам он занимает промежуточное положение между двумя крайними, а по скорости фотосинтеза несколько выше каждого крайнего (рис. 7, г). В целом по всем трем размерным диапазонам создается впечатление, что скорость фотосинтеза – важнейший для растения параметр, который во всем ансамбле осей поддерживается на относительно неизменном уровне за счет существенных различий в разных частях размерного спектра. Трудно не увидеть в этом важнейшую особенность стратегии роста и формирования морфоструктуры этой водоросли.
Отметим, что распределение биологических характеристик в ряду осевых структур целого растения представляется особенно интересным потому, что они образуют естественный и, что особенно важно, завершенный структурный ансамбль, достаточный для осуществления всех функций растения во всем диапазоне условий его обитания. А это значит, что достаточно объективно могут сравниваться структурные ансамбли растений, находящиеся на любой ступени качественной полимеризации. Поскольку таким же завершенным и полнофункциональным набором является совокупность видов, образующих биоту водной или наземной экосистемы, и ее также представляют в виде единого размерного ряда живого вещества [3; 26], то это делает возможным проведение структурно-функциональных сравнений отдельного растения с биотой экосистем.
On an example of multicellular algas three morpho-functional images of plant are considered; plant as the system «of open growth», «of open nutrition» and as the system of population multitude.


