Морфофункциональные особенности краткосрочной культуры мононуклеаров крови у больных несовершенным остеогенезом
Автор: Саприна Татьяна Владимировна, Зайцев Константин Васильевич, Дворниченко Марина Владимировна, Нечаев Кирилл Андреевич, Попков Арнольд Васильевич, Хлусов Игорь Альбертович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1, 2012 года.
Бесплатный доступ
Применение интрамедуллярного биоактивного остеосинтеза и аппарата Илизарова способствует коррекции скелетных де- формаций, позволяет поставить на ноги больных с несовершенным остеогенезом. Морфофункциональные параметры куль- туры мононуклеарных клеток периферической крови могут рассматриваться как вероятные маркеры и предикторы течения несовершенного остеогенеза и продолжительности реабилитации пациентов.
Остеосинтез, кальцийфосфатное покрытие, маркеры остеогенеза, морфология и функция клеток
Короткий адрес: https://sciup.org/142121504
IDR: 142121504
Текст научной статьи Морфофункциональные особенности краткосрочной культуры мононуклеаров крови у больных несовершенным остеогенезом
В настоящее время активно изучается синдром несовершенного остеогенеза (НО), составляющий значительную долю среди всей наследственной патологии костной ткани, обладающий широкой степенью гетерогенности. Классификация D. O. Sillence [12] включала четыре типа (I-IV) НО на основе тяжести клинических проявлений. В настоящее время номенклатура заболевания включает семь типов, но все так же базируется на клинической картине.
Диагностика НО и прочих патологических состояний костной ткани основана, главным образом, на рентгенологическом исследовании костной ткани и некоторых биохимических показателях. Однако при некоторых типах несовершенного остеогенеза плотность костной ткани может оставаться в пределах нормы [11].
В предыдущей работе [2] нам удалось установить, что у больных с НО применение интрамедуллярного биоактивного остеосинтеза способствует кратковременной коррекции скелетных деформаций. В то же время после демонтажа аппарата Илизарова при тяжелой форме заболевания снова появлялись небольшие угловые деформации в местах костной мозоли, что свидетельствует о снижении механических свойств костной ткани.
С точки зрения клеточных технологий, в основе патологии ремоделирования костной ткани лежит дисба- ланс взаимоотношений остеобластов и остеокластов. В связи с этим представляются весьма обоснованными попытки коррекции НО посредством трансплантации стромальных стволовых клеток [3]. Согласно идеологии, заложенной в основу таких методов, дефектные механоциты (пре- и остеобласты, хондробласты и др.) должны быть удалены из организма больного и заменены донорскими клетками [8]. В то же время вопросом, предваряющим проведение лечения, является поиск главного звена патогенеза, клеток-мишеней, ответственных за развитие клинической патологии.
В связи с вышеизложенным, для фундаментальной и практической травматологии и ортопедии представляет несомненный интерес создание подходов, позволяющих моделировать молекулярные механизмы жизнедеятельности, диагностировать и прогнозировать вектор дифференцировки стволовых клеток при НО, оценивать функциональную активность как остеобластического, так и остеокластического клеточного дифферона.
Цель данного пилотного исследования — оценить in vitro связь морфофункциональных параметров культуры мононуклеарных клеток периферической крови с клиническими вариантами несовершенного остеогенеза и сроками реабилитационного периода (клиническим эффектом терапии).
МАТЕРИАЛЫ И МЕТОДЫ
Была проведена серия последовательных операций пациентам с НО с целью исправления углообразных деформаций различных сегментов нижних конечностей — двойная остеотомия бедренных, большеберцо- вых костей с фиксацией аппаратом Илизарова, а также напряженное полисегментарное интрамедуллярное армирование спицами с кальцийфосфатным (КФ) покрытием.
Для интрамедуллярного остеосинтеза использовались спицы с биоактивным (КФ) покрытием, выполненным анодно-искровым способом. Имплантаты имеют регистрационное удостоверение Минздрава РФ № 29 / 12010200 / 1190-00 и сертификат соответствия ГОСТ Р № РОСС RU. АЯ 79.В55386.
Венозную кровь собирали, избегая гемолиза, выделяли плазму крови и замораживали образцы при температуре -75 °С. Перед проведением исследования все компоненты набора и исследуемая плазма крови выдерживалась при комнатной температуре до достижения ими температуры 18 °С. Все образцы анализировались в дублях, в соответствии с требованиями проведения анализа.
Мононуклеарные лейкоциты выделяли в стерильных условиях из периферической крови методом центрифугирования в течение 10 минут при 500 g с использованием градиента плотности Ficoll-Paque («Pharmacia», Швеция) (р = 1,077 г/см 3 ). Взвесь клеток (жизнеспособность более 95 %) культивировали в течение 48-96 часов при температуре 36 °C в концентрации 5×106 нуклеаров / лунку в 1 мл полной культу-ральной среды, способствующей остеогенной дифференцировке клеток: 80 % среды ДМЕМ / F12 (1:1), 20 % эмбриональной телячьей сыворотки, 280 мг/л L-глутамина, 50 мг/л гентамицина сульфат, 10 мМ бета-глицерофосфата, 50 мкг/мл аскорбиновой кислоты, 10-6 М дексаметазона, 10 мМ HEPES буфера.
В качестве модельной культуры стромальных стволовых клеток применяли фибробластоидные клетки легкого человека (ООО «Банк стволовых клеток»), которые клонировали в концентрации 5»104 клеток/см3 в аналогичной культуральной среде. Препараты после 4–5 пассажей представляют собой морфологически и функционально однородную популяцию клеток с ограниченным сроком жизни, сохраняющую при пас- сажах стабильный кариотип и онкогенно безопасную. Клетки свободны от посторонних вирусных (ВИЧ, гепатит, герпес и др.) и бактериальных агентов (сифилис, микоплазмы, хламидии и др.). Жизнеспособность клеток, определяемая согласно ISO 10993-5 по исключению окрашивания в тесте с 0,4 % трипановым синим, составила 91–93 %. Супернатанты (кондиционные жидкости) получали путем забора надосадочной части клеточных культур, их центрифугирования в течение 10 мин при 500 g.
В плазме крови и кондиционных средах оценивали маркеры костного ремоделирования (концентрации кальция, фосфора, остеокальцина, продуктов деградации коллагена I типа (CrossLaps), активность костной изоформы щелочной фосфатазы) как описано ранее [2]. Кальций и неорганический фосфор измеряли колориметрическим стандартным методом, рекомендованным AACC и IFCC [9].
По окончании культивирования 24-луночные планшеты сушили на воздухе, клеточный материал фиксировали в течение 30 сек в парах формалина, окрашивали на щелочную и кислую фосфатазы, как описано Ф. Г. Хейхоу с соавт. [7]. Кроме того, для исследования морфологии прилипающих и неприлипающих клеток применяли окраску азуром II-эозином в течение 10 мин.
Статистическую обработку проводили с применением программ «STATISTICA for Windows 6.0». Для описания изменчивости количественных признаков использовали общепринятые статистические процедуры, включая расчет параметров распределений (средние значения, их ошибки). Проверку на нормальность распределений осуществляли с помощью критерия Колмогорова-Смирнова. В выборках наблюдалось распределение показателей, отличное от нормального. В связи с этим для оценки статистической значимости различий выборок применяли непараметрический критерий Вилкоксона (Т-тест), регрессионный и корреляционный анализ по Спирмену. Различия считались достоверными при уровне значимости р < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
Была изучена клиническая картина четырех пациентов с различной выраженностью патологического процесса. Анализ клинических проявлений заболевания включал: оценку сроков манифестации заболевания; количество переломов; наличие признаков поражения соединительной ткани (голубые склеры, дефекты зубной эмали), выраженности скелетных деформаций, способности к передвижению и опороспо-собность конечностей; время, за которое удалось достигнуть промежуточного клинического эффекта — добиться опороспособности конечности, возможности стоять и ходить с помощью специальных приспособлений («ходунки»).
Пациент 1. Пациент Ч., 16 лет, с НО умеренной степени выраженности патологического процесса. Переломы развиваются после 2 года жизни. Перенес более 25 переломов костей различной локализации. Перестал ходить, передвижение только на носилках или кресле, конечности неопороспособны. Развился постиммобилизационный остеопороз, отмечается избыточная масса тела, проявления гипоталамического синдрома (стрии, эпизоды артериальной гипертензии и т. д.). Белые склеры, эмаль зубов интактна. Деформации нижних конечностей умеренные. Диагноз: несовершенный остеогенез (по классификации Sillence — IV A тип). Наружно-ротационная отводящая контрактура правого тазобедренного сустава. Разгибательная контрактура обоих тазобедренных суставов. Разгибательная контрактура обоих коленных суставов. Комбинированная контрактура обоих голеностопных суставов. В 2006 году оперирован в Екатеринбурге, введены интрамедуллярно штифты в обе бедренные кости. Лечение: интрамедуллярное армирование обеих большеберцовых костей спицами с биоактивным покрытием, удален один из интрамедуллярных штифтов из левой бедренной кости. Сроки промежуточного хирургического эффекта — 3,5 месяца.
Пациент 2. Мальчик В., 8 лет, с тяжелой формой заболевания, переломы появились после 1 года жизни, переломы длинных трубчатых костей появляются 3-4 раза в год. Клинически — отстает в росте от сверстников на 4,1 стандартных отклонения, не только за счет деформаций скелета, но и в результате выявленной в 2007 году соматотропной недостаточности (стимулированная секреция СТГ в двух пробах менее 7,5 нг/мл). Получал терапию рекомбинантным гормоном роста (нордитропин). Имеются голубые склеры, dentinogenesis imperfecta , гиперметропия слабой степени, анемия 1 степени смешанной этиологии нормохромная. По классификации Sillence — III тип НО. Специфический семейный анамнез: отец и мать здоровы, неблизкородственный брак, по отцовской линии — накопление случаев патологии соединительной и костной ткани — у племянников голубые склеры, повышенная потливость, бочкообразная деформация грудной клетки, у сибсов деда отца — болезнь Бехтерева, остеосаркома. Мальчик передвигается с помощью коляски,конечности до операций не опороспособны. Проведена серия корригирующих остеотомий: корригирующая резекция правой бедренной кости, ЧКДО правой бедренной кости. Напряженное интрамедуллярное армирование обеих большеберцовых костей спицами с КФ покрытием. Коррекция деформаций в течение 38 дней, фиксация в течение 14 дней, затем через 2,5 месяца после 1-й операции — закрытый остеосинтез правой бедренной кости аппаратом Илизарова. Еще через месяц — корригирующая резекция левой бедренной кости, ЧКДО левой бедренной кости. Напряженное интрамедуллярное армирование левой бедренной кости с КФ покрытием.
После серии оперативных вмешательств пациент способен передвигаться в специальных «ходунках», конечности опороспособны, исправлены грубые деформации нижних конечностей. Проходит реабилитацию с применением медикаментозной коррекции (препараты кальция, активные метаболиты витамина D), массажа, методов лечебной физкультуры. Временной интервал, за который удалось корригировать деформации нижних конечностей и поставить больного на ноги, составил 8 месяцев.
Пациент 3. Пациент С. с тяжелой формой заболевания, количество переломов — 6–7 в год. Множественные деформации конечностей, ребер, снижение роста, голубые склеры, dentinogenesis imperfecta. По классификации Sillence — III тип НО. Операция: корригирующая остеотомия левой бедренной и большеберцовой костей. Напряженное интрамедуллярное армирование левого бедра. Коррекция деформации проводилась на голени в течение 56 дней, 8 дней фиксации, затем вновь коррекция в течение 87 дней, фиксация в течение 35 дней. Коррекция деформации на бедре проводилась в течение 56 дней, 12 дней фиксации, затем вновь коррекция в течение 56 дней, фиксация в течение 63 дней. Полная консолидация зон остеотомий не наступила.
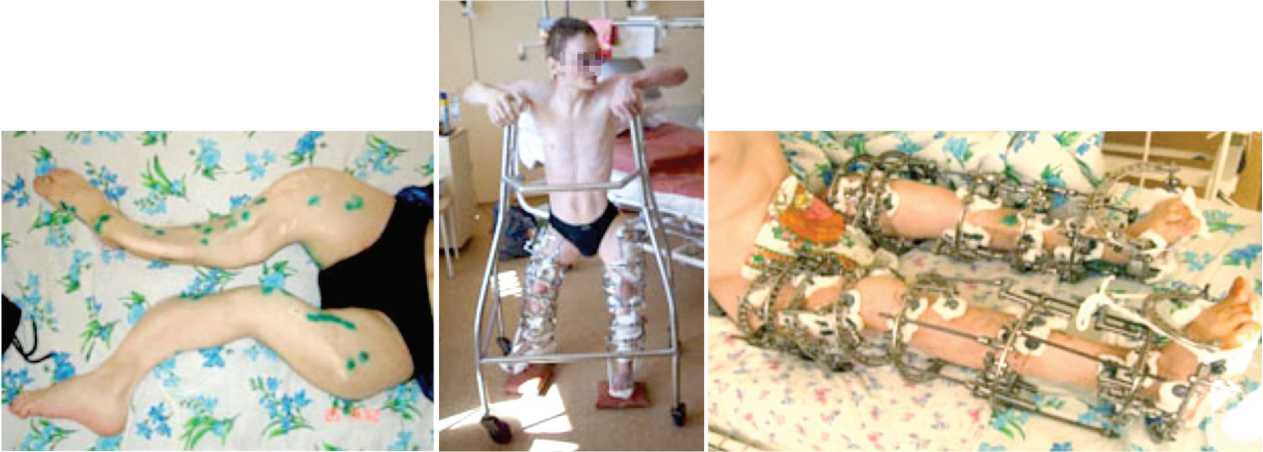
После демонтажа аппарата Илизарова имел место рецидив деформации (умеренные осевые деформа- ции), была наложена циркулярная гипсовая повязка. Конечность неопороспособна. Через месяц после хирургической коррекции с использованием интрамедуллярного армирования спицами с КФ покрытием биохимический профиль маркеров костеобразования также неблагоприятный: CrossLaps превышает нормативные значения на 70 %, уровень костной фракции щелочной фосфатазы выше нормы в 4 раза, скорость костного обмена высокая. Соотношение остеокаль-цин/Crosslaps составляет 13,3. Отсутствует реакция со стороны паращитовидных желез на гипокальциемию. В дальнейшем пациент находился дома, через год поступил для повторной серии корригирующих операций (всего 8). Достигнуты следующие результаты — впервые пациент встает на ноги, конечности опороспособны (рис. 1), проводится комплекс медикаментозной и физической реабилитации больного (массаж, ЛФК с индивидуальным инструктором). Срок промежуточного хирургического успеха — 18 мес.
Пациент 4. Пациентка Г., 18 лет, после 1 года жизни 2-3 раза в год возникали переломы большеберцовых, бедренных костей, ребер. Течение заболевания самое мягкое в сравнении с другими наблюдаемыми больными. По классификации Sillence — IV тип НО. Передвигается с помощью костылей. Операция: двойная корригирующая остеотомия левой бедренной кости, левой малоберцовой кости, интрамедуллярное армирование обоих бедренных и большеберцовых костей. Проводилась коррекция деформации в течение 30 дней, срок фиксации составил 4,5 месяца. Наступила консолидация зон остеотомий. Конечности опороспособные. В контрольные сроки также регистрировалась гипокальциемия, маркеры костеобразования ниже возрастной нормы, маркеры костной резорбции — норма. Соотношение остеокальцин/CrossLaps составляет 14,1. Темпы костного обмена по биохимическим маркерам ниже, чем у других наблюдаемых пациентов, что ассоциировано с более благоприятным клиническим течением заболевания, а также более гладким постоперационным периодом. Гипокальциемия в сочетании со сниженным уровнем паратгормона может указывать на вероятный гипопаратиреоз. Временной интервал, за который удалось реабилитировать пациентку, составил 4,5 месяца. В связи с гормональными сдвигами пациентка была исключена из дальнейшего исследования in vitro .
В качестве модельной культуры стромальных стволовых клеток применяли клетки легкого человека с фибробластоидной морфологией (рис. 2). Согласно доле костной фракции щелочной фосфатазы (ЩФ), занимаемой в общем пуле секретируемой ЩФ, чистота культуры составляла в среднем 88 %. Костная ЩФ считается маркером остеобластов [4], дифференцирующихся в процессе культивирования из стромальных стволовых клеток. Другими клетками в культуре, судя по морфологии, были нейтрофилы и моноциты/макро-фаги, производные кроветворной стволовой клетки.
Результаты показали (табл. 1), что в процессе культивирования стромальных стволовых клеток на пластике происходит снижение в культуральной среде средних значений концентрации кальция и фосфора, увеличение содержания костной ЩФ и остеокальци- на. Согласно корреляционному анализу, в динамике культивирования клеток (2–4 сутки) в кондиционной жидкости статистически значимо увеличивается активность ЩФ (r = 0,85; p < 0,007), падает содержание кальция (r = –0,85; p < 0,008) и остеокальцина (r = –0,85; p < 0,008). При этом обнаружена прямая регрессия концентрации фосфора в среде с повышением активности ЩФ (рис. 3).
а б
в
Рис. 1. Состояние конечностей у пациента С. до и после оперативного вмешательства. Выраженные угловые деформации нижних конечностей до операции (а), пациент проходит курс физической реабилитации (б, в), через 18 мес. конечности опороспособны
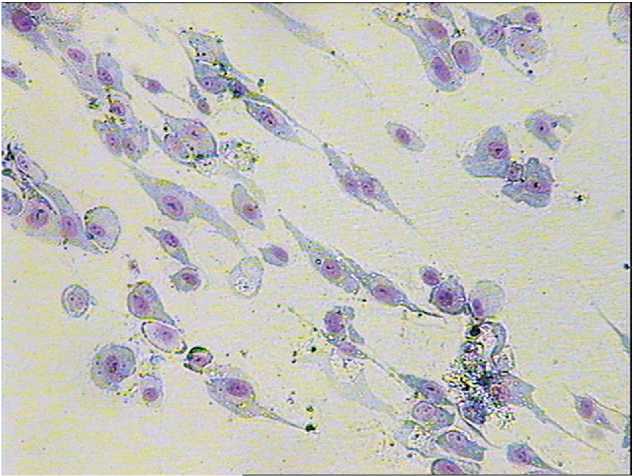
Рис. 2. Культура фибробластоидных клеток легкого человека.
Окраска азуром II-эозином. Увеличение 400
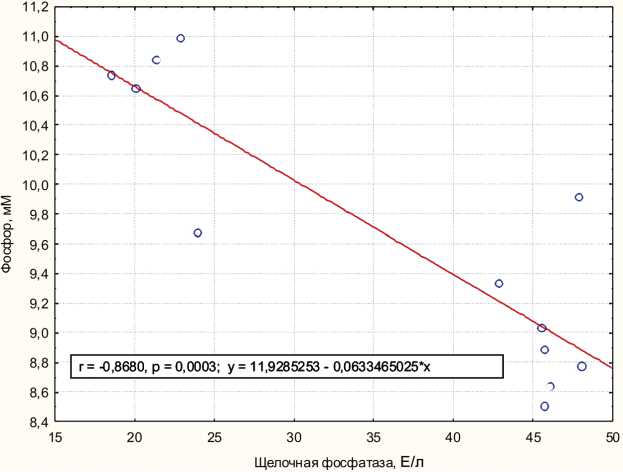
Рис. 3. Регрессионная зависимость концентрации фосфора в межклеточной среде от активности щелочной фосфатазы, секретируемой в модельной культуре стромальных стволовых клеток человека
Таблица 1
Изменение состава культуральной среды ( % от исходного уровня) при культивировании фибробластоидных клеток человека, Х ± m
|
Показатель |
Кальций свободный, мМ |
Фосфор, мМ |
Остеокальцин, нг/мл |
Костный изофермент щелочной фосфатазы, Е/л |
|
Культура фибробластов легкого |
92,48 ± 6,64 n = 8 |
97,68 ± 2,07 n = 8 |
202,54 ± 39,64 n = 8 |
110,18 ± 2,65 n = 8 |
Интерпретация полученных результатов, в соответствии с представлениями Б. Л. Риггс с соавт. [4], говорит о том, что в процессе краткосрочного культивирования стромальных стволовых клеток накапливаются поздние маркеры (ЩФ) их дифференцировки и созревания в остеобласты. Щелочная фосфатаза, по-видимому, вызывает формирование фосфатов кальция, что не противоречит литературным данным [4]. При этом возрастающая в 1,5 раза концентрация CrossLaps (концевые фрагменты молекул коллагена) в супернатанте может свидетельствовать о начале отложения и ремоделирования коллагенового матрикса.
По-видимому, использованный состав культуральной среды, содержащей глицерофосфат и дексаметазон, как описано у В. В. Новицкого с соавт. [1], действительно способствует формированию остеогенной клеточной культуры.
Согласно обзору Q. He с соавт. [10], в периферической крови человека обнаружена очень малая популяция (менее 0,5 клеток на 106 мононуклеаров) мезенхимальных стромальных стволовых клеток (ММСК), количество которых увеличивается при заболеваниях или методиках, вызывающих их мобилизацию из костного мозга. Необходимо подчеркнуть, что циркуляция в крови колониеобразующих единиц фибробластов (КОЕ-Ф), аналогов ММСК, была установлена ранее [10].
Существует проблема нарушения структурнофункционального состояния костной ткани у пациентов с НО. Ранее в периферической крови больных НО мы зафиксировали высокие уровни маркеров ремоделирования костной ткани [2]. Многочисленные переломы и оперативные вмешательства приводят к тому, что в периферической крови у больных НО обнаруживаются мононуклеарные клетки, которые при краткосрочном (2-4 суток) культивировании в остеогенной культуральной среде способны подвергаться бласттрансформации и принимать фибробластоидную морфологию (рис. 4). Процент фибробластоидных клеток варьировал от 4 % (пациент 1) до 14 % (пациент 3). Максимально выраженная фенотипическая трансформация клеток отмечалась у пациента с наиболее тяжелой клинической формой НО.
Фибробластоидные клетки демонстрировали резко положительную окраску на кислую фосфатазу и слабую (в виде отдельных гранул) — на щелочную фосфатазу, что соответствует цитохимическому профилю КОЕ-Ф периферической крови человека [10]. Более того, секреторный статус мононуклеаров свидетельствовал об их остеогенном созревании (табл. 2). Также имела место реципрокная динамика содержания фос- фора в среде и активности костной ЩФ (табл. 2), как и в модельной культуре стромальных стволовых клеток человека (см. рис. 3).
Тем не менее, активность мононуклеаров у больных НО, связанная с формированием костного матрикса, оказалась менее активной, что было зафиксировано по малому усвоению фосфора и слабой секреции остеокальцина в сравнении с культурой стромальных стволовых клеток (табл. 1, 2). С другой стороны, концентрация CrossLaps (концевых фрагментов коллагена I типа) увеличивалась в 14–34 раза в зависимости от клинической тяжести НО (табл. 2), что могло быть связано с повышенной активностью лизосомальных ферментов клеток.
В связи с этим, была составлена матрица признаков для выяснения связи клинической тяжести заболевания у больных НО, времени хирургического клинического успеха, индексов плазмы крови и культуры клеток (табл. 3) для проведения корреляционного и регрессионного анализов. Показатели были разбиты на 2 группы: 1) маркеры деградации костного матрикса; 2) маркеры остеобластов и синтеза костного матрикса. Фибробластоидные клетки были включены в 1-ю группу, т. к. они окрашивались преимущественно на кислую фосфатазу, считающуюся маркером фиброкластов [5] и остеокластов [4], ремоделирующих межклеточный матрикс соединительной ткани и ее производных.
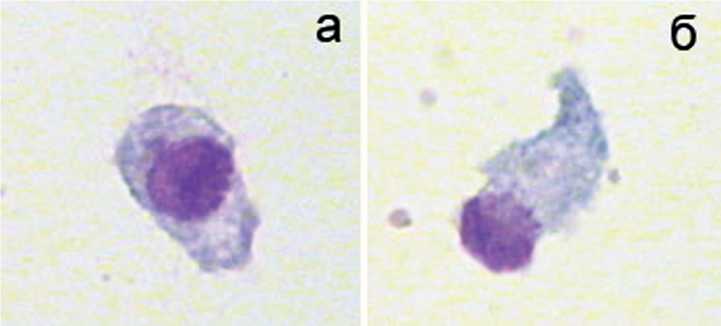
Рис. 4. Морфология бластных (а) и фибробластоидных (б) клеток, выросших в краткосрочной культуре мо-нонуклеаров крови у больных несовершенным остеогенезом. Окраска азуром II-эозином. Увеличение 1000
Таблица 2
Динамика маркеров костного ремоделирования при культивировании мононуклеаров периферической крови пациентов с несовершенным остеогенезом ( %)
|
Сроки культивирования клеток, сутки |
Кальций, мМ |
Фосфор, мМ |
Остеокальцин, нг/ мл |
CrossLaps, нг/мл |
Костный изофермент щелочной фосфатазы, Е/л |
|
Пациент 1 |
|||||
|
2 |
1,58 (114 %) |
4,57 (123 %) |
6,66 (128 %) |
0,001 (100 %) |
46,35 (123 %) |
|
4 |
1,0 (72 %) |
3,92 (105 %) |
2,66 (51 %) |
0,001 (100 %) |
49,64 (132 %) |
|
Пациент 2 |
|||||
|
2 |
1,48 (107 %) |
4,18 (112 %) |
5,05 (97 %) |
0,014 (1400 %) |
46,74 (124 %) |
|
4 |
0,95 (68 %) |
4,0 (107 %) |
3,62 (70 %) |
0,001 (100 %) |
47,61 (126 %) |
|
Пациент 3 |
|||||
|
2 |
1,54 (111 %) |
4,41 (118 %) |
5,70 (109 %) |
0,030 (3000 %) |
38,33 (102 %) |
|
4 |
1,39 (100 %) |
4,30 (115 %) |
2,58 (50 %) |
0,034 (3400 %) |
45,75 (121 %) |
Примечание: представлены данные 3 измерений; в скобках указан процент от уровня показателей в культуральной среде без клеток.
Таблица 3
Клинические показатели и маркеры костного ремоделирования в плазме крови и 4-суточной культуре мононуклеаров периферической крови у пациентов с несовершенным остеогенезом
|
Показатель |
Пациент 1 |
Пациент 2 |
Пациент 3 |
|
Клинические показатели |
|||
|
Тяжесть заболевания, баллы |
1 |
2 |
3 |
|
Время промежуточного хирургического успеха*, мес. |
3,5 |
8 |
18 |
|
Маркеры метаболической активности клеток и деградации костного матрикса |
|||
|
Уровень кальция в супернатанте культуры мононуклеаров крови, мМ |
1 |
0,95 |
1,39 |
|
Уровень фосфора в супернатанте культуры мононуклеаров крови, мМ |
3,92 |
4 |
4,3 |
|
Уровень CrossLaps в плазме крови, нг/мл |
0,509 |
0,468 |
2,324 |
|
Уровень CrossLaps в супернатанте культуры мононуклеаров крови, нг/мл |
0,001 |
0,001 |
0,034 |
|
% фибробластоидных клеток в культуре мононуклеаров крови |
7 |
4 |
16 |
|
Маркеры остеобластов и синтеза костного матрикса |
|||
|
Активность костного изофермента ЩФ в плазме крови, Е/л |
9,216 |
0,798 |
0,414 |
|
Активность костного изофермента ЩФ в супернатанте культуры мононуклеаров крови, Е/л |
49,64 |
47,61 |
45,75 |
|
Уровень остеокальцина в супернатанте культуры мононуклеаров крови, нг/мл |
2,66 |
3,62 |
2,58 |
Примечание: * — время постановки больных на ноги в аппарате Илизарова.
Т-критерий Вилкоксона показал, что у пациента 3, состояние которого характеризуется наиболее тяжелой степенью клинических проявлений заболевания и длительным периодом достижения хирургического успеха, индексы 1-й группы статистически значимо превышали таковые у 1 и 2 пациентов (p < 0,04; n = 5). Однако на данном этапе исследований у больных НО не удалось выявить корреляционные и регрессионные зависимости клинических и лабораторных показателей падения функции остеобластов и усиления деградации костного матрикса.
В то же время, согласно регрессионному анализу (рис. 5), активность костного изофермента ЩФ в супернатантах клеточных культур убывает по мере нарастания клинической картины НО. Если сравнивать результаты с поведением модельной культуры стромальных стволовых клеток (см. выше), описанные изменения активности фермента могут лежать в основе накопления в культуральной среде фосфора (см. табл. 3) как маркера нарушения минерализации костного матрикса.
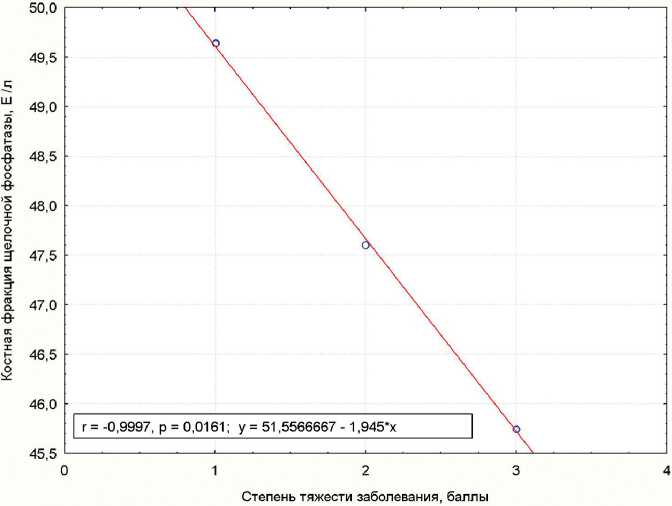
Рис. 5. Регрессионная зависимость активности костного изофермента щелочной фосфатазы в супернатантах культур мононуклеаров крови от степени тяжести несовершенного остеогенеза
ЗАКЛЮЧЕНИЕ
Моделирование in vitro молекулярных механизмов жизнедеятельности стволовых клеток позволяет говорить о дисбалансе остеобластического и остеокласти-ческого клеточного дифферонов при НО.
В периферической крови больных НО циркулирует значительное количество клеток, проявляющих при культивировании in vitro в остеогенной среде фибробластоидную морфологию, окраску на кислую фосфатазу, выраженную активность в отношении образования CrossLaps по мере нарастания клинической тяжести заболевания. В то же время созревание мононуклеаров крови в направлении остеобластов, зафиксированное по секреции костного изофермента ЩФ, убывает в прямой зависимости от увеличения тяжести НО.
Описанные изменения морфофункциональных параметров культуры мононуклеарных клеток пе- риферической крови могут рассматриваться как вероятные маркеры и предикторы течения несовершенного остеогенеза и сроков реабилитации пациентов.
Исследование частично выполнено при поддержке федеральных целевых программ «Исследования и разработки по приоритетным направлениям развития научно-технологического комплекса России на 2007–2012 годы» (государственный контракт № 16.512.11.2087), «Научные и научно-педагогические кадры инновационной России» на 2009–2013 годы (государственный контракт П861 от 25.05.2010), Аналитической ведомственной целевой программы (АВЦП) «Развитие научного потенциала высшей школы на 2009–2011 годы» (регистрационный номер проекта 2.1.1 / 14204).


