Морфофункциональные особенности натуральных киллеров-Т-клеток больных с опухолевыми поражениями печени
Автор: Лебединская О.В., Патютко Ю.И., Забежинский Д.А., Кузовлев Е.Н., Ахматова Н.К., Шубина И.Ж., Вершинина М.Ю., Киселевский М.В.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 3 (15), 2005 года.
Бесплатный доступ
Анализ функций натуральных киллеров-Т-клеток печени и исследование их иммунофенотипа является крайне важным в оценке роли НКТ-клеток в противоопухолевом иммунитете. Целью исследований являлось изучение фенотипа и функциональной активности мононуклеарных клеток (МНК), выделенных из интактных и парагуморальных участков печени онкологических больных в сравнении с мононуклеарами периферической крови (МНПК). НК-активность и цитотоксическую способность МНК определяли с помощью цитотоксического теста. Иммунофенотипироваыие проводили методом проточной питометрии. В результате исследований выявлено, что МНК печени, особенно выделенные из параметастатических участков, по своему иммунологическому фенотипу и цитотоксической активности существенно отличаются от МНПК тех же больных. МНК печени экспрессируют на своей поверхности и дифференцировочные антигены Т-лимфоцитов (CD3), и НК-маркеры (CD57), отличаются высоким уровнем НК-активности и способностью лидировать аутологичные опухолевые клетки, представлены молодыми (иммунобластами и про лимфоцитами) и активированными (пиронинофильными) формами лимфоцитов. Все эти показатели позволяют отнести МНК печени онкологических больных к популяции I lKT-клеток, которые могут быть использованы в иммунотерапии метастатических поражений данного органа,
Короткий адрес: https://sciup.org/14054230
IDR: 14054230
Текст научной статьи Морфофункциональные особенности натуральных киллеров-Т-клеток больных с опухолевыми поражениями печени
Введение. Иммунная система печени включает в себя большинство компонентов врожденной иммунной системы (натуральные киллеры - НК, натуральные киллеры-Т-клетки -НКТ-клетки, дендритные клетки, макрофаги и др.) и небольшую часть эффекторов специфического иммунитета (Т-клетки). Взаимосвязь между этими двумя звеньями иммунной защиты печени до конца не изучена [4,6,12,15,16]. О роли специфических иммунокомпетентных клеток известно достаточно много, гораздо меньше сведений о других субклассах моно-нуклеарных клеток (МНК) печени, особенно об их участии в инициации иммунного ответа.
Печень является основным кроветворным органом на стадии эмбрионального развития, однако и после рождения ее гемопоэтическая функция в ряде случаев сохраняется [1]. У взрослого человека она содержит стволовые клетки (c-kit+) и является органом внетимичес-кой генерации Т-клеток, НК-клеток и даже гранулоцитов. Внетимическая генерация Т-лимфоцитов в печени происходит при участии Т-кле-точных рецепторов (TCR), включая маркеры НКТ-клеток (НК1.1 + TCR) [2, 5].
Практически все сведения о внутрипеченоч-ной активации НКТ-клеток и их взаимодействии с другими звеньями иммунной системы органа были получены в экспериментах на мышах [8, 10, 14]. НКТ-клетки составляют основную часть Т-клеточной популяции печени мышей [4, 6,9] и характеризуются как CD4+, CD4 - CD8 -(двойные негативные) ар Т-клетки (Val4/ Jal8+), CDld+ НКТ-клетки [3]. Мышиные Val4/Jal8(+) НКТ-клетки составляют 30 - 50 % от общего пула Т-лимфоцитов печени и обладают потенциальной противоопухолевой активностью [3,6,10]. Активация НКТ-клеток печени сопровождается поверхностной экспрессией CD69, усилением их цитотоксичности и выработки интерферона- т(ИФН- ) [17]. Генерация НКТ-клеток печени происходит под действием интерлейкина-12 (ИЛ-12), секретируемого антигенпрезентирующими клетками (макрофагами, купферовскими и дендритными клетками) в ответ на воздействие инфекционных и вирусных агентов, эндотоксинов, а также злокачественно трансформированных клеток [8,10,
14]. Большое количество исследований, проводимых в эксперименте на мышах, показало, что НКТ-клетки печени играют важную роль в формировании противоопухолевого иммунитета. В частности, обнаружена инфильтрация НКТ-клетками ткани печени, пораженной опухолевым процессом, особенно параметастатических участков этого органа [3, 6, 8, 10, 14 -17].
Вместе с тем литературные данные, характеризующие методы выделения НКТ-клеток из печени и крови человека, их функциональные особенности, а также иммунологический фенотип, весьма немногочисленны. В настоящее время выявлено, что основная группа НКТ-клеток человека при их выделении из здоровой и пораженной опухолью печени представляет собой Va24/Vpi 1+ НКТ-клетки [2,4, 7, 9, 11, 12]. В отличие от мышиной, печень здорового человека содержит небольшое количество НКТ-клеток (0,5 % CD3+), в периферической крови их еще меньше (0,02 %) [9]. Большинство Va24+ НКТ-клеток печени человека экспрессируют \ф1 1-цепь, что отличает их от НКТ-клеток крови. Вариантами НКТ-клеток являются Т-лимфоциты, несущие на своей поверхности CD4+CD8+, CD4 - CD8 -, а также НК-клетки с высоким уровнем экспрессии таких маркеров, как CD56, CD 161 и/ или CD69 [2, 4, 12]. Некоторые исследователи, основываясь на данных иммунофенотипи-рования, разделяют НКТ-клетки на «классические» (CDld-рестриктированные) и «неклассические», которые экспрессируют на своей поверхности различные Т-клеточные рецепторы и генерация которых не зависит от наличия на их поверхности CD Id [9, 11, 12]. Очевидным является то, что НКТ-клетки охватывают более гетерогенную популяцию Т-лимфоцитов, чем считалось изначально. Дальнейший анализ функций НКТ-клеток печени и исследование их иммунофенотипа и морфологии является крайне важным в оценке роли НКТ клеток в противоопухолевом иммунитете.
Целью исследования являлось изучение морфологических особенностей, иммунофенотипа и функциональной активности мононукле-арных клеток (МНК), выделенных из пораженной опухолевым процессом печени онкологичес- ких больных, в сравнении с мононуклеарами периферической крови (МНПК).
Материалы и методы
Характеристика обследованных больных. В исследование включены 10 больных в возрасте от 15 до 67 лет (мужчин - 7, женщин - 3) с опухолевым поражением печени (табл. 1).
Таблица 1
Распределение больных по локализации первичного очага
|
Локализация первичного очага |
Кол-во больных |
|
Гепатоцеллюлярный рак печени (ГЦР) |
2 |
|
Колоректальный рак |
5 |
|
Рак молочной железы |
1 |
|
Рак почки |
1 |
|
Полииеоплазия: рак сигмовидной кишки+меланома кожи спины (метастазы рака сигмовидной кишки в печень) |
1 |
Выделение МНПК. МНПК выделяли из стабилизированной гепарином (25 Ед/мл) периферической крови на градиенте фиколла («Pharmacia», плотностью 1,077 г/см3), центрифугированием при 400 g в течение 30 мин. Лимфоидные клетки, образовавшие интерфазное кольцо, собирали пипеткой и трехкратно отмывали в среде 199. После каждой отмывки в 10 -кратном объеме среды клетки осаждали центрифугированием при 200 g.
Выделение МНК из интактноп и парату-моральноп областей печени. Из фрагментов печени, полученных после резекции этого органа, была получена клеточная суспензия. Гепатоциты отделяли от МНК путем центрифугирования при 50 g в течение 5 мин. МНК выделяли с помощью центирифугирования в градиенте фиколла («Pharmacia», плотностью 1,077 г/см3) по описанной выше методике. Клетки отмывали 2 раза средой 199 и ресуспендировали в полной культуральной среде (RPMI-1640 с добавлением 10 % эмбриональной телячьей сыворотки, 2 мМ глютамина, стрептомицина с пенициллином по 5000 МЕ/мл).
Получение опухолевых клеток из опухолевого узла печени. Из метастатического узла получали суспензию опухолевых клеток, которую затем дважды отмывали в растворе Хен-кса и ресуспендировали в полной культуральной среде.
Цитологическое исследование. Из взвеси МНК, полученных из различных участков пораженной опухолью печени, готовили мазки, которые фиксировали метиловым спиртом и окрашивали эозином азуром-2 по Романовскому-Гимза, метиловым зеленым пиронином по Браше на РНК с контрольной обработкой РНКазой. Фотографирование меченых клеток и окрашенных мазков производили с использованием системы Axio Vision 4 (Carl Zeiss, Германия).
Цитотоксический тест. НК-активность определяли на линии К-562, клетки которой культивировали в полной культуральной среде при 37°С в атмосфере 4 % СО 2 . Для определения противоопухолевой активности (цитотоксичности) МНК печени использовали аутологические опухолевые клетки. Опухолевые клетки (1хЮ4 в 1 мл) инкубировали в культуральной среде с МНК (в соотношении 1:5) в плоскодонных 96-луночных микропланшетах (Costar, Франция) 18 часов. Затем в лунки добавлялся витальный краситель МТТ (Sigma, США) и по оптической плотности, измеряемой на мультискане МСС-340 (Labsystem, Финляндия), рассчитывали процент лизиса опухолевых клеток (процент цитотоксичности).
Проточная цитометрия (FACS-анализ). Определение экспрессии поверхностных маркеров МНК проводили при помощи моноклональных антител против соответствующих ан- I тигенов (Caltag Laboratories, США), результаты учитывали методом проточной цитофлюорометрии на проточном цитометре FACScan (Becton Dickinson, США). На МНК исследовали уровни экспрессии дифференцировочных антигенов CD3, CD4, CD8, CD16; активационных антигенов CD25, CD38, HLA-DR; молекул ад- I гезии CD57, CD58. Гейт (окно) популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 10.000 клеток в гейте. Статистическая обработка материала проведена при помощи программного пакета WinMDI 2.8.
Морфофункциональные особенности натуральных киллеров-Т-клеток больных
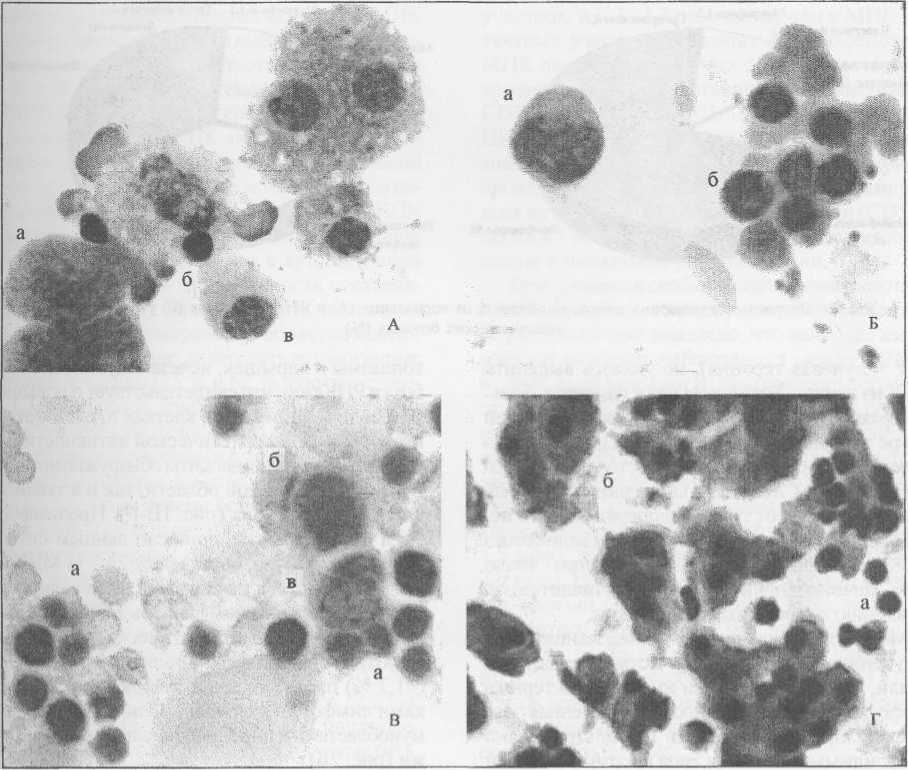
Рис. 1. НКТ в мазках взвеси клеток, взятых из интактного, параметастатического и метастатического участков печени больных:
A. Клетки интактного участка печени онкологического больного: а) гепатоциты, б) лимфоцит, в) макрофаг. Окраска эозин-азуром по Романовскому-Гимза, ок. 10, об. 100;
Б. Инфильтрация активированными лимфоцитами и властными формами параметастатической области печени онкологического больного: а) иммунобласт, б) активированные лимфоциты и пролимфоциты. Окраска эозин-азуром по Романовскому-Гимза, ок. 10, об. 100;
B. Пиронинофильные лимфоциты (а), властные формы (б) и дендритные клетки (в) в параметастатическом участке печени.
Окраска метиловым зеленым-пиронином по Браше, ок. 10, об. 100;
Г. Пиронинофильные лимфоциты (а), окружающие опухолевые клетки (б), в области метастаза печени. Окраска метиловым зеленым-пиронином по Браше, ок. 10, об. 40
Результаты и обсуждение
У первичных больных без предварительно проводимой в предоперационном периоде химио-и лучевой терапии удалось выделить 5 - 6x106 МНК из 1 см3 печени. При этом в паратумораль-ной области количество клеток в 1,5 - 2 раза пре- вышало их число в интактных участках печени. У пациентов, получивших в предоперационном периоде курс химио- и лучевой терапии, количество МНК печени составляло не более 1x10е МНК на 1 см3. У больной раком молочной железы с метастазами в печень, предварительно получившей 4 курса химиотерапии (по схеме
О.В. ЛЕБЕДИНСКАЯ, Ю.И. ПАТЮТКО, Д.А. ЗАБЕЖИНСКИЙ, Е.Н. КУЗОВЛЕВ, Н.К. АХМАТОВА

Рис. 2. Состав мононуклеарных клеток, выделенных из нормальных (А) и метастатических (Б) участков печени онкологических больных (%)
CAF + лучевая терапия), не уцалось выделить МНК из печени. В то время как у пациента, больного раком почки, получавшего перед операцией 1 курс иммунотерапии (Интрон А), количество выделенных из печени МНК составляло 10x106 МНК на 1 см3. Следовательно, количество МНК в печени зависит от типа предоперационного лечения: при химио- и лучевой терапии количество МНК минимальное, при иммунотерапии - число МНК печени значительно увеличивается по сравнению с нелечеными больными.
Морфо-гистохимические исследования МНК, полученных из различных участков печени, показали, что данные клетки имеют характерные морфологические особенности. Пораженная опухолевым процессом печень инфильтрирована лимфоидными клетками типа пролимфоцитов и иммунобластов (наиболее многочисленных в параметастатических областях), которые взаимодействуют с макрофагами и дендритными клетками (рис. 1А-Б). Среди мононуклеаров выявляется значительное количество лимфоцитов, имеющих яркую пиронинофильную окраску ци- топлазмы и ядрышек, исчезающую после обработки РНКазой, что свидетельствует о повышенном содержании РНК в клетках и, следовательно, их высокой синтетической активности. Пи-ронинофильные лимфоциты обнаруживаются как в параметастической области, так и в ткани метастатического узла (рис. 1В-Г). Пролимфоциты и иммунобласты, согласно данным цитологического анализа, составляют 24,7 % МНК интактных участков печени, при этом количество пиронинофильных лимфоцитов достигает 15,7 % (рис. 2А). В параметастатической области абсолютное большинство мононуклеарных клеток (91,3 %) представлено активированными клетками лимфоидного ряда: пролимфоцитами, иммунобластами и пиронинофильными лимфоцитами (рис. 2Б).
Сравнительное исследование цитотоксической активности МНК, выделенных из интактного и паратуморального участков печени, выявило, что при тестировании на НК-чувствительной линии К562 они не имеют достоверных отличий (табл. 2). В то же время по отношению к аутологичным
Таблица 2
Цитотоксическая и НК-активность МИК печени и периферической крови онкологических больных с метастазами в печень (%)
опухолевым клеткам киллерная активность МНК из паратуморальной области выше цитотоксической активности МНК интактного участка печени (62 % и 25 %, соответственно).
МНПК больных характеризуются достоверно меньшим уровнем НК-активности по сравнению с МНК печени и соответствуют степени цитотоксической активности мононуклеаров периферической крови здоровых доноров. МНПК больных практически не обладают киллерной способностью по отношению к аутологичным опухолевым клеткам (их активность составляет в среднем 11 %). При этом МНК интакгной и, особенно, паратуморальной областей печени способны эффективно лизировать аутологичные опухолевые клетки (25 % и 62 %, соответственно). Следовательно, наибольшую цитотоксическую активность по отношению к аллогенным и аутологичным опухолевым клеткам демонстрируют мононуклеары, выделенные из паратумо-ральных участков печени больных.
Сравнительное исследование иммунофено-типамононуклеарных лейкоцитов, выделенных из двух различных областей печени онкологических больных (табл. 3) показало, что процентное содержание клеток, экспрессирующих на своей поверхности дифференцировочные антигены CD4 (9,1 % и 10,4 %), CD8 (42,2 % и 50,9 %), CD3 (60,5 % и 79,9 %), CD16 (10,4 % и 12,2 %), примерно одинаково в интактном и паратумо-ральном участках. Однако следует отметить, что интенсивность флюоресценции при детектировании данных молекул на поверхности МНК, выделенных из параметастатических участков, в 1,2 -1,3 раза выше, чем у МНК интактных участков. Различия иммунофенотипа МНК двух исследованных областей печени по уровню экспрессии активационных антигенов CD25 (5,7 % и 6,6 %), CD38 (42,2 % и 35,9 %) и НК-маркера CD57 (31,9 % и 37,1 %) также незначительны. В то же время число мононукле-аров паратуморальной области, экспрессирующих на поверхности молекулы адгезии (CD58), почти в 3 раза превышает их процентное содержание в интактном участке печени.
При сравнении особенностей иммунофенотипа МНПК больных и мононуклеаров пораженной опухолью печени выявлено, что наиболее выраженные различия наблюдаются между МНПК и МНК, выделенными из паратуморального участка (табл. 3). Как следует из табл. 3 и гистограмм (рис. 3,4), у МНК пораженной метастазами печени по сравнению с мононуклеарными лейкоцитами периферической крови онкологических больных значительно повышены уровни экспрессии дифференцировочного маркера CD8 (в 1.5 раза), активационных антигенов CD38 (в 2.5 раза), НК-маркера CD57 (в 1,7 раза) и моле кул адгезии CD58 (в 4,6 раза). В то же время процентное содержание CD4+ клеток, напротив, у МНПК почти в 4 раза превышает таковую у МНК печени. Количество CD3+, CD 16+ и CD25+ клеток примерно одинаково как в популяции мо-нонуклеарных лейкоцитов крови, так и МНК, вы деленных из печени.
Таким образом, МНК печени онкологических больных по иммунологическому фенотипу и уровню НК-активности существенно отлича-
Таблица 3
Характеристика иммунологического фенотипа МНК, выделенных из печени и периферической крови онкологических больных
|
CD-маркер |
Уровень экспрессии антигенов на поверхности мононуклеарных лейкоцитов, % |
|||
|
Интактный участок печени(1) |
Паратуморальная область печени (2) |
Периферическая кровь (3) |
Достоверность различий между группами |
|
|
CD3 |
60,5±14,0 |
79,9±24,0 |
76,9±18,0 |
р|2> 0,05; р,3> 0,05; р2,> 0,05 |
|
CD4 |
9,1±1,7 |
10,4±4,4 |
36,6±13,0 |
р 12> 0,05; р „< 0,05; р2,< 0.05 |
|
CD8 |
42,2±4,7 |
50,9±12,0 |
35,0±12,0 |
Р u > 0,05; р ,3 > 0,05; р у > 0,05 |
|
CD16 |
10,4±4,2 |
12,2±1,1 |
19,1 ±6,0 |
|
|
CD25 |
5,7±1,7 |
6,6±1,4 |
4,5±1,6 |
|
|
CD38 |
42,2±12,0 |
35,9±4,3 |
13,8±2,7 |
р, > 0,05; р,3< 0,05; р23< 0,05 |
|
CD57 |
31,9±5,2 |
37,1 ±4,9 |
24,3±3,4 |
р|2> 0,05; р,3> 0,05; р„>0,05 |
|
CD58 |
24,0±9,0 |
71,5±19,0 |
15,6±3,8 |
р, <0,05;р,,>0,05;р,,>0,01 |
О.В. ЛЕБЕДИНСКАЯ, Ю.И. ПАТЮТКО, Д.А. ЗАБЕЖИНСКИЙ, Е.Н. КУЗОВЛЕВ, Н.К. АХМАТОВА h MNK h«pam2 СОЗ h MNK hapam2 CD6
li MNK hepam2 CD38
hMNKhepam2CD6B
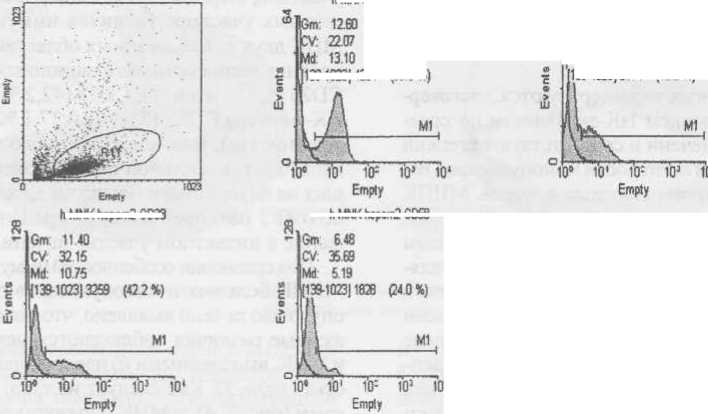
Рис. 3. Иммунологический фенотип МИК, выделенных из интактного участка печени онкологических больных (уровень экспрессии СОЗ, CD8, CD38, CD58)
139-102314264 60 5%)
Gm: 924
CV 32.16
Md. 8.20
139-1023] 2574 (422%)
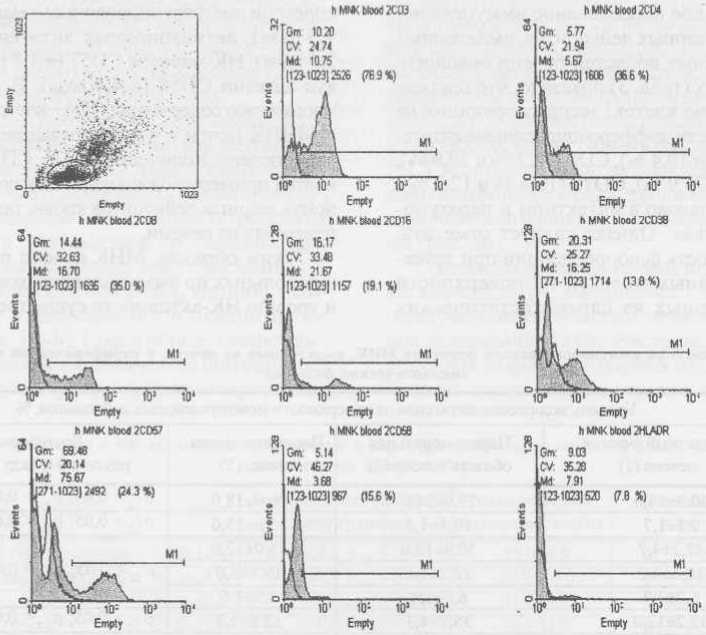
Рис. 4. Иммунологический фенотип МНК, выделенных из периферической крови онкологических больных (уровень экспрессии СОЗ, CD4. CD8, CD38, CD57, СО 58, HLA-DR)
ются от МНПК тех же больных. Исходя из наших данных, они являются преимущественно CD3+ Т-лимфоцитами, но, в отличие от МНПК, активно экспрессируют на своей поверхности антигены натуральных киллеров (CD57). Морфологически популяция МНК пораженной метастазами печени, особенно в паратумораль-ных областях, состоит в основном из молодых и синтетически активных клеток лимфоидного ряда, что свидетельствует о процессах бласт-трансформации, дифференцировки и активации лимфоцитов, приводящих, по-видимому, к формированию субпопуляции НКТ-клеток.
Эта субпопуляция лимфоцитов характеризуется высокой НК-активностью, повышенной экспрессией молекул адгезии (что обеспечивает их фиксацию в области поражения и взаимодействие с антигенпрезентирующими дендритными и с опухолевыми клетками), увеличенным количеством активационных антигенов на поверхности. Печень-ассоциированные лимфоциты обладают достоверно большей цитотоксической активностью по отношению к аутологичным опухолевым клеткам, чем лимфоциты периферической крови больных. Следовательно , результаты наших исследований подтверждают экспериментальные данные о наличии в пораженной опухолевом процессом печени особой субпопуляции НКТ-клеток, которые могут быть использованы для целей иммунотерапии онкологических заболеваний, осложненных метастазированием в печень [3].


