Морфогенез непаразитарных кист печени
Автор: Фрейнд Генриетта Герхардовна, Живаева Елена Викторовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.28, 2020 года.
Бесплатный доступ
В результате внедрения в клиническую практику визуализационных методов исследования значительно возросла частота выявления полостных образований печени, среди которых недостаточно изучены непаразитарные кисты. В работе представлен обзор наиболее часто использующихся классификаций данной патологии. Исследованы клинико-рентгенологические проявления кист на основании анализа результатов компьютерной томографии, магнитно-резонансной томографии и ультразвуковой сонографии 175 больных (109 с солитарными кистами и 66 с поликистозом печени). Гистологическими и иммуногистохимическими методами изучены ткани резецированных участков 81 кисты и прилежащей ткани печени. Выявлены различные варианты кист печени: поликистоз, солитарные кисты и наиболее редко встречающийся вариант - реснитчатые переднекишечные печеночные кисты. Описаны морфологические и гистогенетические особенности солитарных и реснитчатых передне-кишечных печеночных кист, а также изменения прилежащей к полостям ткани печени. Для поликистоза характерно наличие полостей различных размеров, с тонкими соединительнотканными перегородками и выстилкой кубическим или уплощенным эпителием. Выстилка солитарных кист представлена кубическим, цилиндрическим, иногда - многорядным эпителием. В их стенке среди клеток соединительной ткани выявляются незрелые билиарные структуры в виде комплексов фон Мейенбурга, островки гепатоцитов, конгломераты диспластичных сосудов. Реснитчатые передне-кишечные печеночные кисты содержат компоненты стенки первичной кишки - выстилку цилиндрическим мерцательным эпителием, слой рыхлой соединительной ткани, мышечный слой, соединительнотканную капсулу. Морфологические исследования позволили установить нарушения эмбриогенеза при различных вариантах кист. Реснитчатые переднекишечные печеночные кисты развиваются из переднего отдела первичной кишки, в то время как солитарные кисты являются производными ее среднего отдела. Миграция формирующихся зачатков бронхиол из краниального отдела первичной средней кишки в печеночный дивертикул обуславливает наличие всех компонентов стенки полого органа - цилиндрического мерцательного эпителия, рыхлой соединительной ткани, пучков гладкомышечных волокон. Простые солитарные кисты являются результатом нарушения ремоделирования эмбриональной дуктальной пластинки, являясь, таким образом, аномалией развития среднего отдела первичной средней кишки. При морфологическом исследовании прилежащей к стенкам кист ткани печени обнаруживаются гипоплазия долек, персистенция элементов эмбриональной дуктальной пластинки в виде тяжей и комплексов билиарного эпителия, фокусы дуктопении, комплексы фон Мейенбурга, различные варианты дисплазии сосудов.
Печень, солитарные кисты печени, поликистоз печени, реснитчатые передне-кишечные печеночные кисты
Короткий адрес: https://sciup.org/143177406
IDR: 143177406 | DOI: 10.20340/mv-mn.2020.28(3)51-57
Текст научной статьи Морфогенез непаразитарных кист печени
Фрейнд Г.Г., Живаева Е.В. Морфогенез непаразитарных кист печени// Морфологические ведомости.- 2020.- Том 28.- № 3.- С. 51-57. (3):51-57
Freynd GG, Zhivaeva EV. The morphogenesis of nonparasitic liver cysts. Morfologicheskie Vedomosti – Morphological Newsletter. 2020;28(3):51-57. (3):51-57
Введение . Кистозные поражения печени представляют собой гетерогенную группу заболеваний, которые, несмотря на различную морфологию, пато- и морфогенез в современных классификациях часто объединяют в одну группу [1]. Имея длительное бессимптомное течение, они могут провоцировать острые абдоминальные ситуации вследствие обструктивной желтухи и других клинических проявлений – перекрутов кист на ножке, странгуляций, нагноения, кровотечений при разрывах кист, что требует хирургического лечения, выбор которого определяется размерами кист, наличием или отсутствием осложнений [2-3]. Целью мини-инвазивных вмешательств является устранение эпителиальной выстилки различными физическими (электрокоагуляция, криодеструкция, аргон-плазменная коагуляция) или химическими (обработка спиртом, моноэтиламином) методами [3-4]. Лапаротомия с резекцией печени применяется при кистах более 10 см в диаметре и в случаях поликистоза [4]. Диагностика кист, как правило, не вызывает затруднений. Современные методы визуализации позволяют дифференцировать солитарные и паразитарные кисты печени, поликистозную болезнь, абсцессы, гемангиомы и цистаденомы. В рутинной клинической практике используется ультрасонография, которая визуализирует простые кисты как округлые или овальные образования с ровными контурами, тонкой однослойной стенкой и гомогенным содержимым низкой плотности, обусловленным наличием жидкости в просвете полости, иногда, в стенке кисты обнаруживаются кальцинаты. Поликистоз представляет собой множество полостей с перегородками различной толщины, расположенных группой в одной или обоих долях печени. Их следует отличать от множественных солитарных кист, которые визуализируются как единичные, расположенные независимо друг от друга, образования [5].
Непаразитарные кисты печени включены в классификации болезней печени. В большинстве случаев они основаны на макроскопических особенностях, этиологии и клинических проявлениях кист печени [6]. В России наиболее часто используется классификация Б.В. Петровского с соавт. (1972), которая включает поликистозную болезнь или поликистоз (с поражением только печени или в сочетании с поражением почек и других органов); солитарные или истиные кисты печени (простые солитарные кисты, многокамерная цистаденома, дермоидные кисты, ретенционные кисты); ложные кисты (траматические, воспалительные) [6].
Представляет интерес классификация поликистоза Gigot с соавт. (2007), основанная на размерах и объеме кист в паренхиме печени, которые определяются по результатам компьютерной томографии для выбора наиболее оптимального метода хирургического лечения. I тип — количество крупных кист (более 10 см в диаметре) в паренхиме печени не превышает десяти; II тип — кисты средних размеров, диффузно расположенные по всей паренхиме, с большим объемом не пораженной ткани; III тип — тяжелая форма поликистоза с поражением всей печени кистами мелких и средних размеров, при этом небольшие участки здоровой ткани встречаются лишь между кистами [7]. В современную классификацию болезней органов пищеварения (ВОЗ, 2010), включены солитарные кисты желчных протоков, реснитчатые передне-кишечные кисты, перибилиарная железистая гамартома (аденома желчных протоков), и гепатобилиарная цистаденома, реснитчатые передне-кишечные печеночные кисты (ciliated hepatic foregut cyst, далее – РППК). Впервые они упомянуты в классификации полостных образований печени Руссо (2007): кисты паразитарные, одиночные (ретенционные) непаразитарные, реснитчатые переднекишечные печеночные кисты, врожденные (наследственные) кисты печени, в том числе врожденный фиброз печени, изолированные (дизонтогенетические) кисты, аутосомно- доминантное поликистозное заболевание печени и почек и изолированная поликистозная болезнь печени [8]. Несмотря на то, что РППК имеют большое сходство с солитарными кистами печени, которые характеризуются исключительно доброкачественным течением, они могут малигнизироваться [9]. Впервые их описание было представлено Freidreich в 1857 году. На текущий момент в мировой литературе описано 123 наблюдения [9-11].
Цель исследования: морфологическое исследование резецированных участков стенок непаразитарных кист и прилежащей к ним ткани печени.
Материалы и методы исследования . На основании компьютерной томографии, магнитно-резонансной томографии и ультразвуковой сонографии выполнен анализ клинико-рентгенологических проявлений кист и морфологическое исследование резецированных участков их стенок 175 больных (109 с солитарными кистами и 66 с поликистозом печени), которым было проведено хирургическое лечение с 2003 по 2018 гг. на базе гепатологического центра Медико-санитарной части № 1 г. Перми и Пермской краевой клинической больницы. Большинство кист локализовалось на диафрагмальной поверхности печени во II, VI и VII сегментах, согласно классификации [10]. В 81 случае наблюдения проведено морфологическое исследование резецированных кист и участков окружающей ткани печени. Препараты готовили по стандартной методике и окрашивали гематоксилином и эозином, пикрофуксином по Ван-Гизон, орсеином, альциановым синим. Выполнены иммуногистохимические исследования с маркерами на гладкомышечный актин, PanCK, хромогранин, CD10 и СD34, EMA фирмы DAKO.
Результаты исследования и обсуждение . При гистологическом исследовании выявлены солитарные (45) кисты печени и поликистоз (36). Выстилка солитарных кист была представлена однослойным кубическим (48), цилиндрическим (31) или многослойным плоским эпителием (2). В случаях нагноения (16) кисты содержали в просвете гнойный экссудат, в стенке – воспалительный инфильтрат, представленный нейтрофильными гранулоцитами с примесью лимфоцитов и макрофагов (рис. 1). Стенка капсулы непаразитарных кист была представлена фиброзной тканью различной толщины. В случаях поликистоза перегородки между кистами имеют различную толщину, их выстилка представлена уплощенным кубическим эпителием (рис. 2). В стенках кист часто определялись расширенные кровеносные сосуды венозного или артериального типов, нередко в виде конгломератов. В артериях определялись гиперплазия интимы, гипертрофия миоцитов, утолщение адвентиции. В стенках кист обнаруживались также островки гепатоцитов, малодифференцированных клеток, тяжи и комплексы билиарного эпителия.
Четыре наблюдения были расценены как редкий вариант кист – РППК [9]. Выстилка в них была представлена цилиндрическим мерцательным эпителием, под которым определялись рыхлая соединительная ткань, пучки гладкомышечных клеток различной толщины (рис. 3), нервные стволики и фиброзная капсула. Лейомиоциты имели позитивное окрашивание с антителами к гладкомышечному актину (рис. 4). Выстилка данных образцов имела резко положительное окрашивание с PanCK (рис. 5) и на EMA маркер. Выстилка и структуры стенки капсулы показали слабую и умеренно позитивную или отсутствующую реакцию с хромогранином и рецептором CD10, отрицательную реакцию с рецептором CD34. В прилежащих участках ткани печени определись мелкие дольки, разделенные прослойками стромы с дистрофическими изменениями гепатоцитов, а также сосуды с утолщением интимы, малодифференцированные овальные клетки, нервные стволики. Гепатоциты находились в состоянии белковой и очаговой жировой дистрофии, в ряде случаев встречался внутриклеточный холестаз. В прилежащих к кистам участках ткани печени встречались комплексы Мейенбурга с элементами первичных билиарных цилиндров (рис. 6). В ткани печени отмечались также грубый фиброз портальных трактов, расширение междольковых вен. Вблизи кист портальные тракты нередко содержали лимфогистиоцитарный инфильтрат. Часто отмечались признаки портальной гипертензии, обусловленной грубым фиброзом портальных трактов, капилляризацией синусоидов, фиброзом стенок центральных вен. В ткани печени выявлялись очаги дуктопении, нередко
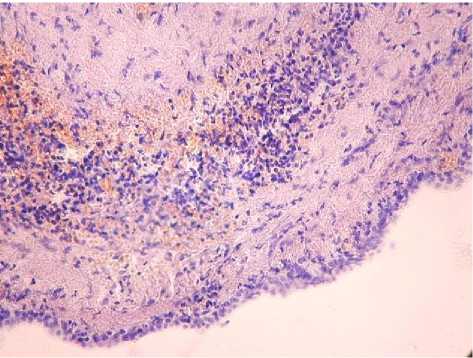
Рис. 1. Выстилка однослойным призмати- ческим эпителием и воспалительная инфильтрация лимфоцитами, лейкоцитами, плазмоцитами в стенке солитарной кисты. Окр. гематоксилином и эозином. Ув.: х400.
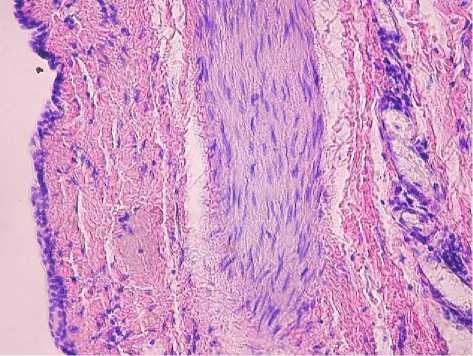
Рис. 3. Стенка реснитчатой переднекишечной печеночной кисты. Выстилка уплощенные цилиндрическим эпителием, тяжи гладкомышечных клеток. Окр. гематоксилином и эозином. Ув.: х400.
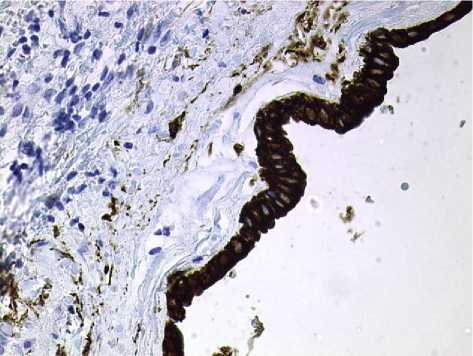
Рис. 5. Положительная иммуногистохимическая реакция цилиндрического эпителия выстилки кисты на маркер PanCK. Окр. гематоксилином. Ув.: х400.
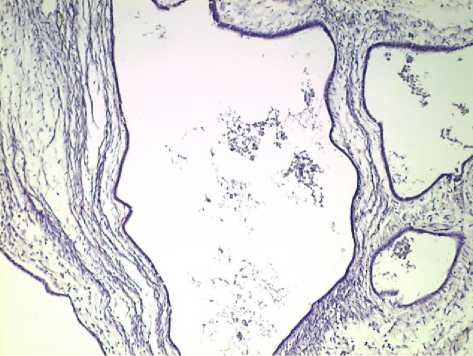
Рис. 2. Поликистоз печени. Выстилка уплощенным кубическим эпителием, перегородки разной толщины. Окр. гематоксилином и эозином. Ув.: х100.

Рис. 4. Положительная иммуногистохимическая реакция с антителами к гладкомышечному актину. Окр. гематоксилином. Ув.: х400.
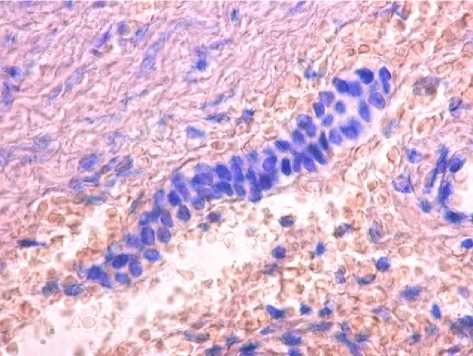
Рис. 6. Элементы билиарного цилиндра и малодифференцированные клетки в стенке кисты. Окр. гематоксилином и эозином. Ув.: x400.
встречались скопления малодифференцированных овальных клеток.
Морфогенез врожденных непаразитарных кист печени является предметом дискуссий. Формирование гепатобилиарной системы начинается на третьей неделе внутриутробного развития с появления зачатка печени. Он представляет собой выпячивание энтодермального эпителия вентральной стенки первичной средней кишки. В центральной части выпячивание имеет углубление в виде желоба, разделяющее его на переднюю — вентрокраниальную, или печеночную, и заднюю — дорсокаудальную, или пузырную, части. Первая врастает в мезенхиму вентральной брыжейки и образует паренхиму печени, ее эпителий разрастается, приобретает вид тяжей, связанных друг с другом многочисленными анастомозами [12]. В дальнейшем эпителиальные тяжи располагаются более упорядоченно, из их дистальных отделов образуются печеночные балки (секреторная часть печени), из проксимальных — внутрипеченочные желчные ходы, печеночные протоки. Между печеночными балками развивается лабиринт широких капилляров-синусоидов [12-13].
Мезодермальные листки вентральной брыжейки превращаются в соединительнотканную капсулу печени, междольковую соединительную ткань, соединительную ткань и мышечный слой стенки желчных протоков. Задняя, пузырная часть печеночного дивертикула находится в непосредственной связи с двенадцатиперстной кишкой и вентральным зачатком поджелудочной железы. В ней имеется закладка желчного пузыря и желчных структур в виде тяжей эпителиальных клеток, окруженных мезенхимой. Первоначально в вентральные отделы пузырного зачатка впадают печеночные протоки. Постепенно этот отдел зачатка удлиняется в каудальном направлении, образуется узкая трубка с множеством впадающих в нее протоков — будущий пузырный проток [12-14]. Изначально субпопуляция клеток-предшественников или так называемых «овальных клеток», рассматриваемых в качестве предшественников эпителиальных клеток желчных протоков и гепатоцитов экспрессирует желчеспецифические цитокератины [7, 19] и локализуется вблизи мезенхимы формирующихся портальных сосудов. Слой клеток-предшественников впоследствии формирует непрерывную однослойную кольцевую структуру, называемую дуктальной пластинкой, которая окружает портальную мезенхиму [14]. Пластинка в дальнейшем частично становится двухслойной. Ее локальные расширения в тех местах, где она является двухслойной, дают начало желчным капиллярам. Оставшаяся часть пластинки в дальнейшем регрессирует путем апоптоза. В случае нарушения механизма апоптоза происходит избыточная пролиферация и ветвление желчных протоков, сопровождающееся избыточным фиброзом [13].
При исследовании молекулярной регуляции формирования протоковой пластинки были установлены некоторые ключевые факторы этого процесса. Транскрипционный фактор HNF6 определяет количество клеток, вовлеченных в процесс формирования эпителия желчных путей, а также расположение желчных путей вблизи портальной мезенхимы [14]. При делеции гена фактора HNF1b возникают аномалии развития внутрипеченочных желчных протоков [15].
Гистогенез РППК до сих пор неясен, но преобладает точка зрения, что они могут возникать из эмбрионального зачатка передней кишки, который простирается от ротоглотки до печеночного дивертикула. Из него в последующем развиваются ткани ротоглотки, пищевод, желудок, двенадцатиперстная кишка, печень, желчный пузырь, поджелудочная железа, трахеобронхиальное дерево и легкие [16]. Нижний отдел респираторного аппарата развивается в конце третьей недели эмбриологического развития как дивертикул вентрального краниального зачатка, из которого затем формируется трахея, бронхиальное дерево и легочные почки. Печень отчетливо дифференцируется на четвертой неделе эмбриогенеза, когда пузырно-печеночный дивертикул поднимается из вентральной части хвостового конца переднего зачатка прямой кишки. Она состоит из энтодермальных клеток, пролиферирующих в поперечной перегородке и дифференцирующихся в гепатоциты, которые формируют трабекулы. Поперечная перегородка соответствует участку мезодермы, локализующемуся между перикардиальной полостью и пупочно-кишечным протоком, который участвует в разделении грудной и брюшной полостей. Это разделение является неполным, в результате чего возникают плевро-перитонеальные каналы, позволяющие расти легочным зачаткам. Закрытие плевроперитонеальных каналов происходит на 8-й неделе в результате слияния плевроперитонеальной мембраны с поперечной перегородкой. Аномальное бронхиолярное почкование может появляться в процессе формирования бронхиол. Зачатки бронхиол могут мигрировать из грудной полости в брюшную полость через плевро-перитонеальный канал до его закрытия. Этот аномальный бронхиолярный бутон может быть включен в поперечную перегородку, а затем окружен энтодермальными клетками печеночного дивертикула [17]. Первоначально левая печеночная доля является основной частью печени. Ремоделирование печени происходит в течение 6-8 недель эмбриогенеза. Правая доля растет, левая подвергается периферической регрессии после девятой недели. Это может объяснить преимущественную локализацию РППК в левой доле печени [16-18]. На десятой неделе цилиндрический эпителий, образующий бронхиальную почку, связанную с трахеобронхиальным деревом, может быть замещен респираторным эпителием с реснитчатыми клетками, слизистыми клетками, эндокринными клетками и клетками Клара.
Заключение . Таким образом, морфологическое исследование позволило выявить особенности структуры непаразитарных кист печени. Для солитарных кист характерна выстилка однослойным кубическим, цилиндрическим или многослойным эпителием, наличие собственной пластинки слизистой и фиброзная капсула, незрелые билиарные структуры, сосуды с признаками интимальной и медиальной дисплазии, островки гепатоцитов в капсуле. Наряду с солитарными кистами типичного строения встречаются реснитчатые передне-кишечные печеночные кисты, которые развиваются из переднего отдела первичной кишечной трубки, в то время как солитарные кисты являются производными среднего отдела первичной кишки, что объясняет различия в их строении. Миграция формирующихся зачатков бронхиол из краниального отдела первичной средней кишки во время 4-6 недель эмбриогенеза в печеночный дивертикул обуславливает наличие всех компонентов стенки полого органа - цилиндрического мерцательного эпителия, рыхлой соединительной ткани, пучков гладкомышечных волокон. Простые солитарные кисты и поликистоз являются результатом нарушения процессов ремоделирования дуктальной пластики, являясь, таким образом, аномалией развития среднего отдела первичной кишки. При морфологическом исследовании прилежащей к стенкам кист ткани печени обнаруживаются признаки дизэмбриогенеза, персистенция элементов дуктальной пластинки в виде тяжей и комплексов билиарного эпителия, интимальная и медиальная дисплазия сосудов, фокусы дуктопении, комплексы фон Мейенбурга.
Список литературы Морфогенез непаразитарных кист печени
- McLennan MT. Bosman FT, Carneiro F, Hruban RH, Theise ND. et al., editors. WHO Classification of Tumors of the Digestive System. IARC: Lyon, France, 2010.- 417pp.
- Glushkov NN, Skorodumov AV, Pakhmutova YUA. Vozmozhnosti ul’trasonografii v diagnostike i lechenii neparazitarnykh kist i abstsessov pecheni. Vestnik khirurgii im. I.I. Grekova. 2009;168:76-78.
- Kotel’nikova LP, Freynd GG, Belyakova YAV. Morfologicheskiye kharakteristiki neparazitarnykh kist i polikistoza pecheni, obosnovaniye ikh deepitelizatsii etilovym spirtom. Meditsinskiy al’manakh. 2014;33(3):136-139.
- Zarivchatskiy MF, Pirozhnikov OYU, Golovanenko AV, Gavrilov OV. Lecheniye bol’nykh s neparazitarnymi kistami pecheni. Ann. khir. gepatologii. 2008;13(4):71-75.
- Zarivchatskiy MF, Pirozhnikov OYU, Golovanenko AV, Gavrilov OV. Printsipy lecheniya neparazitarnykh kist pecheni. Vestnik khirurgii. 2006;165(4):31-33.
- Dadayev SHA, Tashmukhamedov RS, Akhmedov AI, Kim VP, Babakhanov BB. Maloinvazivnoye drenirovaniye i lecheniye kist i abstsessov gepatopankreaticheskoy zony pod kontrolem UZI i KT. Ann khir gepatologii. 2005;10:188.
- SHalimov AA, SHalimov SA, Nechitaylo ME. KHirurgiya pecheni i zhelchevyvodyashchikh putey. Kijev: Kijev, 1993.- 415s.
- Russo P. Liver including tumors, gallbladder, and biliary tree. In: Gilbert-Barnes E, editor. Potter's pathology of the fetus, infant and child. Salt Lake City (Utah): Mosby Elsevier; 2007:1207-68.
- Ambe C, Gonzalea-Cuyar L, Farooqui S, Hanna N, Cunningham SC. Ciliated hepatic foregut cyst: 103 cases in the world literature. Open J of Pathol. 2012;2:45-49.
- Hirata M, Ishida H, Konno K, Nishiura S. Ciliated hepatic foregut cyst: case report with an emphasis on US findings. Abdom Imaging. 2001;26:594-596.
- Khoddami M, Aghdam MK, Alvandimanesh A. Ciliated hepatic foregut cyst: two case reports in children and review of the literature. Case reports in Medicine. 2013. https://doi.org/10.1155/2013/372017
- Zaydfudim V, Rosen MJ, Gillis LA, et al. Ciliated hepatic foregut cysts in children. Pediatr Surg Int. 2010;26:753-757.
- Sharma S, Dean AG, Corn A, et al. Ciliated hepatic foregut cyst: an incresingly diagnosed condition. Hepatobilliary Pancreat Dis Int. 2008;7:581-589.
- Gray SW, Skandalalds JE. Embryology for Surgeons. In book: Gray SW, Skandalalds JE. The Embryologic Basis for the Treatment of Congenital Defects. Philadelphia: W.B. Saunders Company, 1972.- P. 217-383.
- Arbona JL, Figueroaa Fazzi JG, Mayoral J. Congenital esophageal cysts: case report and review of literature. Am J Gastroenterol. 1984;79:177-182.
- Shaw JM, Krige JEJ, Beningfield SJ, Locketz ML. Ciliated hepatic foregut cyst: a rare cystic liver lesion. J Gastrointest Surg. 2008;12:1304-1305.
- Sumiyoshi K, Shimizu S, Enjoji M. Bronchogenic cyst in the abdomen. Virchows Arch. 1985;408:93-98.
- Chatelain D, Chailley-Heu B, Terris B, Molas G, Caе AL, et al. The ciliated hepatic foregut cyst, an unusual brochiolar foregut malformation: a histological, histochemical, and immunohistochemical study of 7 cases. Human Pathol. 2000;31:241-246.


