Морфокинетика клеточных популяций мезентериальных лимфатических узлов под влиянием золотых наночастиц в эксперименте
Автор: Злобина Ольга Вячеславовна, Бугаева Ирина Олеговна, Маслякова Галина Никифоровна, Фирсова Светлана Сергеевна, Бучарская Алла Борисовна, Хлебцов Николай Григорьевич, Хлебцов Борис Николаевич, Дыкман Лев Абрамович
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.7, 2011 года.
Бесплатный доступ
Цель: исследование влияния золотых наночастиц разного размера (1-3 нм, 15 нм и 50 нм) на морфокинетику клеточных популяций мезентериальных лимфатических узлов здоровых лабораторных животных. Методы: эксперимент проведен на 24 белых беспородных крысах, разделенных на 4 группы. Животные в каждой группе получали перорально в течение 15 дней золотые наночастицы по соответствующей схеме. Результаты: установлено, что пероральное введение золотых наночастиц приводит к изменению морфокинетики клеточных популяций мезентериальных лимфатических узлов. Заключение: морфологические перестройки в мезентериальных лимфатических узлах свидетельствуют об активации процессов миграции, пролиферации и дифференцировки иммунокомпетентных клеток, что предполагает наличие иммуномодулирующего действия золотых наночастиц.
Золотые наночастицы, клеточные популяции, мезентеральные лимфатические узлы
Короткий адрес: https://sciup.org/14917309
IDR: 14917309
Текст научной статьи Морфокинетика клеточных популяций мезентериальных лимфатических узлов под влиянием золотых наночастиц в эксперименте
Адрес: 410012, г. Саратов, ул. Б. Казачья, 112.
Тел.: 669751.
доставки лекарственных веществ, генетического материала, антигенов и как собственно лекарственное или диагностическое средство при терапии опухолей или ревматоидного артрита [4]. Два препарата для внутривенного введения — AurImmune™ и AuroLase™ — прошли уже клинические испытания [5]. Опубликован также обширный материал по клиническим испытаниям препарата Aurasol® в виде таблеток для лечения тяжелых форм ревматоидного артрита [4].
Практически синхронно с началом медицинских применений ЗНЧ возникли острые вопросы по по- воду их биораспределения, циркуляции в кровяном русле, фармакокинетики и выведения из организма, а также возможной токсичности на уровне целого организма или на уровне цито- и генотоксичности. Опасения по поводу возможных последствий применения наночастиц отнюдь не беспочвенны. Например, в 1930–1950-х годах 3–10 нм частицы диоксида тория широко применялись в качестве контрастирующего агента («thorotrast») в радиографии. Однако позже было установлено [5], что эти частицы могут накапливаться и оставаться в организме десятилетиями, вызывая нежелательные радиационные эффекты. Недавно появились публикации о токсичности ультрамалых ЗНЧ (порядка 1,5 нм) и о значительном накоплении ЗНЧ в печени и селезенке животных при очень медленной кинетике их выведения. Для золотых наностержней исходным стабилизатором являются молекулы цетилтриметиламмонийбромида (ЦТАБ) [6], который сам по себе в свободном состоянии является известным токсичным ПАВ.
К настоящему моменту установлено, что биологические и токсические действия наноматериалов зависят от нескольких показателей, критическим из которых является размер и форма частиц, поверхностная функционализация, доза и способы введения и т.д. [4, 5, 7, 8]. Проведенный нами скрининг литературных данных [4, 5] показал, что резкий взрыв активности исследований в области биораспределения и токсичности ЗНЧ приходится на последние 3–4 года. Поскольку многие группы начали свои проекты независимо, наблюдается большой разброс в дизайне эксперимента, включая размер и форму частиц, способы функционализации, типы животных, дозы и способ введения частиц и т.д. Соответственно, наблюдается большой разброс данных и выводов по уровням и кинетике биораспределения и по оценкам токсичности. Поэтому имеется настоятельная необходимость в продолжении исследований, связанных с оценками размерных эффектов наночастиц в биораспределении по органам и их воздействии на организм человека и животных, в частности на иммунную систему.
Целью работы явилось комплексное изучение морфокинетики мезентериальных лимфатических узлов здоровых экспериментальных животных при пероральном введении ЗНЧ в эксперименте.
Методы. В эксперименте использовали ЗНЧ, синтезированные в лаборатории нанобиотехнологии ИБФРМ РАН (г. Саратов): частицы коллоидного золота диаметром 15 и 50 нм с числовой концентрацией 1.3х1012 шт/мл и 3.5х1010 шт/мл соответственно (концентрация золота 57 мкг/мл). Средний размер ЗНЧ определяли по электронно-микроскопическим изображениям на микроскопе Libra-120 (Carl Zeiss, Jena, Germany). Наночастицы коллоидного золота с размером 15 и 50 нм синтезировали цитратным методом Фрэнса путем восстановления золотохлористоводородной кислоты (HAuCl4, Sigma-Aldrich, USA) цитратом натрия. Наиболее мелкие частицы 1–3 нм получали по специальным методикам [3].
Для увеличения биодоступности и биосовместимости наночастицы были конъюгированы с полиэтиленгликолем PEG-SH (Nektar, USA). Протокол конъю-гирования состоял в следующем. К 50 мл суспензии наночастиц (наносфер или нанооболочек) добавляли 45 мкл 0,2 М поташа и 500 мкл 5 мМ метилполиэти-ленгликольтиола. В результате ковалентного связывания тиол-групп с поверхностью золотой оболочки образуется конъюгат. Время реакции составляет при- мерно 10 часов. Полученные конъюгаты отмывали от избытка продуктов реакции двукратным центрифугированием и ресуспендированием в 0,9%-ном растворе хлорида натрия.
Эксперимент проведен на 24 белых беспородных крысах мужского пола массой 180–220 г. Животные во время эксперимента содержались в стандартных условиях вивария на обычном пищевом рационе. Для устранения влияния сезонной циркадной зависимости эксперименты проводились в осенне-зимний период во второй половине дня. Все животные при проведении эксперимента находились в одинаковых условиях. Опыты проводились в отдельной лаборатории при постоянной температуре со стандартным уровнем освещения, исключающим посторонние раздражители. Эксперименты на животных проводились в соответствии с Женевской конвенцией «International Guiding principles for Biomedical Research Involving Animals» (Geneva, 1990).
Исследование проведено на четырех группах животных, в каждой группе по 6 особей. Первая группа — контрольная, вторая, третья и четвертая группы — опытные. Крысам опытных групп ЗНЧ вводили перорально через день из расчета 190 мкг/кг массы животного в течение 15 дней по следующей схеме: первая опытная группа — диаметр ЗНЧ 1–3 нм, вторая опытная группа — диаметр ЗНЧ 15 нм, третья опытная группа — диаметр 50 нм. Крысам контрольной группы вводили через день перорально по 1 мл физиологического раствора. Забор материала осуществляли через 24 часа после последнего введения.
Для гистологического исследования мезентериальные лимфатические узлы фиксировали в 10%-ном забуференном формалине. После стандартной гистологической проводки (ацетон-ксилол) материал заливали в парафин. Серийные срезы лимфатических узлов толщиной 5–7 мкм окрашивали гематоксилином и эозином.
Подсчет клеточных элементов (малых, средних, больших лимфоцитов, плазмоцитов, иммунобластов и фигур митоза) проводили в различных функциональных зонах лимфатического узла стандартным методом при увеличении ×100, ×400, × 1000 с использованием морфометрической программы Bio Vision в 10 полях зрения на условные единицы площади (6400 мкм). Фотосъемка гистологических препаратов проводилась с помощью цифровой фотокамеры SCOPETEK DCM. Для статистической обработки полученных результатов использовалась программа Statistica 6,0. Все цифровые показатели обрабатывались методами вариационной статистики. Для изучаемых параметров определяли минимальные и максимальные значения средней арифметической (М) и отклонение средней арифметической (m), среднее квадратическое отклонение (õ). Достоверность различий между средними определяли по t-критерию Стьюдента.
Результаты. Являясь органами иммуногенеза, лимфатические узлы содержат иммунокомпетентные клетки, находящиеся на различных этапах дифференцировки. Эти органы становятся участниками адаптационных реакций организма в ответ на воздействие самых разнообразных факторов. Нами были проведены исследования, в которых мы попытались проанализировать морфологические изменения, возникающие в лимфатических узлах.
Контрольные эксперименты показали, что распределение различных типов клеток в разных зонах лимфоузлов неоднородно. Лимфатические фолликулы кортикальной зоны не содержат светлых центров, в них преобладают малые лимфоциты, значительно меньше обнаруживается средних лимфоцитов, очень мало иммунобластов и практически отсутствуют большие лимфоциты, плазмоциты и тучные клетки. В паракортикальной зоне преобладающими клеточными элементами также являются малые лимфоциты, в 5 раз меньше содержится средних лимфоцитов, редко встречаются большие лимфоциты и плазмоциты и практически отсутствуют иммунобласты и тучные клетки. В мозговых тяжах преобладают малые лимфоциты, однако их абсолютное количество в 3 раза ниже, чем в лимфатических фолликулах и паракор-тикальной зоне. Часто встречаются средние лимфоциты и плазмоциты и лишь в небольшом количестве присутствуют большие лимфоциты, иммунобласты и тучные клетки.
При морфометрическом анализе клеточных популяций различных функциональных зон мезентериальных лимфатических узлов после введения ЗНЧ размером 1–3 нм в течение 15 дней достоверных различий с группой контроля не выявлено. Количество малых лимфоцитов в лимфатических фолликулах и паракортикальной зоне cоставило 62,3±1,6 и 61,2±1,2 соответственно (при контроле 64,2±2,1 и 60,1±1,2 соответственно). Количество средних лимфоцитов в лимфатических фолликулах и пара-кортикальной зоне составило 16,6±1,2 и 14,3±0,8 соответственно (при контроле 18,2±0,4 и 12,1±1,1 соответственно). Количество больших лимфоцитов в лимфатических фолликулах и паракортикальной зоне составило 0,5±0,01 и 0,67±0,1 соответственно (при контроле 0 и 0,75±0,1 соответственно). В зоне мозговых тяжей количество малых лимфоцитов составило 18,3±1,0; средних лимфоцитов 10,4±1,0; плазмоцитов 17,9±1,2; иммунобластов 2,0±0,3 (при контроле 20,2±1,3; 10,2±1,7; 15,3±0,6; 2,3±0,3 соответственно).
В корковом веществе лимфатических фолликулов при изучении морфокинетики клеточных элементов после введения ЗНЧ размером 15 и 50 нм были обнаружены изменения соотношения первичных и вторичных фолликулов, что косвенно свидетельствует об активизации лимфоцитопоэза. При гистологическом исследовании морфокинетики клеточных популяций в этой зоне было обнаружено увеличение количества малых (при 15 нм 71,2±1,2; при 50 нм 83,3±1,7, р<0,01), средних лимфоцитов (при 15 нм 30,1±2,1, при 50 нм 35,3±1,0, р»0,01), иммунобластов (при 15 нм — 4,8±0,3, при 50 нм 10,4±0,3, р<0,01) по сравнению с группой контроля (малые лимфоциты 64,2±2,1, средние лимфоциты 18,2±0,4, иммунобласты 2,5±0,3) (рис. 1).
В паракортикальной зоне мезентериальных лимфатических узлов отмечалось увеличение количества малых лимфоцитов (при 15 нм 66,2±1,1, при 50 нм 72,4±1,1, р<0,05), средних лимфоцитов (при 15 нм 30,1±2,1, при 50 нм 35,3±1,0), иммунобластов (при 15 нм 0,7±0,1, при 50 нм 2,9±0,1) по сравнению с группой контроля (малые лимфоциты 60,1±1,2, средние лимфоциты 12,1±1,1).
В зоне мозговых тяжей мезентериальных лимфатических узлов отмечалось увеличение количества плазмоцитов (при 15 нм 26,4±3,4, при 50 нм 38,4±3,4, р<0,01) по сравнению с группой контроля (15,3±0,6).
Во всех функциональных зонах было обнаружено увеличение количества фигур митоза, особенно в зоне лимфатических фолликулов (при 15 нм 4, 0±0,3, при 50 нм 4,6±0,07,) по сравнению с группой контроля (0,2±0,01) р<0,01 (рис. 2).
Морфокинетика клеточных элементов мезентериальных лимфатических узлов после введения ЗНЧ в течение 15 дней характеризовалась активацией лимфоцитопоэза и носила размерно-зависимый характер, наиболее яркие изменения отмечались при введении ЗНЧ размером 15 и 50 нм.
Обсуждение. Сведений о влиянии ЗНЧ на пролиферативную активность лимфоцитов крайне мало. Известно, в частности, что инъекционное введение лабораторным животным коллоидного золота может приводить к его накоплению в ретикулярных клетках лимфоидной ткани, активации клеточного и гуморального иммунитета [9, 10]. Интересным является установленный факт размерной зависимости цитотоксичности ЗНЧ — была показана выраженная цитотоксичность лишь для частиц диаметром 1,4 нм, но не для частиц диаметром 15 нм [5].
В работах [9, 10] исследовались свойства ЗНЧ для доставки антигенов in vivo и было выявлено, что ЗНЧ увеличивают фагоцитарную активность макрофагов и вызывают функционализацию лимфоцитов, что, вероятно, обусловливает иммуномодулирующий эффект ЗНЧ [10].
Анализируя полученные результаты, можно отметить, что динамические изменения выражались в увеличении количества малых лимфоцитов в
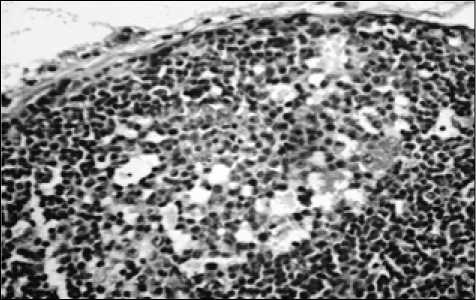
Рис. 1. Реактивный центр лимфатического фолликула коркового вещества лимфатических узлов при пероральном введении наночастиц золота размером 50 нм
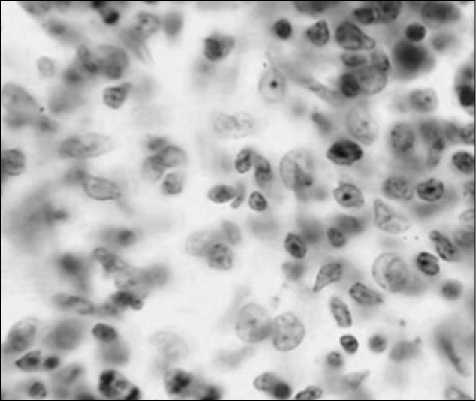
Рис. 2. Фигуры митоза в паракортикальной зоне лимфатических узлов при введении наночастиц золота размером 50 нм лимфоидных фолликулах и паракортикальной зоне лимфоузлов. На гистологических препаратах увеличивается площадь паракортикальной зоны лимфоузлов. В эти сроки экспериментального исследования зафиксированы признаки усиления пролиферативной активности лимфоидных клеток. Косвенным подтверждением этого является увеличение содержания клеток с фигурами митоза, которое в разной степени нашло свое отражение в герминативных центрах лимфоидных фолликулов, паракортикальной зоне и в мозговых тяжах.
В лимфатических узлах экспериментальных животных отмечаются признаки усиления процессов дифференцировки и созревания клеточных элементов. Это выражается в повышении количества иммунобластов и больших лимфоцитов в структурных зонах лимфатических узлов. Отчетливой является и динамика содержания клеток плазмоцитарного ростка, наиболее заметная в мозговых тяжах.
Описанная кинетика клеточных популяций лимфоузлов вполне согласуется с литературными данными о цитологических и функциональных перестройках периферических органов иммуногенеза под влиянием различных воздействий. Динамика малых, средних, больших лимфоцитов и иммунобластов в структурных зонах лимфатических узлов служит морфологическим подтверждением активации процессов миграции, пролиферации и дифференцировки иммунокомпетентных клеток.
Таким образом, выявленные изменения количественных соотношений клеточных компонентов лимфоузлов после введения ЗНЧ указывают на вполне определенную и отчетливую тенденцию к развитию процессов пролиферации и дифференцировки лимфоцитов, что дает основание для предположения о стимулирующем влиянии ЗНЧ размером 15 нм и особенно 50 нм на иммунокомпетентные клетки лимфатических узлов.
Заключение. Резюмируя изложенные данные, можно прийти к заключению, что пероральное введение ЗНЧ размером 15 нм и 50 нм в течение 15 дней приводит к изменению морфокинетики клеточных популяций мезентериальных лимфатических узлов. Морфологические перестройки в мезентериальных лимфатических узлах свидетельствуют об активации процессов миграции, пролиферации и дифференцировки иммунокомпетентных клеток, что предполагает наличие иммуномодулирующего действия ЗНЧ.
Список литературы Морфокинетика клеточных популяций мезентериальных лимфатических узлов под влиянием золотых наночастиц в эксперименте
- Jain К. К., Totowa N.J. A Handbook of Nanomedicine. Humana: Springer, 2008. 251 p.
- Boisselier E., Astruc D. Gold nanoparticles in nanomedicine: preparations, imaging, diagnostics, therapies and toxicity//Chem. Rev. 2009. Vol. 38. P. 1759-1782.
- Дыкман Л.А., Богатырев В.А., Щеголев С Ю., Хлеб-цов Н.Г. Золотые наночастицы: синтез, свойства, биомедицинское применение. М.: Наука, 2008. 319 с.
- Khlebtsov N.G., Dykman L.A. Biodistribution and toxicity of engineered gold nanoparticles: a review of in vitro and in vivo studies//Chem.Soc. Rev. 2011. 18 c DOI: 10.1039/c0cs000
- Хлебцов Н.Г, Дыкман Л.А. Биораспределение и токсичность золотых наночастиц//Российские нанотехнологии. 2011. Т. 6, №1-2. С. 1-21.
- Khlebtsov N.G., Dykman L.A. Optical properties and biomedical applications of plasmonic nanoparticles//J. Quant. Spectr. Radiat. Transfer. 2010. Vol. 111. P. 1-35.
- Yen H.-J., Hsu S.-H., Tsai Ch.-L. Cytotoxicity and immunological response of gold and silver nanoparticles of different sizes//Small. 2009. Vol.5. P. 1553-1561.
- Alkilany A.M. Murphy C.J. Toxicity and cellular uptake of gold nanoparticles: what we have learned so far?//J. Nanopart. Res. 2010. Vol. 12. P. 2313-2333.
- Effect of gold nanoparticles on the respiratory activity of peritoneal macrophages/Staroverov S.A., Aksinenko N.M., Gabalov K. P. [et al.]//Gold Bulletin. 2009. Vol. 42, № 2. P. 153-156.
- Dykman L.A., Staroverov S.A., Bogatyrev V.A., Shchyogolev S. Yu. Gold Nanoparticles as an Antigen Carrier and an Adjuvant. N. Y: Nova Publ., 2010. 54 c.


