Морфологическая характеристика пренатального потомства облученных электронами дозой 2 Грея и получавших обогащенную тромбоцитами плазму крыс-самцов
Автор: Демяшкин Григорий Александрович, Цибулевский Александр Юрьевич, Недорубов Андрей Анатольевич, Ивченко Юлия Валерьевна, Щекин Владимр Иванович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.30, 2022 года.
Бесплатный доступ
Одним из наиболее опасных влияний радиации на здоровье является расстройство репродуктивной функции, зачастую приводящее к бесплодию. Имеющиеся исследования по изучению воздействия излучения на сперматогенез и фертильность не рассматривали возможности применения восстановительной терапии. Одним из современных методов лечения бесплодия является введение аутологичной плазмы крови с повышенным содержанием тромбоцитов и нативных факторов роста. В настоящее время работы по исследованию потомства, полученного при применении этого метода лечения бесплодия и оценке его тератогенности отсутствуют. Цель исследования: морфологическое исследование потомства от крыс-самцов, облученных электронами в дозе 2 Гр и получавших обогащенную тромбоцитами плазму. Самцов крыс породы Wistar (n=35) однократно подвергали прицельному ионизирующему облучению на импульсном ускорителе электронов «NOVAC-11» дозой 2 Гр. Половине (n=15) из облученных животных в течение 12 недель вводили обогащенную тромбоцитами плазму и инсулиноподобный фактор роста-1, после чего самцов обеих групп подсаживали к интактным самкам (n=30) для получения потомства. Состояние развивающегося потомства оценивали путем морфологического анализа после выведения беременных самок из опыта на 20 сутки пренатального развития. Беременность наблюдалась только у самок, оплодотворенных самцами контрольной группы, и самцами, получавшими лечение обогащенной тромбоцитами плазмой. Использовались классические гистологические методы и рентгеновская компьютерная микротомография. В результате исследования установлено, что потомство контрольной и опытной групп макроскопически не отличались, при световой микроскопии существенных изменений их гистологического строения не выявлено. Патоморфологические изменения в развитии потомства самцов опытной группы, получавших обогащенную тромбоцитами плазму после облучения электронами дозой 2 Гр с помощью компьютерной микротомографии также не выявлены. Полученные данные свидетельствует об эффективности проведенного обогащенной тромбоцитами плазмой лечения бесплодия облученных животных, а также об отсутствии ее тератогенных эффектов.
Ионизирующее излучение, потомство, крысы-самцы, обогащенная тромбоцитами плазма, тератогенность
Короткий адрес: https://sciup.org/143178621
IDR: 143178621
Текст научной статьи Морфологическая характеристика пренатального потомства облученных электронами дозой 2 Грея и получавших обогащенную тромбоцитами плазму крыс-самцов
Демяшкин Г.А., Цибулевский А.Ю., Недорубов А.А., Ивченко Ю.В., Щекин В.И. Морфологическая характеристика потомства облученных электронами дозой 2 грея и получавших обогащенную тромбоцитами плазму крыс-самцов. Морфологические ведомости. 2021;29(4):614. (4).614
Demyashkin GA, Tsibulevsky AYu, Nedorubov AA, Ivchenko YuV, Shchekin VI. The morphological characteristics of the offspring of male rats irradiated with electrons at a dose of 2 Gy and treatment by platelet-rich plasma. Morfologicheskie Vedomosti – Morphological Newsletter. 2021;29(4):614. (4):614
Введение. Одним из факторов, приводящим к нарушению репродуктивной функции, вплоть до бесплодия, является облучение. Действие ионизирующего излучения на мужские половые клетки, обладающие высокой радиочувствительностью, вызывает интерес у многих исследователей [1-5]. Экспериментальные исследования на животных являются одним из способов, помогающих получить достоверную информацию. Нарушение сперматогенеза отмечено даже после облучения низкими дозами (0,15–0,25 Гр), которое характеризуется появлением признаков окислительного стресса, дистрофическими изменениями семенных канальцев, снижением количества гамет и необратимым нарушением их внутриклеточного гомеостаза [6-7]. Более высокие дозы приводят к азооспермии продолжительностью от 8 месяцев до 2 лет [8-9]. Определенный интерес вызывают вопросы, связанные с воздействием облучения на будущее потомство. Было показано, что однократное общее γ-облучение самцов крыс Wistar в не стерилизующих дозах (0,5; 1,0; 1,5 Гр), в результате которого их половые клетки, находящиеся на разных стадиях сперматогенеза, получают одну из указанных доз радиации, приводит к нарушениям в анте- и раннем постнатальном развитии потомства [10-11]. В то же время отсутствуют литературные данные о потомстве, рожденном от родителей после воздействия различных видов облучения и коррекции его последствий. С каждым годом совершенствуются методы лечения бесплодия. Одним из современных является введение аутологичной плазмы крови с повышенным содержанием тромбоцитов (Platelet Rich Plasma, PRP) и нативных факторов роста [12-17]. В настоящее время работы по исследованию потомства, полученного при применении этого препарата, а также по оценке его тератогенности отсутствуют.
Цель исследования: морфологический макроскопический и микроскопический анализ потомства, полученного от крыс-самцов, облученных электронами в дозе 2 Гр, которым впоследствии вводился препарат аутологичной плазмы, обогащенной тромбоцитами и бедной лейкоцитами.
Материалы и методы исследования. Все манипуляции с животными осуществлялись согласно «Международным рекомендациям по проведению медикобиологических исследований с использованием животных» (ЕЭС, Страсбург, 1985), «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (ЕЭС, Страсбург, 1986), Руководствам по проведению медико-биологических исследований по уходу и использованию лабораторных животных (ILAR, DELS), Правилам надлежащей лабораторной практики и приказу Министерства здравоохранения РФ № 199н от 01.04.2016 «Об утверждении правил лабораторной практики», исследования также были разрешены локальным этическим комитетом.
Самцы крыс Wistar массой 270±20 грамм в возрасте 9–10 недель (n=35), содержащиеся в виварии, предварительно были случайным образом разделены на контрольную (I, n=5) и две опытные (II, n=15; III, n=15) группы. Животных II и III группы подвергали прицельному облучению в дозе 2 Гр импульсным ускорителем электронов «NOVAC-11» мощностью излучения 10 МэВ с частотой 9 Гц и диаметром поля облучения 100 мм. Затем самцам опытной III группы вводили плазму, обогащенную тромбоцитами и бедную лейкоцитами (далее - LP-PRP) в дозе 200 мкл/кг 1 раз в неделю в течение 12 недель в суммарной дозе 2400 мкл/кг и инсулиноподобный фактор роста-1 (далее IGF-1) в виде препарата рекомбинантного IGF-1 (препарат rhIGF-1, Sigma Aldrich, USA) в дозе 2 мг/кг 1 раз в неделю, также в течение 12 недель. Животным I и II групп в это же время вводили физиологический раствор (0,9% раствор NaCl, 33,6 мл/кг, 1 раз в неделю в течение 12 недель в суммарной дозе 403,2 мл/кг).
После этого самцов всех трех групп подсаживали в клетки к интактным самкам в соотношении животных 1:2 в фазе позднего проэструса, которая определялась по вагинальным мазкам. Первым днем беременности считали день обнаружения сперматозоидов в вагинальном мазке. Через неделю отмечали признаки наступления беременности у крыс I и III групп (прекращение течки, увеличение веса, набухание сосков). У самок I и III групп сначала наблюдалось изменение поведения, животные становились более спокойными, снижалась их подвижность, появлялась избирательность в еде. На поздних сроках беременности отмечали развитие более агрессивного поведения одновременно с началом строительства гнезд для будущего потомства.
Самок выводили из эксперимента путем введения высоких доз анестетика. После эвтаназии на 20 сутки беременности удаляли и вскрывали матку, подсчитывали количество живых, мертвых и резорбированных плодов, затем плоды разделялись и проводился их морфологический анализ. После разделения плоды взвешивали, измеряли краниокаудальный и общий размер, диаметр плаценты, оценивали их внешний вид, состояние костной системы и внутренних органов для регистрация возможных аномалий. Затем фиксировали в растворе Буэна, подвергали стандартной проводке, заливали в парафиновые блоки из которых готовили серийные срезы толщиной 3 мкм, срезы депарафинировали, дегидратировали, окрашивали гематокси- лином и эозином. В препаратах отдельные поля зрения визуально анализировали на возможные аномалии развития внутренних органов.
После фиксации, часть потомства также была помещена на 18 часов в 1% раствор йода в 100% спирте с последующем промывании в течение часа в 100% спирте и далее в пластиковую емкость, заполненную 100% спиртом для сканирования. Контрастированные плоды были визуализированы при помощи рентгеновского микротомографа Bruker Skyscan 1276 (Bruker, Бельгия) с напряжением 65 Кв, силой тока 200 мкА и алюминиевым фильтром толщиной 0,5 мм. Была выполнена 1801 проекция с вокселем 10 мкм (воксель - аналог двумерной единицы изображения пикселя для трехмерного, т.е. объемного пространства, иначе - кубический пиксель). Полученные проекции были реконструированы в программе NRecon (Bruker, Бельгия) и экспортированы в виде последовательности изображений в программу ORS Dragonfly (The Objects, Канада) для дальнейшего анализа. Для улучшения качества изображения срезы в двухмерных проекциях были суммированы с подбором оптимальных значений электронного окна.
Результаты исследования и обсуждение. Беременность наблюдалась только у самок, оплодотворенных самцами I и III групп. Различий в численности по-
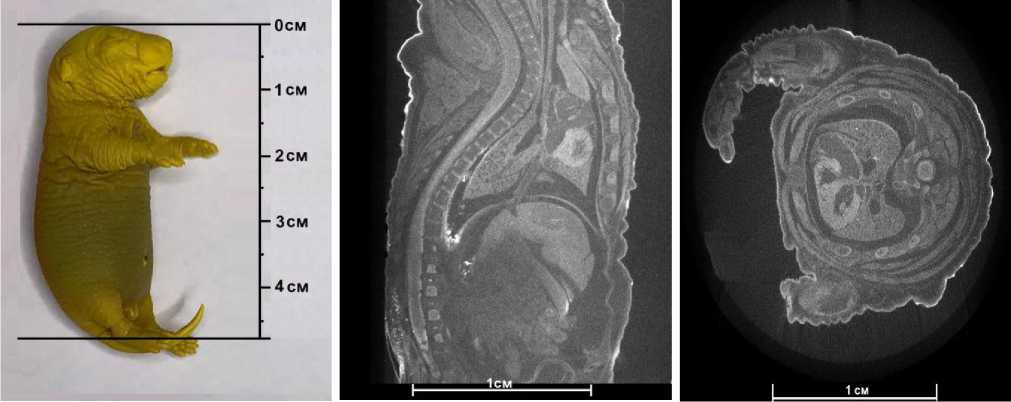
А
Б
В
Рис. 1. Плод крысы, 20 сутки развития, потомок самца III группы. Обозначения: А – внешний вид, Б – компьютерная микротомография в сагиттальной плоскости, В – компьютерная микротомография в горизонтальной плоскости
томства от одной самки, весе, длине тела, диаметре плацент и длине пуповины в сравниваемых I-й и III-й группах не обнаружено (рис. 1-а).
При исследовании потомства с помощью метода компьютерной микротомографии установлено, что строение внутренних органов соответствует физиологическому развитию согласно гестационному сроку. В печени обнаруживаются очаги гемопоэза, обладающие низкой плотностью в сравнении с окружающей их паренхимой, что также является физиологической нормой для срока развития беременности на 20 сутки (рис. 1-б, 1-в).
При световой микроскопии срезов потомства самцов III группы, облученных в дозе 2 Гр и получавших LP-PRP+IGF-1, также наблюдали гистоархитектонику печени одинаковую с образцами контрольной группы (рис. 2). В потомстве обеих групп анатомическое строение внутренних органов соответствовало норме.
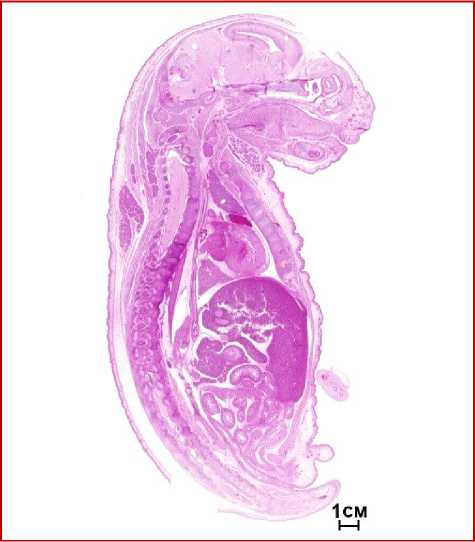
Рис. 2. Плод крысы, 20 сутки развития, потомок самца III группы. Тотальный гистологический препарат (сагиттальная плоскость). Масштаб 1:100. Окр.: гематоксилином и эозином.
Головной мозг состоял из серого (кора и базальные ядра) и белого вещества. Кора серого вещества была представлена шестью слоями различной степени зрело- сти, кора мозжечка – тремя слоями. Спинной мозг снаружи был покрыт твердой, паутинной и мягкой оболочками. В составе глазного яблока были четко различимы три оболочки, наружная фиброзная, средняя сосудистая, и, частично, внутренняя. Слюнные железы содержали ацинусы и выводные протоки. В каждой дольке вилочковой железы различались корковое и мозговое вещества. Стенка трахеи состояла из четырех оболочек, слизистой, подслизистой, фиброзно-хрящевой и адвентициальной. Щитовидная железа была покрыта капсулой из рыхлой волокнистой соединительной ткани, вглубь органа от капсулы отходят прослойки соединительной ткани, которые делят орган на дольки, представленные фолликулами. Сердце было представлено эндокардом, компактным и трабекулярным миокардом и эпикардом. Аорта состояла из внутренней, средней и наружной оболочек. Легкие находились на альвеолярной стадии развития, наблюдались бронхи различного калибра и безвоздушные ацинусы. Пищевод был образован слизистой, подслизистой, мышечной и адвентициальной оболочками, желудок состоял из слизистой, подслизистой, мышечной и серозной оболочек. Гистоархитектоника печени была дольчатой, в ней наблюдались очаги кроветворения, в центре долек различали центральную вену, от которой радиально отходили гепатоциты, образующие балки, чередующиеся с синусоидами, поджелудочная железа была дольчатого строения со сформированными экзокринной и эндокринной частями. Двенадцатиперстная, тощая и подвздошная кишка состояли из слизистой, подслизистой, мышечной и серозной оболочек, также, как и отделы толстой кишки. Селезенка была представлена красной и белой пульпами. В почках обнаружили корковое и мозговое вещество, в хорошо дифференцированном надпочечнике также наблюдали корковое и мозговое вещество, в мочевом пузыре различаются три оболочки, слизистая, мышечная, наружная. Гонады соответствовали физиологической норме и стадии развития. В костях конечностей определялись диафиз и эпифизы с признаками непрямого остеогистогенеза, кож- ный покров был образован эпидермисом и дермой.
В проводившихся ранее экспериментах с использованием однократного гамма-облучения семенников крыс было показано угнетающее влияние ионизирующего излучения на сперматогенез [1, 7, 10, 18-20]. После воздействия в течение трех месяцев β-излучением на семенники самцов II-й опытной группы в настоящем исследовании потомство также получено не было, что свидетельствует о возможных необратимых изменениях сперматогенеза и, как следствие, развитии полной инфер-тильности. В настоящем исследовании была предпринята попытка коррекции такой инфертильности введением препарата LP-PRP. Для этого две опытные группы, II-я и III-я, подверглись однократному прицельному облучению электронами в дозе 2 Гр после чего самцы III-й группы получали лечение препаратом аутологичной плазмы LP-PRP. В результате проведенного пато-морфологического анализа их потомства установлено, что плоды, полученные от контрольной I-й и III-й опытной групп, не имеют между собой существенных различий как на макроскопическом, так и на микроскопическом уровнях, потомство самцов III-й группы по своим показателям соответствуют показателям потомства полученного при физиологически протекающей беременности. Внутриутробная гибель плодов от самцов этой экспериментальной группы также не была выявлена.
Заключение. В целом, в результате исследования можно сделать выводы о том, что полученные данные свидетельствует об эффективности проведенного лечения, а также об отсутствии эмбриотоксичных влияний препарата аутологичной плазмы LP-PRP. На основании результатов описательного патоморфологического анализа можно предположить также высокую эффективность препарата аутологичной плазмы LP-PRP, вероятно оказывающего регенеративное воздействие на сперматогенез у лабораторных крыс.
Список литературы Морфологическая характеристика пренатального потомства облученных электронами дозой 2 Грея и получавших обогащенную тромбоцитами плазму крыс-самцов
- Bansal MR et al. Spermatogenesis and epididymal sperm after scrotal gamma irradiation in adult rats. Reproductive Toxicology. 1990;4(4):321-324. DOI: 10.1016/0890-6238(90)90044-v
- Paulsen CA. The study of radiation effects on the human testis: including histologic, chromosomal and hormonal aspects. Final progress report of AEC contract AT(45-1)-2225, Task Agreement 6. RLO-2225-2, 1973. DOI: 10.1016/j.fertnstert.2013.08.010
- Koruji M, Movahedin M, Mowla SJ et al. The morphological changes of adult mouse testes after 60Co gamma-Radiation. Iran Biomed J. 2008;12(1):35-42
- Marzban M, Anjamshoa M, Jafari P et al. Effects of gamma rays on rat testis tissue according to the morphological parameters and immunohistochemistry: radioprotective role of silymarin. Electron Physi-cian. 2017;9(6):4524-4532
- Meistrich ML. Effects of chemotherapy and radiotherapy on spermatogenesis. Eur Urol. 1993;23:41-136
- Brown SO. Effects of continuous low intensity radiation on successive generations of the albino rat. Ge-netics. 1964;50(5):1101
- Hanafi N. Low doses of gamma radiation may impair testicular tissue in a rat treated CCl4 model: role of BM transplantation. J Biological Sciences. 2012;12(3):128-137. DOI: 10.3923/jbs.2012.128.137
- Abuelhija M et al. Rat models of post‐irradiation recovery of spermatogenesis: interstrain differences. Andrology. 2013;1(2):206-215. DOI: 10.1111/j.2047-2927.2012.00034.x
- Clifton DK, Bremner WJ. The effect of testicular X‐irradiation on spermatogenesis in man: A comparison with the mouse. Journal of andrology. 1983;4(6):387-392. DOI: 10.1002/j.1939-4640.1983.tb00765.x
- Palyga GF i dr. Realizatsiya luchevykh effektov v ontogeneze potomstva dvukh pokoleny samtsov, polo-vye kletki kotorykh oblucheny odnokratno v nesterilizuyushchikh dozakh na stadii zrelykh spermatozo-idov. Radiaciya i risk (Bulleten' Natsional'nogo radiatsionno-epidemiologicheskogo registra). 2010;19(4). In Russian
- Dergilev AA, Chibisova OF, Palyga GF I dr. Vliyanie ioniziruyushchey radiatsii v nesterilizuyushchikh dozakh na embriogenez i postnatal''noe razvitie potomstva dvukh pokoleniy samtsov krys, polovye kletki kotorykh oblucheny na premeyoticheskikh stadiyakh spermatogeneza. Radiatsiya i risk. 2012;21(2):39-45. In Russian
- Palyga GF, Chibisova OF, Ivanov VL. Posledstviya dlya reproduktivnoy funktsii odnokratnogo oblu-cheniya v nesterilizuyushchey doze antenatal'nykh i polovozrelykh yaichnikov krys Vistar. Radiatsiya i risk (Bulleten' Natsional'nogo raditscionno-epidemiologicheskogo registra). 2008;17(3). In Russian
- Marx RE. Platelet-rich plasma (PRP): what is PRP and what is not PRP? Implant dentistry. 2001;10(4):225-228. DOI: 10.1097/00008505-200110000-00002
- Al-Nasser R, Khrait Z, Jamali S. The Effectiveness of Autologous Platelet-Rich Plasma (PRP) in the Therapy of Infertile Men with Non-Abstractive Azoospermia. J Reprod Med Gynecol Obstet. 2018;3(11). DOI:10.24966/RMGO-2574/100011
- Bader R, Ibrahim J, Moussa M et al. In vitro effect of autologous platelet-rich plasma on H2O2-induced oxidative stress in human spermatozoa. Andrology. 2019;8(1):191-200
- Griffeth RJ, Bianda V, Nef S. The emerging role of insulin-like growth factors in testis development and function. Basic Clin Androl. 2014;24(12). DOI: 10.1186/2051-4190-24-12
- Yao J, Zuo H, Gao J et al. The effects of IGF-1 on mouse spermatogenesis using an organ culture method. Biochem Biophys Res Commun. 2017;491(3):840-847. DOI: 10.1016/j.bbrc.2017.05.125
- Demyashkin GA. Vliyanie faktorov rosta na spermatogenez posle pritsel''nogo oblucheniya semennikov krys elektronami v doze 8 grey. Vestnik volgogradskogo gosudarstvennogo meditsinskogo universiteta. 2021;78(2):52-55. In Russian. DOI: 10.19163/1994-9480-2021-2(78)-52-55
- Khan S, Adhikari JS, Rizvi MA, Chaudhury NK. Radioprotective potential of melatonin against 60Co γ-ray-induced testicular injury in male C57BL/6 mice. J Biomed Sci. 2015;22(61). DOI: 10.1186/s12929-015-0156-9
- Jiang Z, Xu B, Yang M et al. Protection by Hydrogen Against Gamma Ray ‐Induced Testicular Damage in Rats. Basic Clin Pharmacol Toxic. 2012;113(3):186-191


