Морфологическая структура печени и ее функциональное состояние при лекарственном поражении и лечении новой фармацевтической композицией
Автор: Морозов Михаил Александрович, Блинова Екатерина Валериевна, Овсепян Жан Артемикович, Дыдыкин Сергей Сергеевич, Блинов Дмитрий Сергеевич, Горшков Всеволод Александрович, Пронина Екатерина Николаевна, Балашов Владимир Павлович, Семелева Е.В., Степанова Анжелика Андреевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.26, 2018 года.
Бесплатный доступ
В работе представлены результаты исследования функциональной активности и описания морфологической структуры печени при экспериментальном моделировании лекарственного гепатита путем двукратного введения парацетамола в дозе 1000 мг/кг белым нелинейным крысам обоего пола на фоне профилактического введения фармацевтической композиции с лабораторным шифром ЛХТ-8-16. Исследуемое вещество вводили животным внутрижелудочно за 1 час до введения гепатотоксина. Изучены изменения биохимических показателей крови, характеризующие функциональную активность печени, оценена её гистологическая картина, а также проведена макро- и микроморфометрия органа. Показано, что вещество ЛХТ-8-16 предотвращает токсическое действие парацетамола на функциональную активность печени, что проявляется в снижении активности парацетамол-индуцированного цитолитического и холестатического синдромов, нормализации уровня общего билирубина в плазме крови животных. Внешний вид печени, её относительная и абсолютная масса у животных с лекарственным гепатитом, получавших ЛХТ-8-16, была сопоставима с интактными крысами...
Морфология печени, лекарственный гепатит, парацетамол, препарат лхт-8-16
Короткий адрес: https://sciup.org/143177243
IDR: 143177243
Текст научной статьи Морфологическая структура печени и ее функциональное состояние при лекарственном поражении и лечении новой фармацевтической композицией
Морозов М.А., Блинова Е.В., Овсепян Ж.А., Дыдыкин С.С., Блинов Д.С., Горшков В.А., Пронина Е.Н., Балашов В.П., Семелева Е.В., Степанова А.А. Морфологическая структура печени и ее функциональное состояние при лекарственном поражении и лечении новой фармацевтической композицией// Морфологические ведомости.- 2018.- Том 26.- № 2.- С. 12-16. (26).02.12-16
Morozov MA, Blinova EV, Ovsepyan GA, Dydykin SS, Blinov DS, Gorshkov VA, Pronina ЕN, Balashov VP, Semeleva EV, Stepanova AA. The morphological structure of the liver and its functional state at medicinal damage and treatment by the new pharmaceutical composition. Morfologicheskie vedomosti – Morphological Newsletter. 2018 June 30;26(2):12-16. (26).02.12-16
Введение. Медикаментозные поражения печени, приводящее к развитию токсических гепатитов, на сегодняшний день представляют собой одну из серьезных медико-социальных проблем в мире, что обусловлено высоким уровнем заболеваемости и существенными экономическими затратами, связанными с потерей трудоспособности, диагностикой и лечением заболевания [1]. Доля медикаментозного поражения составляет около 5-11,9% в структуре смертности при заболеваниях печени [2]. В Западной Европе на острый лекарственный гепатит приходится 15-20% молниеносных гепатитов, в Японии – 10%, в России – 5% [3]. В Великобритании первое место в этиологии фулминантного гепатита занимает передозировка парацетамолом, оттесняя на второй план острые вирусные гепатиты. В США ежегодно острые отравления парацетамолом, требующие госпитализации, регистрируются с частотой примерно 29 на 100 тыс. населения, в Израиле – 57, в Великобритании – 200 [3-4]. Кроме того, как в России, так и за рубежом, несмотря на предпринимаемые усилия со стороны органов здравоохранения и государственные программы, наблюдается рост распространенности токсических гепатитов [2]. В настоящее время известно более 1000 лекарственных препаратов, обладающих гепатотоксическим действием [4]. В качестве провоцирующего повреждение печени фактора на первом месте находятся противотуберкулезные и антибактериальные средства, затем нестероидные противовоспалительные препараты, лекарства, регулирующие деятельность нервной системы, гормональные, цитостатические, гипотензивные, антиаритмические препараты, биологически активные добавки [5-6]. Наиболее уязвимой группой являются беременные женщины, а среди них в группе риска лица, страдающие гестозом, принимавшие до беременности пероральные контрацептивы и перенесшие экстракорпоральное оплодотворение [7].
Комплексная терапия токсического поражения печени требует использования высокоактивных и безопасных гепатопротекторов, способных к фармакологическому «экранированию» гепатоцитов от патологического воздействия токсикантов и восстановлению структурно-функциональных взаимоотношений поврежденной печеночной паренхимы. В связи с этим поиск и создание новых перспективных гепатотропных лекарственных средств является актуальным и своевременным на сегодняшний день.
Цель исследования - изучить морфологическую структуру печени и ее функциональное состояние на фоне парацетамолового гепатита и экспериментальной терапии фармацевтической композицией с цито- и органопротекторной активностью.
Материалы и методы исследования. Эксперименты выполнены на 50 белых нелинейных крысах обоего пола исходным весом 180-220 г, полученных из питомника «Столбовая» ФГБУН НЦБМТ ФМБА России. Животные, содержавшиеся в стандартных условиях вивария Центра перспективных исследований инновационных лекарственных веществ ФГБОУ ВО «МГУ им. Н.П. Огарёва» при соблюдении требований Европейской конвенции по защите позвоночных животных, были разделены на 4 группы: 1-я – интактные животные, 2-я – контроль (крысы с парацетамоловым гепатитом), 3-я и 4-я – животные с парацетамоловым гепатитом, получавшие фармакологическое воздействие препаратом сравнения и исследуемой фармацевтической композицией соответственно. В работе изучено гепатотропное действие фармацевтической композиции с шифром разработчика ЛХТ-8-16, представляющей собой водорастворимый гранулят, в 1 г которого содержится по 250 мг деанола ацеглумата и липоевой кислоты. В качестве препарата сравнения использовали N-аденозил-S-метионин (препарат «Гептрал», флаконы с 760 мг лиофилизата действующего вещества и ампулы по 5 мл с раствором для внутривенного и внутримышечного введения, производства «Фамар Л’Эйль», Франция, номер серии 79134ТВ22). Лекарственный гепатит моделировали путем внутрижелудочного введения раствора парацетамола в дозе 1000 мг/кг через зонд в виде суспензии в 2% крахмальном геле в течение 2-х суток. Исследуемые фармацевтическая композиция в дозе 120 мг/кг и препарат сравнения в дозе 60 мг/кг вводили животным внутрижелудочно за 1 час до введения гепатотоксина в объеме 0,8 мл, а также на 3-и сутки. Крысы 1-й и 2-й группы на протяжении исследования получали водопроводную воду. На четвертые сутки животных выводили из эксперимента под эфирным наркозом путем декапитации; кровь и печень забирали для проведения исследования. В сыворотке крови определяли активность аспарагиновой (АСТ) и аланиновой (АЛТ) аминотрасфераз, общего белка (ОБ), общего билирубина (Б) и щелочной фосфатазы (ЩФ) с помощью автоматического биохимического анализатора FUJIFILM-DRI-CHEM 4000i (Япония). Печень животных взвешивали, оценивали макроструктуру, кусочки из 3-х различных зон фиксировали в 10% растворе нейтрального формалина с последующей окраской гемотоксилином и эозином по стандартной методике. Морфологическую структуру изучали в световой микроскоп Nikon Eclipes Ni (Япония). Морфометрию срезов печени проводили с помощью программы анализа изображений Image Scope Color и cellSens Standart (Россия). Статистическую обработку результатов проводили с помощью компьютерной программы Statistic 10, где достоверность межгрупповых различий по данным экспериментов устанавливали с помощью параметрического критерия Даннета. Рассчитывали средние арифметические (М) и среднеквадратические отклонения (±SD). Использовали 95% уровень статистической значимости различий результатов исследований.
Результаты исследования и обсуждение. В контрольной группе токсическое воздействие парацетамола приводило к значительному увеличению сывороточной активности внутриклеточных ферментативных систем, свидетельствующей о гибели печеночных клеток: так, уровень АСТ превышал показатели интактной группы в среднем на 98,6%, АЛТ – на 94,7% (таблица 1).
Таблица 1
Биохимическая характеристика парацетамолового повреждения печени
|
Группа |
АСТ U/л |
АЛТ U/л |
Билирубин мкмоль/л |
Общий белок г/л |
ЩФ U/л |
|
1 – интактные животные |
13,8±0,3 |
11,3±0,4 |
6,5±1,2 |
28,5±2,2 |
219,5±14,5 |
|
2 – животные с гепатитом (контроль) |
981±7,7* |
214,4±13,5* |
13,3±1,5* |
34,3±4,3 |
386,2±19,1* |
|
3 – животные с гепатитом, получающие ЛХТ-8-16, 120 мг/кг |
128,6±7,1а |
46,8 ±7,7а |
8,8±1,1б |
36,2±3,0 |
273,6±15,3б |
|
4 – животные с гепатитом, получающие N-аденозил-S-метионин, 60 мг/кг |
130,6±1,5а |
47,2±1,01а |
10,6±2,2* |
30,6±1,2 |
247,2±12,9а |
Примечание: * - различия при сравнении с 1 группой статистически достоверны при р<0,05; а – различия при сравнении с 1 и 2 группами статистически достоверны при р<0,05; б – различия при сравнении со 2 группой статистически достоверны при р<0,05 (одномерный дисперсионный анализ, критерий Даннета).
Центр печеночной дольки
Перипортальная зона
к"», •.^’e't
,в?чЛЛ
•t^
#®
>д№л
S^jak *«^^*1^4/ - is^2 ^ o', oSt
was
•V^»
^'^fcs ' .Л
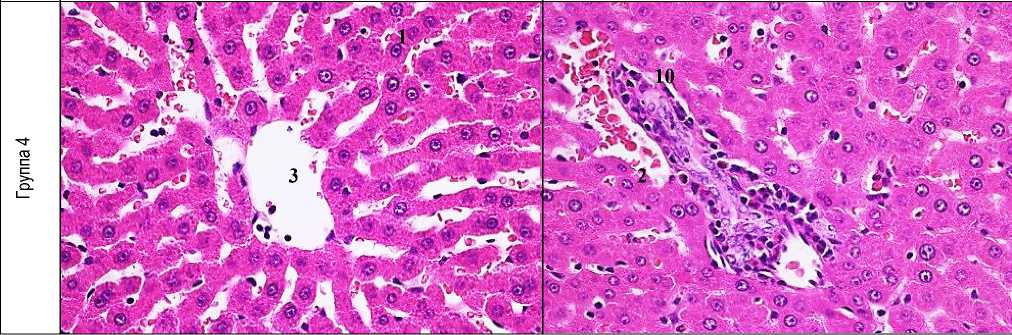
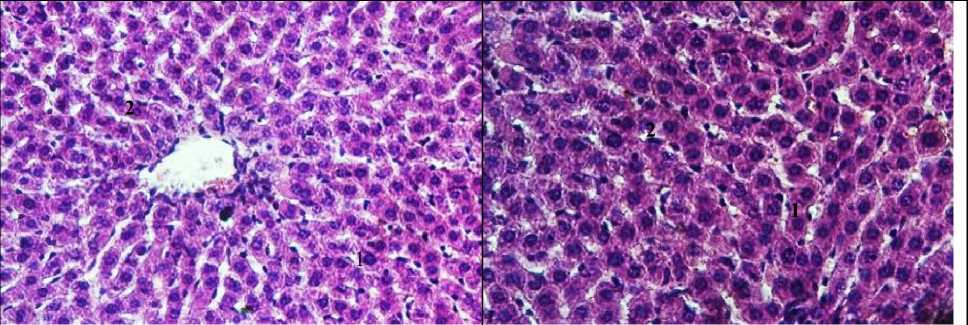
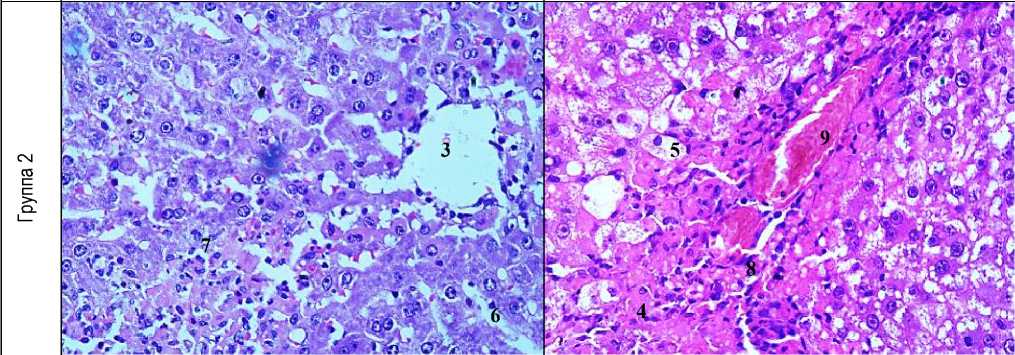
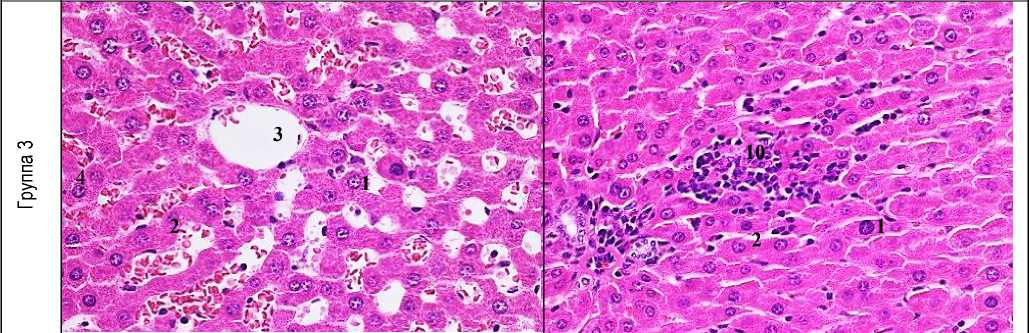
Рис. 1. Морфологическая картина исследуемых групп (окраска гематоксилин-эозин, ув.: х400): 1 - гепатоцит, 2 - балки печеночной дольки, 3 - центральная вена, 4 - зона некроза, 5 - гепатоциты с вакуольной дистрофией, 6 - расширение синусоид, 7 - дискомлексация печеночных балок, 8 - лейкогистиоцитарная инфильтрация, 9 - гиперемия периферических сосудов, 10 - лимфогистиоцитарная инфильтрация.
Рост активности щелочной фосфатазы на 43,2% и общего билирубина указывал на развитие выраженного холестаза и дистрофических изменений печени. Однако, белок-синтетическая функция печени была сохранена. Профилактическое введение ЛХТ-8-16 и препарата сравнения в эквитоксических дозах оказывало сопоставимый цитопротективный эффект, характеризующийся значительным снижением активности аминотрансфераз в сравнении с контрольной группой животных, предотвращением формирования явлений холестаза.
При морфологическом исследовании печени животных контрольной группы установили значительное увеличение органа, края органа были закруглены, печень визуально имела бурую окраску, со значительными участками просветления как на поверхности, так и на разрезе. Абсолютная и относительная масса органа превышала размеры интактных животных. В группе животных, получавших ЛХТ-8-16, коэффициент относительной массы составлял в среднем 0,03 и не отличался от интактной группы. Макроструктура печени была ровной с острыми краями, красно-коричневого цвета, светло-желтые включения были единичны.
Патогистологическое исследование печени крыс показало, что введение токсической дозы парацетамола вызывает развитие необратимых изменений структуры органа: центральные вены были расширены с наличием гемолиза эритроцитов и содержанием плазматической жидкости. Наблюдалась дискомплексация печеночных балок, диффузная вакуольная дистрофия, фокальные некрозы гепатоцитов с явлениями карио- и плазмопикноза, кариолизиса и цитолиза с умеренной перифокальной лейкоцитарной инфильтрацией. В прецентральной зоне печеночной дольки синусоиды были расширены с содержанием большого количества клеток Купфера. Перипортальная зона характеризовалась очаговым внутриклеточным холестазом, выраженной лейкоцитарной и лимфогистиоцитарной инфильтрацией портальных трактов с преобладанием лейкоцитов. Гепатоциты периферии дольки были деформированы с явлениями вакуолизации цитоплазмы и лизиса ядер (рис. 1).
Профилактическое введение фармацевтической композиции ЛХТ-8-16 предотвращало развитие микроструктурных нарушений печени при сравнении с животными группы контроля: сохранялась четкая балочная структура печеночной дольки, гепатоциты имели полигональную форму с округлыми ядрами. В то же время, при сравнении с печенью интактных животных наблюдали отек синусоидальных пространств с присутствием в них эритростазов. Гепатоциты периферии дольки сохраняли нормальное строение, портальные тракты были не расширены с явлениями умеренной лимфогистиоцитарной инфильтрации. Подобная картина наблюдалась у животных, получавших препарат сравнения: центральные вены были умеренно расширены, содержали эритроциты, строение печеночной дольки сохраняло балочно-радиарную структуру, контуры цитоплазматической мембраны гепатоцитов и ядерной оболочки были четкими. Однако сохранялось расширение синусоидов с эритростазами. На периферии дольки структура гепатоцитов не нарушалась, портальные тракты с явлениями пролиферации гистиоцитов с сохранением инфильтрации единичными лейкоцитами (рис. 1). Морфометрические характеристики печени в состоянии парацетамол-индуцированного воспаления отличались увеличением площади цитоплазмы в 2,1 раза, площади ядра в 1,6 раза, ядерно-цитоплазматическое соотношение было равно в среднем 0,2.
Исследуемая композиция ЛХТ-8-16 достоверно уменьшала размеры гепатоцитов в центральной зоне, за счет уменьшения выраженности явлений клеточной дистрофии, площадь ядер была приближена к интактной группе. Печеночные клетки на периферии дольки в группе животных, получавших исследуемую комбинацию в профилактическом режиме, по площади на 30% превосходили показатель здоровых животных, количество полиядерных гепатоцитов в 1,5 раза превосходило показатель животных 2-й и 3-й групп. Парацетамоловое повреждение печени относится к так называемым предсказуемым поражениям органа лекарственной этиологии и представляет собой классическую биологическую систему для оценки изменений органа и возможных точек приложения потенциальных гепатопротекторов [8]. Формирующийся в процессе метаболизма парацетамола N-ацетил-р-бензоксихинонимин связывается с внутриклеточными белками, что влечет повреждение митохондриальных структур, активацию свободнорадикальных процессов и фрагментацию ДНК [9]. Указанные процессы запускают формирование стеатоза, воспаления, некроза и, в последующем - фиброза с нарушением цитоархитектоники органа [10]. Способность ЛХТ-8-16 при курсовом введении сдерживать структурные изменения паренхимы печени, предотвращать гибель гепатоцитов может быть обусловлена наличием у компонентов композиции антиоксидантных свойств, а также их метаболическими эффектами.
Заключение. Гепатопротекторный эффект фармацевтической композиции ЛХТ-8-16 при парацетамоловом поражении печени крыс на макроморфологическом уровне проявляется предотвращением роста абсолютной и относительной массы органа, сохранением формы, структуры и цвета печени. Профилактическое введение ЛХТ-8-16 ограничивает микроструктурные последствия токсического воздействия парацетамола на паренхиму печени: сохраняется четкая балочная структура печеночной дольки, гепатоциты имеют полигональную форму с округлыми ядрами, воспалительная клеточная реакция выражена умеренно. Уменьшение глубины и тяжести структурных нарушений органа под действием ЛХТ-8-16 при лекарственном гепатите сопровождается снижением активности цитолитического и холестатического синдромов, нормализацией пигментного обмена.
Список литературы Морфологическая структура печени и ее функциональное состояние при лекарственном поражении и лечении новой фармацевтической композицией
- Bataller L, Hadengue A, Zoulim F. Barselona. Spain. 2012;1:35-40.
- Lopatkina TN, Burnevich EZ. Lekarstvennye porageniy pecheni. Prakticheskaya gepatologiya. 2004;133-136.
- Polunina TE. iDoctor.2013:5:23-28.
- Bjornsson E, Olsson R. Outcome and prognostic markers insevere drug induced liver disease. Hepatology. 2005;42:481-489.
- Koroleva MV. Exogennj-toxicheskii gepatit. Sovremennyi vzglyad na etiologiu, patogenez, klinicheskoe techenie. Lekarstvennyi vestnik. 2015;2(58)9:18-22.
- Kafrouni MI, Anders RA, Verma S. Gepatotoxichnost, obuslovlennaya primeneniem dieticheskih dobavok, sodergashih anaboliticheskie steroidy. Clinicheskaya Gastroenterologya i gepatologiya. 2009;2(3):163-167.
- Eremina EU. Lekarstvennyi gepatit. Practicheskaya medicina. 2014;1(77):20-29.
- Kullak-Ublick GA, Andrade RJ, Merz M et al. Drug-induced liver injury: recent advances in diagnosis and risk assessment Gut. 2017;3:1-11.
- Rivera P, Pastor A, Arrabal S et al. Acetaminophen-induced liver injury alters the acyl ethanolamine-based anti-inflammatory signaling system in liver. Front Pharmacol. 2017;8:705.
- Ratziu V, Harrison SA, Francque S et al. Elafibranor, an agonist of the peroxisome proliferator-activated receptor-α and -δ, induces resolution of nonalcoholic steatohepatitis without fibrosis worsening. Gastroenterology. 2016;150:1147-1159.


