Морфологические адаптации грибного мицелия и величина минимального ростового модуля в разных экологических условиях
Автор: Иванова Анна Евгеньевна, Марфенина О.Е.
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Материалы лекций и устных докладов
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
На примере микроскопических грибов, имеющих разное строение мицелия (септированный, ценоцитный), разрабатываются подходы для исследования особенности модульной организации грибных организмов. Предлагается рассматривать вегетативные модули грибного мицелия - минимальный ростовой модуль, определяющийся минимальной (критической) величиной жизнеспособного фрагмента мицелия (КВФ) и морфологический вегетативный модуль (связанный с единицей гифального роста - ЕГР). Экспериментально показано, что величина вегетативных модулей грибного мицелия может изменяться в зависимости от природных (температура, содержание органического вещества, кислотность) и антропогенных (загрязнение тяжелым металлом - кадмием) экологических условий.
Квф, егр, величина вегетативных модулей
Короткий адрес: https://sciup.org/146116215
IDR: 146116215 | УДК: 631.466.1
Текст научной статьи Морфологические адаптации грибного мицелия и величина минимального ростового модуля в разных экологических условиях
Московский государственный университет им. М.В.Ломоносова, Москва
На примере микроскопических грибов, имеющих разное строение мицелия (септированный, ценоцитный), разрабатываются подходы для исследования особенности модульной организации грибных организмов. Предлагается рассматривать вегетативные модули грибного мицелия – минимальный ростовой модуль, определяющийся минимальной (критической) величиной жизнеспособного фрагмента мицелия (КВФ) и морфологический вегетативный модуль (связанный с единицей гифального роста – ЕГР). Экспериментально показано, что величина вегетативных модулей грибного мицелия может изменяться в зависимости от природных (температура, содержание органического вещества, кислотность) и антропогенных (загрязнение тяжелым металлом - кадмием) экологических условий.
Мицелиальные грибы являются важнейшими организмами в наземных экосистемах, так как участвуют в процессах деструкции органических веществ. Они обладают сложным жизненным циклом, включающим вегетативную стадию развития мицелия и репродуктивную стадию образования бесполых и половых структур [9].
В природе грибы развиваются в гетерогенных пространственно и нестабильных во времени условиях, в связи с изменениями в них температуры, влажности, содержания органических веществ и т. д. При этом, благодаря способности к динамическому плеоморфизму, морфологические характеристики растущих грибных колоний могут изменяться в зависимости от экологических условий среды [17]. Грибы способны «врастать в ассиметричное жизненное пространство», что согласно современным представлениям [4; 5], является характерным для модульных организмов.
В природной среде обитания грибы обычно растут на поверхности твердых сред. В процессе развития «типичной» колонии [3; 15] из грибной споры центробежно разрастаются апикально удлиняющиеся и регулярно ветвящиеся в субапикальных участках гифы, при этом образуется круглая (сферическая) форма грибной колонии, в центре которой позже появляются новые репродуктивные структуры. Именно, на вегетативной стадии развития мицелия (грибницы, таллома), за счет инвазивного роста гиф, проникающих в твердые субстраты, выделения гифами экзометаболитов (органических кислот, ферментов и т.п.) и адсорбционного поглощения веществ из окружающей среды, грибами осуществляется разрушение органических, минеральных и синтетических соединений: например, растительного опада, животных останков, горных пород, технологических конструкций, зданий и прочих заселенных грибами субстратов [9; 11].
В то же время в естественных условиях развитие колоний грибов часто происходит не из спор, а вегетативно – из частей мицелия, фрагментов гиф. Фрагментация грибных колоний, например, в почвах обусловлена изменением физикохимических условий среды (механическим нарушением, высыханием, замерзанием, оттаиванием почв, температурными перепадами, воздействием загрязнителей и проч.), а также в результате жизнедеятельности других организмов, например, беспозвоночных животных [7; 10].
После фрагментации из образовавшихся частей развиваются новые
Вестник ТвГУ, серия «Биология и экология», вып. 9, 2008 функционально независимые грибные колонии, преимущественно генетически идентичные родительскому организму, но часто морфологически отличные друг от друга в зависимости от экологических условий роста. То есть, каждый фрагмент мицелия служит модулем для построения нового организма. В связи с этим возникает ряд вопросов, которые сегодняшний день мало исследованы. Какие вегетативные ростовые модули можно выделить в грибной колонии? Каковы размеры минимального ростового модуля, из которого возможно восстановление грибного организма после нарушения целостности колонии? От чего зависит величина минимального ростового модуля грибного мицелия – от морфологических свойств самого мицелия и/или параметров среды? Изучение этих вопросов для грибов могут расширить в целом наши знания о модульных организмах и принципах их организации.
Как один из возможных критериев модульного строения грибных колоний для характеристики интенсивности ветвления принято рассматривать показатель единицы гифального роста – ЕГР (G). Несколько десятилетий назад рядом исследователей было отмечено, что количество образующихся ветвей (апексов гиф) в растущей грибной колонии увеличивается примерно пропорционально суммарной длине гиф колонии. Для характеристики этой связи и было предложено использовать соотношение общей длины гиф (L) к числу верхушек роста (n): G = L / n [8]. При этом было показано, что факторы окружающей среды являются определяющими в «выборе» колонией моделей ветвления, наиболее эффективных для использования питательных субстратов при минимальном синтезе биомассы [15].
Было установлено, что ветвление мицелия зависит от средней скорости удлинения гиф (Е) и удельной скорости роста ( µ ) G = E / µ [14], но в то же время определяется механизмами, регулирующими объем ЕГР (V g ) и радиус гифы (r): E = V g µ / π r2 [18]. Кроме того, длина ЕГР связана с пространственными масштабами электро-диффузионных взаимодействий на поверхности многоклеточных систем и коррелирует с величиной эквивалентной кабельтовой постоянной [2]. Следовательно, морфологические и кинетические показатели роста гиф, грибного мицелия тесно взаимосвязаны, и изменение какого-либо одного параметра роста мицелия под влиянием факторов окружающей среды должно приводить к изменению характера ветвления в грибной колонии. Так, значительное увеличение величины ЕГР может происходить в случае изменения стратегии роста грибной колонии под влиянием ряда экологических условий. Например, при истощении используемого субстрата, в колонии в разные стороны разрастаются длинные неветвящиеся «гифы распространения», а при достижении нового места в пространстве с богатым содержанием субстрата, снова развивается плотная колония с регулярно ветвящимся мицелием [12; 13; 16]. Таким образом, единица гифального роста (ЕГР) представляет собой «функционально независимый информационно-энергетический модуль, обладающий достаточным набором материальных, энергетических и информационных ресурсов для поляризованного роста» [1].
В качестве другого вегетативного модуля, который несет в себе достаточный набор свойств для развития нового организма, мы предлагаем рассматривать описанные нами ранее минимальные жизнеспособные (то есть способные к росту) фрагменты гиф [6]. Нами было установлено, что фрагменты гиф разной длины обладали разной жизнеспособностью. Чем меньше была начальная величина фрагмента, тем меньше фрагментов данного класса длин оказывалось способно к росту на питательных средах. С увеличением начальной длины возрастало число жизнеспособных фрагментов. Было показано, что минимальная величина жизнеспособного фрагмента, обозначенная нами как «критическая величина фрагмента» (КВФ), у видов грибов с различным строением мицелия отличалась. КВФ была в несколько раз меньше у видов с септированным мицелием (например у Alternaria alternata Fr. Keissler, Penicillium spinulosum Thom), по сравнению с видами, имеющими ценоцитный (несептированный) мицелий, например, у вида Mucor hiemalis Wehmer. Вероятно, для сохранения способности к росту фрагмента ценоцитного мицелия требуется наличие большего объёма цитоплазмы, содержащей необходимый набор клеточных компонентов. В септированном мицелии наличие септ служит определённой преградой для таких потерь, поэтому способность к росту сохраняется у фрагментов, значительно (в несколько раз) меньших по длине. На примере A. alternata было показано, что КВФ связана с септированностью мицелия: чем плотнее расположены септы в гифе, тем более жизнеспособен фрагмент мицелия.
Также нами было установлено, что минимальный способный к росту фрагмент гифы содержал три клетки. Т.е. наименьшим ростовым вегетативным модулем является фрагмент мицелия, состоящий из трех компартментов. Можно предположить, что крайние компартменты являются своеобразными «буферными» зонами, в том числе защищающими центральную клетку от внешней среды. Данный вывод имеет фундаментальное значение для установления минимальной величины вегетативной колониеобразующей единицы (КОЕ) и для понимания жизнеспособности как свойства грибного мицелия.
Целью данной работы было продолжение предшествующих исследований и изучение особенностей модульного строения грибных колоний под влиянием ряда экологических факторов на примере изменения морфологического вегетативного модуля (ЕГР) при развитии из минимальных ростовых вегетативных модулей (КВФ).
Для исследования были выбраны широко распространенные виды грибов, различных по систематической принадлежности и строению мицелия (рис. 1). Кроме того, они имеют и разное практическое значение: например, Alternaria alternata и Penicillium spinulosum – являются потенциально патогенными для человека грибами. Кроме того, A. alternata может вызывать заболевания растений и обладает аллергенными для человека свойствами.
Мицелии выращивали на жидкой среде Чапека при 25оС, затем для фрагментации взбалтывали на качалке (180 об/мин, 10 мин). Каплю полученной суспензии фрагментов мицелия (0,05 мл) равномерно распределяли по поверхности покрытых агаризированной питательной средой предметных стекол (в 3-х кратной повторности). Далее под микроскопом оценивали способность к росту фрагментов гиф разной длины и учитывали морфологические свойства растущего мицелия (диаметр гиф, расстояние между септами, общую длину растущего мицелия и число ветвей для расчета величины ЕГР). Наблюдения за ростом фрагментов гиф проводили в разных условиях культивирования (рис. 1) в диапазоне изменения естественных (температура, содержание органического вещества, кислотность) и антропогенных (загрязнение тяжелым металлом – кадмием) экологических факторов. Контролем служил рост фрагментов мицелия в стандартных условиях культивирования микроскопических мицелиальных грибов – при 25оС на питательной среде Чапека, содержащей 2% сахарозы (20 г / л) и имеющей pH = 6,2.
Было установлено, что при изменении условий культивирования величина минимального ростового вегетативного модуля изменялась. При неблагоприятном воздействии ряда факторов жизнеспособность сохраняли лишь фрагменты мицелия большей длины (рис. 1). Наиболее чувствительным к изменению экологических условий оказался вид P. spinulosum со светлым септированным мицелием. У этого вида величина КВФ возрастала в 2 раза при увеличении содержания сахарозы в среде, повышении кислотности и в 4 – 5 раз в условиях низких температур. КВФ Mucor hiemalis с несептированным мицелием тоже возрастала в 2 раза при низкой температуре. У вида A. alternata , имеющего септированный, темноокрашенный мицелий, за счет присутствия меланинов, КВФ была наиболее стабильной. Минимальные жизнеспособные фрагменты состояли из 3 клеток, а в исследованных условиях культивирования величина КВФ не изменялась.
Следовательно, по изменению величины КВФ – минимального ростового вегетативного модуля – можно судить о благоприятности условий среды для развития колоний грибов. Увеличение величины КВФ показывает, что рост гриба происходит не в оптимальных для него условиях.
В то же время нужно отметить, что могут существовать определенные отличия по величине минимального модуля у различных штаммов одного и того же вида гриба. Так при сравнении двух штаммов A. alternata длина КВФ штамма 224 была несколько больше (рис. 1), чем у другого штамма. Мы предположили, что это обусловлено более редкой частотой закладки септ в гифах. Плотность септированности, на наш взгляд, может иметь большое значение для величины минимального модуля.
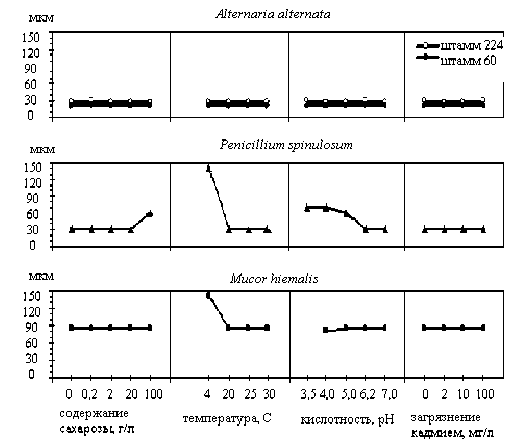
Рис.1. Размеры минимального ростового вегетативного модуля грибного мицелия – критической величины фрагмента (КВФ) – в разных экологических условиях
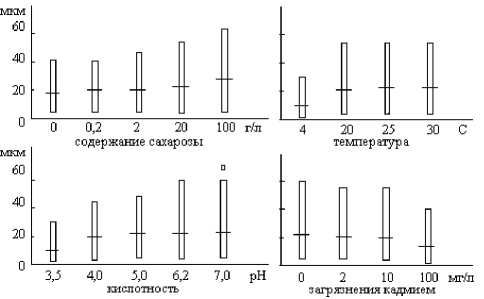
Рис.2. Изменение частоты закладки септ в растущем мицелии A. alternata (штамм 224) в разных экологических условиях
Представлен диапазон расстояний (в мкм) между септами от минимальных до максимальных, чертой отмечены наиболее часто встречаемые расстояния
Нами также было установлено, что частота закладки септ в растущем мицелии зависит от экологических условий культивирования. На примере вида A. alternata было зарегистрировано возрастание плотности септообразования в гифах, растущих в неблагоприятных условиях (рис. 2), например, при увеличении кислотности среды, при понижении температуры, при уменьшении содержания органического вещества в среде, а также при высоких дозах загрязнения кадмием. Штамм 224, с изначально более редкими септами в гифах (более длинными компартментами), оказался и более чувствительным к изменению условий культивирования по сравнению со штаммом 60, характеризующимся более плотной септированностью. Уплотнение компартментов должно приводить к повышению жизнеспособности грибного мицелия. Ранее нами уже было показано, что при одинаковой длине фрагментов способность к росту сохраняется преимущественно у тех фрагментов, в которых плотнее септированность [6].
Увеличение плотности септ в растущем в неблагоприятных условиях мицелии A. alternata сопровождалось увеличением диаметра гиф (рис. 3). При высокой кислотности среды, при низкой температуре, при высоком уровне загрязнения кадмием отмечено утолщение гиф и развитие «четковидного» мицелия, состоящего из вздутых и шаровидных клеток.
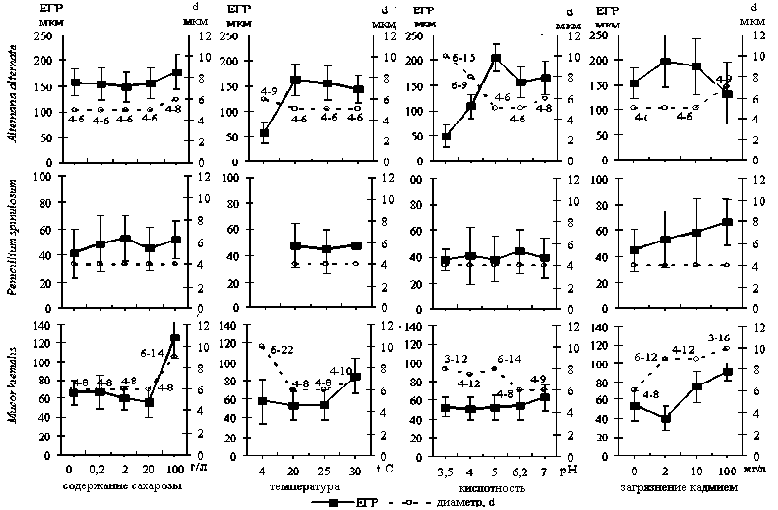
Рис.3. Изменение единицы гифального роста и диаметра гиф исследованных видов в разных экологических условиях
Под влиянием ряда факторов было отмечено изменения толщины мицелия и у вида M. hiemalis, имеющего ценоцитный мицелий. В неблагоприятных условиях низкой температуры (4° С) и при высоком уровне загрязнения кадмием первоначально формировались вздутые клетки и дрожжеподобный мицелий, из которого в дальнейшем росли утолщенные гифы (первого порядка). Последующие ветвящиеся гифы (второго порядка), наоборот, были значительно тоньше, чем в контроле. Важно отметить, что и в благоприятных для этого вида условиях - при высоком содержании сахарозы в среде (100 г/л) – тоже происходило утолщение почти в 2 раза диаметра гиф и боковых ответвлений (рис. 3). При этом при микроскопии наблюдалось резкое увеличение скорости тока цитоплазмы в мицелии.
Изменение морфологических свойств растущего мицелия исследованных видов под действием экологических факторов сопровождалось изменением частоты закладки ветвей в формирующихся колониях. Как реакция на неблагоприятные условия среды у вида A. alternata , имеющего септированный, темноокрашенный мицелий, отмечено более частое ветвление. Уменьшение величины ЕГР, наблюдаемое, как правило, в наиболее стрессовых условиях, сопровождалось уплотнением септообразования и утолщением гиф (рис. 3). При не столь значительных изменениях условий роста (небольших дозах кадмия, невысокой кислотности – Ph = 5,0) ветвление становилось только чуть более редким.
Для M. hiemalis , имеющего несептированный мицелий, по частоте закладки ветвей, наоборот, была свойственна противоположная реакция на воздействие экологических факторов. При стрессовых воздействиях (низкой температуре, высоком уровне загрязнения кадмием) отмечено увеличение ЕГР, то есть более редкое ветвление (рис. 3). Также и в богатых питательным ресурсом условиях, при высоком содержании сахарозы в среде, утолщение гиф M. hiemalis сопровождалось возрастанием величины вегетативного модуля ЕГР (рис. 3).
Для P. spinulosum , имеющего непигментированный септированный мицелий, в исследованном диапазоне влияния экологических факторов значимых изменений ветвления не выявлено.
Следовательно, изменение характера ветвления в грибных колониях может происходить по-разному в зависимости от вида гриба и условий роста.
Таким образом, нами экспериментально показано, что вегетативные модули грибного мицелия – и минимальный ростовой модуль КВФ (критическая величина фрагмента), и морфологический вегетативный модуль ЕГР (единица гифального роста) – могут изменяться, в зависимости от внешних экологических условий. На наш взгляд, изменение этих модулей является примером нецентрализованной саморегуляции, свойственной всем модульным организмам [4; 5]. Морфологические адаптивные реакции растущего мицелия направлены на сбалансированное развитие грибных колоний в изменяющихся под влиянием естественных и антропогенных факторов условиях окружающей среды, что способствует выживанию грибов в природе.
Изучение особенностей модульной организации и развития колоний грибных организмов в разных экологических условиях имеет как фундаментальное так и практическое значение. Для микроскопических грибов это важно для прогноза развития в природе плесеней опасных для человека.
Работа выполнена при частичной поддержке гранта РФФИ № 08-04-00359 .
THE MORPHOLOGICAL ADAPTATIONS OF THE FUNGAL MYCELIUM AND MINIMAL MYCELIAL MODULE VALUE IN THE DIFFERENT
Lomonosov Moscow State University, Moscow
Different approaches for study of peculiarities of modular organization of fungous organism were investigated basing on example of microscopic fungi with different structure of mycelium (septated, coenoecium). It is proposed to consider vegetative modules of fungous mycelium. Among them are minimal growth module (defined by minimal critical quantity of viable fragment of mycelium) and morphological vegetative module (connected with unit of hyphal growth). Experimentally tested, that the size of vegetative modules can change depending on natural (temperature, organic substance content, acidity) and anthropogenic (pollution by high-density metal cadmium) conditions.


