Морфологические аспекты адаптации алкалофильной бактерии Bacillus aequororis к высокой солености и щелочности среды
Автор: А. В. Шилова, Г. Г. Глебов, Ю. Г. Максимова
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 3, 2021 года.
Бесплатный доступ
Получены АСМ-изображения и вычислены морфометрические параметры клеток факультативного алкалофила Bacillus aequororis 5-ДБ и нейтрофильного B. subtilis ATCC 6633 после инкубации в щелочной среде с высокой концентрацией хлорида натрия. Показано, что адаптация B. aequororis 5-ДБ не сопровождается значительными изменениями морфометрических параметров, при этом незначительно (в 1–1.5 раза) снижается объем клеток и возрастает шероховатость их поверхности. Нейтрофильная бацилла, наоборот, реагирует на увеличение концентрации соли и рН (50 г/л, рН 11) значительными изменениями клетки: в 2–3 раза уменьшается объем клетки, а при суточной адаптации к 50 г/л соли и рН 8 возрастает в 2.4 раза за счет увеличения длины клетки. Морфология клеток алкалофильной бациллы, в отличие от таковой нейтрофильной, не претерпевает значительных изменений при высокой минерализации среды как при непосредственном воздействии, так и после суточной адаптации.
Алкалофилы, бациллы, атомно-силовая микроскопия, морфология.
Короткий адрес: https://sciup.org/147235110
IDR: 147235110 | УДК: 579.23 | DOI: 10.17072/1994-9952-2021-3-178-184
Текст научной статьи Морфологические аспекты адаптации алкалофильной бактерии Bacillus aequororis к высокой солености и щелочности среды
В щелочных биотопах с повышенной минерализацией, к которым относятся естественные экосистемы – содовые озера, и среды антропогенного происхождения, такие, как содовые шламохрани-лища, развивается сообщество микроорганизмов, адаптированное к экстремальным условиям такого типа. Сообщество включает экстремофилов – микроорганизмов, которые оптимально развиваются в условиях, отличающихся от так называемых физиологических и экстремотолерантных организмов, способных выживать в таких средах, не яв- ляющихся оптимальными для роста и размножения. Алкалофилам для жизнедеятельности требуется щелочная среда, а оптимум их роста находится в пределах pH 10.0. На основе предпочтения к различным значениям водородного показателя среды обитания такие микроорганизмы группируются в две широкие категории: устойчивые к щелочи организмы, которые демонстрируют оптимальный рост при pH 7.0–9.0, но не могут расти выше pH 9.5, и алкалофильные организмы, которые оптимально растут при pH от 10.0 до 12.0. Они, в свою очередь, подразделяются на факультативных алкалофилов, хорошо растущих в диапа-
зоне нейтральных pH, но с оптимумом при pH 10.0 или выше, и облигатных алкалофилов, которые демонстрируют оптимальный рост при pH выше 10.0, но не растут ниже pH 9.0 [Borkar, 2015].
Вторым экстремальным фактором, который действует на микроорганизмы в щелочных экосистемах, в частности, в содовых шламохранилищах, является высокая минерализация среды. Следствием высокой концентрации соли в среде является потеря клеткой воды в результате осмоса, сопровождающаяся плазмолизом. Клетке для сохранения тургора необходимо поддерживать внутриклеточное осмотическое давление выше такового окружающей среды [Oren, 2008]. Для этого галофилами осуществляется две стратегии: 1) "соль внутри", заключающаяся в аккумуляции молярных концентраций хлорида калия в клетке, и 2) синтез осмотически активных соединений клеткой. Так, выживание и рост Bacillus subtilis в осмотически изменяющейся среде обитания зависит от высоко интегрированных реакций клеточной адаптации, которые либо являются частью общего стрессового ответа, либо специфичны для осмотического стресса. Специфические стрессовые реакции многих Bacillus spp. включают синтез и поглощение определенных органических осмолитов, в частности пролина, глицин бетаина и эктоина, в гиперосмотических условиях [Bremer, 2002]. При попадании микробной клетки в высокоминерализованную среду первыми возникают изменения морфологии и шероховатости поверхности, которые могут быть различными у клеток галоалкалофильных и нейтрофильных бактерий.
Алкалофилы демонстрируют множественные адаптивные реакции, позволяющие им жить при высоком рН [Dhakar, Pandey, 2016]. Известно, что алкалофильным микроорганизмам при росте в щелочной среде, характеризующейся низким содержанием протонов и высоким содержанием ионов натрия, помимо осмоадаптации, необходимо поддерживать внутриклеточный рН-гомеостаз. Протоны, выводимые из клетки в процессе дыхания, не способны совершать полезную работу при возвращении в цитоплазму, поскольку будут двигаться против градиента концентрации. Эта проблема решается клеткой с помощью Na+/H+-антипорте-ров, которые участвуют в замещении ионов натрия на протоны. Формирование хемиосмотического обратного ΔрН обеспечивается электрохимическим градиентом Na+ [Деткова, Пушева, 2006; Морозкина и др., 2010; Krulwich, Sachs, Padan, 2011].
В клетках алкалофилов в адаптации к высокому рН участвует не только цитоплазма, но и клеточная стенка, содержащая соединения с большим количеством карбоксильных групп. Их отрицательный заряд отталкивает карбоксильные ионы и адсорбирует протоны и ионы натрия [Морозкина и др.,
-
2010] . Однако морфологические изменения и влияние рН среды и повышенной концентрации соли на топографию поверхности алкалофильных бактерий недостаточно изучены, в связи с чем целью настоящей работы явилось определение морфометрических показателей и шероховатости поверхности клетки алкалофильного Bacillus aequo-roris при изменении рН среды и увеличении концентрации хлорида натрия в среде и их сравнение с таковыми нейтрофильного штамма B. subtilis .
Изменения морфологии, топографии поверхности микробной клетки, ее внешняя структура с высокой точностью могут регистрироваться с помощью атомно-силовой микроскопии (АСМ). Так, АСМ успешно использовали для изучения капсул [Yu, Ivanisevic, 2004; Stukalov, 2008], спор [Zolock et al., 2006], взаимодействия микробных биопленок с субстратом [Beech et al., 2002], поверхности клеток [Dorobantu, Goss, Burrell, 2012], оценки влияния токсичных веществ, наночастиц, растворителей и других повреждающих агентов на клетку [Коршунова и др., 2016; Максимова, Кузнецова, Демаков, 2016; Glebov et al., 2018]. В связи с этим, основным методом изучения была выбрана АСМ.
Материалы и методы исследования
Объекты исследования и условия культивирования
Bacillus aequororis 5-ДБ (GenBank MT875306) выделили с поверхности грунта старой карты содового шламохранилища АО "Березниковский содовый завод" на богатой среде следующего состава (г/л): пептон – 10, глюкоза – 10, дрожжевой экстракт – 5, K 2 HPO 4 – 1, Na 2 CO 3 – 10, рН 11 [Шилова, Максимов, Максимова, 2021], культивировали на жидкой и поддерживали на твердой среде этого же состава с добавлением 2%-ного агар-агара бактериологического (ДиаМ, Россия). Bacillus subtilis ATCC 6633 культивировали на среде (г/л): пептон – 10, глюкоза – 10, дрожжевой экстракт – 5, K 2 HPO 4 – 1, Na 2 CO 3 – 3, рН 8. Биомассу бацилл наращивали в течение 7 сут. при 25ºС в 100 мл среды состава, указанного выше, в 250 мл колбах Эрленмейера на орбитальном шейкере со скоростью вращения платформы 100 об/мин, концентрировали 20 мин. при 4 444 g на центрифуге 5804R (Eppendorf, Германия). Клетки B. aequororis 5-ДБ отмывали 3 раза боратным буфером (рН 11), B. subtilis ATCC 6633 – фосфатным буфером (рН 8) и помещали в минеральную среду, содержащую (г/л): КН 2 РО 4 – 1.0, К 2 НРО 4 ∙ 3Н 2 О – 3.7, NaCl – 0.5 или 50, рН среды доводили до нужных значений 1 М раствором NaOH.
Рост B. aequororis 5-ДБ и B. subtilis ATCC 6633 изучали в 12-луночных полистероловых плоскодонных планшетах (Eppendorf, Германия) на сре- дах указанного выше состава с рН 8 и 11. Оптическую плотность суспензии (ОП540) определяли на планшетном ридере Infinite M1000 pro (TECAN, Швейцария) при длине волны 540 нм. Удельную скорость роста рассчитывали по формуле
µ = 1 / ОП 0 (ΔОП / Δt), ч-1 , где ОП 0 – ОП540 в момент времени t 0 , ΔОП – изменение оптической плотности культуральной среды за время Δt, ч.
Атомно-силовая микроскопия
Морфологию бактериальных клеток и профили поверхности изучали в атомно-силовом микроскопе (АСМ) Asylum MFP-3D-BIO (Asylum Research, США) в лаборатории атомно-силовой и конфокальной микроскопии на базе Rhodococcus-центра Пермского государственного национального исследовательского университета. Сканирование осуществляли в полуконтактном режиме на воздухе с использованием кремниевых кантилеверов OMCL-AC240TS-R3 (Olympus, Taiwan), покрытых алюминием, с резонансной частотой 70 (50–90) кГц, радиусом кривизны иглы 7 нм и константой жесткости 2 (0.6–3.5) Н/м. Для определения линейных размеров клеток (длина, ширина, высота) и характеристики структуры поверхности клеток (шероховатости) получали двух- и трехмерные топографические изображения бактерий. Форма клетки была принята за эллипсоид, объем клетки был рассчитан по формуле
V=4πabc / 3, мкм3, где a – длина, мкм, b – ширина, мкм, c – высота, мкм.
Препараты для АСМ-сканирования готовили сразу после помещения клеток в соответствующий буфер (1–2 мин) и через сутки. Обработку микрофотографий проводили с помощью программы Igor Pro 6.22A (WaveMetrics, США).
Статистическая обработка. Результаты представлены по трем независимым опытам. При вычислении определяли среднюю, стандартное отклонение и стандартную ошибку среднего.
Результаты и их обсуждение
Влияние рН и высокой концентрации соли на морфологию и топографию поверхности клетки алкалофильной бактерии B. aequororis 5-ДБ, выделенного ранее из щелочного биотопа антропогенного происхождения, изучали в сравнении с не-алкалофильным коллекционным штаммом B. subtilis ATCC 6633. Предварительно проанализировали динамику роста B. aequororis 5-ДБ и B. subtilis ATCC 6633 на слабо- и высокощелочной среде. Показали, что B. aequororis 5-ДБ накапливает значительно большую биомассу по сравнению с B. subtilis ATCC 6633, как на среде с рН 11, так и на среде с рН 8 (рис. 1).
Оптическая плотность суспензии B. subtilis ATCC 6633 при росте на богатой среде с рН 11 не превышала 0.15. При росте B. aequororis 5-ДБ в этих условиях наблюдалась короткая фаза экспоненциального роста (10 ч.), на среде с рН 8 она удлинялась до 72 ч. Удельная скорость роста в экспоненциальной фазе при культивировании B. aequororis 5-ДБ на среде с рН 11 и 8 составляла 0.012 и 0.117 ч-1 соответственно. Стационарная фаза роста B. aequororis 5-ДБ на обеих средах была длительной и волнообразной, рост сопровождался временным увеличением оптической плотности, сменяющимся ее снижением. Полного отмирания не наблюдалось, B. aequororis 5-ДБ на среде с рН 11 в течение изучаемого периода сохраняла жизнеспособность, что подтверждалось высевом на агаризованную среду. Таким образом, рост B. aequororis 5-ДБ на среде с рН 11 был достаточно выражен, хотя накопление биомассы, удельная скорость роста и продолжительность фазы активного роста были ниже, чем на среде с рН 8. На среде с рН 8 данный штамм рос только после по- следовательных пересевов и адаптации.
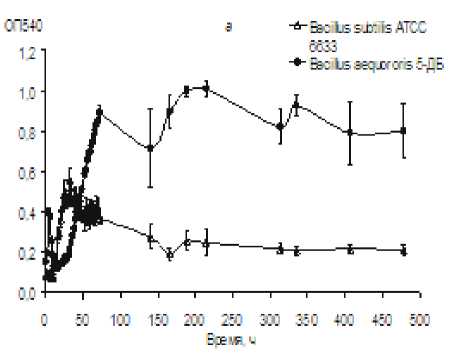
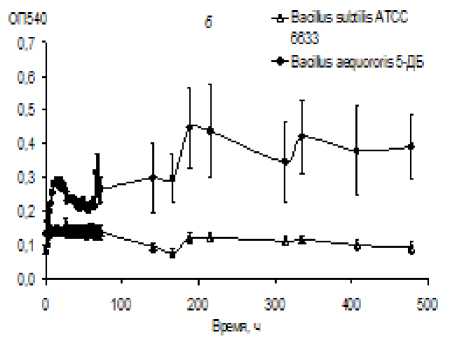
Рис. 1 . Динамика роста Bacillus aequororis 5-ДБ и B. subtilis ATCC 6633 на среде с рН 8 (а) и 11 (б)
Далее изучали влияние рН 8 и 11 и 0.5 и 50 г/л хлорида натрия в среде на морфологию клеток и топографию их поверхности (таблица). Препараты готовили сразу после помещения клеток в такую среду и через сутки инкубации. Показано, что кратковременное воздействие среды с концентрацией NaCl 50 г/л приводило к возрастанию шероховатости поверхности как алкалофильного B. aequororis 5-ДБ, так и нейтрофильного B. subtilis ATCC 6633, тогда как при суточной адаптации этот показатель снижался, за исключением воздействия 50 г/л и рН 8 на B. subtilis ATCC 6633. Возрастание шероховатости может быть связано с незначительным снижением тургора при потере клеткой воды в высокоминерализованной среде. Остальные морфометрические показатели у B. aequororis 5-ДБ изменялись слабо, как и объем клетки, который во всех вариантах опытов был несущественно ниже контроля. Однако у штамма нейтрофильных бацилл отличия во всех показателях были значительны, объем клетки снижался почти вдвое, а в варианте опыта с 50 г/л соли и рН 8 после суток адаптации значительно увеличивался за счет длины клеток. Таким образом, изменения морфологии клеток нейтрофильного штамма в высокоминерализованной среде были гораздо более выражены.
Изменение морфометрических показателей клеток B. aequororis 5-ДБ и B. subtilis ATCC 6633 в зависимости от рН среды и концентрации хлорида натрия
|
Условия инкубации (NaCl, г/л / рН) |
Шероховатость, нм (RMS ± Average Deviation) |
Длина, мкм |
Ширина, мкм |
Высота, мкм |
V, мкм3 |
|
B. aequororis 5-ДБ |
|||||
|
0.5/11 (контроль) |
75.00±59.36 |
1.79±0.02 |
1.15±0.31 |
0.23±0.02 |
2.01 |
|
50/11 (сразу) |
126.72±97.87 |
2.06±0.02 |
0.70±0.02 |
0.25±0.03 |
1.51 |
|
50/11 (сутки) |
108.47±85.74 |
1.52±0.11 |
0.89±0.03 |
0.28±0.02 |
1.56 |
|
50/8 (сразу) |
141.56±112.82 |
2.91±0.04 |
0.70±0.02 |
0.23±0.00 |
1.96 |
|
50/8 (сутки) |
98.41±79.66 |
1.44±0.05 |
0.74±0.02 |
0.31±0.01 |
1.36 |
|
B. subtilis ATCC 6633 |
|||||
|
0.5/8 (контроль) |
77.35±61.49 |
3.97±0.05 |
0.74±0.02 |
0.27±0.01 |
3.24 |
|
50/11 (сразу) |
101.48±83.65 |
2.14±0.12 |
0.74±0.00 |
0.27±0.01 |
1.79 |
|
50/11 (сутки) |
66.62±52.32 |
2.94±0.08 |
0.76±0.02 |
0.17±0.08 |
1.60 |
|
50/8 (сразу) |
135.56±111.59 |
1.10±0.32 |
0.70±0.02 |
0.34±0.00 |
1.10 |
|
50/8 (сутки) |
144.17±120.59 |
4.96±0.06 |
1.15±0.12 |
0.33±0.02 |
7.87 |
Получены АСМ-изображения клеток B. aequo-roris 5-ДБ и B. subtilis ATCC 6633 после инкубации в условиях, отличных от контроля для данного штамма (рис. 2).
Контролем для B. aequororis 5-ДБ являлись условия 0.5 г/л NaCl в среде и рН 11, для B. subtilis ATCC 6633 – 0.5 г/л NaCl в среде и рН 8. Клетки B. aequororis 5-ДБ при воздействии 50 г/л NaCl в среде имели менее ровную поверхность, отмечалось скопление кристаллов соли, а после суточной адаптации в среде с рН 8 и 50 г/л NaCl клетки представляли собой короткие утолщенные палочки, визуально отличающиеся от контроля. Клетки B. subtilis ATCC 6633 при воздействии высокоминерализованной среды имели неровные очертания и выраженную шероховатость поверхности, в препаратах отмечалось много неидентифицированных структур, по-видимому, являющихся клеточными обломками.
Bacillus aequororis 5-ДБ
Bacillus subtilis ATCC 6633

Д

Рис. 2. АСМ-изображения клеток B. aequororis 5-ДБ: А – 0.5 г/л NaCl, рН 11 (контроль); B. subtilis
АТСС 6633: Д – 0.5 г/л NaCl, рН 8 (контроль)

Рис. 2. Окончание: АСМ-изображения клеток B. aequororis 5-ДБ: Б – 50 г/л NaCl, рН 11 (сразу); В – 50 г/л NaCl, рН 11(адаптация сутки); Г – 50 г/л NaCl, рН 8 (адаптация сутки).
B. subtilis АТСС 6633: Е – 50 г/л NaCl, рН 8 (сразу); Ж –50 г/л NaCl, рН 11 (адаптация сутки); З –50 г/л NaCl, рН 8 (адаптация сутки)
Заключение
Таким образом, B. aequororis 5-ДБ, исходя из способа его выделения и стратегии роста, можно отнести к факультативным алкалофилам. Определено, что удельная скорость роста в экспоненциальной фазе при культивировании на среде с рН 11 и 8 составляла 0.012 и 0.117 ч-1 соответственно. Установлено, что морфология клеток алкалофиль-ного B. aequororis 5-ДБ менее подвержена изменениям в среде с высокой концентрацией соли (50 г/л), чем нейтрофильного B. subtilis АТСС 6633, клетки которого значительно уменьшаются в размерах, а после суточной адаптации к 50 г/л NaCl при рН 8, наоборот, увеличиваются в объеме за счет удлинения. Клетки B. aequororis 5-ДБ, являясь предадаптированными к высокой минерализации и щелочной среде, мало изменяются под влиянием условий, отличных от таковых культивирования. Шероховатость поверхности клеток и нейтрофильного, и алкалофильного штамма бацилл незначительно увеличивалась при возрастании концентрации соли в среде, что может говорить о потере воды клеткой, особенно на первых этапах адаптации к высокому содержанию соли.
Исследование выполнено при финансовой поддержке РФФИ в рамках научного проекта № 1934-90103.
Список литературы Морфологические аспекты адаптации алкалофильной бактерии Bacillus aequororis к высокой солености и щелочности среды
- Деткова Е.Н., Пушева М.А. Энергетический метаболизм галофильных и алкалофильных ацетогенных бактерий // Микробиология. 2006. Т. 75, № 1. С. 5–17.
- Коршунова И.О. и др. Влияние органических растворителей на жизнеспособность и морфофункциональные свойства родококков // Прикладная биохимия и микробиология. 2016. Т. 52, № 1. С. 53–61.
- Максимова А.В., Кузнецова М.В., Демаков В.А. Влияние синтетических нитрилов на морфологию и жизнеспособность некоторых видов бактерий // Известия РАН. Сер. биол. 2016. № 6. С. 631–637.
- Морозкина Е.В. и др. Экстремофильные микроорганизмы: биохимическая адаптация и биотехнологическое применение (обзор) // Прикладная биохимия и микробиология. 2010. Т. 46, № 1. С. 5–20.
- Шилова А.В., Максимов А.Ю., Максимова Ю.Г. Выделение и идентификация алкалотолерантных бактерий с гидролитической активностью из содового шламохранилища // Микробиология. 2021. Т. 90, № 2. С. 155–165.
- Beech I.B. et al. The use of atomic force microscopy for studying interactions of bacterial biofilms with surfaces // Colloids and Surfaces B: Biointerfaces. 2002. Vol. 23. P. 231–247.
- Borkar S. Alkaliphilic Bacteria: Diversity, Physiology and Industrial Applications, Chapter 4 // Bioprospects of Coastal Eubacteria. Switzerland: Springer International Publishing, 2015. P. 59– 83.
- Bremer E. Adaptation to Changing Osmolanty // Bacillus subtilis and Its Closest Relatives. Eds. A. Sonenshein, R. Losick, J. Hoch. Washington, ASM Press, 2002. P. 385–391.
- Dhakar K., Pandey A. Wide pH range tolerance in extremophiles: towards understanding an important phenomenon for future biotechnology // Applied Microbiology and Biotechnology. 2016. Vol. 100. P. 2499–2510.
- Dorobantu L.S., Goss G.G., Burrell R.E. Atomic force microscopy: A nanoscopic view of microbial cell surfaces // Micron. 2012. Vol. 43. P. 1312– 1322.
- Glebov G. et al. Combined CLSM/AFM study of rhodococcus cell interactions with zinc oxide nanoparticles // Высокие технологии, определяющие качество жизни: материалы II Междунар. науч. конф. Пермь, 2018. С. 30–31.
- Krulwich T.A., Sachs G., Padan E. Molecular aspects of bacterial pH sensing and homeostasis // Nature Reviews Microbiology. 2011. Vol. 9. P. 330–343.
- Oren A. Microbial life at high salt concentrations: phylogenetic and metabolic diversity // Saline Systems. 2008. 4 : 2. DOI: 10.1186/1746-1448-4-2
- Stukalov O. Use of atomic force microscopy and transmission electron microscopy for correlative studies of bacterial capsules // Appl. and Environ. Microbiol. 2008. Vol. 74, № 17. P. 5457–5465.
- Yu M., Ivanisevic A. Encapsulated cells: an atomic force microscopy study // Biomaterials. 2004. Vol. 25. P. 3655–3662.
- Zolock R.A. et al. Atomic force microscopy of Bacillus spore surface morphology // Micron. 2006. Vol. 37. P. 363–369.


