Морфологические аспекты кровоизлияний в опухоли гипофиза
Автор: Кутин Максим Александрович, Ротин Даниил Леонидович, Шишкина Людмила Валентиновна, Астафьева Людмила Игоревна, Кадашев Борис Александрович, Калинин Павел Львович, Фомичв Дмитрий Владиславович, Шарипов Олег Ильдарович, Сидорук Екатерина Владимировна
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 3 (19), 2016 года.
Бесплатный доступ
Авторами статьи установлены морфологические особенности аденом гипофиза, в строму которых происходят кровоизлияния. Исследованы тинкториальные свойства, макро- и микроскопические характеристики. С помощью иммуногистохимического исследования определён уровень экспрессии VEGF, EGFR, циклина D1, белка р53, что позволило предположить непосредственную причину и патогенез питуитарных кровоизлияний.
Гипофиз, аденома, кровоизлияние, питуитарная апоплексия, морфология
Короткий адрес: https://sciup.org/140222662
IDR: 140222662 | DOI: 10.18027/2224-5057-2016-3-77-82
Текст научной статьи Морфологические аспекты кровоизлияний в опухоли гипофиза
АКТУАЛЬНОСТЬ
В существующей мировой медицинской практике нанокол-лоидные препараты, меченные короткоживущим радионуклидом технеция 99mTc, достаточно широко используются для проведения диагностических исследований в онкологии [1, 9, 12], кардиологии, для обнаружения воспалительных заболеваний опорно-двигательного аппарата, нарушений анатомо-морфологической структуры при опухолях, циррозах, гепатитах и других заболеваниях. По данным мировой литературы для непрямой радиоизотопной лим-фографии и определения сторожевых лимфатических узлов применяется широкий ряд коллоидных радиофар- мпрепаратов (РФП), которые различаются между собой по способу приготовления и диаметру получаемых коллоидных частиц (табл. 1). Вместе с тем, создается впечатление, что предпочтения при клиническом использовании тех или иных коллоидных РФП диктуются не столько особенностями их фармакодинамики, сколько сложившейся производственной практикой. В частности, в европейских странах, где выбор доступных наноколлоидных РФП наиболее широк, чаще всего используются наноколлоиды с диаметром частиц до 100 нм, в Австралии и Канаде также доминируют коллоидные комплексы небольшого размера (3–30 нм). В США единственным зарегистрированным наноколлоидом для идентификации и биопсии сторожевых
Таблица 1
Данные о наноколлоидных препаратах технеция 99mTc, производимых в Европе, представлены в таблице 1.
Все приведенные наноколлоидные препараты изготавливаются на основе соединений, образующих устойчивые гидрозоли. При этом решающим фактором успеха является не их химический состав, а размер наночастиц [8]. Известно, например, что оптимальный размер частиц для проведения лимфосцинтиграфии составляет 20–100 нм. Такие частицы выводятся из тканей со скоростью, не позволяющей им проникать в кровяное русло. Частицы с размерами менее 20 нм легко проходят в кровяное русло, что препятствует визуализации лимфатических узлов [8]. Наночастицы с размерами более 200 нм (Hepatocis) могут быть использованы для мечения аутолейкоцитов с целью выявления очагов воспалений в кардиологии. В настоящее время зарегистрированных в Российской Федерации лимфотропных коллоидов для использования в диагностике метастазов злокачественных новообразований в лимфатических узлах нет. А срок действия регистрации в Российской Федерации ранее использовавшегося в МНИОИ им. П. А. Герцена препарата Nanocis истек более 7 лет назад. Для клинического применения на территории Российской Федерации разрешен радиоколлоид «Технефит 99mTc» с ориентировочным диаметром коллоидных частиц 200–1000 нм и более. В предполагаемом исследовании для отработки методики и получения результатов будет использован отечественный коллоидный препарат «Технефит 99mTc» (рег. номер ЛС-002365), предназначенный для оценки анатомо-топографических особенностей печени и селезенки (формы, размеров, структуры) при опухолях, циррозе, гепатите и других заболеваниях. Препарат интенсивно поглощается ретикуло-эндотелиальной системой печени и селезенки. Готовится ex temporo на основе стандартного набора «Технефит 99mTc» и элюата 99 mТс из генератора технеция 99m. Изотоп 99mТс имеет период полураспада 6,04 часа. При распаде 99mТс испускает гамма-кванты с энергией 140 КэВ и выходом 90%.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Изучить возможности использования радиофармпрепарата «Технефит 99mTc» для определения и биопсии сторожевых лимфатических узлов с их морфологическим исследованием при выполнении операций у больных со злокачественными новообразованиями – рак молочной железы и меланома кожи туловища и конечностей.
Задачи исследования
-
1. Определить дозировку, активность, объем и характер введения радиоактивного коллоида для возможного исследования и биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99mTc» у больных со злокачественными новообразованиями различных локализаций на модели рака молочной железы и меланомы кожи туловища и конечностей.
-
2. Определить пути лимфооттока от опухоли к сторожевым лимфатическим узлам при планарной лимфосцинтиграфии у больных со злокачественными новообразованиями различных локализаций на модели рака молочной железы, меланомы кожи туловища и конечностей с использованием радиофармпрепарата «Технефит 99mTc».
-
3. Изучить возможности использования портативного гамма-детектора NEO2000 при выполнении прицельной биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99mTc».
-
4. Изучить возможности срочного гистологического и цитологического исследования сторожевых лимфатических узлов.
-
5. Провести анализ полученных результатов срочного и планового морфологического исследования удаленных лимфатических узлов.
-
6. Разработать алгоритм исследования и биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99mTc».
ПРИНЦИП МЕТОДА
В основе метода лежит избирательная способность неизмененных ретикулоэндотелиальных клеток лимфатических узлов захватывать меченные радионуклидами коллоидные частицы, поступающие с лимфой из тканевого депо после введения в опухоль, окружающие опухоль ткани и/ или в подкожную клетчатку, расположенную перитумо-рально. При этом получают информацию о направлении путей лимфооттока от опухоли к лимфатическим узлам, являющимися регионарными [4]. Один или несколько регионарных лимфатических узлов, которые первыми стоят на пути оттока лимфы и, следовательно, первыми поражаются мигрирующими с током лимфы опухолевыми клетками, являются «сторожевыми».
Показания
-
I. Рак молочной железы
-
1. Рак молочной железы до 2,5 см (T1–2N0M0).
-
2. Моноцентрический рост опухоли молочной железы.
-
3. Любая локализация опухоли в молочной железе.
-
II. Меланома кожи туловища и конечностей
-
1. Первичный опухолевый процесс или состояние после экономного иссечения.
-
2. Отсутствие клинически определяемых метастатических изменений в регионарных лимфатических узлах.
-
3. Любая локализация меланомы кожи.
-
4. По результатам комплексного обследования отсутствие данных за генерализацию процесса.
Противопоказания
-
I. Общие
-
1. Гиперчувствительность к препарату или его компонентам.
-
2. Беременность.
-
3. Острый гепатит.
-
4. Гипертермия.
-
II. Рак молочной железы
-
1. Предшествующее лечение (операция, лучевая и лекарственная терапия).
-
2. Рубцовые изменения в молочной железе (операция, травма) и в подмышечной области (операция, воспалительный процесс).
-
3. Отечная форма рака молочной железы.
-
4. Метастатические изменения в подмышечных лимфатических узлах.
-
5. Мультицентрический рост опухоли.
-
III. Меланома кожи туловища и конечностей
-
1. Предшествующее широкое иссечение меланомы кожи;
-
2. Рубцовые изменения в области регионарного лимфатического коллектора (операция, воспалительный процесс).
-
3. Метастатические изменения в регионарных лимфатических узлах.
-
4. Генерализация опухолевого процесса.
Приготовление препарата
-
• 5 мл раствора натрия пертехнетата с объемной активностью 185–1480 МБк/мл вводят с помощью шприца во флакон с лиофилизатом, прокалывая резиновую пробку иглой.
-
• Перемешивают содержимое флакона встряхиванием до полного растворения лиофилизата.
-
• Препарат готов к применению сразу после полного растворения лиофилизата.
-
• Далее для визуализации путей лимфооттока и лимфатических узлов «Технефит 99mTc» активностью 75– 200 МБк вводится в окружающие опухоль ткани в подкожную клетчатку, расположенную перитуморально.
МАТЕРИАЛЬНО-ТЕХНИЧЕСКОЕ ОБЕСПЕЧЕНИЕ
-
1) Генератор технеция-99m ГТ-4К Регистрационное удостоверение № ФСР 2010/06695. Активность технеция 99mTc 19,0 ГБк.
-
2) Лиофилизат для приготовления раствора «Технефит 99mTc», регистрационный номер: ЛС-00002365 от 28.09.2011 г.
-
3) Радиометр (дозкалибратор).
-
4) Двухдетекторный однофотонный-эмиссионный компьютерный томограф E.CAM, фирмы Siemens.
-
5) Двухдетекторный однофотонный-эмиссионный компьютерный томограф, совмещенный с компьютерным томографом, AnyScan SC, фирмы Mediso.
-
6) Двухдетекторный однофотонный-эмиссионный компьютерный томограф, совмещенный с совмещенным с компьютерным томографом, Discоvery NM/CT 670, фирмы General Electric.
-
7) Для визуализации лимфатических узлов используют ОФЭКТ, ОФЭКТ-КТ с параллельным коллиматором для низких энергий.
-
8) Окно дискриминатора устанавливается на значение энергетического пика 99mTc 140 кэВ с шириной 25–30%.
-
9) Портативный гамма-детектор NEO2000 (Johnson & Johnson) для пред- и интраоперационной идентификации очагов накопления 99mTc в сторожевых лимфатических узлах.
МЕТОДИКА ИССЛЕДОВАНИЯ
Специальной подготовки больного к исследованию не требуется.
Для определения путей лимфооттока и визуализации сигнальных лимфоузлов можно использовать коллоидные препараты с диаметром частиц от 10 до 200 нм, меченные 99mТс. В предлагаемом способе используется отечественный коллоидный препарат «Технефит 99mTc» (рег. номер ЛС-002365), который готовится ex temporo на основе стандартного набора «Технефит 99mTc» и элюата, полученного из генератора технеция-99m. Радиоактивный коллоид «Технефит 99mTc» активностью 75–200 МБк вводится по периметру опухоли:
-
• При меланоме кожи туловища и конечностей – внутри и подкожно, отступая от видимой границы опухоли на 5–10 мм; при инфильтрации тканей вокруг опухоли инъекции коллоида производятся, отступая на 10–15 мм от видимых границ инфильтрации [11].
-
• При раке молочной железы – внутри и подкожно на расстоянии 1–2 мм от границ опухоли.
Через 30 мин и 2 часа после введения радиофармпрепарата выполняется сцинтиграфия в режиме «все тело» (Whole Body) в передней и задней прямых проекциях. Также возможно выполнение сцинтиграфии в режиме ОФЭКТ (SPECT) в 128 проекциях и в режиме совмещенного ОФЭКТ-КТ (SPECT-CT) исследования. При отсутствии изображения путей лимфооттока и сторожевых лимфоузлов в указанные сроки целесообразно выполнить дополнительное исследование через 4 часа и более после введения препарата.
Основной вид получаемой информации
-
1. Сцинтиграммы.
-
2. Сцинтитомограммы и/или томограммы.
-
3. Цитологические и гистологические препараты удаленных сторожевых лимфатических узлов.
АНАЛИЗ ИЗОБРАЖЕНИЙ
Основной вид анализа получаемой информации – визуальная оценка сцинтиграмм. При анализе сцинтиграфических изображений определяется зона интенсивного накопления радиофармпрепарата в проекции места инъекции, а также очаги накопления препарата, соответствующие регионарному лимфатическому коллектору. Оцениваются количество и локализация лимфатических узлов, накапливающих радиоколлоиды. Определяются сторожевые лимфатические узлы, которые должны соответствовать хотя бы одному из следующих критериев:
-
• единственный лимфатический узел, накапливающий радиоколлоиды;
-
• первый визуализированный лимфатический узел;
-
• лимфатический узел, связанный с опухолью «дорожкой» лимфатических сосудов.
Все лимфатические узлы, визуализированные в той или иной анатомической области после появления в данной области сторожевого лимфатического узла, рассматриваются как лимфатические узлы второго или третьего порядка.
При этом учитывается направление лимфооттока от опухоли, а также топография лимфатических узлов, их форма, четкость контуров, степень контрастности (нормальная, повышенная), снижение или отсутствие накопления РФП в симметричных группах цепочки лимфатических узлов, наличие препарата в приводящих лимфатических сосудах. Понятие патологических изменений лимфатических узлов, выявленных на сцинтиграммах (сцинтитомограм-мах и/или томограммах), имеет относительный характер и должно предусматривать сравнение симметричных групп лимфатических узлов. Оценка анатомического расположения лимфатических узлов предусматривает сравнение их локализации с анатомическими ориентирами, характерными для каждой исследуемой области.
АНАЛИЗ ПОЛУЧЕННЫХ РЕЗУЛЬТАТОВ
– Используя возможности портативного гамма-детектора NEO2000 во время операции для идентификации очагов накопления [2, 3] радиофармпрепарата «Технефит 99mTc», возможно выполнение прицельной биопсии сторожевых лимфатических узлов.
– Удаленные при биопсии сторожевые лимфатические узлы исследуются вне операционного поля для подтверждения накопления радиофармпрепарата «Технефит 99mTc» и направляются на срочное цитологическое и гистологическое исследование.
– Для точного выявления метастазов в сторожевых и несторожевых лимфатических узлах далее применяется стандартное гистологического исследование операционного материала на парафиновых срезах.
МАТЕРИАЛЫ, МЕТОДЫ И РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Проведено 35 исследований (Табл. 2) с применением радиофармпрепарата «Технефит 99mTc» у 33 пациентов с начальными стадиями опухолевого процесса, из которых 3 пациента с начальными стадиями меланомы кожи туловища и конечностей [7], 1 пациент с диагнозом рак дна полости рта [5], остальные с диагнозом рак молочной железы (Табл. 3).
Для проведения непрямой радиоизотопной лимфосцинтиграфии использовался отечественный коллоидный препарат «Технефит 99mTc» (рег. номер ЛС-002365), предназначенный для оценки анатомо-топографических особенностей печени и селезенки.
РФП готовился на основе стандартного набора «Технефит 99mTc» и элюата 99 mТс из генератора технеция-99m. Изотоп 99mТс имеет период полураспада 6,04 часа, при распаде 99mТс испускает гамма-кванты с энергией 140 КэВ и выходом 90%.
Для визуализации путей лимфооттока из лимфатических узлов «Технефит 99mTc» активностью 75–200 МБк вводился перитуморально (Рис. 1).
Через 30 минут после введения радиоактивного коллоида проводилось исследование на ОФЭКТ (E.CAM, фирмы Siemens), ОФЭКТ-КТ (AnyScan SC, Mediso; Discavery NM/CT 670, General Electric) с параллельным коллиматором для низких энергий. Окно дискриминатора устанавливалось на значении энергетического пика 99mTc 140 кэВ с шириной 25–30%. Основной вид анализа получаемой информации – визуальная оценка сцинтиграмм. При анализе сцинтиграфических изображений определялись зона интенсивного накопления радиофармпрепарата в проекции места инъекции, а также, в ряде случаев, очаги накопления препарата, соответствующие регионарному лимфатическому коллектору. Сторожевые лимфатические узлы должны соответствовать хотя бы одному из следующих критериев:
-
• единственный лимфатический узел, накапливающий радиоколлоид;
-
• первый визуализированный лимфатический узел;
-
• лимфатический узел, связанный с опухолью «дорожкой» лимфатических сосудов.
В тех случаях, когда контрастирования сторожевых лимфатических узлов не происходило, выполнялись повторные исследования на ОФЭКТ, ОФЭКТ-КТ через 2, 6, 12 часов.
В целом данный инвазивный метод исследования хорошо переносился больными. Ни у одного из обследованных нами не было отмечено проявлений индивидуальной непереносимости.
Принимая во внимание достаточно большие размеры коллоидных частиц в диапазоне 200–1000 нм, для отра-
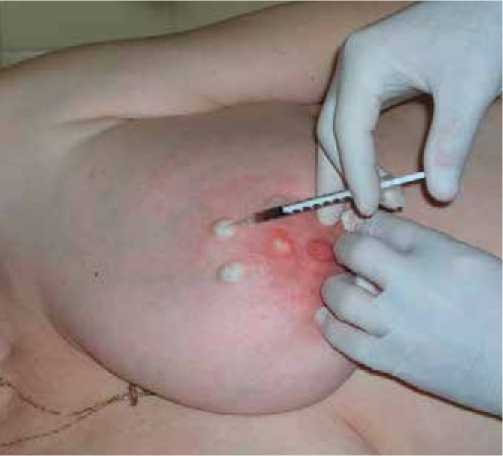
Рис. 1. Перитуморальное введение радиоактивного коллоида «Технефит 99mTc»
Таблица 2. Распределение пациентов по возрасту
|
Возраст |
41–50 |
51–60 |
61–70 |
Старше 71 |
|
Количество Пациентов 35 |
15 |
13 |
6 |
1 |
|
Количество пациентов в% |
42,9 |
37,1 |
17,1 |
2,9 |
Таблица 3. Распределение пациентов РМЖ (31) по сTNM стадии опухолевого процесса
|
Стадия |
0 ст ТisN0M0 |
I ст Т 1N0M0 |
II A ст Т 2N0M0 |
|
Количество Пациентов 31 |
3 |
18 |
10 |
|
Количество пациентов в% |
9,7 |
58 |
32,3 |
Таблица 4. Распределение пациентов РМЖ (31) по pTNM стадии опухолевого процесса
|
Стадия |
0 ст. ТisN0M0 |
I ст. Т 1N0M0 |
II A ст. Т 2N0M0 |
II A ст. Т 1N1M0 |
II B ст. Т 2N1M0 |
III A ст. Т 1N2M0 |
III A ст. Т 2N2M0 |
III C ст. Т 2N3M0 |
|
Кол-во пациентов 31 |
2 |
10 |
11 |
3 |
2 |
1 |
1 |
1 |
|
Кол-во пациентов в% |
6,45 |
32,25 |
35,5 |
9,7 |
6,45 |
3,2 |
3,2 |
3,2 |
Таблица 5. Распределение пациентов РМЖ (31) по локализации опухолевого процесса
|
Локализация |
Нижненаружная |
Центр. |
Граница наружн. |
Гран. внутр. |
Верхневнутр. |
Нижневнутр. |
Верхне-наружн. |
Граница верх. |
|
Кол-во пациентов 31 |
3 |
1 |
3 |
1 |
6 |
2 |
9 |
6 |
|
Кол-во пациентов в% |
9,7 |
3,2 |
9,7 |
3,2 |
19,35 |
6,45 |
29 |
19,35 |
Таблица 6. Распределение пациентов (35) по методу введения и активности РФП («Технефит99mTc»)
|
Серия исследования |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Число |
5 |
3 |
6 |
4 |
1 |
3 |
4 |
5 |
3 |
1 |
|
исслед. (35) |
исслед. |
исслед. |
исслед. |
исслед. |
исслед. (*) |
исслед. |
исслед. (**) |
исслед. (*) |
исслед. |
исслед. (*) |
|
Кол-во РФП |
1,0 мл |
1,0 мл |
1,0 мл |
0,25мл |
1,0 мл |
1,0 мл |
1,0 мл |
1,0 мл |
1,0 мл |
1,0 мл |
|
Инъекция РФП |
в/к-п/к, над узлом |
перитумор. |
перитумор. |
в край узла |
в/к-п/к |
перитумор. |
в/к-п/к |
п/к-перитумор. |
в/к-п/к перитумор. |
в/к-п/к |
|
Тип инъекции РФП |
1 точка |
4 точки |
4 точки |
1 точка |
4 точки |
4 точки |
4 точки + новокаин |
4 точки + новокаин |
4 точки + новокаин. |
4 точки + новокаин |
|
Доза активности РФП |
75 100 125 154 200 мбк |
100 мбк |
150 мбк |
150 мбк |
200 мбк |
200 мбк |
2 иссл. 200 мбк 2 иссл. 100 мбк +100 мбк Макротех |
200 мбк |
200 мбк |
150 мбк |
|
Время инъекции РФП |
8–00 |
8–00 |
8–00 2 иссл. в 14–00 |
8–00 1 иссл. в 14–00 |
11–00 |
8–00 |
8–00 |
8–00 |
8–00 |
8–00 |
|
Экспозиция |
неотсро- |
неотсро- |
2 отсроч. |
1отсроч. |
неотсро- |
неотсро- |
неотсро- |
неотсро- |
неотсро- |
неотсро- |
|
ченная |
ченная |
>17 час |
>17 час |
ченная |
ченная |
ченная |
ченная |
ченная |
ченная |
|
|
Темпер. РФП Дисперсность РФП |
21 град |
21 град |
21 град |
21 град 2-после встрях. |
21 град |
1–21 град 2–37 град |
21 град |
37 град |
37 град После встрях. |
21 град |
|
Лимфография Положительный результат (17) |
Через 30 мин- 1 час миграция в л/узлы В 1 случае 2 л/узла |
В 2 случаях визуал. стор. л/у (1+2л/у) |
В 2 случаях по 1 стор. л/ узла |
В 1 случае через 40 мин 1 стор. л/у |
Через 30 мин 2 сторож. л/узла |
- |
В 3 случ. через 30 мин 1 час миграция в 1 подм. л/узел |
В 3 случ. через 20– 30 мин и 3 часа миграция в 1 подм. л/узел |
- |
- |
|
Лимфография Отрицательный результат (18) |
- |
В 1 случае нет миграции +КТ совмещ. |
В 4 случаях нет миграции В 2 из них >чем 17 часов |
В 3 случаях нет миграц. более 2,5 и 4 часов |
- |
Через 2, через 3 и 4 часа нет миграции |
В 1 случае через 3 часа нет миграции |
В 2 случаях нет миграции более 3 часов |
Через 30 мин-через 2 часа нет миграции |
Через 2 часа нет миграции |
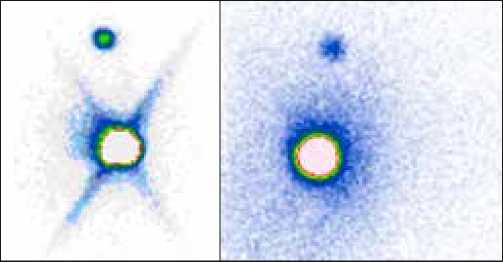
Рис. 2. Пациентка А., 62 года.
Диагноз: рак левой молочной железы, нижне-наружный квадрант. Введено 150 МБк «Технефит 99mTc». На планарных сцинти-граммах, выполненных в передней и задней прямых проекциях, через 30 минут после введения радиофармпрепарата отчетливо определяется включение РФП в депо, а также 1 сторожевой подмышечный лимфатический узел слева
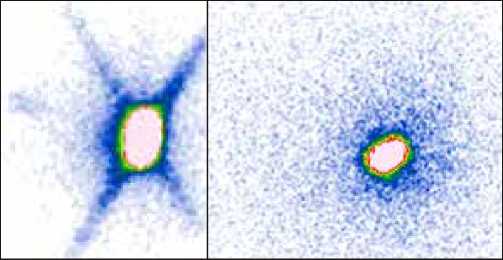
Рис. 4. Пациентка К., 54 года.
Диагноз – рак правой молочной железы, верхне-наружный квадрант. Введено 150 МБк «Технефит 99mTc». На планарных сцинти-граммах, выполненных в передней и задней прямых проекциях, через 30 минут, 17 часов после введения РФП отчетливо определяется включение РФП в депо, накопление РФП в зонах регионарного лимфооттока не выявлено. Интраоперационно – выделено 2 сторожевых подмышечных лимфоузла, при срочном исследовании – без мтс
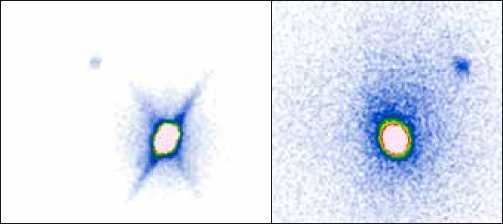
Рис. 3. Пациентка К., 47 лет.
Рак правой молочной железы, внутренняя локализация. Введено 100 МБк «Технефит 99mTc». На планарных сцинтиграммах, выполненных в передней и задней прямых проекциях, через 30 минут после введения радиофармпрепарата отчетливо определяется включение РФП в депо, а также 1 сторожевой подмышечный лимфатический узел справа
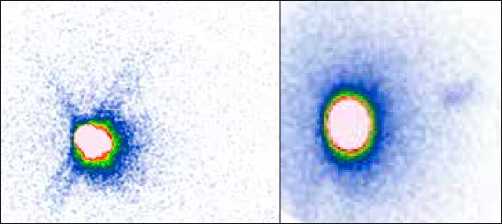
Рис. 5. Пациентка Ш., 68 лет.
Диагноз – рак левой молочной железы, граница наружных квадрантов. Введено 125 МБк «Технефит 99mTc». На планарных сцинтиграммах, выполненных в передней и задней прямых проекциях, через 30 минут после введения радиофармпрепарата отчетливо определяется включение РФП в депо, а также 1 сторожевой подмышечный лимфатический узел слева. Интраоперационно при срочном цитологическом исследовании – метастаз
ботки методики были использованы различные варианты введения радиофармпрепарата «Технефит 99mTc» у больных с различной локализацией опухоли молочной железы (Табл. 5) с целью получения наиболее достоверного результата идентификации сторожевых лимфатических узлов. Для оптимизации полученного результата изменялась дозировка активности, количество вводимого раствора, глубина инъекции [6], количество точек введения [20], использование раствора новокаина [16], с одной стороны улучшающего реологические свойства кровотока и лим-фоотока в ткани [17], и с другой стороны с анестезирующей целью. Кроме этого была использована комбинация двух РФП – «Технефит 99mTc» и «Макротех», изменялась экспозиция проводимого исследования сторожевых лимфатических узлов в гамма-камере от 30 минут до 17 часов после инъекции РФП [18], использовался разный температурный режим инъекции [15], и также изменялась дисперсность раствора путем встряхивания перед непосредственным введением раствора (Табл. 6).
Верхние квадранты – 17, наружные квадранты – 15, внутренние квадранты – 9, нижние квадранты – 5.
За период исследования было проведено 10 серий с различными вариантами введения РФП и идентификации сторожевых лимфатических узлов, которые представлены в таблице 6.

Рис. 5. Использование портативного гамма-детектора NEO2000
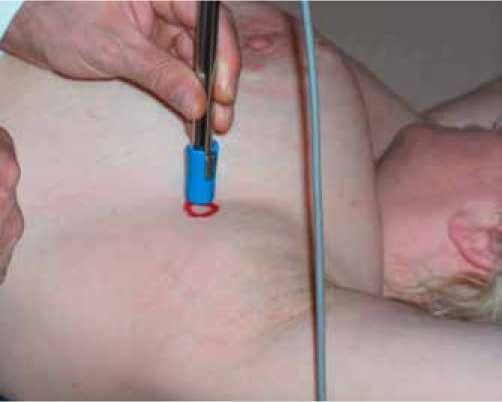
При анализе сцинтиграфических изображений определялась зона интенсивного накопления радиофармпрепарата в проекции места инъекции, а также очаги накопления препарата, соответствующие регионарному лимфатическому коллектору. Оценивались количество и локализация лимфатических узлов, накапливающих радиоколлоиды.
Следует отметить, что вне зависимости от активности и количества вводимого РФП в 17 случаях из 35 (48%) при проведении планарной лимфосцинтиграфии его миграции из депо инъекции в сторожевые лимфатические узлы не было фиксировано ни через 30 минут, ни более. Также в 3 случаях даже через 17 часов после инъекции «Технефит 99mTc» не было получено изображение накопления изотопа в лимфатических узлах. В остальных случаях накопление РФП отмечалось топографически в подмышечной зоне, причем в 3 случаях было получено изображение накопления изотопа в 2 подмышечных лимфатических узлах.
Было отмечено, что в связи с высокой, по заданным характеристикам, активностью технефита от 75 до 200 МБк, требующейся для проведения исследования, при получении изображения на гамма-томографе, место депо инъекции нередко перекрывало картину накопления изотопа в сторожевых лимфатических узлах, что находило свое прямое отражение во время проведения интраоперационного поиска сторожевых лимфатических узлов в зоне лимфооттока и затрудняло выполнение их биопсии.
В одном клиническом случае при отсутствии получения изображения сторожевых лимфатических узлов было применено сцинтиграфическое исследование, совмещенное с КТ, однако и данное исследование не позволило визуализировать сторожевые лимфатические узлы.
Таким образом, при проведении планарной лимфосцинтиграфии с использованием РФП «Технефит 99mTc» полученные данные свидетельствуют о невысокой достоверности результатов проводимого исследования, что позволило визуализировать сторожевые лимфатические узлы в менее чем 50% случаев. Следует отметить, что наилучшие результаты получения сцинтиграфического изображения сторожевых лимфатических узлов были зафиксированы в 1 серии исследования, когда во всех 5 случаях удалось получить положительный результат, при внутрикожно-подкожной инъекции технефита в одну точку над узлом опухоли, вне зависимости от активности РФП от 75 до 200 МБк, при комнатной температуре 21 градус, без предварительной анестезии раствором новокаина (Табл. 6).
При использовании портативного гамма-детектора NEO2000 (Рис.5) для идентификации очагов накопления технеция 99mТС перед операцией определялась активность очага депо непосредственно после инъекции «Технефит 99mTc», а также очагов накопления технеция 99mТС в лимфатических узлах через 1 и более часов после инъекции во время операции. Хирургическое вмешательство начиналось с поиска, идентификации и биопсии сторожевых лимфатических узлов.
Во всех случаях была зарегистрирована постоянная высокая неснижающаяся активность депо «Технефит 99mTc» в диапазоне от 58 до 80 тысяч импульсов в секунду, которая регистрировалась на мониторе гамма-детектора NEO2000, при всех вариантах введения радиофар- мпрепарата. В отдельных случаях, даже через 17 часов после введения радиофармпрепарата, не наблюдались признаки значительного уменьшения активности, из чего можно сделать заключение, что фильтрация «Технефит 99mTc» через поры лимфатических капилляров происходила очень медленно.
Во время операции с помощью гамма-детектора NEO2000 во всех случаях производился поиск очагов накопления радиофармпрепарата в зоне лимфооттока, соответствовавших сторожевым лимфатическим узлам. Регистрировалась активность технеция в очагах накопления в операционном поле. Диапазон активности составлял от 280 до 5000 импульсов в секунду, что отражалось на дисплее монитора гамма-детектора.
Такой большой разброс показателей объясняется различной скоростью миграции «Технефит 99mTc» в лимфатические узлы вне зависимости от способа введения радиофармпрепарата у различных пациентов. При этом какой-либо закономерности в их конституциональных особенностях, в том числе в индексе массы тела, не выявлено. При близком расположении опухолевого узла в молочной железе и, соответственно, очага депо инъекции «Технефит 99mTc» к подмышечному лимфатическому коллектору происходило наслоение сигнала от депо «Технефит 99mTc», даже несмотря на наличие коллиматора на наконечнике «гамма-щупа», то есть место депо инъекции нередко перекрывало картину накопления изотопа в сторожевых лимфатических узлах, и отмечались определенные трудности идентификации очагов накопления изотопа в лимфатических узлах. Это находило свое объяснение высокой, требующейся для проведения исследования по заданным характеристикам активностью «Технефит 99mTc» от 75 до 200 МБк. В таких случаях поиск очагов накопления изотопа изучался на удаленном операционном материале.
В 6 из 35 случаев очагов накопления РФП в лимфатических узлах не было выявлено, в том числе и при исследовании на удаленном операционном материале, то есть поиск сторожевых лимфатических узлов оказался безуспешным (17,1%). В 2 из них были выявлены множественные метастазы в лимфатических узлах, причем в 1 случае (2,85%) был выявлен сторожевой лимфатический узел в подключичной клетчатке, который при срочном морфологическом исследовании оказался метастатически измененным и затем уже при плановом морфологическом исследовании выявлены множественные метастазы в 8 лимфатических узлах (N3).
При исследовании операционного материала удаленных лимфатических узлов в 5 случаях (14,3%) сторожевыми были определены 2 лимфатических узла, располагавшихся в подмышечной клетчатке. В 3 случаях (8,6%) сторожевыми оказались три лимфатических узла подмышечной области. В остальных 21 случаях было обнаружено по 1 сторожевому лимфатическому узлу, 17 (81%) из которых локализовались в подмышечной клетчатке, 3 – в подлопаточной и 1 – в подключичной клетчатке.
Выделенные и маркированные сторожевые лимфатические узлы исследовались вне операционного поля для подтверждения накопления радиофармпрепарата «Технефит 99mTc» и после этого направлялись на срочное морфологическое исследование для выявления метастатических изменений в них. Было произведено 30 срочных морфологических исследований, при которых в 1 случае были диагностированы макроскопические изменения в лимфатических узлах, впоследствии классифицировавшиеся как N2. Из остальных 29 случаев лишь в 2 случаях (6,9%) было проведено срочное гистологическое исследование сторожевых лимфатических узлов на замороженных срезах с лимфатических узлов. Остававшийся биопсийный материал лимфатических узлов направлялся для проведения планового исследования. В одном случае при срочном гистологическом исследовании был выявлен метастаз в сторожевой лимфатический узел, что было подтверждено при плановом гистологическом исследовании, в других удаленных лимфатических узлах – без метастазов. Во втором случае при срочном и плановом исследовании метастазов не было обнаружено. Таким образом, срочное гистологическое исследование для обнаружения метастазов в лимфатических узлах в обоих случаях оказалось достоверным.
В дальнейшем в связи с техническими трудностями срочное гистологическое исследование было заменено цитологическим исследованием отпечатков с разрезанного на две половины каждого исследовавшегося сторожевого лимфатического узла. Было проведено 46 срочных цитологических исследований сторожевых лимфатических узлов. В 5 случаях было исследовано по 2 сторожевых лимфатических узла, в 3 случаях по 3 сторожевых лимфатических узла. По 1 выявленному сторожевому лимфатическому узлу было исследовано в 27 случаях. Срочное цитологическое исследование отпечатков со сторожевого лимфатического узла лишь в одном случае выявило его метастатическое изменение, в то время как данные гистологического исследования подтвердили метастаз в сторожевых узлах в 5 случаях. В одном случае гистологическое обнаружение метастазов меланомы в 2 сторожевых лимфатических узла не предварялось цитологическим исследованием. Еще в одном случае в сторожевом лимфатическом узле подмышечной области не было выявлено метастатических изменений ни при срочном цитологическом, ни при плановом гистологическом исследовании, а в 1 не-
|
Таблица 7. Распределение пациентов РМЖ по ИХГ подтипам опухоли |
|||||
|
ИГХ |
Люминальный |
Люминальный |
Люмин. В |
Нелюмин. |
Трипл-негативный |
|
подтип РМЖ |
А подтип |
В подтип |
Her-2/new + подтип |
Her-2/new + подтип |
подтип |
|
Число случаев, всего 31 |
15 |
3 |
3 |
3 |
7 |
|
Число случаев, (%) |
48,3 |
9,7 |
9,7 |
9,7 |
22,6 |
|
Статус N |
N0 N+ |
N0 N+ |
N0 N+ |
N0 N+ |
N0 N+ |
|
Число случаев |
11 4 |
21 |
12 |
21 |
70 |
сторожевом лимфатическом узле был выявлен метастаз рака молочной железы (получен ложноотрицательный результат).
Плановое гистологическое исследование выявило метастазы в сторожевых лимфатических узлах в 6 случаях, причем у 1 пациента – метастазы меланомы в 2 сторожевых лимфатических узлах.
Следует отметить, что в 1 случае у пациентки 56 лет с диагнозом рак правой молочной железы II A стадия pТ 2N0M0, с локализацией опухоли на границе верхних квадрантов, с трипл-негативным подтипом, Ki-67–60%, которая после завершения хирургического лечения проходила курсы химиотерапии в РОНЦ им. Н. Н. Блохина, при пересмотре стекол гистологических препаратов, впоследствии патоморфологами перед назначением курсов химиотерапии для уточнения стадии заболевания был обнаружен метастаз рака молочной железы в сторожевой лимфатический узел (Табл. 4).
Как один из прогностических факторов у пациентов с диагнозом рак молочной железы был проведен анализ иммуногистохимических показателей. Из 31 клинического случая наибольшие показатели (15) пришлись на люминальный подтип А (48,3%). Наиболее неблагоприятная картина трипл-негативного подтипа пришлась на 7 случаев (22,6%), причем во всех случаях лимфатические узлы оказались неизмененными. Остальные три группы составили люминальный В подтип – 6 случаев (по 3 случая на Her-2/new-позитивный и негативный подтип), и нелюминальный Her-2/new-позитивный – 3 случая. Причем Her-2/new-позитивный рак отмечен в 6 случаях (19,35%), что требовало впоследствии назначение системной таргетной терапии в адъювантном режиме в течение 1 года.
ЗАКЛЮЧЕНИЕ
Изучены возможности и отработана методика использования радиофармпрепарата «Технефит 99mTc» для определения и биопсии сторожевых лимфатических узлов с их морфологическим исследованием при выполнении операций у больных с начальными стадиями злокачественных новообразований.
ВЫВОДЫ
-
1. Определены оптимальная дозировка активности, объем и особенности введения радиоактивного коллоида для возможного исследования и биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99mTc» у больных со злокачественными новообразованиями различных локализаций на модели рака молочной железы и меланомы кожи туловища и конечностей с наилучшими показателями в 1 серии исследования.
-
2. При определении путей лимфооттока от опухоли к сторожевым лимфатическим узлам при проведении лимфосцинтиграфии в гамма-камере у больных со злокачественными новообразованиями различных локализаций на модели рака молочной железы, меланомы кожи туловища и конечностей с использованием радиофармпрепарата «Технефит 99mTc» положительный результат достигнут в 48,57% случаев.
-
3. Во всех случаях была зарегистрирована постоянная высокая неснижающаяся активность депо «Технефит 99mTc» в диапазоне от 58000 до 80000 импульсов в секунду, которая регистрировалась на мониторе гамма-детектора NEO2000, при всех вариантах введения радофармпрепарата. В отдельных случаях, даже через 17 часов после введения радиофармпрепарата, не наблюдались признаки значительного уменьшения активности, из чего можно сделать заключение, что фильтрация «Технефит 99mTc» через поры лимфатических капилляров происходила очень медленно.
-
4. При анализе возможностей использования портативного гамма-детектора NEO2000 при выполнении прицельной биопсии сторожевых лимфатических узлов с использованием радиофармпрепарата «Технефит 99mTc» в 17,1% случаев не удалось обнаружить сторожевые лимфатические узлы.
-
5. Активность в сторожевых лимфатических узлах изотопа технеция 99mTC регистрировалась на дисплее монитора гамма-детектора NEO2000 в диапазоне от 280 до 5000 импульсов в секунду, что объяснялось различной скоростью миграции «Технефит 99mTc» в лимфатические узлы вне зависимости от способа введения радиофармпрепарата у различных пациентов.
-
6. При близком расположении узла опухоли в молочной железе и, соответственно, очага депо инъекции «Технефит 99mTc» к подмышечному лимфатическому коллектору происходит наслоение сигнала от депо «Технефит 99mTc», что вызывает трудности идентификации очагов накопления изотопа в лимфатических узлах.
-
7. При изучении возможности срочного гистологического и цитологического исследования сторожевых лимфатических узлов в диагностике метастазов наиболее оптимально использование сочетания обоих
Список литературы Морфологические аспекты кровоизлияний в опухоли гипофиза
- de Heide L.J., van Toi K.M., Doorenbos В. Pituitary apoplexy presenting during pregnancy. Neth J Med. Nov 2004;62(10):393-396.
- Ito Y., Takano S, Muroi A., Matsumura A. . No shinkei geka. Neurological surgery. Sep 2009;37(9):887-892.
- Serhal D., Weil R.J., Hamrahian A.H. Evaluation and management of pituitary incidentalomas. Cleveland Clinic journal of medicine. Nov 2008;75(11):793-801.
- Salehi F., Kovacs K., Cusimano M.D., et al. Immunohistochemical expression of nestin in adenohypophysial vessels during development of pituitary infarction. Journal of neurosurgery. Jan 2008;108(1):118-123, doi: 10.3171/jns/2008/108/01/0118.
- Kim S.H., Lee K.C. Cranial nerve palsies accompanying pituitary tumour. Journal of clinical neuroscience: official journal of the Neurosurgical Society of Australasia. Dec 2007;14(12):1158-1162, DOI: 10.1016/j.jocn.2006.07.016
- Huang D.Q., Li W.R., Ou X.Y. . Zhonghua er bi yan hou tou jing wai ke za zhi = Chinese journal of otorhinolaryngology head and neck surgery. Apr 2006;41(4):306-307.
- Carsote M., Chirita C., Dumitrascu A., Hortopan D., Fica S., Poiana C. Pituitary incidentalomas -how often is too often? J Med Life. Jan-Mar 2009;2(1):92-97.
- Xing B., Deng K., Ren Z.Y., et al. Magnetic resonance imaging characteristics and surgical results of adrenocorticotropin-secreting pituitary adenomas. Chinese medical sciences journal = Chung-kuo i hsueh k’o hsueh tsa chih/Chinese Academy of Medical Sciences. Mar 2008;23(1):44-48.
- Hiroi N., Ichijo T., Shimojo M., Ueshiba H., Tsuboi K., Miyachi Y. Pituitary apoplexy caused by luteinizing hormone-releasing hormone in prolactin-producing adenoma. Internal medicine (Tokyo, Japan). Aug 2001;40(8):747-750.
- Haboubi H., Azam I., Edavalath M., Redfern R.M., Price D.E., Stephens J.W. Apoplexy in a corticotrophin-secreting pituitary macroadenoma: a case report and review of the literature. QJM. Aug 2010;103(8):607-609, doi: 10.1093/qjmed/hcp197.
- Shou X.F., Wang Y.F., Li S.Q., et al. Microsurgical treatment for typical pituitary apoplexy with 44 patients, according to two pathological stages. Minim Invasive Neurosurg. Oct 2009;52(5-6):207-211, DOI: 10.1055/S-0029-1241848
- Baglin G., Betermiez P., Bertout A., Toussaint P., Bremond-Gignac D., Milazzo S. J Fr Ophtalmol. Oct 2009;32(8):572-576, DOI: 10.1016/j.jfo.2009.04.019
- Sibal L., Ball S.G., Connolly V., etal. Pituitary apoplexy: a review of clinical presentation, management and outcome in 45 cases. Pituitary. 2004;7(3):157-163, doi: 10.1007/s11102-005-1050-3.
- Semple P.L., Jane J.A., Jr., Laws E.R., Jr. Clinical relevance of precipitating factors in pituitary apoplexy. Neurosurgery. Nov 2007;61(5):956-961; discussion 961-952.10.1227/01. neu.0000303191.57178.2a.
- Eaton H.J., Phillips P.J., Hanieh A., Cooper J., Bolt J., Torpy D.J. Rapid onset of pituitary apoplexy after goserelin implant for prostate cancer: need for heightened awareness. Internal medicine journal. Jul 2001;31 (5):313-314.
- Semple P.L., De Villiers J.C., Bowen R.M., Lopes M.B., Laws E.R., Jr. Pituitary apoplexy: do histological features influence the clinical presentation and outcome? J Neurosurg Jun 2006;104(6):931-937, DOI: 10.3171/jns.2006.104.6.931
- McFadzean R.M., Doyle D., Rampling R., Teasdale E., Teasdale G. Pituitary apoplexy and its effect on vision. Neurosurgery. Nov 1991;29(5):669-675.
- Fraioli B., Esposito V., Palma L., Cantore G. Hemorrhagic pituitary adenomas: clinicopathological features and surgical treatment. Neurosurgery. Nov 1990;27(5):741-747; discussion 747-748.
- Cardoso E.R., Peterson E.W. Pituitary apoplexy: a review. Neurosurgery. Mar 1984;14(3):363-373.
- Muller W. PH. Zur Klinik und Autologie der Massenblutungen in Hypophysenadenome -Dtsch ANervenklinik -1953-170.-p. 326-336.1953.
- Grant F.C. The surgical treatment of pituitary adenomas. JAMA.-1939,-113,-p. 1279-1282.1939.
- Poussant T.Y. BP, Anthony D.C. et al. Hemorrhagic pituitary adenomas of adolescence.-Am J Neuroradiol.-1996 -Nov.-17.-p. 1907-1912.1996.
- Chang C.V., Felicio A.C., Toscanini A.C., Teixeira M.J., Cunha-Neto M.B. Pituitary tumor apoplexy. Arquivos de neuropsiquiatria. Jun 2009;67(2a):328-333.


