Морфологические аспекты восстановления дефекта глазницы крысы биоматериалом на основе эластина
Автор: Лебедева А.И., Нигматуллин Р.Т., Кутушев Р.З.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Глазные болезни
Статья в выпуске: 2 т.16, 2020 года.
Бесплатный доступ
Цель; выявить морфологические аспекты замещения ксеногенного децеллюляризированного эластинового матрикса (КДЭМ), трансплантированного в костный дефект верхней стенки глазницы крысы. Материал и методы. Эксперимент проведен на 60 крысах породы Вистар, которым создавали дефект верхнего края глазницы размером 7x4 мм. В опытной группе (п=30) в зону дефекта был помещен КДЭМ размером, аналогичным дефекту, и зафиксирован шовным материалом (шелк 50 мкм). В контрольной группе (п=30) послойно ушивали мягкие ткани. Иссечение тканей производили через 1, 3 и 12 месяцев. Использовали гистологические, иммуногисто-химические и электронно-микроскопические методы. Результаты. КДЭМ постепенно замещался костной тканью на фоне выраженной реакции CD68+/MMP-9+ макрофагов, свидетельствующих о его резорбции и лизисе. Остеогенез происходил эндесмально, периостально, чему предшествовала центростремительная миграция эндотелиальных почек с последующей дифференцировкой в гемокапилляры и разрастание рыхлой волокнистой соединительной ткани, содержащей прогениторные клетки. Микроокружение, представленное ретикулиновыми волокнами, TGF-M, сульфатированными гликозаминогликанами, могло способствовать дифференциации прогениторных клеток в остеогенном направлении и остеогенезу. В контрольной группе на протяжении всего эксперимента дефект оставался открытым. Заключение. Децеллюляризированный биоматериал на основе эластинового матрикса обладает остеокондуктивными и остеоиндуктивными свойствами и может служить адекватным биомиметиком для восстановления костных дефектов.
Кости глазницы, ксеногенный эластиновый биоматериал, регенерация, трансплантация
Короткий адрес: https://sciup.org/149135575
IDR: 149135575 | УДК: 43
Текст научной статьи Морфологические аспекты восстановления дефекта глазницы крысы биоматериалом на основе эластина
Введение. Проблема стимуляции остеорепарации остается актуальной до настоящего времени. Травматические повреждения костей глазницы могут приводить к формированию обширных дефектов. Недостаток костной ткани и его несостоятельная регенерация приводят к необратимым последствиям, связанным с высоким риском осложнений со стороны зрительного аппарата и нервной системы. В настоящее время «золотым стандартом» восстановления объема кости считается аутотрансплантация костной ткани [1]. Однако данный метод имеет определенные ограничения, касающиеся объема костной ткани, травматизма и значительных дефектов в месте ее забора [2]. Ксеногенный биоматериал обладает рядом преимуществ: заготавливается заранее, имеет продолжительный срок хранения при отсутствии дефицита сырья и доступности и пр.
Одним из методов направленной костной регенерации является метод костной инженерии с применением таких доступных, продуктивных остеозамещающих биоматериалов, как ксеногенный децеллюляризированный эластиновый матрикс (КДЭМ) (патент №2440148) [3]. Однако каждый конкретный случай применения трансплантата требует всестороннего изучения.
Цель: выявление морфологических аспектов замещения ксеногенного децеллюляризированно-го эластинового матрикса, трансплантированного в костный дефект верхней стенки глазницы крысы.
Материал и методы . Эксперимент проведен на 60 крысах породы Вистар, которым создавали дефект верхнего края глазницы размером 7х4 мм. Для этого использовался физиодиспенсер KaVo INTRASURG 1000 с наконечником 3мм. Исследование выполнено в соответствии со стандартами Надлежащей клинической практики (Good Clinical Practice) и принципами Хельсинкской декларации. Протокол исследования одобрен этическим комитетом. Удаленный костный фрагмент включает большую часть верхнего края глазницы и является моделью обширной травмы глазницы. В опытной группе (n=30) в зону дефекта был помещен КДЭМ, который сверху покрывался мембранным волокнистым соединительнотканным трансплантатом. Размер был аналогичным дефекту. Весь комплекс трансплантируемых тканей фиксировался к краям костного дефекта шелковой лигатурой диаметром 50 мкм. На кожу накладывались узловые швы. В контрольной группе (n=30) наносился аналогичный дефект, в котором послойно ушивали мягкие ткани. Иссечение биопсийных тканей производили через 1, 3 и 12 месяцев. КДЭМ изготовлен из выйной связки крупного рогатого скота и подвергался физико-химической обработке согласно разработанному протоколу (ТУ 42-2-537-87). Этический комитет одобрил протокол исследования.
Исследуемые ткани фиксировали в 10%-м растворе нейтрального формалина, обезвоживали в серии спиртов возрастающей концентрации и заливали в парафин по общепринятой методике. Готовили на микротоме LEICA RM 2145 (Германия) срезы, которые окрашивали гематоксилином и эозином, по Ван Гизону, по Маллори, по Хейлу, альциановым синим при рН 1,0 и при рН 2,5 после метилирования, импрегнировали солями серебра по Футу.
Для иммуногистохимического исследования парафиновые срезы толщиной 4 мкм окрашивали с помощью иммуногистостейнера Leica Microsystems Bond™ (Германия). В качестве первых антител применяли c-kit, CD68, Thy-1, FGF-b, MMP-9, Pecam, TGF-b1 col-1, col-3 в разведении 1:300 (Santa Cruz Biotechnology, США). Для демаскировки использовали непрямую стрептавидин-биотиновую систему детекции Leica BOND (Novocastra™, Германия). Исследование и визуализацию препаратов проводили с использованием светового микроскопа Leica DMD 108 (Германия).
Для электронно-микроскопического исследования из биопсийных кусочков вырезали фрагменты тканей размером 1-2 мм3 и фиксировали в 2,5%-м растворе глютаральдегида, приготовленного на какодилатном буфере (рН 7,2-7,4) с дофиксацией в 1 %-м растворе OsO4 на том же буфере. Материал обезвоживали в спиртах возрастающей концентрации и заливали в эпон-812 по общепринятой методике. Предварительно готовили полутонкие срезы на ультратоме ЕМ UС 7 (Leica, Германия) и окрашивали их раствором толуидинового синего на 2,5%-м растворе безводной соды. На данных срезах выбирали участки для электронно-микроскопического исследования. Ультратон-кие срезы контрастировали 2%-м водным раствором уранилацетата, цитратом свинца по Рейнольдсу и изучали под трансмиссионным микроскопом JEM-1011 (Jeol, Япония).
Результаты . В опытной группе через 30 суток после трансплантации ксеногенного децеллюляризи-рованного эластинового матрикса в ткани не только выявлялись признаки разрастания волокнистой соединительной ткани перифокально, но и наблюдался инфильтративный рост коллагеновых волокон в межволоконные пространства биоматериала. Окружающая волокнистая соединительная ткань удерживала края трансплантата с костными дефектами глазницы и, таким образом, способствовала репозиции и прочной фиксации пересаженного материала с краями костного ложа. В межволоконных пространствах биоматериала определялись тонкие прослойки рыхлой волокнистой соединительной ткани, которые формировали сеть в центростремительном направлении. При импрегнации солями серебра и идентификации коллагена выявлено, что волокнистый компонент новообразованной соединительной ткани проявлял свойства аргентофилии и определялся как коллаген III типа (Col 3). Данные ретикулиновые волокна характерны для молодой незрелой грануляционной ткани. Инфильтрация окружающей КДЭМ оформленной волокнистой соединительной ткани была макрофагально-фибробластическая с привлечением остеогенных и малодифференцированных клеток. Лимфоциты были единичные в поле зрения. Кроме того, наблюдались признаки миграции FGFb+ клеток. Они присутствовали как в перифокальной зоне, так и в центральных районах трансплантата. TGF-b1+ клетки также обнаруживались в небольшом количестве. Визуально численность их была сопоставима с численностью макрофагов и/или FGF-b + клеток.
На данном сроке выявлялись фрагменты зарождающейся костной ткани в виде мелких округлых островков, локализующихся по периферии, — остеоидов, окруженных остеобластами. Цитоплазма остеобластов содержала укороченные многочисленные каналы гранулярного эндоплазматического ретику-люма. В цитозоле определялись клеточные центры. Митохондрии овальные, мелкие, с плотным митохон-
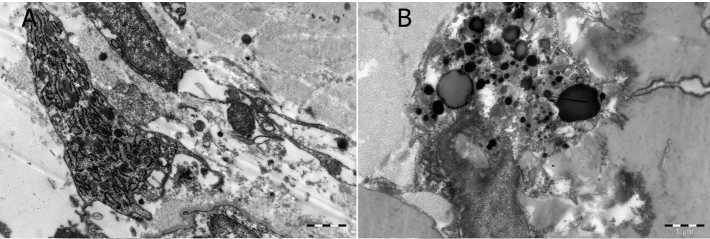
Рис. 1. Инфильтрация ксеногенного децеллюляризированного эластинового матрикса. Электронограмма: А — остеобласты; В — макрофаги
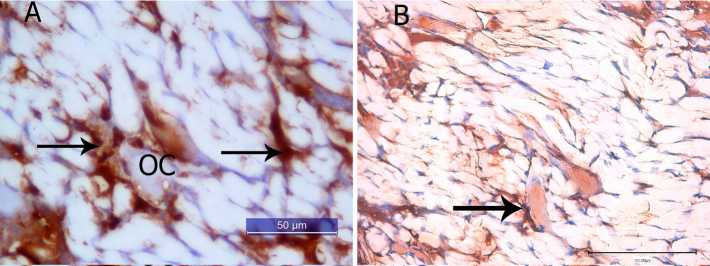
Рис. 2. Разрастание кровеносных сосудов в межволоконных промежутках биоматериала с муральными клетками: А — остеоид (ОС) в окружении Pecam+ клеток (↑) и в межволоконных пространствах ксеногенного децеллюляризированного эластинового матрикса. Непрямой иммунопероксидазный метод выявления Pecam с докраской гематоксилином; В — выявление с-kit+ клеток (↑). Непрямой иммунопероксидазный метод выявления с-kit с докраской гематоксилином
дриальным матриксом. Цитолемма образовывала тонкие, длинные выросты. Ядро было с признаками активации: содержало равномерно распределенный эухроматин. Ультраструктура клеток указывала на активную синтетическую функцию клеток и митотическую готовность (рис. 1 А ). Макрофаги выявлялись возле биоматериала и проявляли признаки активной фагоцитарной деятельности. В их расширенном ободке цитоплазмы обнаруживались многочисленные фагосомы и остаточные тельца (рис. 1 В ).
Эндотелиальные Pecam+ клетки проникали в межволоконные промежутки и обнаруживались возле остеоидов — первичных центров окостенения (рис. 2 А ). Наблюдались c-kit+ и Thy-1+ клетки в составе рыхлой волокнистой соединительной ткани, в частности возле гемокапилляров. Следовательно, клетки либо имели гематогенное, костномозговое происхождение, либо являлись муральными клетками кровеносных сосудов (рис. 2 В ).
При выявлении суммарной фракции гликозаминогликанов (ГАГ) реакция была положительная. При их дифференцировании обнаружено, что основную массу составляют сульфатированные ГАГ: дерматан-, кератансульфат и хондроитинсульфаты -4, -6. Несульфатированные ГАГ не определялись.
Через 90 суток после проведенной операции в ткани выявлялись признаки продолжающегося замещения ксеногенного эластинового биоматериала соединительнотканно-костным регенератом. MMP-9+ и CD68+ клетки выявлялись в перифокальной зоне и, по всей видимости, способствовали разрушению и лизису эластических волокон. Вокруг эластинового матрикса формировалась костная ткань, которая в виде костной капсулы инкрустировала его со всех сторон. Со стороны периоста материнской кости фиксировались признаки миграции периостальных остеогенных клеток в сторону КДЭМ.
Новообразованная кость постепенно разрасталась и дифференцировалась. Определялась остеон-ная структура кости с наличием костных пластинок. Пластины формировали Гаверсовы каналы, в которых выявлялась рыхлая волокнистая соединительная ткань и остеогенные клетки (рис. 3 А ). Соединительнотканная мембрана, служащая ограничителем трансплантата, постепенно лизировалась и резорбировалась макрофагами. На смену фагоцитам мигрировали фибробласты и замещали соединительнотканный трансплантат аутологичной волокнистой соединительной тканью в соответствии с заданным вектором. Таким образом, новообразованная кость снаружи была покрыта плотной волокнистой соединительной тканью.
Спустя 365 суток у всех экспериментальных животных опытной группы (100%) обнаруживался регенерат, состоящий из костной дифференцированной ткани с наличием всех структурных элементов: Гаверсовыми каналами, Фолькмановскими каналами с развитой сетью гемокапилляров. В костных лакунах выявлялись замурованные остеоциты. Новообразованный костный матрикс сохранял черты хронологической гетерогенности матрикса. В части кости все еще преобладал волокнистый матрикс, в основном кость состояла из плотных костных пластин. Новообразованная кость была покрыта надкостницей (рис. 3 В ).
В контрольной группе у всех экспериментальных животных на протяжении всего эксперимента дефект оставался открытым. Костная ткань не формировалась на всей площади раны глазницы. В месте дефекта разрасталась волокнистая соединительная ткань. Прогениторные фибробластические клетки
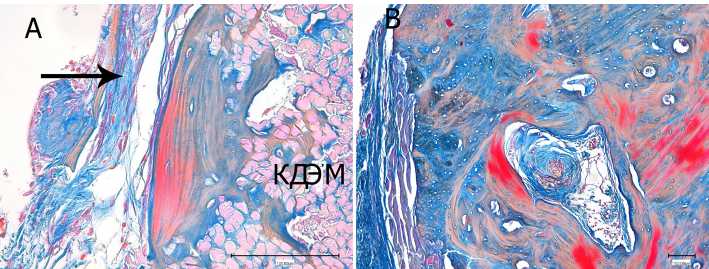
Рис. 3. Замещение ксеногенного децеллюляризированного эластинового матрикса (КДЭМ) костной тканью:
А — остеогенез через 90 суток. Сохраняются фрагменты биоматериала. Новообразованная волокнистая соединительная ткань — периост (↑); В — новообразованная губчатая кость через 365 суток, Гаверсовы каналы, кровеносные сосуды. Окраска по Маллори
Thy-1+, а также профиброгенные ростовые факторы FGF-b, TGF-b1 практически отсутствовали. При ИГХ-исследовании выявлено, что макрофаги CD68+ содержались в строме в малом количестве и только в начальный период эксперимента, как и MMP-9+ клетки.
Обсуждение. В опытной группе в зоне трансплантации эластинового биоматериала формировалась губчатая кость, которая замещала дефект на протяжении всей раневой поверхности. Более продуктивному и эффективному течению заживления в опытной группе предшествовал ряд ключевых факторов. КДЭМ служил подложкой, замещающей костный дефект и удовлетворяющей требованиям биосовместимости биоматериалов [4].
Анализируя клеточную реакцию в ответ на трансплантацию эластинового биоматериала, можно заключить, что КДЭМ был достаточно инертным и не вызывал в ткани иммунное воспаление. Клеточная реакция в период 30 суток после пересадки была направлена на фиброзирование биоматериала. Лимфоцитарная реакция выражена слабо. Она наблюдалась в основном в начальный период замещения, так как, вероятно, связана с хирургической травмой. Следовательно, эластиновый биоматериал обладал низкой иммуногенностью.
Выявлено, что КДЭМ являлся хемоаттрактантом умеренного количества CD68+ макрофагов, что свидетельствовало о его постепенном лизисе и резорбции. Перегруженность цитоплазмы вторичными вакуолями является ярким показателем биодеградации эластинового матрикса. MMP-9 является ферментом семейства металлопротеиназ и участвует в ремоделировании межклеточного матрикса. Источниками MMP-9 являются кератиноциты, моноциты, лейкоциты, макрофаги и фибробласты [5]. MMP обусловливают деградацию компонентов межклеточного матрикса, таких как компоненты базальных мембран (коллаген IV типа, ламинин, энтактин, протеогликаны и гликозаминогликаны), коллагенов I, II, III типов, фибронектина, нефибриллярных коллагенов, эластина. Он способствует не только деградации, но и фиброзированию ткани при его избыточной концентрации. Численность и локализация CD68+ и MMP-9+ клеток была сопоставима, поэтому можно предположить, что основным источником коллагеназ являлись макрофагальные клетки. Известно о гетерогенности и полярности макрофагальных клеток. Они могут секретировать либо профиброгенные факторы, либо провоспалительные [6]. Исходя из представленных данных, фенотип макрофагов соответствовал
М2-дифференциации, что подтверждает низкую иммуногенность трансплантата.
Фиброгенные факторы FGF-b и TGF-b1 могут активировать и различные клеточные популяции: макрофаги, фибробласты, миофибробласты. Выявленные цитокины стимулируют развитие малодифференцированных клеток в фибробластическом направлении и синтезе ими коллагеновых волокон и новообразованной стромы. Известно также, что FGF-b и TGF-b1 являются мощными ангиогенными факторами [7]. В нашем эксперименте эти данные подтверждаются активным ростом межклеточного матрикса, представленного коллагеном III типа — ретикулиновыми волокнами и сульфатированными гликозаминогликанами.
Наряду с коллагеногенезом происходил интенсивный ангиогенез, который предшествовал резорбции и фиброзному замещению биоматериала. Происходила центростремительная миграция эндотелиальных почек (Pecam+) с последующей дифференцировкой в гемокапилляры в межволоконных пространствах. Недавние исследования показали, что экзосомы, секретирующиеся эндотелиальными клетками, напрямую связаны с остеогенезом. Костные повреждения мобилизуют эндотелиальные про-гениторные клетки из костного мозга в периферическую кровь, направляя их в районы поврежденной кости, что может способствовать ангиогенезу и регенерации костной ткани. Наряду с ангиогенезом действие стромально-клеточного фактора 1, присутствующего в перицитах, также способствует ускорению заживления и эффективной минерализации. При дефиците эндотелиально-производных экзосом эффективной регенерации кости не происходит, а следовательно, значительно удлиняются сроки заживления [8].
В нашем исследовании в составе муральных клеток выявлялись мезенхимные стволовые клетки с-kit и Thy-1. Если Thy-1 клетки расценивают как прогени-торные фибробластические клетки, то с-kit+ клетками могут являться перициты. Перициты присутствуют в любом органе в составе микрососудов, способны дифференцироваться в остеогенном, адипогенном, хондрогенном и муральном направлениях. Известно, что и с-kit+-малодифференцированные примитивные мезенхимные стволовые клетки (МСК) обладают плюрипотентностью и могут трансформироваться в различные клеточные клоны: остеогенный, адипо-генный и хондрогенный, ангиогенный (эндотелиоци-ты и перициты) [9].
Микроокружение, представленное ретикулиновыми волокнами (Соl-3) и содержащее TGF-b1
с сульфатированными гликозаминогликанами, могло способствовать дифференциации прогениторных клеток в остеогенном направлении и формированию минерализированных островков и костных каллусов. TGF-b1 является одним из членов семейства TGF-b, хорошо изучена его роль в ремоделировании костной ткани. Он стимулирует дифференцировку мезенхимных стволовых клеток в остеобласты [10]. Механические свойства биоматериала могут оказывать как прямое, так и косвенное влияние на реакцию клеток, и в частности на мезенхимальные стволовые клетки. Известно также, что механические свойства матрикса играют важную роль в судьбе клеток, причем целый ряд стволовых клеток проявляет особую чувствительность к механической жесткости. Сообщается, что жесткость матрикса дифференцированно инициирует сигнальный путь TGF-b в контексте МСК-хондрогенеза, предполагая, что механическая жесткость окружающей среды влияет на то, насколько чувствительна клетка к экзогенному фактору. TGF-b обычно секвестрируется в экстрацеллюлярном матриксе матриксно-связанным большим латентным комплексом до тех пор, пока не высвобождается матриксными деградирующими протеазами во время ремоделирования матрикса. Латентные TGF-b связывающие белки являются ключевыми компонентами большого латентного комплекса и связываются с белками эластинового каркаса и эластиновыми сшивающими белками, такими как фибриллин-1 и фибулин-5. Учитывая эти данные, протеолитическая деградация эластина и высвобождение TGF-b могут быть одним из механизмов, способствующих развитию кальцификации сосудов [11].
Признано, что механические, структурные и биохимические сигналы влияют на биологическую активность клеток. Эта совокупность свойств субстрата способна действовать синергически или деструктивно либо может дифференцированно инициировать реакцию клеток на другие сигналы, что делает стратегии ортогонального управления этими сигналами важной проектной целью. Результаты, представленные здесь, служат важным доказательством принципа скоординированного подхода к изучению пересечения механических и биомолекулярных сигналов. Мы обнаружили, что жесткость матрикса способствует пролиферации и дифференциации мезенхимальных клеток в остеогенном направлении.
Данные последних лет указывают, что при использовании эластинподобного белка у стволовых клеток жировой ткани человека проявлялась остеогенная дифференцировка и демонстрировалось более близкое сходство с естественным механизмом формирования костной ткани по сравнению с коллагеновыми гидрогелями. Эластиновый матрикс обладает более прочными, жесткими механическими свойствами по сравнению с коллагеновыми матриксами. Трехмерная структура внеклеточного матрикса оказывает влияние на клеточную ориентацию и дифференцировку. Показано, что более жесткие коллаген-гликозаминогликановые субстраты направляют остеогенную связь стволовых клеток жировой ткани независимо от наличия или отсутствия факторов роста, что значительно влияет на микроструктурные сигналы, представленные стволовым клеткам, и повышает степень их остеогенного ответа [12]. Следовательно, данные нашего исследования согласуются с результатами других ученых и подтверждают гипотезу о том, что более жесткий каркас будет имитировать аналогичное внеклеточное микроокружение нативных костных клеток и сигнализировать клеткам о пролиферации, дифференцировке и минерализации в большей степени. Соединительнотканный же трансплантат, служащий футляром для эластиново- го комплекса, не обладал механической жесткостью конструкции и замещался волокнистой соединительной тканью.
В контрольной группе наблюдалось отсутствие клеток с данным спектром ростовых факторов, что указывает на ослабление реактивных фиброзирующих процессов в ткани и стабилизацию клеточностромальных взаимоотношений. В итоге наблюдался незавершенный остеогенез за счет дефицита костной ткани.
Таким образом, анализируя полученные данные, можно заключить, что в опытной группе происходил периостальный, эндесмальный остеогенез. КДЭМ обладает свойствами остеокондукции — служит матрицей для образования новой кости в ходе репаративного остеогенеза, способен направлять ее рост; обладает остеопротекцией — заменяет кость по механическим свойствам.
Заключение . Децеллюляризированный биоматериал на основе эластинового матрикса обладает остеокондуктивными и остеоиндуктивными свойствами и может служить адекватным биомиметиком для восстановления костных дефектов. Предпринятая попытка является основой для продолжающейся работы в нашей лаборатории по повышению регенеративного потенциала пространственно-градуированных эластиновых каркасов для регенеративной ремоделяции костных дефектов.
Список литературы Морфологические аспекты восстановления дефекта глазницы крысы биоматериалом на основе эластина
- Sjostrom M, Sennerby L, Nilson H, et al. Reconstruction of the atrophic edentulous maxilla with free iliac crest grafts and implants: a 3-year report of a prospective clinical study. Clin Implant Dent Relat Res 2007; 9 (1): 46-59.
- Joshi A. An investigation of post-operative morbidity following chin graft surgery. Brit Dent J 2004; 196 (4): 215-8.
- Xenogenic biomaterial for regenerative surgery: Patent №2440148/Muldashev ER, Nigmatullin RT, Galimova VU, et al.; priority 21.12.2009; publ. 20.01.2012, Bull. 2. Russian (Ксено-генный биоматериал для регенеративной хирургии: патент №2440148/Э. Р. Мулдашев, Р. Т. Нигматуллин, В. У. Галимова и др.; приоритет 21.12.2009; опубл. 20.01.2012, Бюл. № 2).
- Sevastyanov VI. Biocompatibility. Moscow, 1999; 367 p. Russian (Севастьянов ВИ. Биосовместимость. М.: Информ. центр ВНИИгеосистем, 1999; 367 с.).
- Benyon RC, Iredate JP. Is liver fibrosis reversible? Gut 2000; 46: 443-6.
- Van Ginderachter JA, Movahedi K, Hassanzadeh Ghassabeh G, et al. Classical and alternative activation of mononuclear phagocytes: picking the best of both worlds for tumor promotion. Immunobiology 2006; 211 (6-8): 487-501.
- Rachmiel A, Leiser Y. The molecular and cellular events that take place during craniofacial distraction osteogenesis. Plast Reconstr Surg Glob Open 2014; 2: e98.
- Jia Y, Zhu Y, Qiu Sh, Xu J, et al. Exosomes secreted by endothelial progenitor cells accelerate bone regeneration during distraction osteogenesis by stimulating angiogenesis. Stem Cell Res Ther 2019; 10: 12.
- Pavlova SV, Rozanova IA, Chepeleva EV, et al. Angiogenic potential of cardiac stem and mesenchymal stromal cells of rat bone marrow. Circulatory Pathology and Cardiac Surgery 2015; 19 (4-2): 77-84. Russian (Павлова С. В., Розанова И. А., Чепелева Е. В. и др. Ангиогенный потенциал кар-диальных стволовых и мезенхимальных стромальных клеток костного мозга крысы. Патология кровообращения и кардиохирургия 2015; 19 (4-2): 77-84).
- Hu BT, Chen WZ. MOTS-c Improves Osteoporosis by Promoting Osteogenic Differentiation of Bone Marrow Mesenchymal Stem Cells via TGF-p/Smad Pathway. Eur Rev Med Pharmacol Sci 2018; 22 (21): 7156-63.
- Ngai D, Lino M, Bendeck MP. Cell-Matrix Interactions and Matricrine Signaling in the Pathogenesis of Vascular Calcification. Front Cardiovasc Med 2018; 5: 174.
- Gurumurthy B, Bierdeman PC, Janorkar AV. Composition of elastin like polypeptide — collagen composite scaffold influences in vitro osteogenic activity of human adipose derived stem cells. Dental Materials 2016; 32 (10): 1270-80.


