Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии
Автор: Гривцова Л.Ю., Чернявская Т.З., Мелкова К.Н., Колбацкая О.П., Купрышина Н.А., Воротников И.К., Григорьева Т.А., Сельчук В.Ю., Тупицын Н.Н.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Профилактика, диагностика и лечение онкологических заболеваний
Статья в выпуске: 1 т.8, 2018 года.
Бесплатный доступ
При анализе 58 образцов стимулированного костного мозга (39 онкологических больных и 19 здоровых доноров), полученного для трансплантации онкологическим больным, и сопоставлении основных показателей с исторической нормой и 13 образцами костного мозга больных контрольной группы (мастопатия) выявлен ряд особенностей стимулированного костного мозга. Показано достоверное увеличение количества бластных клеток костного мозга у онкологических больных в сравнении с донорами и группой контроля (р
Костный мозг, стимуляция г-ксф, субпопуляции лимфоцитов, морфология, аутологичная и аллогенная трансплантации
Короткий адрес: https://sciup.org/140243774
IDR: 140243774 | DOI: 10.18027
Текст научной статьи Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии
Высокодозная химиотерапия с поддержкой кроветворения аутологичными кроветворными клетками, равно как и аллогенная трансплантация кроветворных клеток, является терапией выбора для многих онкогематологиче-ских больных [1, 2, 3].
В качестве терапии поддержки наиболее широко используются мобилизованные клетки периферической крови (ПК), поскольку они обеспечивают более быстрое восстановление функций кроветворения и иммунной системы [4]. Вместе с тем все чаще в клинической практике в качестве поддержки используется сочетанная трансплантация аутологичных мобилизованных клеток ПК и аутологичного костного мозга или только клетки аутологичного костного мозга после предварительной стимуляции цитокинами.
В случае аллогенной трансплантации предпочтение отдается костному мозгу — в первую очередь из-за более низкого (в 4–10 раз) содержания зрелых Т-клеток, опосредующих развитие реакции «трансплантат против хозяина» (РТПХ) [5–9]. Вместе с тем определенное соотношение субпопуляций лимфоцитов трансплантируемой кроветворной ткани чрезвычайно важно, поскольку роль субпопуляций неоднозначна. Донорские Т-клетки, как указано выше, определяют развитие РТПХ, но важны для полноценного восстановления функций иммунной системы реципиента, и, что принципиаль- но, отдельные их субпопуляции опосредуют развитие реакции «трансплантат против опухоли» [10–12]. Данный эффект подтвержден в отношении CD8+ Т-клеток памяти [13].
Среди особенностей субпопуляционного состава стимулированного костного мозга описано преобладание минорной субпопуляции Т-регуляторных клеток с протекторными свойствами в отношении пост-трансплантацион-ной РТПХ [14, 15], несмотря на то, что большая часть клеток данной субпопуляции, напротив, опосредует развитие РТПХ в случае аллогенной трансплантации мобилизованных ПК [16].
Таким образом, костный мозг с иммунологической точки зрения является более привлекательным как для ауто-, так и в качестве алло-трансплантата у онкологических больных. Учитывая высокую клиническую востребованность клеток стимулированного костного мозга в качестве трансплантата и неоднозначную роль отдельных субпопуляций лимфоцитов при этом, актуальным является детальное изучение особенностей стимулированного костного мозга.
Цель
Целью данного исследования стал детальный анализ морфологических и иммунологических (субпопуляционный состав лимфоцитов) показателей стимулированного
Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии
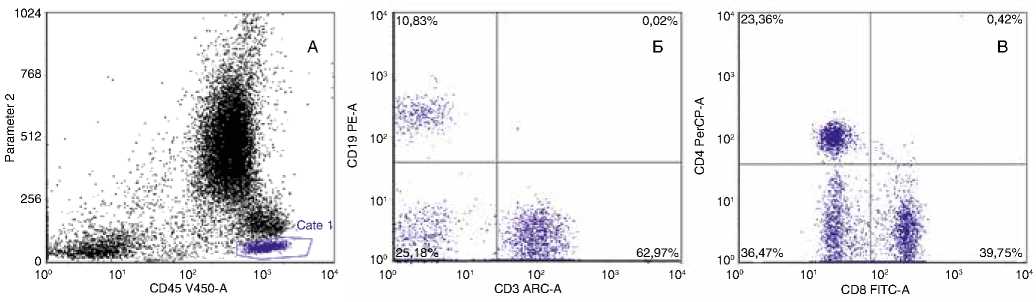
Рисунок 1. Пример оценки субпопуляций лимфоцитов стимулированного аутологичного костного мозга (6-цветная проточная цитометрия). Цитограмма А – гейт лимфоцитов CD45+ (выделены синим). Цитограммы Б, В демонстрируют субпопуляционный состав лимфоцитов: Б – процент В-клеток составил 10,83% от лимфоцитов (ось ординат, левый верхний квадрант), Т-лимфоцитов (CD3%) – 62,9% (ось абсцисс); В – пропорция Т-хелперов CD4+ – 23,4% (ось ординат левый верхний квадрант), пропорция Т-киллеров CD8+ – 39,7% (ось абсцисс, правый нижний квадрант)
гранулоцитарным ростовым колониестимулирующим фактором (Г-КСФ) костного мозга онкологических больных и доноров и сопоставление показателей образцов стимулированного костного мозга с нормой.
Материалы и методы
Проанализировано 39 образцов стимулированного костного мозга, полученных для аутологичной трансплантации у 39 онкогематологических больных взрослого возраста, и 19 образцов костного мозга, полученных на фоне стимуляции Г-КСФ (гранулоцитраный колониестимулирующий фактор) у 19 здоровых взрослых доноров для трансплантации взрослым онкогематологическим больным.
В группе онкологических больных было 22 женщины и 17 мужчин. Средний возраст больных – 36 лет при медиане 33 года (от 18 до 57 лет). Большинство составили пациенты с лимфомой Ходжкина – 21 человек, 11 больных – с ОМЛ (острый миелоидный лейкоз), два – с не-ходжкинскими лимфомами высокой степени злокачественности и один – с острым лимфобластным лейкозом (В-линейный иммуноподвариант).
Группу доноров костного мозга составили 9 мужчин и 10 женщин, средний возраст 40 лет, медиана 37 лет (от 18 лет до 61 года).
Как аутологичный, так и аллогенный костный мозг получен на фоне предшествующей стимуляции кроветворения Г-КСФ. У доноров Г-КСФ применяли в течение трех суток до эксфузии костного мозга в дозе 10 мкг/кг в сутки. У онкологических больных стимуляция проводилась в стабильной фазе кроветворения, доза Г-КСФ и режим стимуляции были такими же, как у доноров.
В качестве группы сравнения проанализированы 13 образцов аспиратов костного мозга женщин, у которых диагноз рака молочной железы был исключен.
Образцы стимулированного и аутологичного, и аллогенного костного мозга получены в условиях операционной в начале процедуры эксфузии (первый вкол), объем образца не превышал 1 мл.
Каждый образец костного мозга охарактеризован морфологически и иммунологически, исследования проведены из одной пробирки – мазки и клетки для иммунологического исследования приготовлены непосредственно в лаборатории.
Клеточность образцов подсчитывалась на гематологическом анализаторе Micros 60.
Субпопуляционный состав лимфоцитов и количество клеток-предшественников оценено иммунологически (многоцветная, 3–6-цветная проточная цитометрия) с использованием прямых коньюгатов моноклональных антител к антигену клеток-предшественников CD34, а также к основным антигенам Т-клеток, В-клеток и NK-клеток (клон и метки указаны в табл. 1). Подсчет субпопуляций лимфоцитов осуществлялся в пределах лимфоцитов – лимфоцитарном гейте (рис. 1).
Таблица 1. Характеристика моноклональных антител
|
Антиген |
Клон антител |
Флуоресцентная метка |
|
CD34 |
8G12 |
Фикоэритрин (PE) |
|
CD45 |
HI30 |
PЕ-Сy5 (фикоэритрин-цианин 5), ECD (фикоэритрирн-тексас ред), V-450 |
|
CD3 |
UCHT1 SK7 |
PЕ-Сy5 (фикоэритрин-цианин 5) APC (алофикоцианин) |
|
CD4 |
SK3 |
FITC (флуоренсцеин) PЕ-Сy5 (фикоэритрин-цианин 5) |
|
CD8 |
SK1 |
PE (фикоэритрин) FITC (флуоресцеин) |
|
CD56 |
MY31 |
Фикоэритрин (PE) |
|
CD16 |
3G8 NKP15 |
Фикоэритрин (PE) FITC (флуоресцеин) |
|
CD19 |
SJ25C1 |
Фикоэритрин (PE) FITC (флуоресцеин) |
Уровни неспецифического связывания определялись на основании изотипических контролей – мышиных иммуноглобулинов с соответствующей флуоресцентной меткой.
Статистическая обработка данных проведена с использованием программы SPSS 17.0.
Результаты
В 41,0% образцов онкологических больных (16 из 39) и в 26,3% образцов доноров (5 из 19) костный мозг был гиперклеточным. Один из образцов костного мозга, полученный у 62-летнего донора, был гипоклеточным 21,0 x 10 3 в мкл. В остальных случаях костный мозг был нормоклеточным.
Характеристика морфологического состава образцов представлена в табл. 2.
Количество бластных клеток в образцах доноров составило 1,3±0,16% (от 0,2 до 3,2%) и 2,6±0,48% (от 0,2
до 15,8 %) – в образцах больных. Более 0,6% бластных клеток выявлено в 79,4% образцов (31 из 39) костного мозга онкологических больных и в 84,2% (16 из 19) донорских образцов. У двух больных ОМЛ количество бластов превысило 10,0%.
В большинстве случаев и у больных (53,8%, 21 из 39), и в донорских образцах костного мозга (78,9%, 15 из 19) гранулоцитарный росток был расширен за счет промиелоцитов и миелоцитов. Индекс созревания нейтрофилов был выше верхней границы (0,9) в 23 из 39 образцов костного мозга онкологических больных (58,9%) и в 8 из 19 (42,1%) образцов доноров. В 15,0% образцов больных (6 из 39) и образцов доноров (3 из 19) индекс созревания нейтрофилов составил менее 0,5. Необходимо отметить, что мегакариоциты выявлены во всех образцах.
Количество лимфоцитов и красный росток в образцах костного мозга доноров были близки к нормальным показателям. В 69% образцов стимулированного костного мозга (27 из 39) онкологических больных количество лимфоцитов было меньше нижней границы нормы, сужение
Таблица 2. Морфологическая характеристика образцов костного мозга
|
Показатель |
Аутологичный костный мозг (онкологические больные) |
Аллогенный костный мозг (доноры) |
P1 |
Контроль |
Р2/P3 |
|
|
Клеточность |
среднее |
194,3±19,0 |
158,3±19,7 |
0,1 |
клеточный |
|
|
медиана |
180,0 |
139,0 |
||||
|
разброс |
40,0–466,0 |
21,0–315,0 |
||||
|
Бласты (%) |
среднее |
2,67±0,46 2,1 |
1,39±0,17 1,4 |
0,012 |
0,95±0,15 1,0 |
0,037/ 0,06 |
|
медиана |
||||||
|
разброс |
0,2–15,8 |
0,2–3,2 |
0,0–0,2 |
|||
|
Сумма клеток гра- |
среднее |
67,7±2,4 |
71,2±2,1 |
0,2 |
66,3±3,29 |
0,7/ |
|
нулоцитарного ряда (%) |
медиана |
68,3 |
71,1 |
65,8 |
0,2 |
|
|
разброс |
24,2–93,0 |
54,2–88,2 |
34,2–83,2 |
|||
|
Индекс созревания |
среднее |
1,25±0,12 |
0,84±0,13 |
0,026 |
0,34±0,04 |
< 0,0001/ |
|
нейтрофилов |
медиана |
1,15 |
0,75 |
0,4 |
0,001 |
|
|
разброс |
0,1–3,0 |
0,1–2,3 |
0,1–0,5 |
|||
|
Моноциты (%) |
среднее |
2,7±0,29 |
2,6±0,32 |
0,8 |
3,3±0,47 |
0,3 |
|
медиана |
2,4 |
2,5 |
3,0 |
|||
|
разброс |
0,0–6,4 |
0,2–6,0 |
0,8–6,8 |
|||
|
Лимфоциты (%) |
среднее |
5,5±0,54 4,7 |
7,7±0,69 8,1 |
0,017 |
11,2±1,1 11,6 |
0,0001/ 0,008 |
|
медиана |
||||||
|
разброс |
1,2–18,0 |
2,2–14,4 |
5,8–17,8 |
|||
|
Сумма клеток |
среднее |
21,1±1,89 |
16,3±1,92 |
0,1 |
15,5±1,97 |
0,1/ |
|
красного ряда |
медиана |
21,2 |
15,0 |
16,0 |
0,7 |
|
|
разброс |
1,6–49,0 |
3,2–34,2 |
0,6–26,1 |
|||
|
Лейко-эритроидное |
среднее |
7,34±1,86 |
6,8±1,69 |
0,8 |
4,82±0,83 |
0,4 |
|
соотношение |
медиана |
3,2 |
5,05 |
4,1 |
||
|
разброс |
0,5–56,8 |
0,5–27,0 |
2,3–13,0 |
|||
P1 – достоверность различий при сопоставлении показателей аутологичных и аллогенных образцов
P2 – достоверность различий при сопоставлении показателей аутологичных образцов и контроля
P3 – достоверность различий при сопоставлении показателей аллогенных образцов и контроля
Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии красного ростка (менее 14,0% клеток красного ряда суммарно) демонстрировали 25,6% (10 из 39) образцов.
Сопоставление морфологического состава костного мозга показало достоверно более высокий бластоз (р=0,012 и р=0,037) и более низкую пропорцию лимфоцитов (р=0,017 и р<0,0001) в образцах костного мозга больных в сравнении как с донорским костным мозгом, так и с контрольной группой. Достоверно выше у онкологических больных был индекс созревания нейтрофилов в сопоставлении с донорским стимулированным костным мозгом и группой контроля (р=0,026 и р<0,0001 соответственно).
Сопоставление показателей миелограмм стимулированного костного мозга больных ЛХ (20 образцов) и ОМЛ (15 образцов) показало достоверное преобладание среднего количества клеток гранулоцитарного ростка (73,5±2,33% против 60,0±4,5%, р=0,008) и более высокую клеточность (255,4±28,0 кл/мкл против 125,2±19,3 кл/мкл, р=0,001) в образцах группы ЛХ. Группа образцов костного мозга больных ОМЛ в сравнении с ЛХ демонстрировала достоверно более высокое содержание лимфоцитов (7,2±0,9% против 4,4±0,58%, р=0,012) и клеток красного ряда (25,7±3,65% против 17,0±1,9%, р=0,03).
Среди лимфоцитов стимулированного костного мозга (в случае и онкологических больных, и доноров) преобладали зрелые Т-клетки (CD3+), и большинство среди них составляли Т-киллеры CD8+ (табл. 3).
Сопоставление иммунологических характеристик клеток костного мозга показало недостоверное преобладание количества CD34+ клеток-предшественников в образцах онкологических больных в сравнении с донорскими. Наибольшее количество CD34+ клеток – 10,9% – выявлено в случаях ОМЛ, при этом у онкологических больных число CD34+ клеток было прямо пропорционально числу бластов (р<0,0001), в донорской группе данная корреляция отсутствовала.
Образцы стимулированного костного мозга онкологических больных характеризовались достоверным преобладанием относительного количества (%) CD3 лимфоцитов (р=0,04), Т-киллеров CD8+ (р<0,0001) и, соответственно, более низким иммуно-регуляторным индексом (р<0,0001) в сравнении с донорскими.
В образцах стимулированного костного мозга онкологических больных выявлена обратная взаимосвязь иммуно-регуляторного индекса и индекса созревания нейтрофилов (R= –0,363, p=0,027), данная корреляция в образцах донорской группы была недостоверной.
При сравнении показателей образцов костного мозга больных группы ЛХ и ОМЛ в отношении субпопуляционного состава лимфоцитов установлено достоверное преобладание количества CD3+ лимфоцитов (82,9±3,3% и 68,3±4,5%, р=0,021) и CD4 лейкоцитов (2,14±0,2% и 1,02±0,16%, р=0,001) в группе ОМЛ.
Образцы стимулированного костного мозга, полученные у больных ЛХ, характеризовались достоверно более высоким содержанием NK-клеток CD56+ (5,6±0,5% и 3,5±0,5%, р=0,05) и более высокой пропорцией CD19+ В-лимфоцитов (26,4±5,9% и 8,1±2,9%, р=0,01) в сравнении с группой ОМЛ.
Сопоставление иммунологических показателей образцов стимулированного костного мозга (как онкологических больных, так и доноров) с контрольной группой показало достоверно более высокую пропорцию Т-киллеров и самый низкий иммуно-регуляторный индекс в образцах онкологических больных в сравнении с группой контроля (р=0,0001). Среди лимфоцитов стимулированного костного мозга и онкологических больных, и доноров выявлена достоверно более высокая пропорция субпопуляций NK-клеток – как CD16+, так и CD56+ (р<0,06 и p<0,004 соответственно), в сопоставлении с контрольной группой.
Обсуждение
В исследовании сопоставлен морфологический состав стимулированного костного мозга онкологических больных и доноров, который был получен для трансплантации онкологическим больным, с показателями образцов контрольной группы (пациенты без онкологической патологии и без стимуляции гемопоэза).
Проанализированы особенности субпопуляционного состава лимфоцитов (Т-клетки, хелперы, супрессоры. В-клетки CD19+, NK-клетки CD16, CD56) стимулированного костного мозга в сопоставлении с контрольной группой без стимуляции.
С точки зрения морфологического состава, стимуляция Г-КСФ в первую очередь отражается на увеличении пропорции бластов в костном мозге как в сравнении с исторической нормой [17], так и в сопоставлении с собственной контрольной группой.
Под влиянием Г-КСФ отмечено омоложение гранулоцитарного ростка за счет промиелоцитов и миелоцитов, что находит отражение в изменении индекса созревания нейтрофилов. В то время как суммарное количество клеток гранулоцитарного ростка незначительно превышает историческую норму и не отличается от показателей собственной контрольной группы.
С иммунологической точки зрения влияние Г-КСФ проявляется в увеличении количества (% лимфоцитов) зрелых CD3+ Т-клеток в сравнении с группой контроля. Увеличение суммарного количества Т-клеток важно c точки зрения вероятности развития РТПХ. Данный аспект может сыграть и положительную роль в отношении развития реакции «трансплантат против болезни» [5, 10–12, 14].
Важно, что среди лимфоцитов стимулированного костного мозга (в случае и онкологических больных, и доноров)
Таблица 3. Иммунологические характеристики образцов костного мозга
|
Показатель |
Аутологичный костный мозг (39 образцов) |
Аллогенный костный мозг (19 образцов) |
Контроль |
Р1 |
P2/P3 |
|
|
Клетки-предшественники CD34+ (% от ЯСК костного мозга) |
среднее медиана разброс |
1,28±0,27 0,92 0,18–10,92 |
0,88±0,11 0,73 0,32–2,45 |
нд |
0,1 |
нд |
|
CD3 |
среднее |
74,3±2,9 |
65,1±2,3 |
57,3±3,7 |
0,047 |
0,08/ |
|
(% лимфоцитов) |
медиана разброс |
78,1 29,3–94,6 |
66,7 32,0–75,3 |
56,8 35,0–72,6 |
0,7 |
|
|
CD3 (% миелокариоцитов) |
среднее медиана разброс |
3,97±0,38 3,1 1,12–10,4 |
5,17±0,51 4,76 1,43–10,8 |
Нд |
0,07 |
нд |
|
CD4 |
среднее |
27,2±1,66 |
31,7±1,8 |
26,3±3,1 |
0,07 |
0,8/ |
|
(% лимфоцитов) |
медиана разброс |
25,7 8,9–46,6 |
33,3 11,0–43,9 |
25,8 13,8–46,7 |
0,11 |
|
|
CD4 (% миелокариоцитов) |
среднее медиана разброс |
1,44±0,16 1,12 0,48–4,8 |
2,38±0,25 2,18 0,87–4,9 |
нд |
0,003 |
нд |
|
CD8 (% лимфоцитов) |
среднее медиана разброс |
46,4±1,9 46,2 16,9–74,9 |
32,4±1,6 30,8 21,8–49,4 |
30,8±2,1 31,7 22,0–41,0 |
<0,0001 |
<0,0001/ 0,5 |
|
CD8 (% миелокариоцитов) |
среднее медиана разброс |
2,49±0,23 1,95 0,51–6,28 |
2,57±0,25 2,29 0,63–5,1 |
нд |
0,8 |
нд |
|
иммуно-регуляторный индекс |
среднее |
0,59±0,03 |
1,02±0,08 |
0,9±0,14 |
0,0001 |
0,004/ |
|
(CD4/CD8) |
медиана разброс |
0,55 0,21–1,21 |
0,96 0,46–1,86 |
0,76 0,39–1,94 |
0,48 |
|
|
CD16+CD3– |
среднее |
6,77±0,69 |
6,26±0,94 |
12,9±2,47 |
0,6 |
0,002/ |
|
(% лимфоцитов) |
медиана разброс |
6,35 0,2–16,5 |
5,6 0,9–15,7 |
12,7 2,7–24,7 |
0,006 |
|
|
CD16+ CD3– (% миелокариоцитов) |
среднее медиана разброс |
0,38±0,05 0,34 0,01–1,29 |
0,44±0,07 0,4 0,08–1,35 |
нд |
0,55 |
нд |
|
CD56+ CD3– |
среднее |
4,74±0,51 |
6,7±1,0 |
14,1±2,4 |
0,09 |
<0,0001/ |
|
(% лимфоцитов) |
медиана разброс |
4,3 0,6–11,8 |
5,6 0,9–15,7 |
13,9 4,0–27,0 |
0,004 |
|
|
CD56+ CD3– (% миелокариоцитов) |
среднее медиана разброс |
0,26±0,03 0,21 0,01–0,84 |
0,48±0,08 0,41 0,09–1,35 |
нд |
0,01 |
нд |
|
CD19 |
среднее |
17,3±3,65 |
21,47±2,44 |
19,9±2,65 |
0,4 |
0,5/ |
|
(% лимфоцитов) |
медиана разброс |
6,9 0,1–71,0 |
17,2 12,4–49,0 |
21,5 8,5–31,0 |
0,9 |
|
|
CD19 (% миелокариоцитов) |
среднее медиана разброс |
1,16±0,3 0,32 0,01–7,0 |
1,64±0,25 1,48 0,38–4,5 |
нд |
0,2 |
нд |
P1 – достоверность различий при сопоставлении показателей аутологичных и аллогенных образцов
P2 – достоверность различий при сопоставлении показателей аутологичных образцов и контроля
P3 – достоверность различий при сопоставлении показателей аллогенных образцов и контроля нд – не определялось
Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии выявлено достоверно более высокое содержание CD8+ субпопуляций лимфоцитов, поскольку данные клетки могут быть протекторами РТПХ [13].
Влияние Г-КСФ проявилось и в отношении субпопуляций NK-клеток (CD3-CD16+ CD3-CD56+ лимфоциты), количество которых было достоверно более низким в образцах стимулированного костного мозга. Доза трансплантируемых NK-клеток, по данным литературы, находится в обратной корреляции с вероятностью развития хронической РТПХ, но в прямой корреляции со скоростью восстановления нейтрофилов и вероятностью развития вирусных инфекций в пост-трансплантационный период [18–20].
Необходимо отметить, что, наряду с увеличением пропорции зрелых Т-клеток в стимулированных образцах, количество лимфоцитов в большинстве случаев невысо-
ко и достоверно ниже данного показателя образцов контрольной группы.
Таким образом, в ходе исследования установлены достоверные отличия морфологического и иммунологического (субпопуляции лимфоцитов) состава костного мозга, стимулированного Г-КСФ, а именно: увеличение количества бластных клеток, омоложение гранулоцитарного ростка за счет промиелоцитов и миелоцитов, повышение содержания среди клеток эритроидного ростка более зрелых форм эритробластов и снижение процента зрелых лимфоцитов как у онкологических больных, так в донорских образцах. Среди лимфоцитарных популяций под влиянием ГКСФ и у доноров, и у онкологических больных отмечено преобладание суммарного числа зрелых CD3+ Т-клеток и CD8+ Т-киллеров и снижение количества субпопуляций NK-клеток CD56+CD3– и/или CD16+CD3 – .
Список литературы Морфологические и иммунологические особенности стимулированного Г-КСФ аутологичного и аллогенного костного мозга, применяемого для трансплантации в клинической онкологии
- Appelbaum F. R. Hematopoietic-cell transplantation at 50. The New England Journal of Medicine. 2007. Vol. 357 (15). P. 1472-1475.
- Baldomero H., Gratwohl M., Gratwohl A., Tichelli A., Niederwieser D., Madrigal A. et al. The EBMT activity survey 2009: trends over the past 5 years. Bone Marrow Transplantation. 2011. Vol. 46 (4). P. 485-501.
- Pasquini M. C., Zhu X. Current uses and outcomes of hematopoietic stem cell transplantation: 2014 CIBMTR Summary Slides. Available from: http://www.cibmtr.org 2014.
- Morton J., Hutchins Ch., Durrant S. Granulocyte -colony-stimulating factor (G-CSF) -primed allogeneic bone marrow: significantly less graft-versus-host disease and comparable engraftment to G-CSF -mobilized peripheral blood stem cells. Blood. 2001. Vol. 98. P. 3186-3191.
- Flowers M. E., Parker P. M., Johnston L. J. et al. Comparison of chronic graft-versus-host disease after transplantation of peripheral blood stem cells versus bone marrow in allogeneic recipients: long-term follow-up of a randomized trial. Blood. 2002. Vol. 100 (2). P. 415-419.
- Storek J., Gooley T., Siadak M. et al. Allogeneic peripheral blood stem cell transplantation may be associated with a high risk of chronic graft-versus-host disease . Blood. 1997. Vol. 90. P. 4705-4709.
- Holtick U., Albrecht M., Chemnitz J. M. et al. Bone marrow versus peripheral blood allogeneic haematopoietic stem cell transplantation for haematological malignancies in adults. Cochrane Database Syst. Rev. 2014. Vol. 4. CD010189.
- Anasetti C., Logan B. R., Lee S. J. et al. Peripheral-blood stem cells versus bone marrow from unrelated donors. N. Engl. J. Med. 2012. Vol. 367 (16). P. 1487-1496.
- Eapen M., Logan B. R., Horowitz M. M. et al. Bone marrow or peripheral blood for reduced-intensity conditioning unrelated donor transplantation. J. Clin. Oncol. 2015. Vol. 33 (4). P. 364-369.
- Mackall C. L., Gress R. E. Pathways of T cell regeneration in mice and humans: implications for bone marrow transplantation and immunotherapy. Immunol. Rev. 1997. Vol. 157. P. 61-72.
- Collins R. H. Jr., Shpilberg O., Drobyski W. R., Porter D. L., Giral S., Champlin R., Goodman S. A., Wolff S. N., Hu W., Verfaillie C. et al. Donor leukocyte infusions in 140 patients with relapsed malignancy after allogeneic bone marrow transplantation. J. Clin. Oncol. 1997. Vol. 15. P. 433-444.
- Kolb H. J., Schattenberg A., Goldman J. M., Hertenstein B., Jacobsen N., Arcese W., Ljungman P., Ferrant A., Verdonck L., Niederwieser D. et al. Graft-versus-leukemia effect of donor lymphocyte transfusions in marrow grafted patients. European Group for Blood and Marrow Transplantation Working Party Chronic Leukemia. Blood. 1995. Vol. 86. P. 2041-2050.
- Zheng H., Matte-Martone C., Jain Dh., McNiff J., Shlomchik W. D. Central Memory CD8_ T Cells Induce Graft-versus-Host Disease and Mediate Graft-versus-Leukemia. The Journal of Immunology. 2009. Vol. 182. P. 5938-5948.
- Zhao X. Y., Wang Y. T., Mo X. D., Zhao X. S., Wang Y. Z., Chang Y. J., Huang X. J. Higher frequency of regulatory T cells in granulocyte colony-stimulating factor (G-CSF) -primed bone marrow grafts compared with G-CSF-primed peripheral blood grafts. Journal of Translational Medicine. 2015. Vol. 13. P. 145.
- Rezvani K., Mielke S., Ahmadzadeh M., Kilical Y., Savani B. N., Zeilah J. et al. High donor FOXP3-positive regulatory T-cell (Treg) content is associated with a low risk of GVHD following HLA-matched allogeneic SCT. Blood. 2006. Vol. 108 (4). P. 1291-1297.
- Pabst C., Schirutschke H., Ehninger G., Bornhauser M., Platzbecker U. The graft content of donor T cells expressing gamma delta TCR+ and CD4 + foxp3+ predicts the risk of acute graft versus host disease after transplantation of allogeneic peripheral blood stem cells from unrelated donors. Clin. Cancer Res. 2007. Vol. 13 (10). P. 2916-2922.
- Абрамов М. Г., Воробьев А. И. Костный мозг, клеточный состав//Руководство по гематологии/под ред. А. И. Воробьева. Т. 1. Москва, 2002. С. 47-53.
- Abramov M. G., Vorob’ev A. I. Kostnyi mozg, kletochnyi sostav, Rukovodstvo po gematologii. A. I. Vorob’ev (ed.). Vol. 1. Moscow, 2002. P. 47-53. (In Russ.)
- Abrahamsen I. W., Somme S., Heldal D., Egeland T., Kvale D., Tjonnfjord G. E. Immune reconstitution after allogeneic stem cell transplantation: the impact of stem cell source and graft-versus-host-disease. Haematologica. 2005. Vol. 90. P. 86-93.
- Yamasaki S., Henzan H., Ohno Y., Yamanaka T., Iino T., Itou Y., Kuroiwa M., Maeda M., Kawano N., Kinukawa N., Miyamoto T., Nagafuji K., Shimoda K., Inaba S., Hayashi S., Taniguchi S., Shibuya T., Gondo H., Otsuka, T., Harada M., Fukuoka Blood and Marrow Transplantation Group. Influence of transplanted dose of CD56+ cells on development of graft-versus-host disease in patients receiving G-CSF-mobilized peripheral blood progenitor cells from HLA-identical sibling donors. Bone Marrow Transplantation. 2003. Vol. 32. P. 505-510.
- Rocha V., Carmagnat M. V., Chevret S., Flinois O., Bittencourt H., Esperou H., Garnier F., Ribaud P., Devergie A., Socie G., Dal’Cortivo L., Marolleau J. P., Charron D., Gluckman E., Rabian C. Influence of bone marrow graft lymphocyte subset on the outcome of HLA-identical sibling transplants. Experimental Hematology. 2001. Vol. 29. P 1347-1352.


