Морфологические и молекулярно-генетические особенности первичных глиобластом у пациентов с необычно высокой продолжительностью жизни
Автор: Мацко Марина Витальевна, Мацко Дмитрий Евгеньевич, Волков Никита Михайлович, Улитин Алексей Юрьевич, Моисеенко Владимир Михайлович, Имянитов Евгений Наумович, Иевлева Аглая Геннадиевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.18, 2019 года.
Бесплатный доступ
Первичная глиобластома (ГБ) - опухоль ЦНС, которая характеризуется быстрым течением и агрессивным поведением. Длительная продолжительность жизни пациентов с первичной ГБ является редким феноменом. По данным большинства исследователей, под «долгоживущими» пациентами с ГБ подразумеваются больные с продолжительностью жизни 3 года и более. В литературе указываются различные факторы, которые могут способствовать такой выживаемости. Цель исследования - проведение сравнительной оценки демографических, клинических, морфологических, иммуногистохимических и молекулярных особенностей первичной ГБ у пациентов с различной выживаемостью. Материал и методы. Авторами выполнено проспективное исследование 69 пациентов с первичной ГБ, наблюдавшихся в РНХИ им. проф. А.Л. Поленова с 2009 г. В рамках данной работы оценивались клинические характеристики больных, а также был выполнен анализ ряда морфологических (Ki67, P53, INA, EGFR) и молекулярногенетических параметров (экспрессия РНК генов MGMT, VEGF, PDGFRA; мутации в генах IDH1/2; ко-делеция 1 p/19q). Результаты. Продолжительность жизни более трёх лет наблюдалась у 11 (15,9 %) пациентов. В качестве позитивных прогностических факторов выступали молодой возраст больного (p=0,002), использование интенсивной терапии темозоломидом (6 и более курсов) в первой линии (p=0,016), проведение второй линии терапии (р=0,017), а также низкий уровень экспрессии гена MGMT в опухолевой ткани (p=0,038). Другие изучаемые показатели, такие как пол больных, уровень экспрессии генов VEGF и PDGFRA, наличие мутации в гене IDH1, сочетанная делеция 1p/19q, а также иммуногистохимические маркеры Ki67, p53, INA, EGFR не были ассоциированы с выживаемостью свыше 3 лет (p>0,05). Заключение. Таким образом, относительно благоприятное течение первичной ГБ ассоциировано с определёнными клиническими и биологическими особенностями данного заболевания. Высокий уровень 3-летней выживаемости больных с первичной ГБ в нашем исследовании объясняется в первую очередь индивидуальным подходом к лечению и интенсивной химиотерапевтической тактикой (от 6 до 15 циклов ХТ темозоломидом в первой линии и проведение второй линии терапии) в отличие от стандартных, ограниченных по длительности терапии, протоколов лечения.
Глиобластома, продолжительность жизни при глиобластоме, прогностические факторы при глиобластоме
Короткий адрес: https://sciup.org/140254260
IDR: 140254260 | УДК: 616-006.484-091.8:577.21 | DOI: 10.21294/1814-4861-2019-18-3-34-44
Текст научной статьи Морфологические и молекулярно-генетические особенности первичных глиобластом у пациентов с необычно высокой продолжительностью жизни
Primary glioblastoma (GB) is a rapidly progressing central nervous system tumor with aggressive biological behavior. Long-term glioblastoma survival, defined as survival beyond 3 years, is a rare phenomenon. Various factors contributing to such prolonged lifespan have been proposed. aim. This study aimed to compare demographic, clinical, morphologic, immunohistochemical and molecular features of primary GB in patients with different survival. Material and Methods. This prospective study included 69 patients, who were treated at A.L. Polenov Neurosurgery institute. The analysis considered clinical, morphologic, immunohistochemical (Ki67, P53, INA, EGFR) and genetic (MGMT, VEGF and PDGFRA gene expression; IDH1/2 mutational status, 1p/19q co-deletion) characteristics of the disease. Results. 11 (15.9 %) patients survived beyond 3 years. Prolonged survival was associated with younger patient age (p=0.002), use of more than 6 cycles of temozolomide in the 1st line therapy (p=0.016), use of the 2nd line therapy (p=0.017) and low level of MGMT expression in the tumor tissue (p=0.038). Other factors including patients’ gender, VEGF and PDGFRA mRNA expression levels, IDH1 mutation, 1p/19q deletion, and the immunohistochemical markers Ki67, p53, INA, EGFR, were not associated with prolonged survival (p>0.05). Conclusion. Prolonged survival in GB patients is a non-random event and can be explained by several clinical and biological factors. A high percentage of 3-year survival of GB patients in our study may be explained by an individual approach to treatment and intensive chemotherapeutic tactics (from 6 to 15 cycles of temozolomide in the 1st line therapy and use of the 2nd line therapy), as opposed to standard short treatment protocols.
Первичная глиобластома (ГБ) у взрослых – злокачественная опухоль головного мозга с самой низкой медианой продолжительности жизни (10–16 мес) среди всех новообразований данной локализации [1–4]. В общей онкологической практике принято оценивать 5-летнюю выживаемость, однако для первичной ГБ этот подход представляется недостаточно адекватным. В научной литературе под «долгоживущими» пациентами с ГБ подразумеваются больные, продолжительность жизни которых составляет 1–5 лет [5–14].
При этом большинство исследователей считает более правильным использовать 3-летний порог для определения этого понятия [15–18].
Для объяснения возможных причин такой продолжительности жизни недостаточно благоприятного сочетания прогностических факторов, которые традиционно оцениваются нейрохирургами: возраст пациента, функциональный статус по шкале Карновского, локализация опухоли, степень радикальности оперативного вмешательства [17, 19–22]. Следует отметить, что не все эти факторы строго влияют на продолжительность жизни у больных с ГБ [9, 19, 23]. Зачастую у радикально прооперированных пациентов с удовлетворительным функциональным статусом, вовремя получивших необходимый объем лечения (лучевая и химиотерапия), развивается ранний рецидив. С другой стороны, больные, которым выполнялось только частичное удаление опухоли или стереотаксическая биопсия, также с последующей лучевой (ЛТ) и химиотерапией (ХТ), иногда могут демонстрировать лучшие показатели выживаемости, чем больные с радикально удаленными новообразованиями [18, 23, 24–27]. Помимо вышеупомянутых клинических прогностических факторов, в настоящее время активно изучается влияние ряда молекулярно-генетических опухолевых характеристик на прогноз заболевания при первичной ГБ. В первую очередь, к таким характеристикам относится статус гена О(6)-метилгуанин-ДНК метилтрансферазы (MGMT): низкая экспрессия MGMT, обусловленная метилированием промотора данного гена, ассоциирована с лучшим ответом на терапию темозоломидом [5, 28–33].
При оценке молекулярных характеристик ГБ обычно оценивается статус соматических мутаций в генах IDH1 и IDH2, кодирующих изоцитратдегидрогеназы 1 и 2, соответственно [34]. Мутации IDH1/2 приводят к образованию онкогенного метаболита 2-гидроксиглутарата, это способствует формированию так называемого «метиляторного» фенотипа опухоли (Glioma CpG Island Methyla-tor phenotype, G-CIMP), который ассоциирован с лучшим прогнозом при глиомах [35–38]. Данные мутации встречаются с высокой частотой в диффузных и анапластических астроцитомах GII/GIII (60–90 %), олигодендроглиомах GII/GIII (88–100 %) и вторичных ГБ (62–84 %) [35, 36, 39, 40]. Частота повреждений IDH1/2 в первичных ГБ намного ниже: от 2 % до 12 % в европейской популяции [18, 34–36, 39–48, 50] и около 16 % у пациентов из Китая [49]. Присутствие мутации IDH1/2 не является обязательным условием высокой (более 3 лет) продолжительности жизни у больных с первичной ГБ; тем не менее, по данным нескольких крупных исследований, среди «долгоживущих» пациентов их частота достигает 23–34 % [27, 48].
Делеция протяжённых участков хромосом 1 и 19 в результате несбалансированной транслокации между этими хромосомами (ко-делеция 1p/19q) – ещё один важный для глиом молекулярный параметр. Ко-делеция 1p/19q в первичных ГБ – событие достаточно редкое [50]. Имеются значительные расхождения в оценках прогностической значимости сочетанной делеции 1p/19q [27, 51–53].
Материал и методы
Проведено проспективное исследование 69 пациентов старше 18 лет с супратенториальными первичными глиобластомами. Всем больным вы- полнялось оперативное вмешательство с разным объемом циторедукции – от стереотаксической биопсии (СТБ) до макроскопически тотального удаления опухоли. Больным после операции проводилась ЛТ (с темозоломидом или без) и ХТ (табл. 1). Под «интенсивной ХТ» понималось проведение 6 и более циклов терапии темозоломидом, а под «стандартной ХТ» – от 2 до 5 циклов [23]. При наступлении рецидива заболевания больные в большинстве случаев повторно оперировались с последующим проведением ЛТ или радиохирургии, а также 2-й/3-й линий терапии.
Гистологический диагноз ставился в соответствии с классификациями ВОЗ опухолей ЦНС (2007/2016). Иммуногистохимическое исследование (ИГХ) выполнялось c использованием антител GFAP (poly, DakoCytomation), Ki67 (MIB-1, DakoCytomation), P53 (DO-7, DakoCytomation), EGFR (EP38Y, BioGenex), INA (poly, BioGehex), при необходимости – Syn (27G12, DakoCytomation), NSE (BBS/NC/VI-H14, DakoCytomation), NB (NB84A, Leica). При оценке цитоплазматического окрашивания антителами GFAP и EGFR пользовались полуколичественным методом: 0 – окрашивание отсутствует, 1+ – слабое окрашивание, 2+ – умеренное окрашивание, 3+ – интенсивное окрашивание. При ядерном окрашивании (антитела Ki67, P53 и INA) определялся процент окрашенных клеток к их общему числу.
Относительная экспрессия мРНК генов MGMT, VEGF, PDGFRA определялась в архивном гистологическом материале при помощи полимеразной цепной реакции (ПЦР) в режиме реального времени. Пороговые уровни для разграничения низкой, средней и высокой экспрессии каждого гена (выраженные в ∆ Ct относительно гена-нормализатора SDHA) определялись как 20 и 80 перцентилей значений относительной экспрессии соответствующих генов в группе из 50 солидных опухолей, отобранных случайным образом. Мутации в генах IDH1 (экзон 4) и IDH2 (экзон 4) в опухолевой ткани детектировали при помощи анализа кривых плавления ПЦР-продуктов с высоким разрешением (HRMA – High Resolution Melting Analysis) с по-следуюшим секвенированием ДНК. Сочетанная делеция 1p/19q определялась путем оценки потери гетерозиготности по 12 однонуклеотидным заменам на участках хромосом 1p36 и 19q13. Присутствие ко-делеции 1p/19q устанавливалось в случае потери гетерозиготности по всем информативным (гетерозиготным) маркерам в образце ДНК, выделенной из опухолевого материала, при наличии не менее 1 информативного маркера на каждой хромосоме. Информативность (гетерозиготность) маркеров оценивалась в образце ДНК, выделенной из лимфоцитов периферической крови.
Оценка эффективности терапии осуществлялась по данным МРТ с контрастным усилением после каждых двух циклов химиотерапии и каждые
|
Сравнительная характеристика двух групп пациентов с первичной ГБ (c выживаемостью до 3 лет и более 3 лет) |
Таблица 1 |
||
|
Клинические характеристики |
Выживаемость |
Выживаемость |
|
|
<36 мес (n=58) |
>36 мес (n=11) |
p |
|
|
Пол |
0,484 |
||
|
Мужчины |
25 (43,1 %) |
6 (54,5 %) |
|
|
Женщины |
33 (56,9 %) |
5 (45,5 %) |
|
|
Возраст (средний) |
54 (95 % CI, 52–57) |
44 (95 % CI, 37–51) |
0,002 |
|
Химиотерапия в первой линии |
|||
|
Темозоломид |
|||
|
2–5 циклов |
21 (36,2 %) |
1 (9,1 %) |
|
|
6–15 циклов |
20 (34,5 %) |
9 (81,9 %) |
0,016 |
|
PCV |
5 (8,6 %) |
0 (0 %) |
|
|
Другое |
2 (3,5 %) |
1 (9,1 %) |
|
|
Без ХТ |
10 (17,2 %) |
0 (0 %) |
|
|
Молекулярно-генетические характеристики |
|||
|
Уровень экспрессии гена MGMT |
|||
|
Низкий |
18 (31,0 %) |
5 (45,5 %) |
0,384 |
|
Средний |
33 (56,9 %) |
6 (54,5 %) |
|
|
Высокий |
7 (12,1 %) |
0 (0 %) |
|
|
Уровень экспрессии гена VEGF |
0,755 |
||
|
Низкий |
0 (0 %) |
0 (0 %) |
|
|
Cредний |
13 (22,4 %) |
2 (18,2 %) |
|
|
Высокий |
45 (77,6 %) |
9 (81,8 %) |
|
|
Уровень экспрессии гена PDGFRA |
0,127 |
||
|
Низкий |
5 (9,1 %) |
0 (0 %) |
|
|
Cредний |
31 (56,4 %) |
9 (90 %) |
|
|
Высокий |
19 (34,5 %) |
1 (10 %) |
|
|
Мутация в генах IDH1/2 |
0,287 |
||
|
Да |
2 (3,4 %) |
1 (9,1 %) |
|
|
Нет |
47 (81,0 %) |
10 (90,9 %) |
|
|
Нет данных |
9 (15,5 %) |
0 (0 %) |
|
|
Kо-делеция 1p19q |
0,639 |
||
|
Да |
0 (0 %) |
0 (0 %) |
|
|
Нет |
36 (62,1 %) |
6 (54,5 %) |
|
|
Нет данных |
22 (37,9 %) |
5 (45,5 %) |
|
|
Иммуногистохимические характеристики |
|||
|
Ki67 (среднее значение) |
27,4 (95 % CI, 23–31) |
21 (95 % CI, 16–25) |
0,156 |
|
P53 (среднее значение) |
29 (95 % CI, 16–41) |
24,3 (95 % CI, 9–39) |
0,742 |
|
INA |
0,298 |
||
|
Окраска отрицательная |
0 (0 %) |
0(0 %) |
|
|
1+ |
5 (8,6 %) |
2 (18,2 %) |
|
|
2+ |
1 (1,7 %) |
0 (0 %) |
|
|
3+ |
3 (5,2 %) |
2 (18,2 %) |
|
|
Нет данных |
49 (84,5 %) |
7 (63,6 %) |
|
|
EGFR |
0,067 |
||
|
Окраска отрицательная |
0 (0 %) |
1 (9,1 %) |
|
|
1+ |
5 (8,6 %) |
2 (18,2 %) |
|
|
2+ |
3 (5,2 %) |
0 (0 %) |
|
|
3+ |
4 (6,9 %) |
2 (18,2 %) |
|
|
Нет данных |
46 (79,3 %) |
6 (54,5 %) |
|
2–4 мес после ее окончания по критериям RANO (Response Assessment in Neuro-Oncology Working Group) [54]. Некоторые пациенты обследовались при помощи ПЭТ с метионином с целью оценки эффективности проведенного лечения и для исключения псевдопрогрессии опухоли.
Статистическая обработка данных проводилась с использованием программного обеспечения SPSS Version 17.00. Значимость различий качественных признаков в сравниваемых группах оценивалась с использованием χ2 Пирсона или точного теста Фишера. Выживаемость пациентов была проанализирована методом Каплан – Мейера.
Результаты
Продолжительность жизни 3 года и более наблюдалась у 11 (15,9 %) пациентов (табл. 1). Детальные клинические характеристики больных с длительной продолжительностью жизни представлены в табл. 2. У больных с выживаемостью 3 года и более средний возраст составил 44 года (95 % CI, 37–51) по сравнению с 54 годами (95 % CI, 52–57) у пациентов, проживших менее 3 лет (р=0,002, t-критерий Стьюдента) (табл. 1). Первая линия лекарственной терапии была проведена 48 пациентам из группы сравнения и всем 11 пациентам с высокой продолжительностью жизни. Темозоломид получали 51/59 (86,4 %) больных, причем интенсивный режим ХТ этим препаратом (6–15 циклов) проводился значительно чаще пациентам с выживаемостью более 3 лет (9/11, 81,8 % vs 20/48, 41,7 %, p=0,016, χ2 Пирсона). Проведена оценка влияния второй линии терапии на выживаемость более 3 лет. Пациенты с выживаемостью менее 3 лет получали лекарственную терапию во второй линии в 48,3 % (28/58) случаев, тогда как в группе больных с выживаемостью 3 года и более – в 90,9 % (10/11) случаев, статистическая разница в группах – р=0,017 (тест Фишера).
В группе «долгоживущих» больных уровень экспрессии MGMT был ниже, чем у пациентов, проживших менее 3 лет (средние значения показателя delta Ct составили 3,6 и 2,5 соответственно, p=0,038, t-критерий Стьюдента). Примечательно, что среди «долгоживущих» пациентов высокая экспрессия MGMT не наблюдалась ни в одном из случаев (табл. 1, 3). При низком уровне MGMT (при терапии темозоломидом) безрецидивный период был длительнее в обеих группах (рис. 1).
Другие изучаемые показатели, такие как пол больных, уровень экспрессии генов VEGF и PDGFRA, наличие мутации в гене IDH1, сочетанная делеция 1p/19q, а также иммуногистохимические маркеры Ki67, p53, INA, EGFR, не были ассоциированы с выживаемостью свыше 3 лет (табл. 1). Уровень экспрессии сосудистоэндотелиального фактора роста (VEGF) у пациентов обеих групп был чаще высоким: в группе с выживаемостью более 3 лет – в 81,8 % случаев и в 77,6 % – в группе сравнения (табл. 1). Данные о высокой экспрессии VEGF соответствовали наличию пролиферации сосудов и их эндотелия в опухоли. У длительно живущих больных высокий уровень мРНК PDGFRA наблюдался реже, чем в группе сравнения (10 % vs. 34,5 %). Мутация в гене IDH1 (R132H) была выявлена у 3 из 60 (5 %) протестированных больных. В группе пациентов с длительной выживаемостью мутация наблюдалась только в одном случае из 11 (9,1 %), а в группе сравнения – в 2 из 49 (4,1 %). Сочетанная делеция 1p/19q не была обнаружена ни в одном из 42 протестированных случаев.
В группе «долгоживущих» больных с ГБ при гистологическом исследовании пролиферация сосудов и эндотелия была выявлена более чем в половине наблюдений (табл. 3). В подавляющем числе образцов имелись некрозы. Индекс пролиферативной активности чаще не превышал 20 % и только в 3 случаях составил от 22 до 35 %. ИГХ-окрашивание опухолевых клеток антителами P53, EGFR, INA проводилось в части случаев (табл. 3).
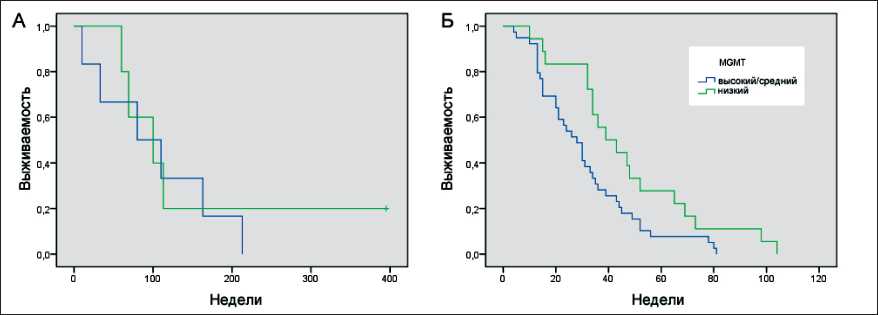
Рис. 1. Выживаемость больных с первичной ГБ в зависимости от уровня экспрессии гена MGMT. Метод Каплан – Майера: А – безрецидивная выживаемость после первой операции у больных с выживаемостью 3 года и более (11 больных);
Б – безрецидивная выживаемость после первой операции у больных с выживаемостью менее 3 лет (57 больных)
Обсуждение
Высокая продолжительность жизни у больных с ГБ – редкий и во многом не объясненный феномен. Существенно, что для достижения более чем 3-летней выживаемости недостаточно наличия известных благоприятных прогностических признаков: молодого возраста, наличия мутации в генах IDH1/2, высокого функционального статуса по шкале Карновского (который, по сути, дает лишь возможность полноценно пролечить больного) и других. Даже при сочетании всех этих благоприятных факторов пациент может не прожить и года с момента установления диагноза.
Однозначного ответа на вопрос о том, какие именно факторы в наибольшей степени влияют на выживаемость больных с ГБ свыше 3 лет, пока нет. В ряде исследований продемонстрировано, что высокой продолжительности жизни способствуют более радикальное хирургическое вмешательство, молодой возраст, женский пол, высокий
Таблица 2
Клиническая характеристика пациентов с первичной ГБ и выживаемостью более 3 лет
|
№ |
н се а о |
© И |
Локализация опухоли |
ИК |
S 2 = © л о ё о |
Первая линия терапии ЛТ ХТ |
Лечение после рецидива опе-терапия, ра- ЛТ 2/3 линии ция |
БРП 1/2 |
ОВ |
|||
|
1 |
48 |
м |
Четверохолмие |
50 |
СТБ |
54 Гр+Тем |
Тем 14 циклов (ПО) |
Нет |
40 Гр |
Ава+Ири 6 циклов |
23 мес |
36 мес 1 нед |
|
2 |
39 |
м |
Левая ЛД |
90 |
СТБ |
62 Гр+Тем |
Тем 15 циклов (ПО) |
Нет |
Нет |
Нет |
Не достигнута > 91 мес |
Не достигнута |
|
3 |
54 |
м |
Левая ТД (3 очага) |
70 |
ТУ |
35 Гр |
Тем 9 циклов |
Да |
40 Гр |
Тем +Ава 9 циклов |
18 мес 2 нед/10 мес 1 нед |
40 мес |
|
4 |
37 |
ж |
Правая ВД |
70 |
ТУ |
60 Гр |
Тем 6 циклов |
Да |
50 Гр |
Тем 5 циклов |
16 мес/7 мес |
36 мес 1 нед |
|
Тем 8 циклов/ |
||||||||||||
|
5 |
40 |
ж |
Левая ЗД |
80 |
ЧУ |
60 Гр+Тем |
Тем 6 циклов (ПО) |
Да |
Кибер нож |
Ава+Ири 9 циклов/вак-цинотерапия/ |
26 мес/24 мес/12 мес |
Не достигнута > 75 мес |
|
Ава+Тем |
||||||||||||
|
6 |
53 |
м |
Правая ЛД |
80 |
Б |
66 Гр |
Дак + Карбо 8 циклов (ЧО) |
Да |
Кибер нож |
Тем 9 циклов/ Ава+Ири 12 циклов |
14 мес/8 мес |
41 мес 1 нед |
|
7 |
60 |
м |
Левая ТД |
90 |
СУ |
60 Гр+Тем |
Тем 11 циклов (ПО) |
Нет |
Кибер нож |
Тем 10 циклов |
25 мес 2 нед |
38 мес 2 нед |
|
8 |
27 |
ж |
Левая ВД, ОД, гиппокамп, МТ |
80 |
СТБ |
61 Гр |
Тем 13 циклов (ПО) |
Нет |
Нет |
Тем 4 цикла/ Докс-нано |
49 мес |
57 мес 3 нед |
|
9 |
56 |
ж |
Левая ЛД |
80 |
ЧУ |
60 Гр+Тем |
Тем 6 циклов (ПО) |
Да |
48 Гр+Тем |
Тем 4 цикла |
37 мес 3 нед |
Не достигнута > 47 мес |
|
10 |
46 |
м |
Левая ТД и левая ЗД |
80 |
ТУ |
62 Гр+Тем |
Тем 6 циклов |
Да |
40 Гр |
Ава+Ири 11 циклов/ Тем 6 циклов |
7 мес 3 нед/15 мес |
44 мес 2 нед |
|
11 |
32 |
ж |
МТ, обе ЛД |
70 |
ЧУ |
51 Гр |
Тем 2 цикла (ПР) |
Да |
Нет |
PCV 6 циклов |
2 мес 2 нед/22 мес |
Не достигнута > 38 мес |
Список литературы Морфологические и молекулярно-генетические особенности первичных глиобластом у пациентов с необычно высокой продолжительностью жизни
- Burton E.C., Lamborn K.R., Forsyth P., Scott J., O’Campo J., Uyehara-Lock J., Prados M., Berger M., Passe S., Uhm J., O’Neill B.P., Jenkins R.B., Aldape K.D. Aberrant p53, mdm2, and proliferation differ in glioblastomas from long-term compared with typical survivors. Clin Cancer Res. 2002 Jan; 8(1): 180-7.
- Scoccianti S., Magrini S.M., Ricardi U., Detti B., Buglione M., Sotti G., Krengli M., Maluta S., Parisi S., Bertoni F, Mantovani C., Tombolini V, De Renzis C., Lioce M., Fatigante L., Fusco V., Muto P., Berti F, Rubino G., Cipressi S., Fariselli L., Lupattelli M., Santoni R., Pirtoli L., Biti G. Patterns of care and survival in a retrospective analysis of 1059 patients with glioblastoma multiforme treated between 2002 and 2007: a multicenter study by the Central Nervous System Study Group of Airo (Italian Association of Radiation Oncology). Neurosurgery. 2010 Aug; 67(2): 446-58. DOI: 10.1227/01.NEU.0000371990.86656.E8
- Johnson D.R., Leeper H.E., Uhm J.H. Glioblastoma survival in the United States improved after Food and Drug Administration approval of bevacizumab: a population-based analysis. Cancer. 2013 Oct 1; 119(19): 3489-95. DOI: 10.1002/cncr.28259
- Gilbert M.R., Dignam J.J., Armstrong T.S., Wefel J.S.,Blumenthal D.T., Vogelbaum M.A., Colman H., Chakravarti A., Pugh S., Won M., Jeraj R., Brown P.D., Jaeckle K.A., Schiff D., Stieber V.W., Brachman D.G., Werner-Wasik M., Tremont-Lukats I.W., Sulman E.P., Aldape K.D., Curran W.J., Mehta M.P. A randomized trial of bevacizumab for newly diagnosed glioblastoma. N Engl J Med. 2014 Feb 20; 370(8): 699-708. 10.1056/ NEJMoa1308573. DOI: 10.1056/NEJMoa1308573
- Gerber N.K., Goenka A., Turcan S., Reyngold M., Makarov V., Kan-nan K., Beal K., Omuro A., Yamada Y., Gutin P., Brennan C.W., Huse J.T., Chan T.A. Transcriptional diversity of long-term glioblastoma survivors. Neuro Oncol. 2014 Sep; 16(9): 1186-95. DOI: 10.1093/neuonc/nou043


