Морфологические изменения артерий головного мозга крыс при экспериментальном моделировании дефицита магния
Автор: Смирнов А.В., Снигур Г.Л., Евсюков О.Ю., Спасов А.А., Харитонова М.В., Желтова А.А.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Обзорные статьи
Статья в выпуске: 4 (36), 2012 года.
Бесплатный доступ
При изучении морфологических изменений базилярной артерии крыс в условиях экспериментального дефицита магния обнаружено повреждение эндотелия и гладкомышечных клеток средней оболочки, увеличение степени цитоплазматической экспрессии TRPM7 в них.
Эндотелий, магний, дефицит, воспаление, рецептор
Короткий адрес: https://sciup.org/142148994
IDR: 142148994 | УДК: 616.132.2-092.9:546
Текст научной статьи Морфологические изменения артерий головного мозга крыс при экспериментальном моделировании дефицита магния
Магний, являющийся кофактором более трехсот ферментов, участвует в регуляции регионарного и системного сосудистого тонуса. Одним из ведущих факторов клеточного метаболизма катионов Mg2+являются белки суперсемейства TRPM — transient receptor potential melastatin. TRPM7 играет особую роль в клетках, регулируя магниевый гомеостаз, с одной стороны, и механизмы клеточной адгезии, сократимости, а также условия развития воспалительных процессов, с другой [5]. Магниевая недостаточность тесно связана с увеличением заболеваемости сахарным диабетом, метаболическим синдромом, ишемической болезнью сердца, церебро-васкулярными заболеваниями. Согласно современным представлениям, развивающаяся при дефиците магния дисфункция сосудистого эндотелия сопровождается повышением уровня молекул адгезии, что приводит к адгезии лейкоцитов, увеличению концентрации провоспалительных цитокинов, повышению сосудистой проницаемости, пролиферации и миграции гладкомышечных клеток, а также активации тромбоцитов [4].
В условиях экспериментального дефицита магния в стенках артерий миокарда крыс обнаружены изменения, свидетельствующие о развитии хронического воспаления с последующим склерозированием, что приводит к гипоксическому повреждению сердечной мышцы [2]. Кроме того, при моделировании алиментарного магнийде-фицитного состояния выявлены морфологические признаки повреждения нейронов крупноклеточных ядер гипоталамуса [3], однако многие аспекты структурных преобразований артерий головного мозга при дефиците магния остаются недостаточно изученными.
ЦЕЛЬ РАБОТЫ
Определение влияния алиментарной недостаточности магния на структурные изменения артерий головного мозга крыс.
МЕТОДИКА ИССЛЕДОВАНИЯ
Исследования были выполнены на 30 половозрелых нелинейных белых крысах-самцах массой 200—220 г. Интактная группа животных (n = 10) составляла контроль. У остальных крыс (20 животных) моделировали магнийдефицитное состояние. Животные содержались в условиях вивария, согласно правилам лабораторной практики при проведении доклинических исследований в РФ (ГОСТ Р 50258-92, ГОСТ З 51000.3-96 и 51000.4-96) с соблюдением Международных рекомендаций Европейской конвенции по защите позвоночных животных, используемых при экспериментальных исследованиях (1997). Для моделирования алиментарного дефицита магния животные содержались на магнийдефицитной диете «ICN Biomedicals Inc.» (Aurora, Ohio, США), которая включала 20 % казеина, 70 % крахмала, 0,3 % DL-метионина, 0,2 % холина битартрата, 5 % кукурузного масла, 1 % поливитаминной смеси, 3,5 % диеты составляла полиминеральная смесь AIN-76, не содержащая магния. Для питья использовалась дистиллированная вода. Скорость и глубину развития гипомагнезиемии контролировали, определяя концентрацию магния в плазме и эритроцитах крови спектрофотометрическим методом по цветной реакции с титановым желтым (Sigma, США) с измерением на спектрофотометре «СФ-26» (ЛОМО, Россия) в кювете с длиной оптического пути 1 см при длине волны 550 нм. При снижении концентрации магния ниже 1,4 ммоль/л в эритроцитах и ниже 0,7 ммоль/л в плазме считалось, что у животных развилась гипомагнезиемия средней тяжести. К началу 8-й недели магнийдефицитной диеты у животных наблюдалось статистически значимое снижение уровня магния в эритроцитах на 57 % и в плазме — на 47 % (p < 0,05) по отношению к группе интактных крыс, после чего животных выводили из эксперимента внутрибрюшинным введением этаминала-натрия в дозе 40 мг/кг. После декапитации животных гильотинным методом образцы головного мозга фиксировали в нейтральном забуференном 10%-м формалине с дальнейшим обезвоживанием в батарее спиртов и изготовлением парафиновых срезов толщиной 5 мкм. Для проведения иммуногистохимического исследования использовались поликлональные кроличьи антитела к рецепторам TRPM7 в разведении 1 : 1200. Антигенная демаскировка проводилась высокотемпературным способом, в миниавтоклаве («Pascal», Canada) с использованием высокощелочного фосфатного буфера (pH = 9,0). Для визуализации использовалась полимерная система EnVision (Dako, Дания), в качестве хромогена — диаминобензидин (Dako, Дания). После проведения иммуногистохимической реакции с изучаемыми антигенами препараты докрашивались гематоксилином. Полуколичественную оценку результатов иммуногистохимического исследования артерий гипоталамуса крыс производили на основании данных, предложенных в виде визуально-аналоговой шкалы (Allred, 2004).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯИ ИХ ОБСУЖДЕНИЕ
У животных интактной группы в мелких артериях мышечного типа эндотелий представлен одним слоем плоских одноядерных клеток со слабо эозинофильной однородной цитоплазмой, уплощенным ядром, располагающимся в центральном отделе клетки. Гладкомышечные клетки средней оболочки имели веретеновидную форму, эозинофильную цитоплазму с уплощенным ядром, располагающимся параллельно направлению оси клетки. Признаки воспалительной инфильтрации в стенке артериальных сосудов и тромбообразования отсутствовали (рис. 1).
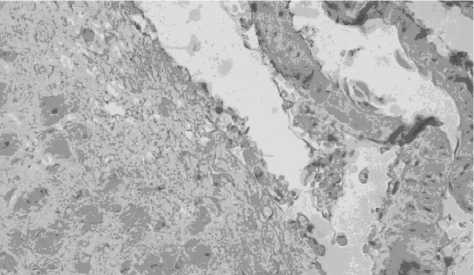
Рис. 1. Стенка артерии мышечного типа в контрольной группе. Исследование TRPM7 ПАП-методом с амплификацией, 1 : 1200, увеличение х 400
У животных с моделируемой магниевой недостаточностью в артериях мышечного типа отмечались дистрофические изменения и набухание эндотелио-цитов с их очаговой десквамацией, субэндотелиальный отек, краевое стояние и адгезия полиморфноядерных лейкоцитов к эндотелию. В отдельных артериальных сосудах мышечного типа определялись признаки вазоспазма, поверхностные дефекты эндотелиальной выстилки с формированием мелких пристеночных тромбов. В среднем слое стенок мелких артерий наблюдались признаки вакуольной дистрофии гладкомышечных клеток, гиперхромные ядра которых имеют округлую форму с трудно различимым ядрышком. Кроме того, отмечались периваскулярный отек, множественные очаговые диапедезные кровоизлияния в периваскулярных пространствах.
При иммуногистохимическом исследовании TRPM7 с применением поликлональных кроличьих антител в разведении 1 : 1200 в артериях головного мозга животных контрольной группы отмечалась равномерная умеренно выраженная (степень 1—2 по Allred) цитоплазматическая экспрессия изучаемых антигенов, ядра иммунонегативны; гладкомышечные клетки средней оболочки имели слабо выраженную (степень 1 по Allred) равномерную цитоплазматическую экспрессию или иммунонегативны. Клетки адвентициальной оболочки иммунонегативны.
При иммуногистохимическом исследовании TRPM7 с применением поликлональных кроличьих антител в разведении 1 : 1200 в артериях головного мозга опытных животных отмечалось резко выраженное усиленное накопление иммунореактивного материала (степень 3—4 по Allred) в виде плотно расположенных гранул в цитоплазме эндотелиоцитов (рис. 2). Гладкие миоциты имеют иммунонегативное ядро с перинуклеарной зоной просветления, в цитоплазме их наблюдалась умеренная и сильно выраженная грануло-вакуолярная экспрессия изучаемого антигена (степень 3—4 по Allred). Адвентициальные клетки также характеризовались выраженной иммунопозитивной цитоплазматической реакцией (степень 3 по Allred).
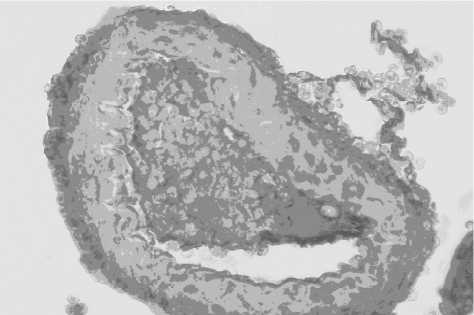
Рис. 2. Усиление экспрессии TRPM7 в условиях дефицита магния. ПАП-метод с амплификацией, 1 :1200, увеличение х 400
Структурные признаки обратимых повреждений, выявленные в эндотелии мозговых артерий, в виде отека, дистрофических изменений, усиления цитоплазматической экспрессии TRPM7, по-видимому, отражают изменения функциональной активности эндотелиоцитов. Обнаруженные нарушения в исследуемых артериальных сосудах можно рассматривать как результат влияния ионов магния на метаболизм эндотелиоцитов и других клеток сосудистой стенки, что находит отражение в развитии синдрома эндотелиальной дисфункции, продемонстрированном в ряде экспериментальных исследований (Bobkowski W., 2005; Ueshima K., 2005; Wolf F. I., 2007; Maier J. A., 2010). Выявленные изменения экспрессии TRPM7 в стенках артерий головного мозга при дефиците магния свидетельствуют о важной роли TRPM7 в регуляции сосудистой структурно-функциональной целостности. Полученные данные согла- суются с результатами аналогичных исследований Paravicini В. (2012), где показано, что гладкие миоциты отдельных фрагментов аорты мышей с моделированием у них низкой внутриклеточной концентрации Mg2+ характеризовались увеличением TRPM7 экспрессии, но снижением уровня экспрессии ан-нексина-I, отражая, по-видимому, магнийзависимые механизмы повреждения клеток и межклеточных коопераций. Обнаруженные морфологические изменения в артериях головного мозга крыс при экспериментальном воспроизведении алиментарного дефицита магния соответствуют данным [1] о важной роли повреждения сосудистого эндотелия в патоморфогенезе магниевой недостаточности. В исследованных артериях при экспериментальном моделировании алиментарного дефицита магния найдено преобладание признаков повреждения эндотелия и гладкомышечных клеток, в отличие от результатов подобного исследования мелких артерий и артериол миокарда [2], где наряду с альтерацией эндотелия обнаружены явления продуктивного васкулита, ведущего к склерозу сосудистой стенки.
ЗАКЛЮЧЕНИЕ
Морфогенез сосудистых преобразований в артериях головного мозга крыс при моделируемом алиментарном дефиците магния характеризуется преимущественно обратимыми повреждениями эндотелия с развитием его дисфункции, гладких миоцитов средней оболочки с усилением в них цитоплазматической экспрессии TRPM7, важного регулятора магниевого гомеостаза, выступающего в качестве маркера нарушений структурно-функциональной целостности сосудов.


