Морфологические изменения головного мозга у лабораторных крыс при урановой нагрузке
Автор: Алдашукуров Ырысбек Абдыжапарович
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Медицинские науки
Статья в выпуске: 8 т.8, 2022 года.
Бесплатный доступ
Исследованы структурные изменения клеток головного мозга у белых лабораторных крыс под влиянием радионуклидов. В исследованиях были использованы белые лабораторные крысы. Известно, что ионизирующее излучение повреждает ДНК, РНК и белки непосредственно, но более часто повреждение этих молекул происходит под действием высокоактивных свободных радикалов, которые образуются под влиянием радиации в результате радиолиза воды. Большие дозы радиации могут вызвать смерть клеток, в то время как более низкие дозы негативно влияют на эндогенные системы молекулярного восстановления, гомеостаз и пролиферацию клеток. Повреждение этих и других клеточных компонентов может привести к прогрессирующей гипоплазии тканей, атрофии и в конечном итоге к фиброзу. Однако теперь ясно, что уничтожение клеток само по себе не может объяснить многие тканевые реакции, потому что эти реакции также зависят от сложных событий, включая воспалительные, хронические окислительные и иммунные реакции, а также от повреждения сосудов и внеклеточного матрикса. В целом, ранние реакции, например кожные или гастроинтестинальные, состоят в уничтожении стволовых клеток/ранних клеток-предшественников, из которых развиваются функционально зрелые клетки ткани, а также в воспалительных реакциях. С другой стороны, поздние реакции (например, в легких, почках и головном мозге) включают сложные и динамические взаимодействия между разнообразными типами клеток в тканях и органах и включают инфильтрирующие иммунные клетки, продукцию цитокинов и факторов роста, часто в виде персистирующих циклических каскадов, и хронического оксидативного стресса.
Мозжечок, кора, гипоталамус, радионуклиды, мозговая оболочка, нейроны, повреждение
Короткий адрес: https://sciup.org/14124765
IDR: 14124765 | УДК: 616-092.9 | DOI: 10.33619/2414-2948/81/18
Текст научной статьи Морфологические изменения головного мозга у лабораторных крыс при урановой нагрузке
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №8. 2022
УДК 616-092.9
Ионизирующая радиация повреждает ткани по-разному, что зависит от многих факторов: дозы радиации, степени и вида внешнего воздействия, области тела человека или животных, подвергшейся облучению [5].
В данное время на территории Кыргызстана размещено 72 объекта складирования радиоактивных отходов (РАО) горнорудной промышленности. Общий объем РАО = 132 млн. м3 , занимаемая площадь 6 214 000 м2 (621 Га). Урановые хвостохранилища (Майлуу-Суу – 23; Каджисай – 1; Мин-Куш – 3; Кара-Балта – 1) содержат радионуклиды уранового ряда, суммарная активность ≈ 130 тыс. Кюри. Кроме того, в Майлуу-Сууйском месторождении, в отличие от других месторождений по содержанию урана богатые от 0,2–0,5% до 20% и очень богатые от 0,5% и выше составляли до 5% всех запасов урана [6], т.е. высокотоксичные радионуклиды были в большом количестве. Эти отходы до сих пор дают о себе знать, так как полностью не захоронены. Наиболее проблематичным является Майлуу-Сууйское месторождение, его отвалы и хвостохранилища расположены вдоль берега одноименной реки, некоторые из них внутри жилых кварталов города. Кроме того, в этой зоне с 1944 г произошло более 250 оползней, в том числе, со смывом урановых хвостохранилищ и отвалов. Из них наиболее опасным был оползень, произошедший в 1958 г вследствие аварийного разуплотнения дамбы хвостохранилища, в реку Майлуу-Суу было выброшено и смыто до 600 тыс м3 радиоактивно опасных веществ, распространившихся по руслу реки через территорию Кыргызстана в сторону густонаселенной Ферганской долины. Что представляет существенную опасность распространения радионуклидов водным путем по пойме реки Майлуу-Суу, далее по Сыр-Дарье по всей Центральной Азии [7].
Цели и задачи: Разработать этиопатогенетические механизмы развития радиационных эффектов в головном мозге обусловленных поступлением радионуклидов урана в организм животных. Изучить изменение структур нейронов головного мозга у животных под воздействием радионуклидов в дозе 10 мл/кг массы тела.
Материалы и методы исследования
Эксперименты были проведены на 16 белых лабораторных крысах с соблюдением Хельсинкской декларации Всемирной ассоциации от 2000 г. Все животные были подразделены на 2 группы. Первую контрольную группу составили 8 крыс, во вторую экспериментальную группу вошли 8 крыс получившие соли урана из расчета 10 мг/кг. Содержались в стандартных условиях вивария масса животных к началу эксперимента составляла 150–220 г. Уход и содержание экспериментальных животных были стандартными — 12-часовой период освещения при комнатной температуре (18–22 °С).
В течение всего периода проведения экспериментов крысы содержались в пластмассовых контейнерах размером 60×30×20 по 8 животных в каждой.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №8. 2022
Методика подготовки гистологических срезов проводилась в республиканской лаборатории патологической анатомии. Крыс забивали под нембуталовым наркозом в соответствии с этическими нормами, декапитировали, извлекали мозг и помещали в морозильник на один день. После этого выделяли срезы коры головного мозга, мозжечка и гипоталамуса [3]. Фиксировали в 10–15% формалине в течение 24 часа, в спирт-формалине — 24 часа, в жидкости Карнуа — 2–4 часа, в 96 % спирте — 24 часа. Затем заливали в парафин и наклеивали в колодки. Из парафиновых блоков изготавливали микроскопические срезы толщиной 5–7 микрон и окрашивали серебрение по Футу на предметном стекле. Окраску проводили по схеме: 1) окрашивали при комнатной температуре; 2) споласкивали в водопроводной воде 1-2 минуты; 3) дифференцировали чистым 96 % спиртом; 4) просветляли в эвкалиптовом масле; 5) промывали ксилолом; 6) заключали в бальзам [4].
Результаты и обсуждение
Морфологические исследования головного мозга экспериментальных животных с урановой нагрузкой начинали с макроскопического изучения головного мозга и его отделов, обращая особое внимание на область гипоталамуса [1, 2].
При внешнем осмотре мозга экспериментальных животных обращали внимание, прежде всего на кровенаполнение сосудов. Вне зависимости от зоны, отмечается выраженное полнокровие, создавая впечатление, что кровеносные сосуды специально залиты, так как даже мельчайшие сосуды четко проступали (Рисунок 1). Это особенно хорошо было видно в мягкой мозговой оболочке. Мягкая мозговая оболочка прозрачна, в отличие от контрольной группы животных содержание спинномозговой жидкости заметно больше. Ткань мозга вне зависимости от зон полнокровна, при разрезе липнет к лезвию скальпеля, что говорит об ее отечности. Полнокровные сосуды в веществе мозга видны в виде точек красного цвета, хотя в норме они незаметны. Выраженное полнокровие сосудов особенно заметно на сосудах хориальной оболочки желудочков головного мозга. Какого-либо различия в кровенаполнении различных отделов головного мозга, в том числе области гипоталамуса не заметно. В отличие от нормы, в 6–ти наблюдениях экспериментальных животных отмечается некоторое увеличение содержания спинно-мозговой жидкости не только под мягкой мозговой оболочкой, но и в желудочках. Очаговых изменений в ткани мозга не обнаружили. Значительно разнообразнее и выраженное изменения в ткани головного мозга, в частности области гипоталамуса.
В отличие от нормы оболочка мозга представлена прослойками соединительно-тканевых волокон разной толщины, структура которых просматривается практически на всем протяжении. Среди волокон расположены уплощенные ядра соединительно-тканевых клеток. Каких-либо структурных отклонений в волокнистых образованиях оболочки мозга не видно. В отдельных наблюдениях отмечалось избыточное накопление жидкости между мягкой мозговой оболочкой и тканью мозга.
Серое вещество коры головного мозга состоит из нескольких прослоек нервных клеток и их отростков, среди которых имеются клетки стромы. Закономерность расположения слоев нейроцитов не нарушена. Нейроциты отличаются по форме и размеров, что позволяет их дифференцировать. Нейроциты одного и того же слоя коры несколько отличаются друг от друга, прежде всего размерами и содержанием гранул. Чаще всего эти изменения встречаются в нейроцитах горизонтальной молекулярной пластинки и в пирамидальных нейроцитах. В этих слоях чаще, чем в более глубоких слоях встречаются явления перицеллюлярного отека и сетчатого разрежения. Клетки гиганто-пирамидальной ганглиозной пластинки практически не
Бюллетень науки и практики / Bulletin of Science and Practice
Т. 8. №8. 2022
изменены. В сером веществе коры в верхних слоях нейроцитов встречаются остатки нейроцитов, от которых сохранились только клеточные оболочки — так называемые клетки тени (Рисунок 2).
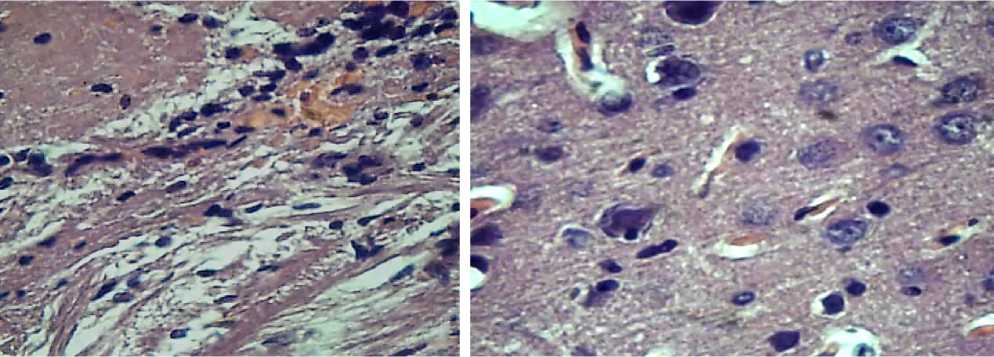
Рисунок 1. Морфологическое состояние головного мозга при радиации. Отек мягкой мозговой оболочки, развожнение, полнокровие и стаз в капиллярах. Окраска Г+Э. увеличение х 460
Рисунок 2. «Клетки тени». Периваскулярный отек. Окраска Г+Э. Увеличение х 460
В более глубоких слоях коры такие клетки не обнаружены. Появляются они только в области секретирующих нейроцитов.
По сравнению с контрольной группой, структура мозжечка сохранена и слои нейроцитовкоры отчетливо просматриваются, так же как и нейроциты, составляющие кору.
Оболочка мозжечка представлена продольно расположенными прослойками соединительно-тканных волокон, в основном эластических. Структура волокон сохранена.
В отличие от нормы в глубине извилин отмечается скопление жидкости, окрашивающейся в бледно-розовый цвет, иногда с элементами крови – эритроцитами. Сосуды под мягкой мозговой оболочкой полнокровны, застойны. Местами отмечается неравномерное утолщение сосудистой стенки.
Топография нейроцитов коры мозжечка сохранена, однако в самих нервных клетках отмечаются дистрофические изменения. По сравнению с нормой и предыдущей группой наблюдений, значительно увеличилось количество мелких клеток с перицеллюлярным отеком во всех 3-х слоях коры. В части нейроцитов отмечалось либо исчезновения гранул, либо их слияние с формированием глыбок. Чаще чем в норме, встречались клетки, в которых сохранились только клеточная оболочка и единичные внутриклеточные гранулы. Отчетливо выраженный перицеллюлярный отек имеет место вокруг корзинчатых клеток белого вещества.
При окраске препаратов по Футу отростки корзинчатых клеток четко прослеживаются. Из-за разного количества гранул корзинчатые клетки окрашены разной интенсивностью. В отличие от контрольной группы более выражен отек стромы, что делает ткань мозжечка рыхлой, придавая своеобразный «сетчатый» вид.
Известно, что нейросекреторные клетки головного мозга более лабильны по сравнению с нервными клетками и их реакция на воздействия факторов внешней среды более выражены. Структурная организация головного мозга в целом и гипоталамической области в частности, сохранена. Однако, обращает внимание соотношение различных клеточных элементов в
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №8. 2022 экспериментальной группе по сравнению с контрольными животными, кровенаполнение и состояние нейросекреторных и нервных клеток. Отклонения от нормы данных показателей и характеризует морфологию гипоталамической области экспериментальных животных.
Изменение в кровеносной системе гипоталамуса были наиболее выраженными, что доказывает многочисленные утверждения о лабильности именно сосудистой системы. Значительные морфологические сдвиги имели место во всех 8-ми случаях и были идентичным — выраженное полнокровие во всех зонах гипоталамуса, особенно сосудов наименьшего калибра – капилляров. Капилляры расстянуты, стенки их истончены, между эндотелиальными клетками наблюдается значительный разрыв, иногда эндотелий слущен. Вокруг таких сосудов зона просветления – зона периваскулярного отека. В более крупных сосудах, хотя также полнокровны, однако изменения их стенок менее выражены, периваскулярный отек зачастую не выражен. В 3х случаях из 8ми наблюдений отмечается гомогенизация сосудистой стенки, когда структура стенки не просматривается. В таких случаях стенка сосуда кажется значительно утолщенной. Эндотелий таких сосудов слущен, периваскулярный отек выражен. Отмечаются небольшие очаги кровоизлияний, преимущественно около измененных сосудов, то есть прослеживается определенная взаимосвязь изменений сосудистого русла с экстравазатами. Гистологические изменения сосудов одинаковы вне зависимости от зон гипоталамуса, однако отек сосудистой оболочки мозга выражен значительно и проявляется накоплением жидкости под мягкой мозговой оболочки.
В 2-х наблюдениях данной группы имело место кровоизлияния в мягкую мозговую оболочку. Таким образом, изменения в сосудах гипоталамуса подопытных животных выражены наиболее ярко и выходит на первый план в морфологической картине гипоталамуса.
При исследовании гипоталамуса основное внимание уделялось той его части, которая относится к гипоталамо–нейрогипофизарной системе, то есть области супраоптических и паравентрикулярных ядер переднего гипоталамуса. Гистологические исследования выявило определенные сдвиги соотношения клеточных элементов в сторону увеличения малоактивных в функциональном отношении секреторных элементов, образующих супраоптические и паравентрикулярные ядра. Как известно, функционально наиболее активными в секретирующих клетках являются более крупными, с увеличенным содержанием гранул в цитоплазме. Снижение функциональной активности обычно приводит к уменьшению размеров клеток и содержанию гранул.
Практически во всех случаях отмечалось заметное уменьшение числа функционально активных клеток. В то же время количество малоактивных клеток заметно увеличивалось. Изменились не только размеры нейросекреторных клеток, но и их строение.
По сравнению с нормой, чаще встречались клетки с дегрануляцией цитоплазмы, даже при сохранении размеров клеток, причем исчезновения гранул наблюдалось как в секреторных, так и глиальных клетках. В отличие от контроля в гипоталамусе подопытных животных появились «клетки тени», когда от клетки сохранилась только клеточная оболочка при полном исчезновении содержимого. Это касалось как секреторных, так и глиальных клеток.
Отмечена также некоторая дискомпленсация клеток, то есть нарушение нормальной структуры — беспорядочность локализации, в отдельных нервных клетках, сохранивших нормальные размеры несоразмерно, уменьшены ядра. Описываемые изменения касаются в основном той части гипоталамуса, где продуцируется вазопрессин, окситоцин и внутримозговой серотонин.
Бюллетень науки и практики / Bulletin of Science and Practice Т. 8. №8. 2022
Строма гипоталамуса оказалось структурной, наименее подверженной к изменениям. Во всех наблюдениях в подопытной группе структурные сдвиги однотипны и сводились в основном к той или иной мере выраженному отеку. Можно отметить 2 типа отека, перицелюлярный и диффузный или так называемое набухание. Диффузный отек местами довольно выраженный, причем без определенной топографической закономерности. Лишь в зоне супраоптических и паравентрикулярных ядер заметны разрыхления волокнистых структур.
Выводы
Радионуклиды поражают прежде всего размеры нейроцитов коры головного мозга и на содержание гранул, а на серое вещество коры до полного разрушения нейроцитов, от которых сохраняются только клеточные оболочки – так называемые клетки тени (рисунок–2).
Сосуды головного мозга, под влиянием радионуклидов изменяются, одинаково вне зависимости от зоны гипоталамуса, отек сосудистой оболочки мозга выражен значительно и проявляется накоплением жидкости под мягкой мозговой оболочкой.
Список литературы Морфологические изменения головного мозга у лабораторных крыс при урановой нагрузке
- Bushberg J. T. The AAPM/RSNA physics tutorial for residents. X-ray interactions // Radiographics. 1998. V. 18. №2. P. 457-468.
- Hlouschek J. et al. Targeting SLC25A10 alleviates improved antioxidant capacity and associated radioresistance of cancer cells induced by chronic-cycling hypoxia // Cancer Letters. 2018. V. 439. P. 24-38.
- Корыстова А. Ф., Кублик Л. Н., Левитман М. Х., Самохвалова Т. В., Шапошникова В. В., Корыстов Ю. Н. Ионизирующая радиация увеличивает активность ангиотензинпревращающего фермента в аорте крыс // Бюллетень экспериментальной биологии и медицины. 2018. Т. 165. №2. С. 178-182.
- Тухватшин Р. Р. и др. Особенности влияния нарастающей информационной и радионуклидной нагрузки на головной мозг (обзор литературы) // Вестник КГМА им. ИК Ахунбаева. 2017. №5. С. 140-145.
- Васильев Р. О., Трошин Е. И., Югатова Н. Ю., Цыганов А. В. Клинико-гематологические изменения у крыс на фоне воздействия лучистой энергии // Актуальные проблемы ветеринарной медицины, зоотехнии и биотехнологии. 2019. С. 72-74.
- Тункатарова Э. И., Бектурганова Б. Ш., Джакшылыкова Ж. Б. Биогеохимия основных микроэлементов экосистем Сон-Кульской котловины // Вестник Киргизско-Российского Славянского университета. 2021. Т. 21. №4. С. 191-195.
- Аумолдаева З. М., Тухватшин Р. Р., Абаева Т. С., Исупова А. А., Жексенова А. Н. Влияние токсичных металлов на обмен веществ у экспериментальных животных // Известия вузов Кыргызстана. 2017. №8. С. 34-36.


