Морфологические изменения костного мозга при экспериментальном описторхозе
Автор: Сидельникова Алевтина Анатольевна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 1 т.26, 2018 года.
Бесплатный доступ
Отдельные исследования свидетельствуют о цитотоксических проявлениях описторхоза в морфологических изменениях форменных элементов периферической крови. Однако эти эффекты обладают видовой специфичностью. Проведено экспериментальное исследование клеток гемопоэтического и стромального компонентов красного костного мозга при описторхозе у кроликов через 4 месяца после заражения. Выявлено изменения только клеток миелоцитарного ростка гемопоэтического компонента. Установлено нарушение тинкториальных свойств структуры ядер эозинофильных и псевдоэозинофильных промиелоцитов с сохранением этого признака на стадии миелоцита, а также отсутствие и неравномерное распределение зернистости у эозинофильных и псевдоэозинофильных миелоцитов, метамиелоцитов, отставание естественных изменений тинкториальных свойств зернистости у эозинофильных созревающих форм. Лимфобласты с вакуолизированной цитоплазмой, ядром, без ядрышек и измененной окраской цитоплазмы. При оценке морфологии эритроцитарного ростка оксифильные нормоциты и ретикулоциты практически не встречались, что характеризует угнетение конечных этапов эритропоэза...
Экспериментальный описторхоз, морфология красного костного мозга, гемопоэз
Короткий адрес: https://sciup.org/143177237
IDR: 143177237 | DOI: 10.20340/mv-mn.18(26).01.55-57
Текст научной статьи Морфологические изменения костного мозга при экспериментальном описторхозе
Сидельникова А.А. Морфологические изменения костного мозга при экспериментальном описторхозе// Морфологические ведомости.-2018.- Том 26.- № 1.- С. 55-57. (26).01.55-57
Sidelnikovа AA. Morphological changes of the bone marrow by the experimental opisthorchiasis. Morfologicheskie Vedomosti – Morphological Newsletter. 2018 Mar 31;26(1):55-57. (26).01.55-57
Введение . Исследования периферической крови при описторхозе выявляют наличие существенных изменений морфологии форменных элементов [1-3]. Поскольку изменения периферической крови являются очень нестойкими, это основание думать, что основным звеном повреждения является красный костный мозг, что приводит к нарушению гемопоэза, спровоцированному инвазией. Отдельные исследования гемопоэза при экспериментальном описторхозе у сирийских хомячков показало активацию миело- и эритропоэза, тогда как у мышей нарушений гемопоэза, а именно колониеобразующей активности, не обнаружено [1]. В клетках крови и красного костного мозга золотистых хомячков достоверно повышается количество клеток, гибнущих путем апоптозом из-за цитотоксического эффекта описторхоза [2]. Столь неоднозначные результаты позволяют предположить видовую специфичность реакции клеток компонентов красного костного мозга.
Цель исследования - изучить светооптические особенности структуры клеток гемопоэтического и стромального компонентов красного костного мозга у кроликов при экспериментально индуцированном описторхозе.
Материалы и методы исследования. Работа проведена на 20 взрослых кроликах-самцах. При работе с животными авторы руководствовались «Правилами проведения работ с использованием экспериментальных животных» Минздрава России. Работа одобрена локальным этическим комитетом Кемеровского государственного медицинского университета Минздрава России. Контрольную группу составили здоровые животные без инвазии (n=10). Для инвазирования опытной группы (n=10) использована снулая рыба из реки Томь (видовая принадлежность – язь, Leuciscus idus), полученная от кафедры ихтиологии и гидробиологии Томского государственного университета. Выделение живых (двигающихся) метацеркариев осуществляли вручную с помощью компрессориума и светового микроскопа при увеличении ×100. Заражение каждой особи проводили перорально мышечной тканью рыб, содержащей по 50 метацеркариев. Через 2 месяца подтверждали состоявшуюся инвазию анализами кала по Като и методом Parasep с обнаружением яиц паразита Opisthorchis felineus. Через 4 месяца после заражения Opisthorchis felineus осуществляли вывод животных из эксперимента миорелаксантом, затем передозировкой наркоза (Рометар, Золетил), и взятие красного костного мозга из диафиза бедренной кости, изготовляя по 3 мазка соответственно. Для окрашивания мазков использовали фиксацию эозинметиленовым синим по Май-Грюнвальду (10 минут), затем докрашивали азур-эозином по Романовскому 10 минут. Исследование препаратов проводили сухим объективом при увеличении ×400 и иммерсионной микроскопией при увеличении х1000. В каждом мазке просматривали 20 полей зрения. Критериями оценки структуры клеток гемопоэтического и стромального компонентов красного костного мозга служили их тинкториальные свойства, морфологическая характеристика и дегенеративные изменения.
Результаты исследования и обсуждение . При исследовании клеток стромального компонента красного костного мозга из всех клеток оценивали только липоциты. Клетки гемопоэтического компонента располагались в виде гемопоэтических островков, включающих созревающие клетки миелоидного и лимфоидного ростков. При визуальной оценке гемопоэтический компонент визуально преобладал над стромальным, что в целом позволяет считать красный костный мозг при описторхозе функционально активным. При оценке липоцитов установлено, что это клетки крупных размеров, располагаются среди созревающих клеток гемопоэза. По периферии липоцитов в узком ободке цитоплазмы присутствует ядро круглой формы. Основное место в клетках занимает липидная капля. При исследовании миелоцитарного ростка красного костного мозга отмечали наличие псевдоэозинофильных миелобластов (у человека аналогом являются нейтрофильные формы). Они имели круглое ядро с нежным сетчатым хроматином. Визуально отмечается смещение ядерно-цитоплазматического соотношения в сторону преобладания размеров ядра. В ядре располагалось 2-3 ядрышка, цитоплазма клеток была слабо базофильна, в ней находилась мелкая азурофильная зернистость. Псевдо-эозинофильные промиелоциты содержали в цитоплазме аналогичную миелобластам зернистость, но их ядро сохраняет гипохромность окраски за счет равномерно распределенного лепто-хроматина. У промиелоцитов, ядро может сохранять остатки нежной структуры, но она не равномерна [4]. Таким образом при описторхозе первые дегенеративные изменения клеток появляются на стадии промиелоцита.
У псевдо-эозинофильных миелоцитов и псевдо-эозинофильных метамиелоцитов периферические части кариоплазмы отличались наличием светлых участков, не характерных для созревающих клеток , несмотря на то, что ядро имело обычную овальную и бобовидную форму, соответственно. Глыбчатый хроматин базофильной окраски локализовался только в центре ядра. Цитоплазма псевдо-эозинофильных миелоцитов содержала слабо оксифильную зернистость. Цитоплазма метамиелоцитов содержала более выраженную, характерную, резко оксифильную зернистость, вакуоли в ней не обнаруживаются. В цитоплазме около ядра наблюдали небольшой светлый участок, подобный светлому дворику в цитоплазме плазмоцитов, зернистость в нем отсутствовала. Отсутствие зернистости в цитоплазме и ее перераспределение может быть следствием нарушения способности клетки к накоплению отдельных веществ, например, гликогена. Известно, например, что нарушение накопления зерен гликогена в нейтрофильных миелобластах, промиелоцитах, миелоцитах и метамиелоцитах у потомства может быть связано с повреждением гепатобилиарной системы организма матери при экспериментальных токсических поражениях печени [5]. Следовательно, при описторхозе повреждаются не только созревающие клетки нейтрофильного ряда, но и эозинофильного ряда. Возможно, уровень повреждения затрагивает более молодые формы не только миелоидного, но и лимфоидного ряда, что объясняет подавление неспецифического иммунитета при описторхозе. Палочко-ядерные псевдо-эозинофилы имели узкое и резко базофильное ядро в форме подковы. В сегментоядерных псевдо-эозинофилах число сегментов ядра более чем у половины клеток было равно пяти, другие же имели по два длинных сегмента. Гиперсегментация ядра сегментоядерных псевдо-эозинофилов, вероятно, провоцируется выделением паразитом.цитотоксических веществ. Известно, что гиперсегментация встречается при дефицитах фолиевой кислоты и В 12 [6]. В тканях трематод ( Opisthorchis felineus ) содержалось множество витаминов, полученных из кишечника хозяина, среди которых обнаружены B i и В 12 [2]. Это означает, что гиперсегментация может провоцироваться вторичным дефицитом витаминов. Эозинофильные промиелоциты содержали в цитоплазме базофильные и в небольшом количестве оксифильные крупные гранулы. Их ядро с лепто-хроматином и бази-хроматином, распределенными в кариоплазме неравномерно, можно охарактеризовать как мраморное. Эозинофильные миелоциты имели округлое светлое ядро. В периферической части обнаружены участки с частично пустой, бледно-голубой цитоплазмой без гранул. Участки, содержащие зернистость, локализовались около ядра. Эозинофильные метамиелоциты имели оксифильную и базофильную окраску зернистости с некоторой тенденцией к метахромазии. Ядро клеток имело бобовидную форму. Палочко-ядерные формы эозинофилов имели аналогичную по тинкториальным свойствам зернистость цитоплазмы, важно отметить, что цитоплазма этих клеток была частично без гранул. Пустые участки локализовались в периферической части неравномерно. Эозинофильные гранулоциты, встречающиеся в красном костном мозге содержали четыре сегмента ядра, т.е. гиперсегментация этого ряда клеток также происходит в условиях влияния токсического фактора. Базофильные метамиелоциты имели бобовидное ядро, содержащее гиперхромный гетерохроматин. В цитоплазме локализовалась крупная, резко базофильная зернистость, заполнявшая весь ее объем. Таким образом, у созревающих гранулоцитов базофильного ряда в красном костном мозге наблюдалась сохранность зернистости цитоплазмы, дегрануляция зрелых их форм происходит позже, в кровеносном русле.
Лимфобластные клетки имели двойное ядро с перинуклеарной зоной просветления, их ядра не содержали ядрышек, в кариоплазме отдельных клеток наблюдалась вакуолизация. Ядро других клеток одиночное, но иногда имеет одну крупную вакуоль, расположенную эксцентрично. Пролимфоциты имели гиперхромную цитоплазму, также встречались типичного строения плазматические клетки. Среди всех созревающих клеток гемопоэтического компонента отмечается значительное количество мегакариоцитов (далее - Мгц). Визуальные размеры этих клеток в пределах одного препарата варьируют. Увеличение размеров Мгц отдельные авторы связывают с действием противоспалительного цитокина ИЛ-6, что отмечается у больных с индуцированной острой инфекцией [7]. Однако, при описторхозе подобные изменения Мгц не встречаются. Гиперплазия Мгц наблюдается также при полицитэмии, геморрагической тромбоцитэмии, характеризующихся преобладанием зрелых полиморфноядерных Мгц гигантских размеров [8]. Наличие кровяных пластинок значительных размеров в периферической крови при описторхозе объясняет повреждение Мгц еще в красном костном мозге [8]. При исследовании цитоморфологии Мгц были обнаружены некоторые особенности ядра и цитоплазмы (рис. 1). Цитоплазма Мгц слабо базофильна, с пылевидной азурофильной зернистостью, в отдельных случаях в отдельном участке цитоплазмы на периферии клетки встречаются крупные круглые базофильные гранулы в небольшом числе. Ядро лопастное, напоминающее форму облака. Контуры ядра выглядят нечеткими, смазанными. В центре ядро имеет выраженный гиперхромный хроматин. По периферии кариоплазмы хроматин светлый, нитевидный, его структура выглядит размытой, в него вкрапляются базофильные глыбки гетерохроматина. Иногда в цитоплазме Мгц писутствует один базофильный фрагмент, визуально - не менее трети самого ядра, локализованный у края цитоплазмы. Неоднородная зернистость для Мгц в норме не характерна, что может быть связано с влиянием инвазии, так как они являются без зернистыми клетками. Среди Мгц встречались голоядерные клетки, которые относятся к инволютивной форме Мгц, образованными вследствие бурного распада цитоплазмы на кровяные пластинки.
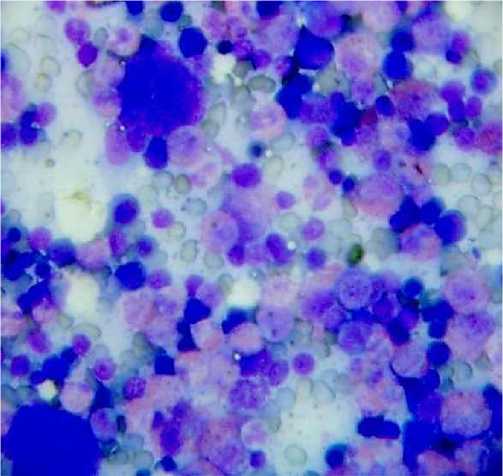
Рис. 1. Мазок красного костного мозга кролика. Мегакриоциты через 4 месяца после инвазии Opisthorchis felineus . Фиксация препарата эозин-метиленовым синим по Май-Грюнвальду. Окр. азур-эозином по Романовскому. Ув.: х400.
В эритроидном ростке гемопоэза эритробласты и пронормоциты встречались в мазках очень редко, их цитоморфология особенностей не имела. У полихроматофильных нормоцитов цитоплазма имела грязно синий цвет, круглое ядро с грубым хроматином. Трудно согласиться с активацией эриропоэза при описторхозе, отмеченного другими авторами [1]. По нашему мнению, наоборот, при описторхозе происходит угнетение эритроцитарного ростка красного костного мозга. Таким образом, при описторхозе в красном костном мозге первоначально гемопоэтический компонент не повреждается. В дальнейшем наблюдается описанные выше изменения структуры гемопоэтических клеток отдельных ростков гемопоэза.
Заключение. При описторхозе в эксперименте в костном мозге у кроликов обнаружена определенная незрелость ядра у созревающих форм клеток, отстающая по стадиям в пределах 1-2 переходных форм. Гиперсегментация зрелых клеток наблюдается уже в гемопоэтических островках, а нарушение тинкториальных свойств зернистости у гранулоцитов псевдо-эозинофильного ряда. Полученные данные позволяют характеризовать ответную реакцию организма кроликов на инвазию, сопровождающуюся изменениями структуры мегакариоцитов, эозинофильных и псевдо-эозинофильных созревающих клеток и угнетением созревания клеток эритроцитарного ростка.
Список литературы Морфологические изменения костного мозга при экспериментальном описторхозе
- Avgustinovich D.F., Orlovskaya I.A., Toporkova L.B., Vishnivetskaya G.B. i dr. Eksperimental'nyy opistorkhoz: issledovanie sostava formennykh elementov krovi, gemopoeza i startl-refleksa u laboratornykh zhivotnykh// Vavilovskiy zhurnal genetiki i selektsii.- 2016.-№ 20(2).- S. 155-164.
- Kuzhel' D.K., Zorina V.V., Bekish V.Ya. Izmeneniya pokazateley shchelochnogo gel' elektroforeza somaticheskikh kletok khozyaina pri eksperimental'nom opistorkhoze // Rossiyskiy parazitologicheskiy zhurnal.- 2014.- № 3.- S. 52-58.
- Sidel'nikova A.A., Nacheva L.V. Morfologicheskie izmeneniya perifericheskoy krovi v dinamicheskom nablyudenii pri ostrom opistorkhoze u eksperimental'nykh zhivotnykh// Sovremennye problemy nauki i obrazovaniya.- 2016.- № 6; URL: http://www.science-education.ru/article/view?id=25514 (data obrashcheniya 14.11.2016).
- Vorob'ev A.I. Rukovodstvo po gematologii. V 21. T.1/ Pod red. A.I. Vorob'eva.- M.: Meditsina,1985.- 448s.
- Nevzorova N.V., Bryukhin G.V. Kharakteristika Shik-pozitivnogo materiala v kletkakh neytrofilotsitarogo pula kostnogo mozga u potomstva samok krys s eksperimental'nym porazheniem pecheni// Fundamental'nye issledovaniya.- 2012.- № 8-1. - S. 116-121; URL: https://fundamental-research.ru/ru/article/view?id=30279 (data obrashcheniya: 17.02.2017).
- Drozdov A.A., Drozdova M.V. Zabolevaniya krovi. Polnyy spravochnik.- M.: Eksmo, 2008.- 151 s.
- Smirnova L.A., Semenikhin A.V., Kostko N.A. Trombotsitozy//Meditsinskie novosti.- 2005.- №9.- S. 36-39.
- Zalyubovskaya O.I., Litvinova O.N., Kireev I.V., Zlenko V.V., Karabut L.V. Klinicheskaya laboratornaya diagnostika.- Kharkov: Izd-vo NFaU, 2008. 100s.


