Морфологические изменения кожи вызванные эмульсионным фотосенсибилизатором на основе фуранокумаринов борщевика Сосновского
Автор: Шляпкина В.И., Куликов О.А., Балашов В.П., Агеев В.П., Плешкова К.И., Нуянзина В.А., Хуторская И.А., Аверкина М.О.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 2 т.31, 2023 года.
Бесплатный доступ
Фуранокумарины являются природными фотосенсибилизаторами и могут эффективно использоваться в качестве лекарственных средств для лечения заболеваний кожи, в том числе и поверхностных опухолей. Имеются достаточно давние и редкие исследования кожных и системных токсических эффектов фуранокумаринов, однако, в настоящее время отсутствуют данные о фотосенсибилизирующем действии фуранокумаринов борщевика Сосновского и других гигантских борщевиков. Отсутствует также и удобная и легко дозируемая форма фуранокумаринов ввиду того, что фуранокумарины являются довольно липофильными веществами и легко образуют нерастворимые в воде игольчатые кристаллы. Цель исследования - оценить фотосенсибилизирующее действие новой эмульсионной формы фуранокумаринов борщевика Сосновского на кожу лабораторных животных. В ходе исследования была получена эмульсия фуранокумаринов, извлеченных из борщевика Сосновского и стабилизированная твином-80 с концентрацией 8-метоксипсоралена 1 мг/мл. Эмульсию вводили внутривенно однократно белым лабораторным крысам при дозе 8-метоксипсоралена 3 мг/кг. Участок кожи крыс после введения эмульсии подвергали ультрафиолетовому облучению в дозе 44 дж/см2 с длиной волны 365 нм. Спустя 7 дней производили гистологическое исследование биоптатов кожи участка облучения. Макроскопически у крыс после введения эмульсии и ультрафиолетового облучения наблюдались признаки ожога второй степени. Микроскопически были выявлены повреждения эпидермиса до сосочкового слоя дермы, сопровождающиеся атрофией волосяных фолликулов, буллезными субэпидермальными полостями, лейкоцитарной инфильтрацией субэпидермальной зоны. Эмульсионная форма фуранокумаринов борщевика Сосновского при внутривенном введении и фотоактивирующем действии облучения вызывает такой же степени ожог, как и при контактном воздействии, глубина цитотоксического действия лимитирована исключительно проникающей способностью ультрафиолетового излучения с длиной волны 365 нм. У интактных животных, получивших только ультрафиолетовое облучение без введения эмульсии, повреждения кожи отсутствовали. Таким образом, полученная эмульсия фуранокумаринов при внутривенном введении проявляет фотосенсибилизирующее действие.
Кожа крысы, ультрафиолетовое облучение, фуранокумарины, борщевик сосновского
Короткий адрес: https://sciup.org/143180792
IDR: 143180792 | DOI: 10.20340/mv-mn.2023.31(2).757
Текст научной статьи Морфологические изменения кожи вызванные эмульсионным фотосенсибилизатором на основе фуранокумаринов борщевика Сосновского
Shlyapkina VI, Kulikov OA, Balashov VP, Ageev VP, Pleshkova KI, Nuyanzina VA, Khutorskaya IA, Averkina MO. Morphological changes of the skin caused by a photosensitizer emulsion based on furanocoumarins of Sosnovsky's Hogweed’s. Morfologicheskie Vedomosti – Morphological newsletter. 2023;31(2):757. (2).757
Введение. Гигантские борщевики чрезвычайно токсичны, так как вызывают буллезный фотодерматит одинаковый с ожогами 2-й степени, что при большой площади поражения может приводить к интоксикации и летальному исходу [1]. В России наибольшую опасность представляет борщевик Сосновского (Heracleum Sosnovsky), так как он широко распространен и содержит высокие концентрации фуранокумаринов [2-3]. Исследователи проводят дифференциацию между системными фототоксическими реакциями кожи, обусловленными цитотоксическими свойствами фуранокумаринов под воздействием длинноволнового ультрафиолетового света и контактным аллергическим фотодерматитом [4]. При этом сравнения всей микроскопической картины в случае контакта с растениями, обладающими фотосенсибилизирующими свойствами в литературе не проводится. Имеются достаточно давние и редкие исследования кожных и системных токсических эффектов фуранокумаринов [5]. Однако, в настоящее время отсутствуют данные о системном фотосенсибилизирующем действии фуранокумаринов борщевика Сосновско-го и других гигантских борщевиков. Отсутствует удобная и легко дозируемая форма фуранокумаринов ввиду того, что фуранокумарины являются довольно липофильными веществами и легко образуют нерастворимые в воде игольчатые кристаллы [6-7]. Для оценки фототоксичности необходимо также решить проблему растворимости фуранокумаринов в воде. Это можно сделать путем создания эмульсионной формы [8]. Получение лекарственной формы фуранокумаринов может привести к изменению или исчезновению нативного фотосенсибилизирующего эффекта, вызываемого самим растением [9]. До настоящего времени не разрабатывались и не использовались эмульсии фуранокумаринов на основе лекарственного растительного сырья борщевиков. В связи с этим становиться актуальным контроль специфической активности действующих веществ, в нашем случае фуранокумаринов. Эффективная лекарственная форма фуранокумаринов при доступном виде сырья для ее изготовления может широко использоваться как средство для PUVA-терапии (терапии путем употребления фотосенсибилизирующих средств, например, псоралена, с последующим облучением всего тела ультрафиолетовым светом) или как противоопухолевое средство в борьбе с кожными неоплазиями.
Цель исследования: оценить фотосенсибилизирующее действие новой эмульсионной формы фуранокумаринов борщевика Сосновского путем исследования морфологических изменений кожи у лабораторных крыс.
Материалы и методы исследования. Комплекс фуранокумаринов извлекали из сока надземной части растения борщевик Сосновского (далее - БС) и подвергали качественному и количественному анализу согласно описанному методу [10]. Для изготовления эмульсии сухую фракцию фуранокумаринов сока БС растворяли при нагревании в персиковом масле (Мирролла, Россия) достигая концентрации 8-метоксипсоралена (далее 8-МОП) в растворе 6,125 мг/мл. При данной концентрации масляный раствор мог оставаться стабильным при температуре 20°С продолжительное время. При изготовлении эмульсии фуранокумаринов в качестве стабилизатора использовали водный 2,5% раствор полисорбата 80 (Твин-80, Sigma-Aldrich, США). При интенсивном перемешивании и постоянной температуре 25°С к 5 мл раствора полисорбата по каплям добавляли 1 мл (0,916 г) масляного раствора фуранокумаринов БС. Готовую смесь перемешивали в течение 10 минут, затем подвергали воздействию ультразвука (50 вт) 3 раза по 10 минут. Качество образовавшейся эмульсии контролировали по отсутствию игольчатых кристаллов с помощью световой микроскопии.
Для установления фотосенсибилизирующего действия эмульсионных фуранокумаринов были использованы белые беспородные крысы, молодые самцы массой 180–200 г. Животных разделили на 2 группы, опытную и контрольную по 5 особей в каждой. У животных была удалена шерсть на участке спины ближе к хвосту с помощью крема для депиляции за 24 часа до эксперимента. Крысам опытной группы внутривенно вводили эмульсию
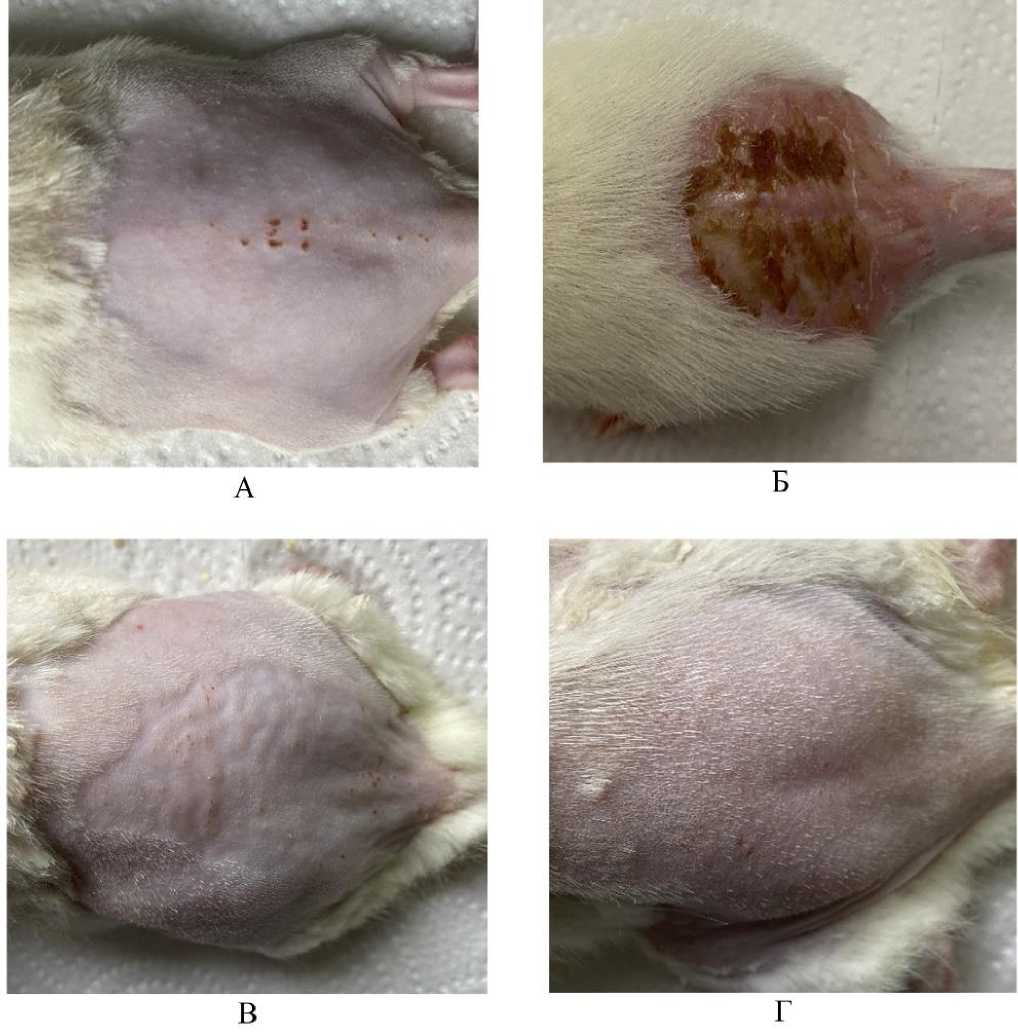
Рис. 1. Участок кожи крыс, подвергнутый ультрафиолетовому облучению длиной волны 365 нм и мощностью 44 дж/см2. Обозначения: А – участок кожи крысы до введения эмульсии с фуранокумаринами, выделенными из БС и до ультрафиолетового облучения; Б – участок кожи крысы спустя 7 дней после внутривенного введения эмульсии и последующего локального ультрафиолетового облучения; В – участок кожи крысы контрольной группы до введения физиологического раствора и до ультрафиолетового облучения; Г – спустя 7 дней после внутривенного введения физиологического раствора и последующего локального ультрафиолетового облучения
фуранокумаринов БС с концентрацией 8-МОП 1 мг/мл. Доза 8-МОП для животных составила 3 мг/кг что соответствовало допустимому объему внутривенного введения крысе [11]. В контрольной группе животным внутривенно ввели равный по объему физиологический раствор. Спустя
10 и 60 минут после внутривенного введения всем животным производили ультрафиолетовое облучение участка кожи площадью 4 см2, лишенного шерсти. Использовали источник ультрафиолетового излучения 365 нм, мощностью 40 вт (Camelion LH26-FS/BLB/E27, Китай).
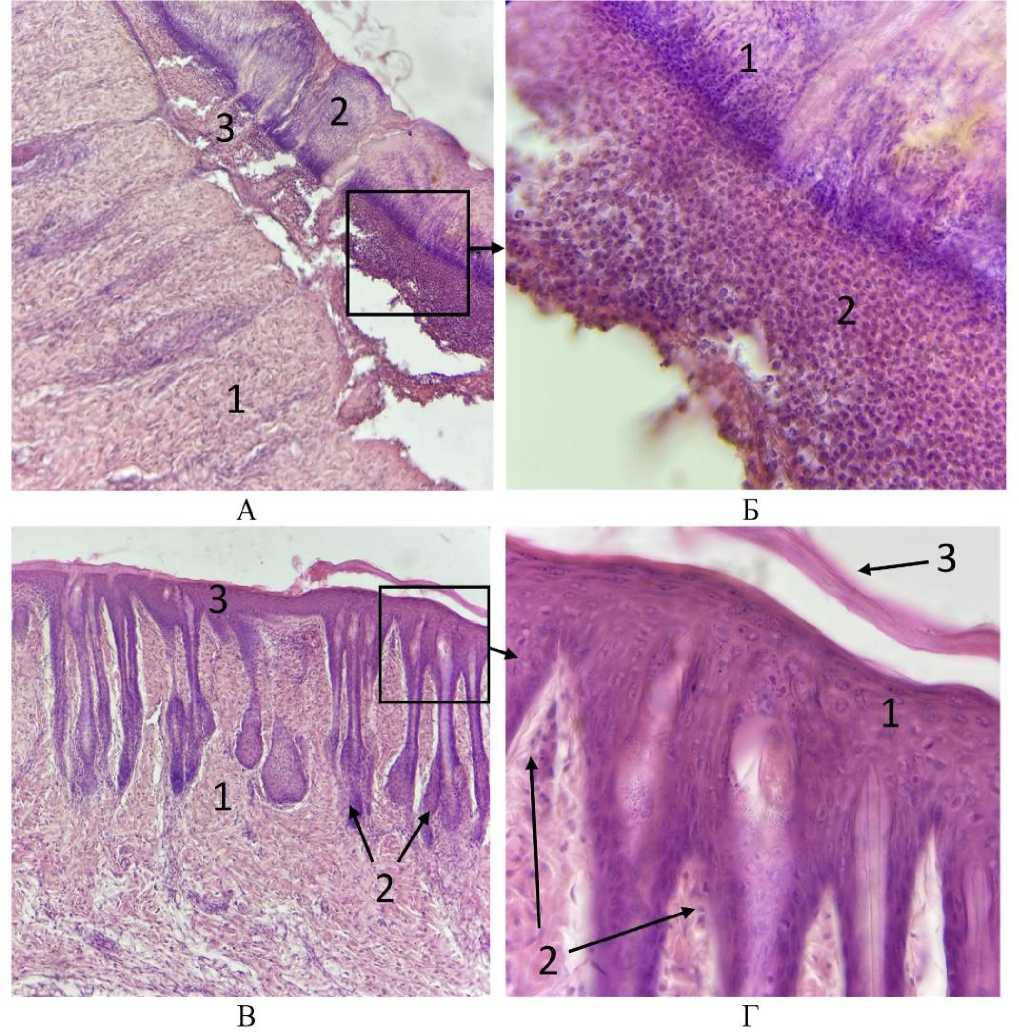
Рис. 2. Микрофото гистологических препаратов кожи крыс опытной (А-Б) и контрольной (В-Г) групп спустя 7 дней после внутривенного введения эмульсии фуранокумаринов БС и ультрафиолетового облучения . Окр.: гематоксилином и эозином. Ув. А, В - х100; Б, Г - х400. Обозначения - на рис. А: 1 – ткань дермы с редуцированными клетками волосяных фолликулов, 2 – отслоенный эпидермис, 3 – лейкоцитарные клетки под базальным слоем эпидермиса; на рис. Б: 1 – деструктивно измененные клетки эпидермиса в слое фибрина, остатки зернистого слоя с более базофильной окраской, 2 – скопление гранулоцитов под базальным слоем эпидермиса; на рис. В: 1 – дерма, 2 – волосяные фолликулы и сальные железы, 3 – эпидермис; на рис. Г: 1 – нормальные клетки эпидермиса, 2 – сосочковый слой дермы, 3 – роговой слой эпидермиса
Интенсивность излучения измеряли с помощью радиометра ThorLabs PM100D (GmbH, Germany). Доза облучения для каждого животного составила 44 дж/см2. За животными наблюдали 7 дней и фиксировали макроскопические изме- нения состояния кожи в месте облучения. На 7-й день у животных под наркозом Зо-летил (Virbac, Франция) и Рометар (Bioveta, Чехия) забирался участок кожи площадью около 1 см2 в зоне, подвергнутой облучению.
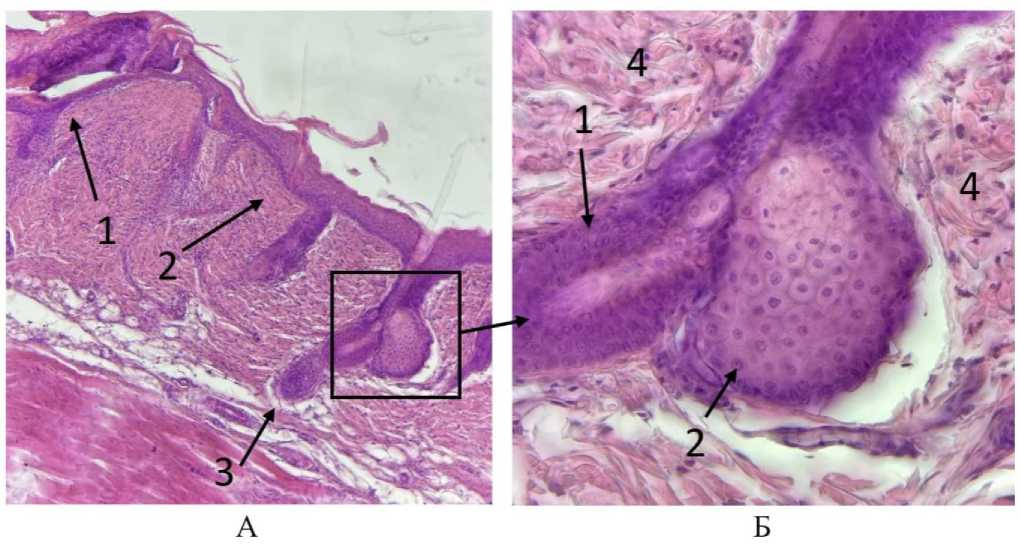
Рис. 3. Микрофото гистологических препаратов кожи крыс за пределами распространения ожогового струпа спустя 7 дней после внутривенного введения эмульсии фуранокумаринов БС и ультрафиолетового облучения . Окр. гематоксилином и эозином. Ув.: А – х100; Б – х400. Обозначения - на рис. А: 1 – кожа в области повреждения, 2 – кожа вне зоны повреждения, 3 – волосяная луковица нормального волосяного фолликула; на рис. Б: 1 – клетки эпителиального влагалища волосяного фолликул, 2 – клетки сальной железы, 3 – клетки дермы
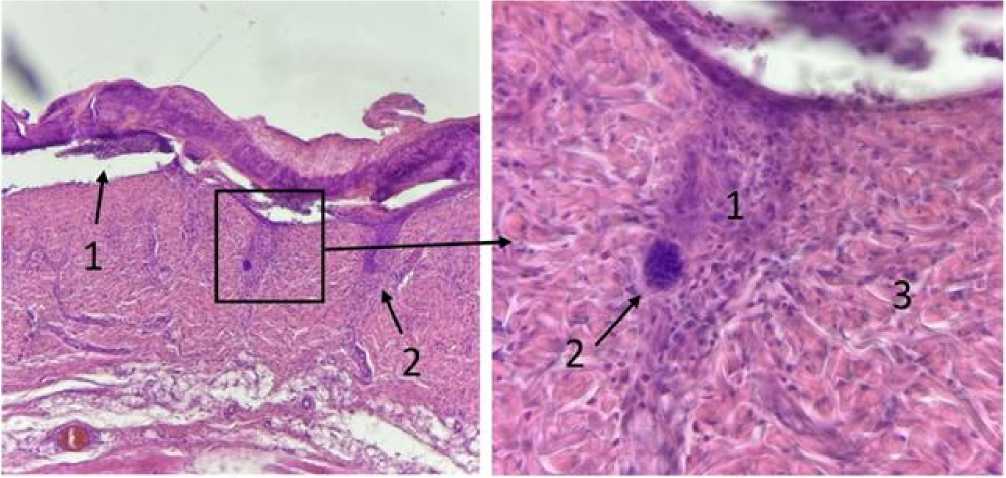
Рис. 4. Микрофото гистологических препаратов кожи крыс на периферии ожогового струпа спустя 7 дней после внутривенного введения эмульсии фуранокумаринов БС и ультрафиолетового облучения . Окраска гематоксилином и эозином. Ув.: А – х100; Б – х400. Обозначения - на рис. А: 1 – отслоение поврежденного эпидермиса от дермы, 2 – деструкция волосяного фолликула; на рис. Б: 1 – апоптоз клеток эпителиального влагалища, 2 – клетки волосяной луковицы с кариопикнозом, 3 - нормальные клетки дермы
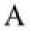
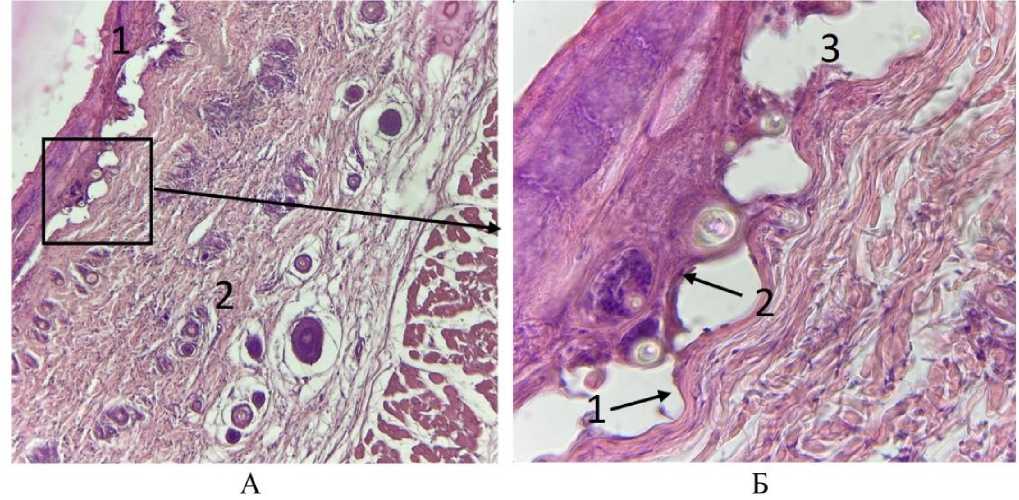
Рис. 5. Микрофото гистологических препаратов кожи крыс на периферии ожогового струпа спустя 7 дней после внутривенного введения эмульсии фуранокумаринов БС и ультрафиолетового облучения . Окраска гематоксилином и эозином. Ув.: А – х100; Б – х400. Обозначения - на рис. А: – 1 – эпидермис, отслоившийся от дермы, 2 – нормальные клетки дермы; на рис. Б: 1 – сосочковый слой дермы, 2 – базальный слой эпидермиса, 3 – буллезное субэпидермальное расширение
Кожный дефект в месте биопсии ушивался и обрабатывался антисептиком. Для гистологического исследования образец кожи фиксировали в растворе 10% формалина. Препараты заливали в парафин и изготавливали срезы толщиной 10–15 мкм на роторном микротоме PFM Rotary 3003. Депарафинированные срезы окрашивали гематоксилином и эозином. Гистологические препараты просматривали в световом микроскопе Nikon Eclipse NI-SS. Микрофотографии изготавливали с помощью фотокамеры Nikon DS-F21 при увеличении х100, х200 и х400.
Результаты исследования и обсуждение. Непосредственно после внутривенного введения эмульсии и спустя 7 дней все животные в экспериментальной группе выжили. Изменения в поведении крыс на протяжении всего периода наблюдения не отмечалось. На 7-е сутки у всех крыс опытной группы сформировался кожный струп, при этом в контрольной группе участок кожи, подвергнутый облучению, остался чистым и начал обрастать шерстью (рис. 1). Микроскопически у животных опытной группы в зоне струпа выявлено повреждение кожи однотипное с ожогом второй степени [12]. На рисунке 2-а, 2-б можно наблюдать отслоение эпидермиса у крыс опытной группы. Эпидермис представлен деструктивно измененными клетками в массе фибрина под слоем которого находится обширное скопление лейкоцитарных элементов (преимущественно гранулоцитов). Дерма утрачивает сосочковый слой из-за атрофии волосяных фолликулов. Вероятно, первичным в патогенетической картине повреждения является нарушение процессов регенерации в зернистом слое эпидермиса и исчезновение (выпрямление) сосочкового слоя дермы [13]. На рисунке 3 можно видеть волосяные фолликулы и клетки сальной железы участка кожи крысы опытной группы за пределами зоны воздействия ультрафиолетового излучения. Здесь четко различимы слои эпидермиса, отсутствуют скопления лейкоцитов. Клетки эпителиального влагалища и волосяной луковицы имеют четкие контуры, компактное ядро и хроматин.
На рисунке 4 представлен участок кожи в зоне расположения струпа. На нем можно наблюдать нечеткие контуры фолликулов, сгруппированные клетки волося- ной луковицы с нечеткими контурами ядра и рыхло расположенным хроматином. Клетки эпителиального влагалища волоса не различимы. По-видимому, клетки волосяного фолликула и придаточных тканей подверглись апоптозу, что могло быть следствием, как фотохимической деструкции ДНК, так и последующих иммунных реакций [14], при этом большему повреждению подвергнуты активные митотические клетки фолликула эпителиального происхождения. На рисунке 5 видна микроскопическая картина спавшихся субэпидермальных пузырей. На нем отмечается региональное отслоение эпидермиса от подлежащей соединительной ткани и сохранность сосочкового слоя дермы. Вероятно, причиной такого повреждения и отслоения эпидермиса является фотосенсибилизирующий эффект. Учитывая проникающую способность ультрафиолетового излучения с длиной волны около 365 нм, повреждения кожи сосредоточены исключительно на участках до сосочкового слоя дермы [15-16].
При изучении гистологической картины кожи крыс, подвергнутых системной фотосенсибилизации с помощью внутривенного введения эмульсионной формы фуранокумаринов БС, установлено, что в основе морфологических изменений кожи лежит нарушение дермальноэпидермального соединения и апоптотиче-ская гибель клеток волосяных фолликулов при сохранении нормальной морфологии дермы. Повреждение кожи не распространяется на более глубокие слои, по-видимому, вследствие лимитирования проникающего действия ультрафиолетового излучения с длиной волны 365 нм [15-16]. Не исключено также, что важным компо-
Список литературы Морфологические изменения кожи вызванные эмульсионным фотосенсибилизатором на основе фуранокумаринов борщевика Сосновского
- Pfurtscheller K, Trop M. Phototoxic plant burns: report of a case and review of topical wound treatment in children. Pediatr Dermatol. 2014;31(6):156-159. DOI: 10.1111/pde.12396
- Andreevа LV. Sosnowsky’s Hogweed: new ways to use. IOP Conference Series Earth and Environmental Science. 2020;613. DOI: 10.1088/1755-1315/613/1/012006
- Nielsen C, Ravn HP, Nentwig W, Wade M. The Giant Hogweed Best Practice Manual. Guidelines for the management and control of an inva-sive weed in Europe. Denmark, Hoersholm: Forest & Landscape, Denmark, 2005.- 44 pp
- Karimian-Teherani D, Kinaciyan T, Tanew A. Photoallergic contact dermatitis to Heracleum giganteum. Photodermatol Photoimmunol Pho-tomed. 2008;24(2):99-101. DOI: 10.1111/j.1600-0781.2008.00346.x
- Langner A, Wolska H, Marzulli FN et al. Dermal toxicity of 8-methoxypsoralen administered (by gavage) to hairless mice irradiated with long-wave ultraviolet light. J Invest Dermatol. 1977;69(5):451-457. DOI: 10.1111/1523-1747.ep12511300
- Wang X, Peng P, Pan Z et al. Psoralen inhibits malignant proliferation and induces apoptosis through triggering endoplasmic reticulum stress in human SMMC7721 hepatoma cells. Biol Res. 2019;52(1):34. DOI: 10.1186/s40659-019-0241-8
- Li S, Tu H. Psoralen inhibits the proliferation and promotes apoptosis through endoplasmic reticulum stress in human osteosarcoma cells. Folia Histochem Cytobiol. 2022;60(1):101-109. DOI: 10.5603/FHC.a2022.0010
- Baroli B, López-Quintela MA, Delgado-Charro MB et al. Microemulsions for topical delivery of 8-methoxsalen. J Control Release. 2000:69(1):209–218. DOI: 10.1016/s0168-3659(00)00309-6
- Wu JY, Li YJ, Liu TT et al. Microemulsions vs chitosan derivative-coated microemulsions for dermal delivery of 8-methoxypsoralen. Int J Nano-medicine. 2019:14:2327–2340. DOI: 10.2147/IJN.S191940
- Ageev VP, Shlyapkina VI, Kulikov OA i dr. Kachestvenny i kolichestvenny analiz osnovnykh proizvodnykh psoralena soka borshchevika Sos-novskogo. Farmatsiya. 2022;71(3):10-17. DOI: 10.29296/25419218-2022-03-02. In Russian
- Hankenson FC. Critical care management for laboratory mice and rats. New York: CRC Press, 2013.- 271 pp
- Bi Q, Liu J, Wang X, Sun F. Downregulation of miR-27b promotes skin wound healing in a rat model of scald burn by promoting fibroblast proliferation. Exp Ther Med. 2020;20(5):63. DOI: 10.3892/etm.2020.9191
- Vinaik R, Abdullahi A, Barayan D, Jeschke MG. NLRP3 inflammasome activity is required for wound healing after burns. Transl Res. 2020;217:47-60. DOI: 10.1016/j.trsl.2019.11.002
- Sierra-Sánchez Á, Kim KH, Blasco-Morente G, Arias-Santiago S. Cellular human tissue-engineered skin substitutes investigated for deep and difficult to heal injuries. NPJ Regen Med. 2021;17;6(1):35. DOI: 10.1038/s41536-021-00144-0
- Battie C, Jitsukawa S, Bernerd F, Del Bino S et al. New insights in photoaging, UVA induced damage and skin types. Exp Dermatol. 2014;23(1):7-12. DOI: 10.1111/exd.12388
- Hofmann-Wellenhof R, Smolle J, Roschger A et al. Sunburn cell formation, dendritic cell migration, and immunomodulatory factor production after solar-simulated irradiation of sunscreen-treated human skin explants in vitro. J Invest Dermatol. 2004;123(4):781-787. DOI: 10.1111/j.0022-202X.2004.23322.x
- Stolbovskaya OV, Khayrullin RM, Kulikova TK i dr. Issledovanie vyazko-elasticheskikh svoystv tsitoplazmaticheskoy membrany limfotsitov krovi cheloveka metodom atomno-silovoy mikroskopii. Fundamental'nye issledovaniya. 2013;4-5:1149-1152. In Russian
- Müller-Röver S, Rossiter H, Paus R et al. Overexpression of Bcl-2 protects from ultraviolet B-induced apoptosis but promotes hair follicle re-gression and chemotherapy-induced alopecia. Am J Pathol. 2000;156(4):1395-1405. DOI: 10.1016/S0002-9440(10)65008-0
- Lu Z, Fischer TW, Hasse S, Sugawara K et al. Profiling the response of human hair follicles to ultraviolet radiation. J Invest Dermatol. 2009;129(7):1790-1804. DOI: 10.1038/jid.2008.418
- Moore RB, Xiao Z, Owen RJ et al. Photodynamic therapy of the canine prostate: intra-arterial drug delivery. Cardiovasc Intervent Radiol. 2008;31(1):164–176. DOI: 10.1007/s00270-007-9213-4
- Foster TH, Giesselman BR, Hu R et al. Intratumor administration of the photosensitizer pc 4 affords photodynamic therapy efficacy and selectiv-ity at short drug-light intervals. Transl Oncol. 2010;3(2):135–141


