Морфологические изменения нейронов хвостатого ядра крыс, склонных к формированию алкогольной зависимости
Автор: Гуров Д.Ю., Туманов В.П., Смирнов А.В., Снигур Г.П., Григорьева Н.В., Быхалов П.С., Хлопонин П.А., Самусев Р.П.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Обзорные статьи
Статья в выпуске: 2 (62), 2019 года.
Бесплатный доступ
В работе проведен анализ морфологических изменений в хвостатом ядре крыс, склонных и несклонных к формированию алкогольной зависимости, отобранных с использованием метода определения алкогольной мотивации, основанный на определении уровня общей неспецифической реактивности организма. Парафиновые срезы толщиной 4-6 мкм окрашивали гематоксилином и эозином, тионином по методу Ниссля, проводили иммуногистохимические реакции с использованием моноклональных антител против рецепторов-2 глутамата (GLUR2). В хвостатом ядре крыс, предрасположенных к алкогольной зависимости, выявлены морфофункциональные различия в структурной организации, достоверно большая объемная плотность перикарионов нейронов, по сравнению с животными, несклонными к алкоголизации. При иммуногистохимическом исследовании обнаружена более высокая степень экспрессии иммунореактивного материала в перикарионах нейронов хвостатого ядра крыс, склонных к формированию алкогольной зависимости, что свидетельствует о наличии иммунофенотипических различий и метаболизма в глутаматцептивных нейронах неостриатума.
Крыса, хвостатое ядро, алкоголь, предрасположенность
Короткий адрес: https://sciup.org/142224335
IDR: 142224335 | УДК: 616-091.8
Текст научной статьи Морфологические изменения нейронов хвостатого ядра крыс, склонных к формированию алкогольной зависимости
В связи с ростом интереса к проблеме формирования алкогольной зависимости исследование различных отделов ЦНС с позиций конституционально обусловленного влечения к алкоголю и лечению хронической алкогольной зависимости остается актуальным [5].
Механизмы алкогольной аддикции связаны как с изменением локального уровня ацетальдегида в мозге, возникающим при употреблении алкоголя, так и c генетически детерминированной активностью систем метаболизма этанола и ацетальдегида в печени и в головном мозге.
Результаты различных исследований указывают на то, что феномен предпочтения эта- нола животными и предрасположенность к потреблению алкоголя у людей имеют генетически обусловленную структурную основу и могут быть связаны с интенсивностью обмена алкоголя в организме, зависят от активности ферментных систем метаболизма спиртов и альдегидов, являющихся мощными регуляторами уровня ацетальдегида в клетке [6, 10].
В морфогенезе алкогольной болезни головной мозг, структуры стриопаллидарной системы в частности, играют существенную роль в интегративном взаимодействии различных отделов центральной нервной системы, обеспечивая поддержание мышечного тонуса, контроль произвольных движений [4, 7].
При длительной алкоголизации развиваются нарушения нейромедиаторного обмена, усиленный синтез катехоламинов, высвобождение дофамина в префронтальной коре, экс-трастриатальное связывание и глутаматергиче-ская передача через метаботропные глутаматные рецепторы [7].
Существующие гипотезы рассматривают развитие атрофических изменений в подкорковых областях головного мозга при хроническом алкоголизме как результат влияния алкоголя, его метаболитов, при этом коморбидная патология способна активировать протективные механизмы; с другой стороны, коморбидная патология при хронической алкогольной зависимости способствует формированию в подкорковых областях изменений воспалительного характера на фоне существующей атрофии ткани, маскируя клинические проявления алкогольинду-цированной субкортикальной атрофии [9].
Таким образом, исследование морфологических изменений в подкорковых ядрах, в частности, nucleus caudatus у животных, склонных и несклонных к формированию алкогольной зависимости, является актуальным с учетом роли стриопаллидарной системы в поддержании мышечного тонуса, экстрапирамидного контроля движений, участии в формировании мотивационного поведения и связанных с ним эмоций [12].
ЦЕЛЬ РАБОТЫ
Исследовать морфологические изменения нейронов в хвостатом ядре крыс, склонных и несклонных к формированию алкогольной зависимости.
МЕТОДИКА ИССЛЕДОВАНИЯ
В работе нами использован метод определения алкогольной мотивации, основанный на определении уровня общей неспецифической реактивности организма (УОНРО) – интегративного генетически обусловленного показателя, отражающего степень общей чувствительности организма к различным экзогенным воздействиям («Способ определения предрасположенности к алкоголизации у лабораторных крыс» № 204120726/14 (022241 от 06 июля 2004 г.). При отборе крыс с различными уровнями начальной алкогольной мотивации использовали 180 белых крыс-самцов весом 180–220 г. Все экспериментальные животные были выведены в питомнике ФКУЗ «Волгоградский научно-исследовательский противочумный институт». Важное внимание при проведении экспериментальной части исследования было уделено вопросам содержания, отбора, группировки животных, что позволило выполнить за- планированные научные задачи. Содержание экспериментальных животных осуществляли в стандартных клетках Т-3 (Чехия). Кормление осуществлялось по стандартному лабораторному рациону со свободным доступом к воде, при температуре воздуха в виварии 18–22 °С, относительной влажности воздуха – 50–60 %.
Наиболее приемлемым для распределения животных по УОНРО является подход, основанный на определении болевой (ноцицептивной) чувствительности посредством дозированного электроболевого воздействия [1]. В результате тестирования было установлено, что средний порог вокализации в группе «короткоспящих» животных составил (17,4 ± 1,1) В и был достоверно ниже, чем в группе «долгоспящих» животных, где этот показатель составил (26,2 ± 0,8) В (P ± 0,05). Таким образом, «короткоспящие» животные, потенциально склонные к приему алкоголя, отличались большей чувствительностью к действию электробо-левого стресса (высокий уровень УОНРО).
Результаты теста послужили основанием для отбора 15 крыс с коротким сном, средняя продолжительность анестезии этанолом у которых была (45,6 ± 3,9) минуты, и 17 крыс с длительным сном продолжительностью (184,3 ± 11,4) минут. «Длительноспящие» животные имеют отрицательную алкогольную мотивацию по сравнению с «коротко спящими» крысами, у которых предрасположенность к алкогольной зависимости высокая [1, 4].
После эутаназии производили вскрытие животного и осмотр внутренних органов на предмет патологических изменений. Вскрывали череп, извлекали головной мозг и быстро проводили забор материала, который помещали в 10%-й раствор нейтрального формалина. После фиксации в формалине в течение 48 часов образцы тканей обезвоживали и заливали в парафин. С парафиновых блоков готовили срезы толщиной 4–6 мкм. Их окрашивали по хорошо разработанным и описанным ранее методикам гематоксилином и эозином, тионином по методу Ниссля [2, 8].
Иммуногистохимическое исследование проводили на парафиновых срезах толщиной 4 мкм, которые помещали на адгезивные стекла и инкубировали во влажной камере с первичными моноклональными антителами против рецепторов глутамата (GLUR-2, клон 6C4, Thermo Fisher Scientific, USA) в разведении 1:75 при комнатной температуре в течение 30 минут, использовали полимерную визуализирующую систему, рекомендованную в соответствии с протоколом фирмы-производителя [3]. По завершении проведения иммуногиcтохимичеcкой реакции для лучшей визуализации ядер в нерв- ных клетках головного мозга производили до-краcку гематоксилином.
Фотодокументирование производили с использованием цифровой фотокамеры Canon (Japan) светового микроскопа Axiostar plus (Карл Цейc, Германия) с объективами х10, х40.
Статистическую обработку данных проводили с использованием пакетов программ Statistica 6,0 (StatSoft, USA). Различия между группами оценивали при помощи непараметрического критерия Манна-Уитни (Mann-Whitney, U-test) и считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При морфологическом исследовании крыс, склонных к формированию алкогольной зависимости, в хвостатом ядре обнаруживается увеличение плотности расположения нейронов в ростральной области и постепенное её снижение в каудальном направлении. Нейроны располагаются внутри нечетко отграниченных областей, окруженных пучками нервных воло- кон. При окраске по Нисслю обнаруживаются пузырьковидные округлые ядра в центральной части перикариона нейрона, реже встречаются нейроны с ядрами овальной формы. Ядрышко, как правило, выражено, расположено в центральной части ядра, в некоторых случаях эктопировано. Цитоплазма перикарионов большинства нейронов умеренно базофильна.
У крыс, не склонных к формированию алкогольной зависимости плотность расположения нейронов меньше (см. табл.), в состав группы входит в среднем около десяти нейронов. Перикарионы большинства нейронов имеют полигональную форму и меньшие размеры по сравнению с перикарионами крыс, склонных к формированию алкогольной зависимости. При окраске по методу Ниссля в нейронах хорошо определяется центрально расположенное крупное круглое ядро с базофильной нуклеолеммой и центральным достаточно крупным ядрышком. Цитоплазма перикариона слабо базофильная. Гранулы базофильной субстанции не визуализируются в большинстве перикарионов.
Морфометрические показатели хвостатого ядра крыс с различной конституциональной алкогольной мотивацией, (M ± m)
|
Показатели |
Экспериментальные группы крыс |
|
|
несклонные к формированию алкогольной мотивации |
склонные к формированию алкогольной мотивации |
|
|
Объёмная плотность перикарионов нейронов, % |
16,6 ± 0,9 |
19,8 ± 1,06* |
|
Объёмная плотность ядер нейронов, % |
6,6 ± 0,7 |
7,2 ± 0,7 |
|
Объёмная плотность цитоплазмы перикарионов нейронов, % |
10,0 ± 0,9 |
12,6 ± 0,8* |
|
Объёмная плотность нейропиля, % |
83,4 ± 1,8 |
80,2 ± 1,4* |
|
Средний объём перикарионов нейронов, мкм3 |
654,2 ± 32,2 |
769,3 ± 41,1* |
|
Средний объём ядер нейронов, мкм3 |
342,9 ± 14,6 |
355,3 ± 19,2 |
|
Средний объём цитоплазмы перикарионов нейронов, мкм3 |
345,3 ± 18,9 |
414,0 ± 31,7* |
|
Ядерно-цитоплазматическое отношение |
0,99 ± 0,08 |
0,85 ± 0,07 |
|
Объемное отношение перикарионов нейронов к нейропилю |
0,20 ± 0,03 |
0,25 ± 0,02* |
* р < 0,05.
При морфометрическом исследовании хвостатого ядра обнаружено, что объёмная плотность перикарионов нейронов у крыс, несклонных к формированию алкогольной зависимости, составляет (16,6 ± 0,9) % (табл.), что на 3,2 % ниже по сравнению с животными, склонными к алкоголизации, у которых данный морфометрический показатель составляет (19,8 ± 1,06) % (при р < 0,05). Объёмная плотность цитоплазмы перикарионов нейронов у крыс, несклонных к формированию алкогольной зависимости, составляет (10,0 ± 0,9) % (табл.), что на 2,6 % ниже по сравнению с животными, склонными к алкоголизации, у которых данный морфометрический показатель составляет (12,6 ± 0,8) % (при р < 0,05).
Средний объем перикарионов нейронов у крыс, несклонных к формированию алкогольной зависимости, составляет (654,2 ± 32,2) мкм3, что на 15 % ниже по сравнению с животными, склонными к алкоголизации (табл.), у которых данный морфометрический показатель составляет (769,3 ± 41,1) мкм3 (при р < 0,05). Изменение данного параметра сопровождается значимым снижением среднего объёма цитоплазмы перикарионов нейронов у крыс, несклонных к формированию алкогольной зависимости, который составляет (345,3 ± 18,9) мкм3, что на 16,6 % ниже по сравнению с животными, склонными к алкоголизации, у которых данный морфометрический показатель составляет (414,0 ± 31,7) мкм3 (при р < 0,05).
При иммуногистохимическом исследовании хвостатого ядра крыс, склонных к формированию алкогольной зависимости, с использованием моноклональных антител к рецепторам-2 глутамата (GLUR2) обнаруживается низкая степень экспрессии иммунопозитивного материала в перикарионах нейронов среднего размера (рис. 1). Им-мунопозитивный материал распределен равномерно в цитоплазме перикарионов. Значительная часть нейронов обладает иммунонегативной цитоплазмой перикарионов. Кроме того, определяется слабопозитивная реакция в нейропиле. При иммуногистохимическом исследовании nucleus caudatus крыс, несклонных к формированию алкогольной зависимости, обнаружены глутамат-цептивные нейроны, обладающие слабой степенью экспрессии иммунореактивного материала при использовании моноклональных антител к рецепторам-2 глутамата (GLUR2).
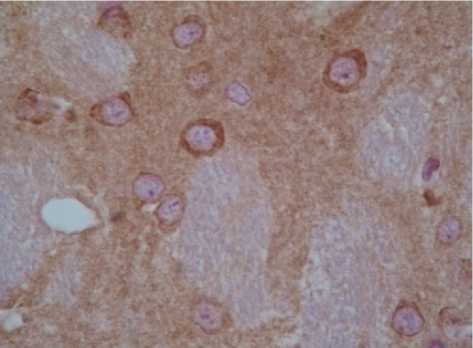
Рис. 1. Строение вентрального отдела хвостатого ядра крыс, склонных к формированию алкогольной мотивации. Иммуногиcтохимичеcкая реакция с моноклональными антителами против рецепторов-2 глутамата (GLUR2), докраcка гематоксилином. Ув. х 400
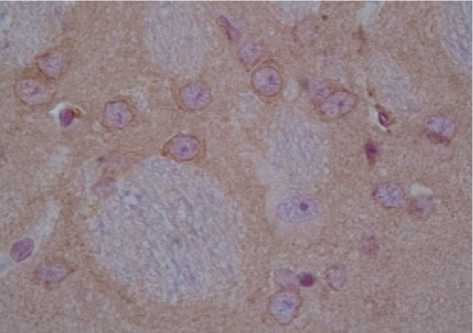
Рис. 2. Строение вентрального отдела хвостатого ядра крыс, несклонных к формированию алкогольной мотивации. Иммуногиcтохимичеcкая реакция с моноклональными антителами против рецепторов-2 глутамата (GLUR2), докраcка гематоксилином.
Ув. х 400
Обнаруживаемая иммуногистохимическая картина свидетельствует о существовании внутри популяции нейронов средних размеров в хвостатом ядре крыс, несклонных к формированию алкогольной зависимости, глутаматцеп-тивных нейронов, обладающих меньшей степенью экспрессии рецепторов глутамата (GLUR-2) по сравнению с группой крыс, склонных к формированию алкогольной зависимости.
ЗАКЛЮЧЕНИЕ
Морфологические различия в организации подкорковых структур головного мозга у крыс с различной предрасположенностью к формированию алкогольной зависимости неразрывно связаны с особенностями нейрохимического обмена, активности различных медиаторных систем и количественного распределения рецепторов на нейронах, что создает определенное пространственно-временное состояние отдельных областей головного мозга и влияет на их вклад в формирование аддиктивного поведения.
В головном мозге крыс, склонных к формированию алкогольной мотивации, нами обнаружены морфофункциональные отличия в передних отделах хвостатого ядра, которые выражаются в различиях структурной организации на тканевом, клеточном и молекулярном уровнях, в том числе достоверно большей объемной плотностью перикарионов нейронов и объемной плотностью цитоплазмы перикарионов нейронов по сравнению с животными, несклонными к формированию алкогольной мотивации, и, соответственно, меньшей объёмной плотностью нейропиля, что сочетается с более высокими объемными параметрами нейронов (объём перикарионов нейронов, объём цитоплазмы перикарионов нейронов).
При хронической алкогольной интоксикации различные типы нейромедиаторов могут оказывать синергичное и антогонистичное воздействие на нейроны [4]. Считается, что нарушения в дофаминергической передаче тесно связаны с глутаматергической системой. Этот феномен особенно важен, поскольку помимо основной роли возбуждающего нейромедиатора, глутамат может проявлять нейротоксические свойства [5]. При гиперактивации глутама-тергической передачи происходит интенсивное поступление ионов кальция в клетку индуцирующего процессы образования активных форм кислорода, а также активацию протеинкиназ. Следствием этих процессов может стать глута-матиндуцированное повреждение и гибель нейронов [7], которая сопровождается атрофическими изменениями в подкорковых ядрах [12].
При иммуногистохимическом исследовании с использованием первичных антител против рецепторов-2 глутамата (GLUR2) обнаружена высокая степень экспрессии иммунореактивного материала в перикарионах нейронов хвостатого ядра крыс, склонных к формированию алкогольной зависимости, что свидетельствует, с одной стороны, о наличии иммунофе-нотипических различий и метаболизма в глута-матцептивных субкортикальных нейронах, с другой стороны, о потенциально большем риске повреждения и гибели нейронов у крыс, склонных к формированию алкогольной мотивации, хотя уже при моделировании хронической алкогольной интоксикации у крыс в некоторых отделах головного мозга, в супраоптических ядрах, обнаруживается низкая экспрессия метаболических глутаматных рецепторов [11].
Список литературы Морфологические изменения нейронов хвостатого ядра крыс, склонных к формированию алкогольной зависимости
- Мулик А. Б. Оптимизация медико-биологического эксперимента in vivo / А. Б. Мулик - Волгоград, 2003. - 212 с.
- Особенности структурных изменений головного мозга при моделировании алиментарного дефицита магния // А. В. Смирнов [и др.], Современные проблемы науки и образования. - 2013. - № 4.
- Петров, С. В. Руководство по иммуногистохимической диагностике опухолей человека / С. В. Петров, Н. Т. Райхлин // Казань. - 2012. - 624 с.
- Писарев, В. Б. Вариабельность структур центральной нервной системы и ее роль в развитии патологических процессов / В. Б. Писарев, А. В. Смирнов, Д. Ю. Гуров // Волгоград, Изд-во ВолГУ. - 2006. -192 с.
- Azevedo, C. A. Neuromodulation Therapies for Alcohol Addiction: A Literature Review / C. A. Azevedo, A. Mammis // Neuromodulation. - 2018. -Vol. 21 (2). - P. 144-148.
- Ceramide pathways modulate ethanol-induced cell death in astrocytes / M. Pascual [et al.] // J. Neurochem. - 2003. - № 6. - P. 1535-1545.
- Cerebral dopaminergic and glutamatergic transmission relate to different subjective responses of acute alcohol intake: an in vivo multimodal imaging study/ G. Leurquin-Sterk [et al.] // Addict Biol. - 2018. -Vol. (3). - P. 931-944.
- Ermilov V. V. The role of р-amyloidopathy in the pathogenesis of age-related macular degeneration in correlation with Alzheimer's disease // Neuro-degenerative diseases. - 2017. - Vol. 17. - S1. -P. 606.
- Fein, G. Subcortical volumes are reduced in shortterm and long-term abstinent alcoholics but not those with a comorbid stimulant disorder / G. Fein, D. Fein // Neuroimage Clin. - 2013. - Vol. 3. -P. 47-53.
- Genotypic differences in ethanol sensitivity in two tests of motor incoordination / J. C. Crabbe [et al.] // J. Appl. Physiol. - 2003. - № 4. - P. 1338-1351.
- Muram, S. Presynaptic G Protein-Coupled Receptors Differentially Modulate Spontaneous Glutamate Release in the Supraoptic Nucleus / S. Muram, T. M. Rowe, M. Hirasawa // J. Neuroendocrinol. - 2016. - Vol. 28 (4).
- Resting state synchrony in long-term abstinent Alcoholics: Effects of a current major depressive disorder diagnosis / G. Fein [et al.] // Alcohol. - 2017. -Vol. 59. - P. 17-25.


