Морфологические изменения тканей после имплантации биодеградируемых нитей для коррекции инволюции кожи тыльной поверхности кисти
Автор: Чекмарева Ирина Александровна, Паклина Оксана Владимировна, Тищенко Андрей Леонидович, Абдувосидов Хуршед Абдувохидович, Агапова Марина Александровна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.28, 2020 года.
Бесплатный доступ
Процесс старения кожи кисти непрерывно прогрессирует от зрелого возраста до преклонного. С возрастом кожа рук становится пигментированной, сухой, морщинистой с подчеркнутым кожным рисунком, снижается тонус кожи кисти, отмечается истончение и атрофия жировой ткани, теряется эластичность кожи с формированием избытка гипоэластичной истонченной дермы. В последние годы для коррекции инволюционных изменений кожи тыльной поверхности кисти используются гладкие нитевые имплантаты. Цель исследования - морфологическая оценка эффективности коррекции инволюционных изменений кожи тыльной поверхности кисти нитевыми имплантатами на основе поликапролактона и поли-L-молочной кислоты (PCL-PLLA) с насечками. Методами световой и электронной микроскопии изучена реакция клеток и межклеточного вещества на введение в подкожное пространство биодеградируемых нитей. Обнаружено, что имплантация нитей PCL-PLLA повышает репаративный потенциал тканей. Через 3 месяца после имплантации отметили стимуляцию неоколлаганеза и ангиогенеза в дерме и гиподерме. Усилилась функциональная и пролиферативная активность клеток. Митотическая активность клеток в базальном слое эпидермиса привела к увеличению его толщины. Клинически подтвержденный эффект отмечен через 3 месяца и сохранялся на протяжении 18 месяцев после имплантации. Длительная биодеградация нитей (1,5-2 года) способствует замедлению процессов старения кожи тыльной поверхности кисти, пролонгируя процессы ревитализации тканей.
Кожа, старение кожи, электронная микроскопия, кисть, биодеградируемые имплантаты
Короткий адрес: https://sciup.org/143177429
IDR: 143177429 | DOI: 10.20340/mv-mn.2020.28(1)43-50
Текст научной статьи Морфологические изменения тканей после имплантации биодеградируемых нитей для коррекции инволюции кожи тыльной поверхности кисти
Введение. На коже тыльной поверхности кистей первые видимые признаки старения проявляются наиболее рано, что связано с морфофункциональными особенностями ее строения: тонкий эпидермис, истонченная дерма с небольшим количеством сальных желез, незначительный объем подкожно-жировой клетчатки. Кожа рук постоянно подвергается воздействию факторов, повреждающих кожный барьер (ультрафиолетовое излучение, агрессивные компоненты бытовой химии) [1-2]. Процесс старения тыла кожи кисти начинается с 30 лет и непрерывно прогрессирует до преклонного возраста. С возрастом кожа рук становится пигментированной, сухой, морщинистой с подчеркнутым кожным рисунком, снижается тонус, отмечается истончение и атрофия жировых прослоек, как подкожных, так и межмышечных, теряется эластичность с формированием избытка гипоэластичной истонченной дермы с появлением выраженных кожных складок, особенно при разгибании лучезапястного сустава [1]. С потерей объема подкожной клетчатки отмечается явление «скелетизации» тыла кисти, венозные сосуды и сухожилия на тыльной стороне кисти контурируются, а суставы пальцев кажутся увеличенными и подагрическими. Формируется характерная клиническая картина «стареющей» кисти или так называемая «птичья лапка». Для описания возрастных изменений кожи предложен термин «дерматопороз», который проявляется в потери эластичности кожи вследствие разрушения коллагеновых и эластических волокон, что, по мнению некоторых исследователей, связано со снижением содержания гиалуроновой кислоты и потерей экспрессии основных поверхностных рецепторов клеток в дерме, в частности рецептора CD44 [3-4].
В последние годы для коррекции инволюционных изменений кожи тыльной поверхности кисти, восполнения утраченного объема жировой клетчатки и ее увлажнения активно используются жидкие имплантаты на основе гиалуроновой кислоты, полимолочной кислоты, гидроксиапатита кальция и гладкие нитевые имплантаты из соединений поликапролактона и поли-L-молочной кислоты (далее - PCL-PLLA), полидиоксанона [5-8]. Используются также нити PCL-PLLA с насечками [9], однако детальная характеристика их ревитализирующих эффектов и процессов их структурной деградации в литературе отсутствует.
Цель исследования : морфологическая оценка эффективности коррекции инволюционных изменений кожи тыльной поверхности кисти нитевыми имплантатами с насечками на основе поликапролактона и поли-L-молочной кислоты.
Материалы и методы исследования. Для установки имплантатов была выбрана пациентка 50 лет без соматических заболеваний с выраженными признаками старения кожи в области тыла кистей. На проведение исследований получено разрешение локального этического комитета медицинского института Российского университета дружбы народов. Получение материала осуществлялось в Швейцарском Центре омоложения «Versua Clinic» (Москва, Россия). Пациентка была информирована о цели исследования и от нее получено письменное согласие.
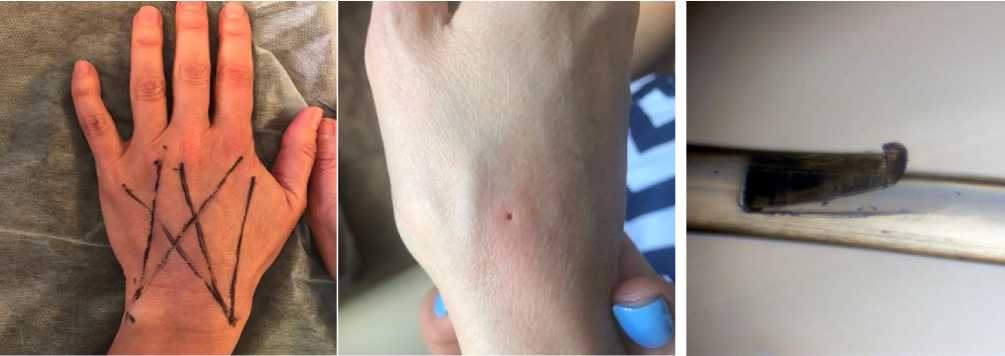
Состав нитевых имплантатов: PCL-поликапролактон и PLLA-L–лактид полимолочной кислоты; толщина – 2/0 USP (по стандартам Фармакопеи США) с насечками; сроки биодеградации имплантантов от 12-ти до 24 месяцев (рис. 1в) [10]. Установка нитей проведена с соблюдением правил асептики и антисептики после предварительно проведенной инфильтрационной анестезии. Нити имплантировались в область надапоневротической клетчаточной щели (подкожное пространство) по веерной методике. Суммарно на каждой кисти установили по 5 нитевых имплантатов. Нити частично пересекались в центре тыла кисти, формируя ромбовидную сетку (рис. 1а).
Проведено электронно-микроскопическое исследование фрагментов кожи тыльной поверхности кисти отобранных при помощи панч-биопсии до процедуры имплантирования и через 3 месяца после процедуры (рис. 1б). Панч-биоптаты кожи размером приблизительно 1,5 мм3 фиксировались в 2,5% растворе глутарового альдегида и 1% растворе четырехокиси осмия, обезвоживались в спиртах возрастающей концентрации (50, 70, 96 и 100%), пропитывались в смеси окись пропилена-аралдитовая смола и заливались в аралдитовую смолу в капсулы, которые помещались в термостат при температуре 60оС на 48 часов. Из полученных блоков готовились полутонкие срезы толщиной 1,5-2 мкм которые окрашивались толуидиновым синим. Предварительно срезы исследовали на светомикроскопическом уровне. Ультратонкие срезы толщиной 100-200 нм получали на ультрамикротоме фирмы LKB (Швеция). Ультраструктурное изучение препаратов проводили при помощи электронного микроскопа JEM 100-CX (JEOL, Япония) в трансмиссионном режиме при ускоряющем напряжении 80КВ.
1а 1б 1в
Рис. 1. Кисти пациентки в процессе имплантации биодеградируемых нитей; 1а - схема установки нитей PCL+PLLA; 1б - участок кожи кисти после панч-биопсии для проведения морфологического исследования; 1в - фрагмент биодеградируемой нити из PCL+PLLA с микронасечкой.
Клиническую оценку результатов производили через 3, 6 и 12 месяцев после имплантации нитей используя шкалы оценки качества кожи Merz Hand Grading Scale [5] и глобальную шкалу эстетического улучшения и безопасности процедуры GAIS [11].
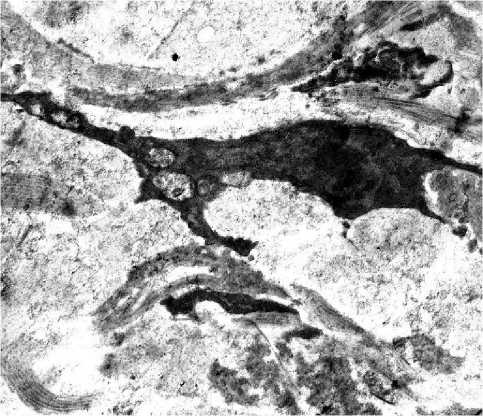
Результаты и обсуждение . До введения биодеградируемых нитей выявлены морфологические признаки возрастных изменений кожи тыльной поверхности кисти. Отмечено истончение эпидермиса, уплощение дермально-эпидермального соединения, снижение количества фибробластов в дерме, дезинтеграция коллагеновых и эластических волокон, уменьшение числа и размеров кровеносных сосудов. При электронномикроскопическом исследовании отмечали деструктивные изменения коллагеновых и эластических волокон дермы, утолщение стенок сосудов, атрофию потовых и сальных желез, а также гиподермы. Из-за уменьшения количества и снижения функциональной активности клеток соединительной ткани - фибробластов, нарушается (снижается) синтез коллагена и эластина, что приводит к уменьшению толщины дермы и снижению ее плотности. Между измененными коллагеновыми волокнами отмечали функционально малоактивные фибробласты - фиброциты, имеющие удлиненную форму с длинными тонкими цитоплазматическими отростками и узкий ободок цитоплазмы с единичными гипертрофированными митохондриями (рис. 2а).
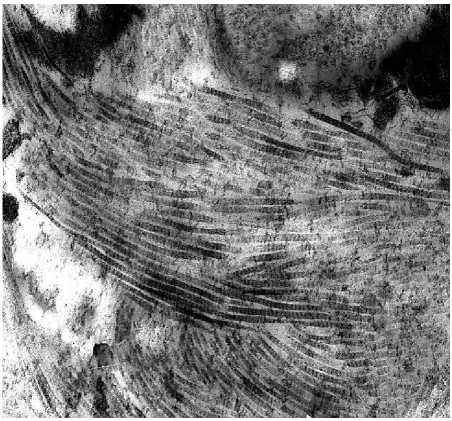
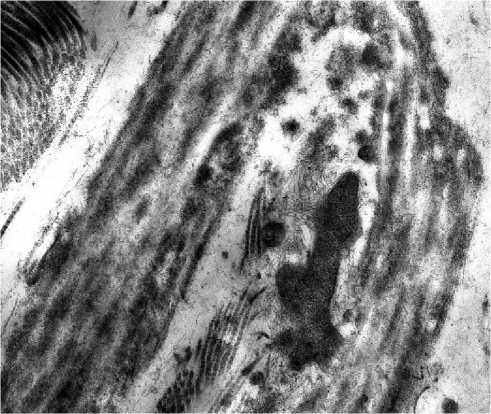
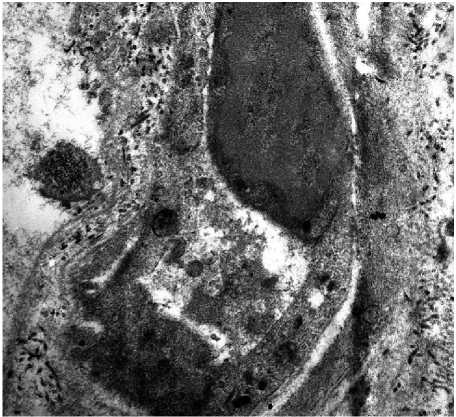
Сеть коллагеновых волокон в сетчатом слое дермы плотная, волокна утолщены и сплетены в пучки с беспорядочной ориентацией, что приводит к уменьшению или потере способности к растяжению (рис. 2б). Если в молодой коже в сосочковом слое коллагеновые волокна образуют тонкую сетку, то в измененной с возрастом коже отмечаются признаки склероза - короткие плотные коллагеновые волокна с единичными капиллярами, что указывает на недостаточную трофику верхних слоев дермы. Эластические волокна дегенеративно изменены - отмечаются набухание, разволокнение, фрагментация, образование глыбок, истончение волокон с образованием в сетчатом слое дермы лакун, в пределах сосочкового слоя формировалась сеть из тонких разнонаправленных волокон (рис. 2в). Нарушение васкуляризации кожи связано с уменьшением количества капилляров и деструктивными изменениями в эндотелиоцитах, что приводит к ухудшению терморегуляции кожи и снижению трофики тканей (рис. 2г).
2а
2б
2в
2г
Рис. 2. Морфология кожи тыльной поверхности кисти женщины 50 лет; 2а – фиброцит среди коллагеновых волокон. Электронограмма. Ув.: х12000; 2б – разнонаправленные пучки коллагеновых волокон. Электронограмма. Ув.: х23000; 2в – деструктивно измененное эластическое волокно. Электронограмма. Ув.: х17000; 2г – деструктивно измененный капилляр. Электронограмма. Ув.: х14000.
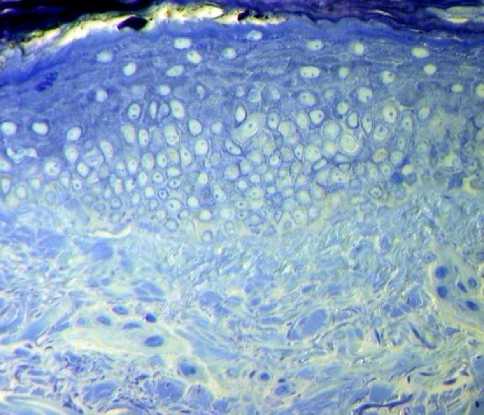
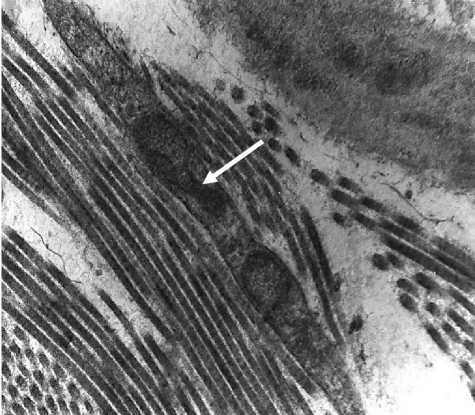
Из-за малого размера ткани, взятой для электронно-микроскопического исследования во время панч-биопсии (1,5 мм3), фрагмент нити и клеточная реакция непосредственно вокруг нее через 3 месяца после имплантации не были исследованы. Присутствие в подкожном пространстве биодеградируемых нитей PCL+PLLA с насечками привело к оживлению клеточной реакции во всех слоях кожи. Через 3 месяца после введения нитей отмечали увеличение толщины эпидермиса за счет ускорения обновления клеток в базальном слое эпидермиса (рис. 3а). Появились эпидермальные выросты. Признаков воспаления не было. На улучшение васкуляризации сосочкового слоя дермы указывали капилляры среди тонких фибрилл коллагена и эластина. Отмечали улучшение гистоархитетоники дермы, упорядоченное строение коллагеновых и эластических волокон, коллагеновые волокна чаще располагались параллельно друг другу или под углом. Структура коллагеновых фибрилл не нарушена. Между коллагеновыми волокнами находились фиброциты - клетки удлиненной формы с длинными цитоплазматическими
Морфологические ведомости – Morphological Newsletter: 2020 Том 28 Выпуск 1 отростками и с низким уровнем функциональной активности, выполняющие в основном опорную функцию (рис. 3б).
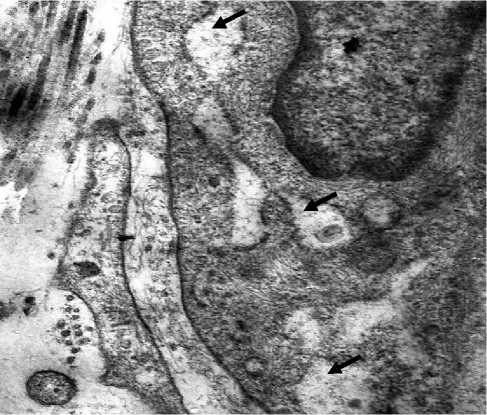
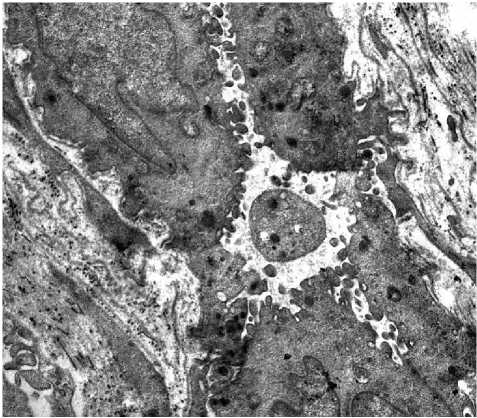
Наиболее выраженная клеточная реакция наблюдалась в области гиподермы. Фибробласты с различным уровнем функциональной активности находились на близком расстоянии друг от друга. Это были в основном функционально активные белоксинтезирующие клетки с характерной ультраструктурной организацией, практически весь объем цитоплазмы был занят умеренно расширенными канальцами гранулярной цитоплазматической сети, что указывало на превалирование функции синтеза белков, в том числе и коллагена, над секрецией синтезированных белков. В клетках с резко расширенными канальцами, которые образовывали большие полости с хлопьевидным содержимым (синтезированный белок), коллаген-продуцирующая функция была в основном завершена и клетки находились в стадии секреции коллагена во внеклеточное пространство. В результате вокруг фибробластов отмечали скопления хлопьевидного материала и тонких фибрилл коллагена (рис. 3в). Таким образом, запускается процесс неоколлагенеза, результатом которого становится повышение тургора кожи. Внешне это выражалось в уплотнении кожного покрова, разглаживании рельефа его поверхности. В гиподерме отмечено улучшение трофики, сосуды микроциркуляторного русла с активным эндотелием находились преимущественно в этой зоне. О функциональной активности эндотелиоцитов судили по большому количеству цитоплазматических выростов на люминальной и базальной поверхностях (рис. 3г). Таким образом, имплантация в подкожное пространство тыльной поверхности кисти биодеградируемых нитей из PCL+PLLA стимулирует функциональную активность клеток гиподермы, митотическую активность клеток, в частности базального слоя эпидермиса, приводящих к увеличению его толщины. Происходит стимуляция коллагеногенеза и ангиогенеза.
При оценке клинических результатов имплантации в подкожное пространство тыльной поверхности кисти биодеградируемых нитей PCL-PLLA c насечками максимальный эффект отмечен через 3 месяца и он сохранялся на протяжении 18 месяцев после имплантации. Согласно шкалам оценки Merz Hand Grading и Scale кожа тыльной стороны кисти с 3-й степени до процедуры улучшилась до 2-й степени после имплантирования, а по GAIS оценена в 5 баллов, как врачом, так и пациентом.
Результатом старения кожи является избыточность ткани и снижение эластичности кожи тыла кисти, что затрудняет процессы омоложения, так как введение жидких филлеров дает лишь ограниченное восполнение потерянного объема, а при использовании большего объема филлера - неестественный результат [12]. При проведении имплантирования нитей из PCL-PLLA c насечками в подкожное пространство кисти клинической целью было достижение сокращения поверхности кожи с сохранением естественности внешнего вида тыла кисти. Изучение влияния нитей из PCL-PLLA на клетки кожи показало биостимулирующий эффект, который обусловлен сочетанным воздействием механического, биологического и химического факторов. При имплантации в организм любого чужеродного материала возникает воспалительно-репаративная реакция на механическое повреждение и на инородное тело, которая является выражением защитной и репаративной функций соединительной ткани. Выраженность реакции зависит от биосовместимости материала с тканями организма, от поверхностных свойств материала, его формы. Биодеградируемые нити на основе поликапролактона и поли-L-молочной кислоты не отторгаются тканями и не вызывают аллергических реакций. Имплантация нитей взывает иммунный ответ организма и образование зоны асептического воспаления вокруг нитей, которое ведет к пролиферации фибробластов и продукции ими коллагеновых волокон и других компонентов экстрацеллюлярного матрикса.
Биостимулирующий эффект биодеградируемых нитей связан и с их химическим составом. По многочисленным данным литературы, входящая в состав нитей и выделяемая в процессе биодеградации L-молочная кислота стимулирует неоколлагенез в коже [13-15].
3б
3в
3г
Рис. 3 . Морфология кожи тыльной поверхности кисти женщины 50 лет через 3 месяца после имплантации в подкожное пространство биодеградируемых нитей PCL-PLLA с насечками. 3а - митоз базальных кератиноцитов. Окраска толуидиновым синим. Ув.: х200; 3б - фиброцит сосочкового слоя дермы - стрелка, эластическое волокно -звездочка, коллагеновые волокна - ромб. Электронограмма. Ув.: х12000; 3в -функционально активный фибробласт гиподермы с умеренно расширенными канальцами гранулярной эндоплазматической сети. Расширения гранулярной цитоплазматической сети - стрелки, коллагеновое волокно - ромб. Электронограмма.
Ув.: х23000; 3г - капилляр гиподермы. Электронограмма. Ув.: х10000.
Эффективность нитей из PCL-PLLA обусловлена также тем, что разнонаправленные микронасечки обеспечивают фиксацию нитей в тканях и дополнительную стимуляцию процессов фиброплазии [12].
Заключение. Таким образом, имплантация в подкожное пространство тыльной поверхности кисти биодеградируемых нитей из PCL-PLLA с насечками повышает репаративный потенциал тканей. Через 3 месяца после имплантации нитей отмечается стимуляция неоколлаганеза и ангиогенеза в дерме и гиподерме, усиливается сосудистая, клеточная функциональная и пролиферативная активность. Стимуляция митотической активности клеток в базальном слое эпидермиса привела к увеличению его толщины. Биодеградация нитей происходит в течение 1,5-2 лет, можно предположить, что ревитализация в коже тыльной поверхности кисти будет происходить до момента полного гидролиза нитей, и будет способствовать замедлению процессов старения.
Авторы сообщают об отсутствии каких-либо конфликтов интересов при планировании, выполнении, финансировании и использовании результатов настоящего исследования.
Список литературы Морфологические изменения тканей после имплантации биодеградируемых нитей для коррекции инволюции кожи тыльной поверхности кисти
- Jakubietz RG, Kloss DF, Gruenert JG, Jakubietz MG. The ageing hand. A study to evaluate the chronological ageing process of the hand. Journal of Plastic, Reconstructive & Aesthetic Surgery. 2008;(61):681-686. https://doi.org/10.1016/j.bjps.2007.12.028.
- Lefebvre-Vilardebo M, Trevidic P, Moradi A, Busso M, Sutton A.B., Bucay V.W. Hand: Clinical Anatomy and Regional Approaches with Injectable Fillers. Plastic and Reconstructive Surgery. 2015;136(5):258S-275. https://doi.org/10.1097/PRS.0000000000001828.
- Kaya G, Saurat JH. Dermatoporosis: a chronic cutaneous insufficiency/fragility syndrome. Clinicopathological features, mechanisms, prevention and potential treatments. Dermatology. 2007;215(4):284-294.
- Wang YZ, Cao M, Liu YW, He YQ, Yang CX, Gao F. CD44 mediates oligosaccharides of hyaluronan-induced proliferation, tube formation and signal transduction in endothelial cells. Exp Biol Med (Maywood). 2011;236(1):84-90. https://doi.org/10.1258/ebm.2010.010206.
- Bertucci V, Solish N, Wong M, Howell M. Evaluation of the Merz Hand Grading Scale After Calcium Hydroxylapatite Hand Treatment. Dermatol Surg. 2015;41(1):389-96. https://doi.org/10.1097/DSS.0000000000000546.
- Jabbar A, Arruda S, Sadick N. Off Face Usage of Poly-L-Lactic Acid for Body Rejuvenation. J Drugs Dermatol. 2017;1;16(5):489-494.
- Lim K, Mulcahy A. Hand rejuvenation: Combining dorsal veins foam sclerotherapy and calcium hydroxylapatite filler injections. Phlebology. 2016;32(6). https://doi.org/10.1177/0268355516655684.
- Paklina OV, Chekmareva IA, Agapova MA, Zhukova OG, Gulyaeva IV, Tsinoeva FI. Comparative morphological characteristics of human tissue reactions to bioreosorbable thread implants. Annals of Plastic, Reconstructive and Aesthetic Surgery. 2018;(2):26-36.
- Vieira AC, Vieira JC, Guedes RM, Marques AT. Degradation and viscoelastic properties of PLA-PCL, PGA-PCL, PDO and PGA fibres. Materials Science Forum. 2010:825-832. https://doi.org/10.4028/www.scientific.net/msf.636-637.825.
- Panova OS, Gubanova YeI, Lapatina NG, Ernandes E, Sharova A. Contemporary methods for the assessment of skin hydration and biomechanical properties. Vestn Dermatol Venerol. 2009;(2):80-87.
- Zhukova OG, Sergeeva NG. Aptos Nano threads - a new word in modern cosmetology. Kosmetik International. 2013;(4):76-77.
- Zhukova OG, Sergeeva NG. Aptos biodegradable threads - a new tool for cosmetic correction. Kosmetik International. 2014;(5):40-41.
- Fitzgerald R, Vleggaar D. Facial volume restoration of the aging face with poly-l-lactic acid. Dermatol Ther. 2011;24(1):2-27. https://doi.org/10.1111/j.1529-8019.2010.01375.x.
- Moy RL, Fincher EF. Poly-L-lactic acid for the aesthetic correction of facial volume loss. Aestet. Surg. J. 2005;25(6):646-648. https://doi.org/10.1016/j.asj.2005.10.001.
- Schierle CF, Casas LA. Nonsurgical rejuvenation of the aging face with injectable poly-L-lactic acid for restoracion of soft tissue volume. Aesthet. Surg. J. 2011;31(1):95-109. https://doi.org/10.1177/1090820X10391213.


