Морфологические изменения в мегакариоцитах при лечении гидроксимочевиной истинной полицитемии и первичного миелофиброза
Автор: Гаркуша Т.А.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Морфология. Патология
Статья в выпуске: 4 т.15, 2025 года.
Бесплатный доступ
Ведение. Миелопролиферативные заболевания характеризуются нарушением одной или более клеточной линии миелопоэза в костном мозге. При истинной полицитемии, первичном миелофиброзе и эссенциальной тромбоцитемии происходит гиперплазия мегакариоцитарного ростка с формированием их атипичных форм. В мегакариоцитах при данных новообразованиях наблюдается угнетение апоптоза, что способствует сохранению атипичных форм. Для лечения Ph-негативных миелопролиферативных заболеваний применяется гидроксимочевина. Механизм действия данного препарата связан с ингибированиием рибонуклеотидредуктазы. В настоящем исследовании была поставлена цель – дать ультраструктурную характеристику мегакариоцитов с определением потенциальных терапевтических мишеней при лечении гидроксимочевиной Ph-негативных миелопролиферативных новообразований. Материалы и методы. Было исследовано четыре образца костного мозга, полученные от пациентов методом трепанобиопсии ости подвздошной кости. У пациентов были диагностированы истинная полицитемия и первичный миелофиброз. Все представленные пациенты, независимо от нозологии, получали лечение гидроксимочевиной в терапевтических дозах. Результат. В образцах костного мозга, в цитоплазме мегакариоцитов визуализировались «пустоты», имеющие вид оптически пустых вакуолей. При электронной микроскопии мегакариоцитов, в препаратах костного мозга, в проекциях описанных выше оптически пустых вакуолей определялись полости от округлой до неправильной формы разных размеров. В части данных полостей визуализировались слоистые массы, пластинки которых имели концентрическое направление – аутофагические вакуоли. Слоистые структуры с концентрически направленными пластинками, напоминавшие содержимое аутофагических вакуолей, определялись и вне клеток. Конденсации хроматина в ядрах мегакариоцитов не наблюдалось. Вывод. Результаты, полученные в исследовании, предполагают, что гидроксимочевина инициирует в мегакариоцитах при лечении Ph-негативных миелопролиферативных новообразований аутофагический ответ. Возможно, как инициирование в клетках аутофагической гибели, что могло бы объяснить его терапевтический эффект. Однако также возможно, что аутофагия имеет цитопротективную роль. Таким образом, аутофагия является потенциальной терапевтической мишенью при лечении гидроксимочевиной.
Миелопролиферативные новообразования [D054437], мегакариоциты [D008533], аутофагия [D001343], гидроксимочевина [D006918], истинная полицитемия [D011087], первичный миелофиброз [D055728], костный мозг [D001853], ультраструктура [D014463], электронная микроскопия [D008854]
Короткий адрес: https://sciup.org/143185005
IDR: 143185005 | УДК: 616.155.392:615.277.3:616-091.8 | DOI: 10.20340/vmi-rvz.2025.4.MORPH.5
Текст научной статьи Морфологические изменения в мегакариоцитах при лечении гидроксимочевиной истинной полицитемии и первичного миелофиброза
Миелопролиферативные неоплазии (МПН) – клональные заболевания, характеризующиеся нарушением пролиферации одной или более клеточной линии миелопоэза в костном мозге. Наиболее частые Ph-негативные МПН – истинная полицитемия (ИП), первичный миелофиброз (ПМФ) и эссенциальная тромбоцитемия (ЭТ). Морфологически ИП, ПМФ и ЭТ характеризуются гиперплазией мегакариоци-тарного ростка, формированием атипичных форм мегакариоцитов и кластеров [1]. В то время как остальные ростки кроветворения могут быть интактны, что, в первую очередь, характерно для ЭТ. В мегакариоцитах при ИП, ЭТ, ПМФ имеется нарушение апоптоза, характеризующееся его угнетением, что, в том числе, способствует сохранению атипичных мегакариоцитов и их гиперплазии [2–5].
Одним из химиотерапевтических препаратов, применяемым в настоящее время при лечении Ph-негативных МПН, является гидроксимочевина. Механизм действия данного препарата связан с ингибированием рибонуклеотидредуктазы – фермента, который катализирует превращение рибонуклеотидов в дезоксирибонуклеотиды во время синтеза ДНК de novo. Это приводит к ингибированию синтеза ДНК в S-фазе клеточного цикла и инициации гибели клетки [6].
В литературе описаны различные изменения опухолевых клеток, возникающие под действием химиотерапевтических лекарственных средств, в том числе генетически детерминированная гибель клетки [7–11]. В настоящее время выделяют несколько типов генетически детерминированной гибели клеток, в частности апоптоз [7, 8, 11–18] и опосредованную аутофагией клеточную гибель [7–9, 11–19]. В клетке одновременно могут быть активированы разные варианты гибели клетки [11, 16].
Наиболее изученным из данных типов гибели клетки является апоптоз. Выделяют два пути активации апоптоза – внешний и внутренний [7, 9, 11, 12, 15, 16]. Однако независимо от того, каким путём был активирован апоптоз, ультраструктурно он характеризуется конденсацией хроматина у ядер-ной мембраны, формированием апоптотических телец [12, 13, 16, 18]. Апоптотические тельца представлены частью цитоплазмы клетки, ограниченной мембраной, в части могут содержаться фрагменты ядра с конденсированным хроматином [13, 16].
Другие изменения, описанные в литературе при применении химиотерапевтических лекарственных средств, представлены аутофагией. Выделяют три вида аутофагии: микроаутофагия, шаперон-опосредованная аутофагия и макроаутофагия [10, 13, 17, 18]. В настоящей статье речь пойдет о макроаутофагии. В отличие от апоптоза, аутофагия может носить характер как промотора, так и протектора гибели клетки [7–11, 13, 15–19, 21, 22]. Механизм аутофагической гибели клетки пока мало изучен, однако в литературе имеются данные об экспериментах, подтверждающих наличие такого типа гибели клетки. При этом имеет место макроаутофагия, характеризующаяся формированием двухмембранной структуры, в полости которой находится часть цитоплазмы или слоистое содержимое [8, 9, 11, 12, 16–22]. Данная структура получила название аутофагическая вакуоль или аутофагосома. Аутофагическая вакуоль в дальнейшем сливается с лизосомой, формируя аутолизосому, в которой происходит разрушение содержимого, после чего остаётся пустая полость [7, 8, 11, 13, 16, 17–19, 21, 22]. При чрезмерном разрушении компонентов клетки происходит необратимое нарушение жизнедеятельности клетки, и она погибает [7, 10, 11, 17, 19, 21]. Однако, как описано выше, аутофагия может защищать клетку от гибели несколькими путями: поглощение и изоляция токсических веществ (к которым также относятся и химиотерапевтические лекарственные средства); прямое подавление апоптоза в клетке; поглощенные органеллы и долгоживущие белки в условиях голода клетки, которые разрушаясь в аутолизосомах, высвобождают энергию, необходимую для выживания клетки.
В настоящем исследовании была поставлена цель – дать ультраструктурную характеристику мегакариоцитов с определением потенциальных терапевтических мишеней при лечении гидроксимочевиной Ph-негативных МПН. Для достижения поставленной цели часть трепанобиоптата, полученного из подвздошной кости, забиралась для проведения трансмиссионной электронной микроскопии, что позволяло сохранить гистоархитектонику костного мозга и оценить мегакариоцитарное звено гемопоэза in situ.
Материалы и методы
Было исследовано четыре образца костного мозга, полученных от пациентов методом трепанобиопсии ости подвздошной кости иглой Джамшиди с диаметром сечения G18. Во всех случаях трепанобиопсия костного мозга проводилась с целью определения степени фиброза костного мозга у пациентов, с диагностированными ранее ИП и ПМФ. Характеристика группы пациентов по нозологическим формам и клинико-лабораторным показателям представлена в таблице 1. Все представленные пациенты, независимо от нозологии, получали лечение препаратом гидроксимочевина в терапевтических дозах. Во всех случаях получено добровольное информированное согласие пациента на участие в исследовании.
Таблица 1. Клинико-лабораторные характеристики пациентов исследуемой группы
Table 1. Clinical and laboratory characteristics of patients in the study group
|
Параметр |
Пациент № |
|||||||
|
1 |
2 |
3 |
4 |
|||||
|
На момент постановки диагноза |
После проведенного лечения |
На момент постановки диагноза |
После проведенного лечения |
На момент постановки диагноза |
После проведенного лечения |
На момент постановки диагноза |
После проведенного лечения |
|
|
Возраст (лет) |
75 |
77 |
54 |
55 |
28 |
35 |
59 |
60 |
|
Пол |
Ж |
Ж |
Ж |
М |
||||
|
Диагностированное заболевание |
Истинная полициемия |
Истинная полициемия |
Первичный миелофиброз |
Перв миело |
чный иброз |
|||
|
Гемоглобин (г/л) |
161 |
118 |
134 |
129 |
127 |
135 |
105 |
108 |
|
Эритроциты (х1012/л) |
6,82 |
2,72 |
4,92 |
4,34 |
4,32 |
5,23 |
4,06 |
3,77 |
|
Лейкоциты (х109/л) |
44,3 |
7,23 |
13,2 |
5,87 |
17,58 |
19,4 |
19,8 |
7,49 |
|
Тромбоциты (х109/л) |
531 |
230 |
821 |
410 |
1167 |
1044 |
2766 |
438 |
|
Размеры селезенки по УЗИ (см) |
20×9,4 |
12×6,7 |
18,9×8,4 |
17,3×7,3 |
– |
11,6×4,4 |
13×5 |
– |
Электронно-микроскопическое исследование образцов проводилось с применением просвечивающего электронного микроскопа Zeiss Libra 120 PLUS в режиме TEM при различных увеличениях и с выполнением картирования изображения для формирования обзорных снимков. Оценке подлежали снимки, полученные камерой TRS Dual speed 220V 50-60Hz, SN 441/13. Морфометрический анализ получаемых изображений выполнялся с применением программного обеспечения Olympus iTEM.
Морфологическое исследование полутонких срезов и препаратов костного мозга, окрашенных гематоксилином-эозином, азур-2-эозином по А.А. Максимову в модификации Ю.А. Криволапова [23], импрегнация солями серебра по Гордону-Свитсу, проводилось на основе анализа цифровых сканированных изображений, полученных с применением гистологического сканера Pannoramic FLASH 250 (3D HISRECH), с использованием программ CaseViewer 2.0 RTM v2.0.2.61392 и Pannoram-ic Viewer. Статистический анализ проводился мето- дами вариационной статистики для непараметрических величин. Значения приведены в медианах с указанием 25 и 75 перцентилей.
Результаты
Средняя длина трепанобиоптата, полученного из подвздошной кости, составила 3,8±0,3 см. В образцах костного мозга исследуемых пациентов на светооптическом уровне визуализировалось множество атипичных форм мегакариоцитов, в том числе крупные мегакариоциты с гиперсегментиро-ванным ядром. В их цитоплазме, в том числе вблизи ядра, визуализировались «пустоты», имеющие вид оптически пустых вакуолей (рис. 1).
При оценке полутонких срезов в цитоплазме мегакариоцитов также определялись «пустоты», которые могли локализоваться в какой-либо зоне цитоплазмы в виде групп либо рассеянно по всей цитоплазме в виде отдельных оптически пустых вакуолей (рис. 2).
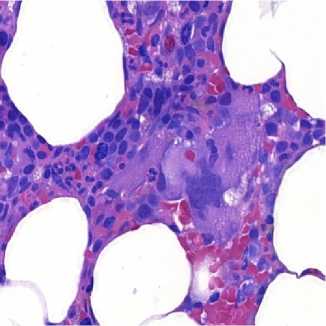
Рисунок 1. Микрофотографии мегакариоцитов при Ph-негативных мик-лопролиферативных заболеваниях. Крупный мегакариоцит с гипер-сегментированным ядром и наличием «пустот» в цитоплазме. Окраска азур 2 эозином в модификации Ю.А. Криволапова, увеличение ×400 Figure 1. Micrographs of megakaryocytes in Ph-negative microprolif-erative diseases. Large megakaryocyte with a hypersegmented nucleus and the presence of "voids" in the cytoplasm. Staining of azure 2 with eosin modified by Yu.A. Krivolapov, magnification ×400
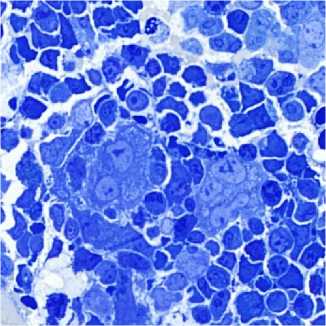
Рисунок 2. Микрофотографии мегакариоцитов при Ph-негативных миклопролиферативных заболеваниях. Мегакариоциты с нормо-сегментацией ядра и «пустотами» в цитоплазме. Полутонкие срезы, окраска толуидиновым синим, увеличение ×400
Figure 2. Micrographs of megakaryocytes in Ph-negative microprolif-erative diseases. Megakaryocytes with normal segmentation of the nucleus and "voids" in the cytoplasm. Semi-thin sections, stained with toluidine blue, magnification ×400
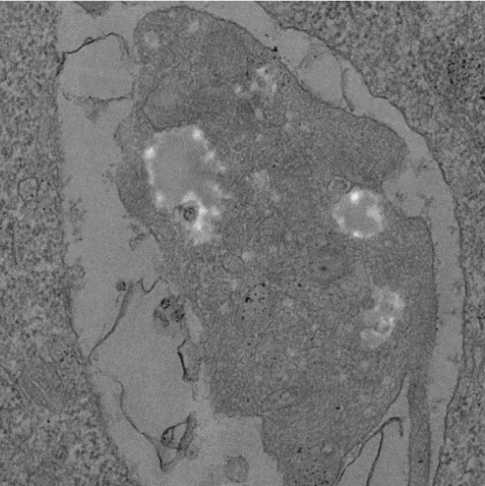
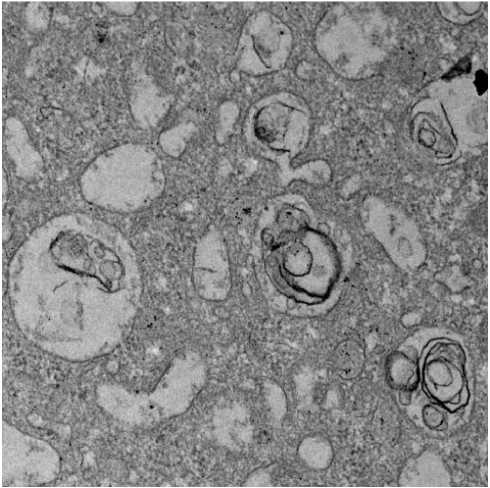
При электронно-микроскопическом исследовании мегакариоцитов, в препаратах костного мозга, в проекциях описанных выше оптически пустых вакуолей, определялись полости от округлой до неправильной формы разных размеров. В части дан- ных полостей визуализировались участки цитоплазмы, ограниченные собственной мембраной или слоистые массы, пластинки которых имели концентрическое направление – аутофагческие вакуоли (рис. 3, A и Б).
Б
Рисунок 3. Микрофотографии цитоплазмы мегакариоцитов при Ph-негативных миклопролиферативных заболеваниях. A. Ограниченный мембраной участок цитоплазмы мегакариоцита. Электронномикроскопический снимок, контрастирование уранил ацетатом и цитратом свинца; ZeissLibra 120, увеличение ×5000. Б. Ограниченные мембраной вакуоли, в просвете части которых определяется слоистое содержимое. Электронномикроскопический снимок, контрастирование уранил ацетатом и цитратом свинца; ZeissLibra 120, увеличение ×5000
Figure 3. Micrographs of megakaryocyte cytoplasm in Ph-negative microproliferative diseases. A. Membrane-bounded region of megakaryocyte cytoplasm. Electron micrograph, contrasted with uranyl acetate and lead citrate; ZeissLibra 120, magnification ×5000. Б. Membrane-bounded vacuoles, in the lumen of some of which layered contents are determined. Electron micrograph, contrasted with uranyl acetate and lead citrate; ZeissLibra 120, magnification ×5000
Слоистые структуры с концентрически направленными пластинками, напоминавшие содержимое аутофагических вакуолей, определялись и вне клеток. Конденсация хроматина в ядрах мегакариоцитов отсутствовала, в ядре визуализировалось ядрышко. В цитоплазме также имелись другие органоиды, такие как митохондрии, демаркационная мембранная система, рибосомы, аппарат Гольджи, альфа гранулы и другие. В части органоидов имелся отёк. Апоптотические тельца отсутствовали во всех образцах.
При светооптическом исследовании образцов визуализировались небольшие фрагменты цитоплазмы мегакариоцитов, не содержащие ядра. По всему фрагменту визуализировались оптически пустые вакуоли (рис. 4).
При электронно-микроскопическом исследовании данных фрагментов цитоплазма дезорганизована, имелись единичные органоиды, в проекции вышеописанных «пустот» определялись крупные, местами сливающиеся между собой, аутофагосомы (рис. 5).
Обсуждение
К заболеваниям с нарушением пролиферации и апоптоза клеток миелопоэза относятся Ph-негативные МПН. При лечении Ph-негативных
МПН применяют химиотерапевтические лекарственные средства, одним из которых является гидроксимочевина. Данный препарат ингибирует ри-бонуклиотидилредуктазу, тем самым нарушает синтез ДНК в клетке, что может приводить к её гибели. Описаны различные механизмы гибели клетки, которые могут возникать при применении химиотерапевтических лекарственных средств, каждый из которых имеет свои морфологические черты.
У всех пациентов представленной группы имелось клиническое улучшение, характеризовавшееся уменьшением спленомегалии, снижением уровня тромбоцитов и приближением уровня гемоглобина к нормальным значениям. В образцах костного мозга у всех представленных пациентов в цитоплазме мегакариоцитов на светооптическом уровне имелись оптически пустые вакуоли. При проведении электронной микроскопии оптически пустые вакуоли были представлены аутофагическими вакуолями с фрагментами цитоплазмы или слоистым содержимым и пустыми вакуолями. Конденсация хроматина в ядрах и разделение клетки на апоптотические тела отсутствовали. В образцах также имелись фрагменты цитоплазмы, не содержавшие ядра, в которых визуализировались крупные аутофагические вакуоли, местами сливавшиеся между собой, и только единичные органоиды.
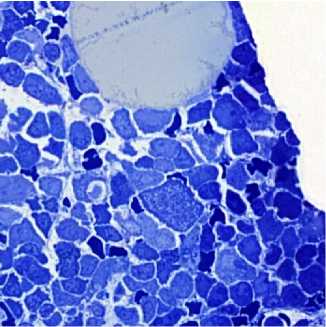
Рисунок 4. Микрофотографии фрагментов цитоплазмы мегакариоцита. Фрагмент цитоплазмы мегакариоцита без ядра с наличием множества «пустот». Полутонкие срезы, окраска толуидиновым синим, увеличение ×400
Figure 4. Micrographs of megakaryocyte cytoplasm fragments. Megakaryocyte cytoplasm fragment without nucleus with multiple "voids". Semi-thin sections, toluidine blue staining, magnification ×400
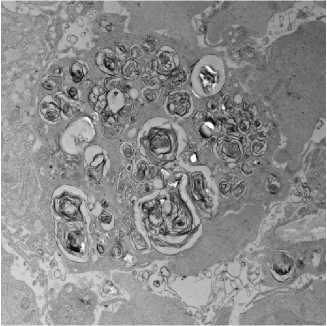
Рисунок 5. Микрофотографии фрагментов цитоплазмы мегакариоцита. Цитоплазма мегакариоцита не содержит органоидов, визуализируется множество ограниченных мембраной аутофагических вакуолей. Электронномикроскопический снимок, контрастирование уранил ацетатом и цитратом свинца; ZeissLibra 120, увеличение ×5000
Figure 5. Micrographs of megakaryocyte cytoplasm fragments. Megakaryocyte cytoplasm does not contain organelles; multiple membrane-bound autophagic vacuoles are visualized. Electron microscopic image, contrasted with uranyl acetate and lead citrate; Zeiss Libra 120, magnification ×5000
Заключение
Полученные результаты предполагают, что гидроксимочевина инициирует в мегакариоцитах при лечении Ph-негативных МПН аутофагический ответ. Возможно, данное химиотерапевтическое лекарственное средство инициирует в клетках аутофагическую гибель клеток, чем можно было бы объяснить его терапевтический эффект. Однако, также возможно, что аутофагия имеет цитопротективную роль. Таким образом, аутофагия является потенци- альной терапевтической мишенью при лечении гидроксимочевиной ИП, ЭТ и ПМФ. В настоящее время существуют химиотерапевтические средства, способные влиять на аутофагию [8, 9, 11, 20–22]. Модулируя активность аутофагии в разные фазы, возможно, удастся усилить терапевтический эффект гидроксимочевины, снизить частоту осложнений и увеличить выживаемость при ИП, ЭТ и ПМФ. Данная гипотеза требует дальнейшего всестороннего изучения.


