Морфологические изменения в органах лабораторных животных при длительном пероральном введении золотых наночастиц
Автор: Маслякова Г.Н., Пахомий С.с, Бучарская А.Б., Злобина О.В., Наволокин Н.А., Понукалин А.Н., Хлебцов Н.Г., Хлебцов Б.Н., Богатырев В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.9, 2013 года.
Бесплатный доступ
Цель: оценить выраженность морфологических изменений во внутренних органах лабораторных животных при длительном пероральном введении золотых наночастиц разного размера. Материал и методы. Эксперимент выполнен на 40 белых беспородных крысах, разделенных на 4 группы. Животные опытных групп получали перорально золотые наночастицы по соответствующей схеме. Результаты. При сравнении морфологических изменений во внутренних органах лабораторных животных установлено, что введение золотых наночастиц разного размера приводит к однотипным нарушениям морфологической структуры, при этом наиболее выраженные изменения вызывают золотые наночастицы размером 1-3 и 50 нм. Заключение. Наиболее выраженные морфологические перестройки во внутренних органах вызывают золотые наночастицы размером 1-3 и 50 нм, что свидетельствуют о размерно-зависимом влиянии золотых наночастиц.
Золотые наночастицы, морфология, морфометрия, токсичность
Короткий адрес: https://sciup.org/14917708
IDR: 14917708
Текст научной статьи Морфологические изменения в органах лабораторных животных при длительном пероральном введении золотых наночастиц
1 Введение. В последние годы отмечается резкое увеличение количества публикаций, посвященных наномедицине [1]. Предполагается, что в ближайшем будущем применение наноматериалов приведет к революционным достижениям в лечении многих заболеваний. Уже сегодня коллоидное золото используют в качестве носителя для доставки лекарственных веществ, генетического материала, антигенов и как собственно лекарственное или диагностическое средство при терапии опухолей или ревматоидного артрита [1, 2].
Однако активное внедрение нанотехнологий в практическую медицину требует тщательного изучения потенциальных рисков и возможных побочных эффектов, связанных с их применением. Несмотря на то что наноматериалы в мире уже используются более десяти лет, ни один вид наночастиц не был изучен в полном объеме на безопасность ни в одной из стран мира [3, 4].
По отношению к золотым наночастицам (ЗНЧ) остаются нерешенными вопросы биораспределения и циркуляции в кровяном русле, их фармакокинетики и выведения из организма, а также потенциальной токсичности с учетом размеров, длительности и способов введения. В рамках данной проблемы актуальным является определение характера и выраженности повреждающего влияния ЗНЧ на организм лабораторных животных с обязательным морфологическим исследованием внутренних органов. Это связано с тем, что оценка морфологического состояния органов, в первую очередь ответственных за метаболизм и экскрецию, непосредственно после окончания введения исследуемого вещества позволяет визуально оценить патологические изменения в структуре органа и охарактеризовать их количественно [5].
Цель: оценить выраженность морфологических изменений во внутренних органах лабораторных животных при длительном пероральном введении ЗНЧ разного размера. Актуальность задачи продемонстрирована недавно в работе [6], в которой также изучались эффекты размера и заряда золотых наночастиц при длительном пероральном введении самкам крыс. В частности, авторы указали, что на сегодняшний день пока трудно сделать какие-либо общие выводы из результатов их исследования.
Материал и методы. Экспериментальное исследование выполняли на базе Научно-образовательного центра фундаментальной медицины и нанотехнологий Саратовского государственного медицинского университета. Эксперименты на животных проводили в соответствии с Женевской конвенцией «International Guiding principles for Biomedical Research Involving Animals» (Geneva, 1990). Принимая во внимание тот факт, что биологические эффекты наночастиц зависят от нескольких параметров, в нашем исследовании использовались частицы коллоидного золота диаметром 1–3 нм, 15 нм и 50 нм (концентрация золота 57 мкг/мл), синтезированные в лаборатории нанобиотехнологии ИБФРМ РАН (г. Саратов) (зав. лабораторией д-р физ.-мат. наук проф. Н. Г. Хлебцов). Средний размер ЗНЧ определяли по электронно-микроскопическим изображениям на микроскопе Libra-120 (Carl Zeiss, Jena, Germany).
Эксперимент выполнен на сорока здоровых белых беспородных половозрелых крысах-самцах с массой тела 180–260 г, полученных из вивария ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России. При разработке модели экспериментального исследования за основу положено «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» [5]. Исследование выполнено на четырех группах животных. Первая группа — контрольная. Вторая, третья и четвертая группы — опытные. Крысам опытных групп ЗНЧ вводили перорально через день из расчета 190
мкг/кг массы животного в течение 8 дней по следующей схеме: 1-я опытная группа — ЗНЧ диаметром 1–3 нм, 2-я опытная группа — ЗНЧ размером 15 нм, 3-я опытная группа — ЗНЧ 50 нм. Крысам контрольной группы вводили через день перорально по 1 мл физиологического раствора.
Для обработки полученных в ходе исследований данных использовали пакет прикладных статистических программ Statistica 10.0 (Stat Soft Inc, США). Представленная статистическая обработка данных заключалась в проверке соответствия формы распределения количественных признаков нормальному с помощью применения теста Колмогорова — Смирнова. Нулевую гипотезу отвергали в случае р<0.05. Для каждого показателя в исследуемых группах вычисляли среднее арифметическое (М), среднюю ошибку среднего арифметического (m), среднеквадратичное отклонение (σ). Показатель достоверности различий (Р) определялся с использованием критериев Стьюдента (t). Различия оценивались как достоверные при вероятности 95% (р<0.05) и выше. Исследование взаимосвязи между количественными признаками осуществляли при помощи метода Пирсона, при этом определяли наличие связи, ее направление и силу.
Результаты. Проведенные исследования показали, что морфологические изменения, возникающие во внутренних органах лабораторных животных при длительном пероральном введении ЗНЧ, носят размерно-зависимый характер.
В легких строение бронхиального дерева сохранялось, в просвете бронхов разного калибра содержалась слизь, в группе введения ЗНЧ размером 50нм в просвете так же обнаружены слущенные клетки мерцательного эпителия. В области корней легкого располагались клеточные инфильтраты, состоящие преимущественно из лимфоцитов, немногочисленных бластных клеток, макрофагов, плазматических клеток. Во всех группах отмечается увеличение средней площади перибронхиальных инфильтратов: ЗНЧ размером 1–3 нм — 1580, ЗНЧ диаметром 15 нм — 1480, ЗНЧ 50нм — 1620, что статистически значимо превышало контрольные значения (1098±70) (табл. 1).
В респираторном отделе легких во всех опытных группах отмечалось образование очагов острой эмфиземы с истончением и разрывом межальвеолярных перегородок. В группе введения ЗНЧ размером 50 нм также были обнаружены участки утолщения межальвеолярных перегородок за счет незначительного отека и полнокровия.
В печени гистоархитектоника органа была сохранена, в гепатоцитах развивалась различной степени выраженности белковая дистрофия. При введении ЗНЧ размером 15 нм в цитоплазме гепатоцитов появлялась незначительная зернистость. В группе животных, получавших ЗНЧ диаметром 1–3 нм и 50 нм, обнаружена более выраженная зернистая дистрофия, а в некоторых случаях помимо зернистой дистрофии появлялись единичные клетки с вакуолизацией цитоплазмы. Фрагментация цитоплазмы на отдельные глыбки была обнаружена только в группе введения ЗНЧ размером 50 нм (в 70% случаев).
При анализе морфометрических показателей печени определяли коэффициент нормализации паренхимы (КНП), абсолютное число лимфоцитов и непаренхиматозных элементов (НПЭ) — клеток Купфера, эндотелиоцитов, клеток Ито. При пероральном введении ЗНЧ во всех опытных группах отмечается значительное снижение количества нормальных гепатоцитов и увеличение числа клеток паренхимы с признаками дистрофии и некроза (дегенерирующих) по сравнению с группой контроля (табл. 2).
Число дегенерирующих гепатоцитов при размерах ЗНЧ 15 нм составило 82.7±6.2 (P<0.001), при введении ЗНЧ размером 50 нм — 99.1±10.9 (Р<0.001).
Таблица 1
Средняя площадь перибронхиальной инфильтрации при 8-дневном введении ЗНЧ разного размера
|
Показатель |
Контроль |
ЗНЧ перорально (190 мкг/кг) (М±m) |
||
|
ЗНЧ 1–3 нм |
ЗНЧ 15 нм |
ЗНЧ 50 нм |
||
|
Средняя площадь перибронхиальной инфильтрации, мм2 |
1098±70 |
1580±130 |
1480±130 |
1620±120 |
Таблица 2
Изменение клеточного состава печени при пероральном введении ЗНЧ разного размера в течение 8 дней
|
Группы наблюдения |
Морфометрические показатели в поле зрения. Ув. 400 |
|||
|
Общее число дегенерирующих гепатоцитов |
Нормальные гепатоциты |
Кол-во некро-тизиро-ванных гепатоцитов |
КНП |
|
|
1. Контрольная |
37.2±4.1 |
431.5±24.9 |
- — |
11.7±1.7 |
|
2. ЗНЧ 1–3 нм |
124.58±9.7 |
143.7±11.9 |
43.9±6.0 |
1.15±0.12 |
|
3. ЗНЧ 15 нм |
82.7±6.2 |
243±21.2 |
26.3±3.2 |
2.9±0.23 |
|
4. ЗНЧ 50 нм |
99.08±10.9 |
122.8±9.8 |
31.6±6.4 |
1.2±0.13 |
|
Достоверность раз- |
P 1–2<0.001 |
P 1–2<0.001 |
P 1–2<0.001 |
P 1–2<0.001 |
|
личий |
P 1–3<0.001 |
P 1–3<0.001 |
P 1–3<0.001 |
P 1–3<0.001 |
|
P 1–4<0.001 |
P 1–4<0.001 |
P 1–4<0.001 |
P 1–4<0.001 |
|
Максимальное количество дегенерирующих гепатоцитов наблюдалось при введении ЗНЧ размером 1–3 нм (124.6±9.7, Р<0.001). Кроме того, в группе введения ЗНЧ 1–3 нм и 50 нм выявляются умеренно выраженные некробиотические изменения в виде фокальных некрозов гепатоцитов с вовлечением в процесс нескольких клеток. Число очаговых некрозов единичных гепатоцитов и групп клеток (3–5 гепатоцитов) составило 9–12 в поле зрения (х400).
Для оценки выраженности дистрофических и некробиотических изменений в печени применяли коэффициент нормализации паренхимы КНП, показывающий отношение нормальных гепатоцитов к дегенерирующим. Наиболее наглядно реакцию гепатоцитов в ответ на введение ЗНЧ разных размеров иллюстрирует рис. 1.
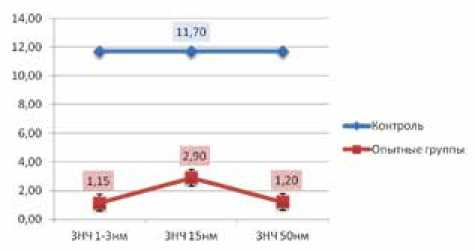
Рис. 1. Изменение КНП при пероральном введении ЗНЧ разного размера в течение 8 дней
Количество НПЭ печени во всех опытных группах увеличивалось по сравнению с группой контроля (табл. 3).
Как видно из табл. 3, в группе крыс, получавших ЗНЧ диаметром 1–3 нм, по сравнению с контрольной группой, абсолютное число клеточных элементов было статистически значимо увеличено за счет лимфоцитов (38.2±3.0, Р1-2<0.001). Аналогичная морфологическая картина наблюдалась и при введении ЗНЧ диаметром 15 нм и 50 нм (38.3±9.1 и 23.9±4.5 соответственно).
При корреляционном анализе обращает на себя внимание большое количество достоверных отрицательных взаимосвязей, что в целом указывает на то, что максимальное повреждающее действие оказали ЗНЧ размером 1–3 нм. Умеренную отрицательную корреляционную зависимость с размером ЗНЧ показали такие параметры, как количество дегенерирующих гепатоцитов (r=–0.57, Р<0.01), количество некро- зов (r=0.58, Р<0.01), абсолютное число НПЭ (r=–0.59, Р<0.01) и количество лимфоцитов (r=–0.69, Р<0.01).
Сила и направление корреляционных зависимостей изменяется в зависимости от сравниваемых показателей. Наиболее выраженная положительная корреляционная зависимость обнаружена между количеством нормальных гепатоцитов и КНП (r=0.95, Р<0.01), при этом важным моментом является тот факт, что повышение количества дегенерирующих гепатоцитов и некрозов приводит к снижению КНП (r=–0.74, Р<0.01 и r=–0.56, Р<0.01 соответственно). Кроме того, стоит отметить, что увеличение количества дегенерирующих гепатоцитов приводит к уменьшению количества нормальных гепатоцитов (r=–0.50, Р<0.01) и увеличению количества некрозов (r=–0.67, Р<0.01). Повышение количества НПЭ печени сопровождается повышением количества лимфоцитов (r=0.97, Р<0.01) и клеток РЭС (r=0.47, Р<0.01)
При гистологическом исследовании почек существенных отличий морфологической картины между группами не обнаружено. В почках развивается дистрофия эпителия канальцев, отмечается некроз отдельных клеток. Просвет извитых канальцев был сужен, имел звездчатый вид, в некоторых полях зрения в просвете отмечался слущенный эпителий. Клубочки имели нормальные размеры или были незначительно увеличены за счет полнокровия, просвет капсулы свободный. Капиллярные петли клубочков были умеренно расширены, заполнены эритроцитами. В мелких артериолах отмечалось плазматическое пропитывание.
В селезенке в группах введения ЗНЧ размером 1–3 и 15 нм отчетливо различалась граница между красной и белой пульпой, лимфоидные фолликулы были обычных размеров, округлой или овальной формы, единичные фолликулы содержали светлые центры размножения, представленные несколькими крупными клетками. В группе введения ЗНЧ 50 нм практически во всех случаях граница между красной и белой пульпой отчетливо не различалась, наружные контуры лимфатических фолликулов были размытые. В белой пульпе отмечалось увеличение размеров лимфатических фолликулов, появлялись светлые центры размножения.
При сравнении морфологических изменений во внутренних органах лабораторных животных можно отметить, что, введение ЗНЧ разного размера приводит к однотипным нарушениям морфологической
Таблица 3
Абсолютное количество лимфоцитов и непаренхиматозных элементов в печени крыс контрольной и опытных групп
ную и отчетливую тенденцию к развитию размерно-зависимого повреждающего действия ЗНЧ.
Заключение. Резюмируя изложенные данные, можно прийти к заключению, что пероральное введение ЗНЧ разного размера в течение 8 дней приводит к изменению морфологического строения внутрен-
Обсуждение. Сведений о влиянии ЗНЧ на морфологию внутренних органов крайне мало. Основная масса исследований, направленных на изучение токсичности ЗНЧ, выполнена в экспериментах с клеточными культурами in vitro. Количество данных, полученных в экспериментах с животными in vivo, весьма незначительно. Оценке токсического действия ЗНЧ различного диаметра (от 3 до 100 нм) посвящена работа Chen et al. [7]. По их данным, внутрибрюшинное введение ЗНЧ диаметром 3, 5, 50 и 100 нм не сопровождалось какими-либо изменениями в состоянии животных, в то время как введение ЗНЧ диаметром 8, 12, 17 и 37 нм приводило к повышенной утомляемости, потере аппетита, изменению окраса, потере веса. В работе Cho et al. [8] при внутривенном однократном введении 13 нм ЗНЧ в дозах 0.17, 0.85 и 4.26 мг/кг обнаружены признаки острого воспаления и апоптоза в клетках печени.
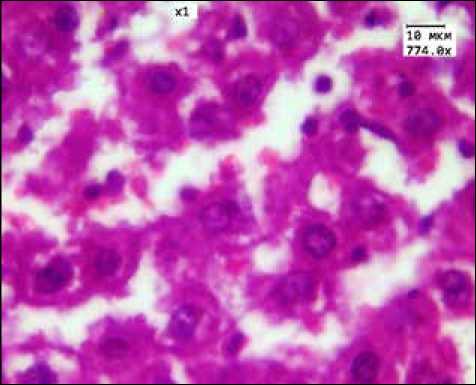
Рис. 2. Морфологическая картина печени при пероральном введении ЗНЧ 50 нм
Исследованию закономерностей распределения ЗНЧ в организме лабораторных животных и изучению морфологических изменений, развивающихся под их влиянием в мягких тканях и внутренних органах, посвящена работа Масляковой и др. [9] (см. также работу Terentyuk et al. [10] по размерной зависимости циркуляции, биораспределения и морфологическим эффектам золотых наночастиц и нанооболочек). Установлено, что морфологические изменения во внутренних органах при внутривенном введении ЗНЧ носят размерно-зависимый характер. По данным авторов, морфофункциональное состояние органов в большей степени обусловлено размером ЗНЧ и в меньшей степени их количественным содержанием.
А
Проведенное нами исследование показало, что морфологические изменения во внутренних органах при длительном пероральном введении ЗНЧ носили размерно-зависимый характер, при этом наиболее выраженные изменения вызывали ЗНЧ размером 1–3 и 50 нм. На гистологических препаратах печени во всех группах зафиксированы признаки повреждения гепатоцитов. Морфологическим подтверждением размерно-зависимого влияния ЗНЧ на строение печени служит снижение КНП, который является одним из важнейших критериев в морфологической оценке состояния печени, так как позволяет оценить интенсивность дистрофических и некробиотических изменений в органе на основе отношения количества нормальных гепатоцитов к дегенерирующим [11]. Минимальные значения КНП были получены в группах введения ЗНЧ размерами 1–3 и 50 нм (рис. 2).
Б
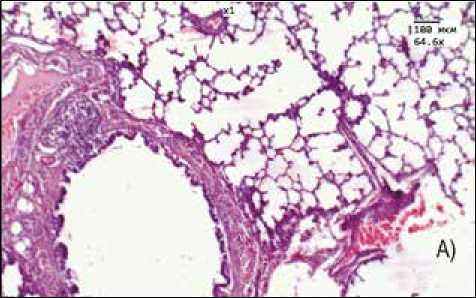
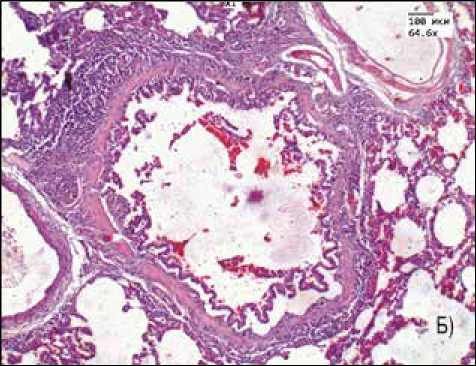
Рис. 3. Морфологическая картина легкого:
А) контрольная группа, Б) группа перорального введения ЗНЧ размером 50 нм
В легких лабораторных животных отмечается увеличение средней площади перибронхиальных инфильтратов, максимальные показатели зафиксированы для групп введения ЗНЧ размером 1–3 и 50 нм (рис. 3).
В почках развивается дистрофия эпителия канальцев, отмечается некроз отдельных клеток. В селезенке в группе введения ЗНЧ 50 нм найдены признаки усиления процессов пролиферации и дифференцировки иммунокомпетентных клеток, что выражалось в повышении количества иммунобластов в белой пульпе селезенки.
Описанная морфологическая картина вполне согласуется с литературными данными о морфологических перестройках внутренних органов лабораторных животных под влиянием различных воздействий. Таким образом, выявленные морфологические изменения во внутренних органах указывают на вполне определен- них органов лабораторных животных, которое имеет обратимый характер. Наиболее выраженные морфологические перестройки во внутренних органах вызывают ЗНЧ размером 1–3 и 50 нм, что свидетельствуют о размерно-зависимом влиянии ЗНЧ.
Список литературы Морфологические изменения в органах лабораторных животных при длительном пероральном введении золотых наночастиц
- Dykman L, Khlebtsov N. Gold nanoparticles in biomedical applications: Recent advances and perspectives//Chem.Soc. Rev. 2012. Vol. 41. P. 2256-2282
- The golden age: gold nanoparticles for biomedicine/E. С Dreaden, A. M. Alkilany, X. Huang [et al.]//Chem. Soc. Rev. 2012. Vol. 41. P. 2740-2779
- Khlebtsov N.G., Dykman L.A. Biodistribution and toxicity of engineered gold nanoparticles: a review of in vitro and in vivo studies//Chem. Soc. Rev. 2011. Vol. 40. P. 1647-1671
- Постановление Главного государственного санитарного врача РФ от 31 октября 2007 г. № 79 «Об утверждении Концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов». М., 2007
- Хабриев Р. У. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ М.: Медицина, 2005. 86 с.
- Schleh С, Semmler-Behnke М., Lipka J., Wenk А., Hirn S., Schaffler M., Schmid G., Simon U., Kreyling W.G. Size and surface charge of gold nanoparticles determine absorption across intestinal barriers and accumulation in secondary target organs after oral administration//Nanotoxicology. 2012. Vol. 6. P. 36-46
- Chen Y.-S., Hung Y.-C, Liau I., Huang G.S. Assessment of the in vivo toxicity of gold nanoparticles//Nanoscale Res. Lett. 2009. Vol. 4. P. 858-864
- Cho W.-S., Cho M., Jeong J., Choi M., Cho H.-Y, Han B.S., Kim S. H., Kim H.O., Lim Y.T., Chung B.H., Jeong J. Acute toxicity and pharmacokinetics of 13 nmsized PEG-coated gold nanoparticles//Toxicol. Appl. Pharmacol. 2009. Vol. 236. P. 16-24
- Морфологические изменения во внутренних органах крыс после внутривенного введения золотых наночастиц/Г.Н. Маслякова, Л.В. Сулейманова, ГС. Терентюк [и др.]//Российский биотерапевтический журнал. 2009. Т. 8, № 1. С. 21
- Circulation and distribution of gold nanoparticles and induced alterations of tissue morphology at intravenous particle delivery/G.S. Terentyuk, G.N. Maslyakova, L.V Suleymanova [et al.]//J. Biophotonics. 2009. Vol. 2. P. 292-302
- Проблема регенерации патологически измененных органов и обратимости патологических изменений/под ред. Б. П. Солопаева//Регенерация, адаптация, гомеостаз: сб. науч. трудов. Горький, 1990. С. 6.


