Морфологические изменения в печени лабораторных животных при пролонгированном введении золотых наночастиц
Автор: Пахомий С.с, Бучарская А.Б., Наволокин Н.А., Маслякова Г.Н., Злобина О.В., Хлебцов Н.Г., Хлебцов Б.Н., Богатырев В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Макро- и микроморфология
Статья в выпуске: 2 т.10, 2014 года.
Бесплатный доступ
Цель: оценить выраженность морфологических изменений в печени лабораторных животных при пролонгированном введении функционализованных полиэтиленгликолем золотых наночастиц разного размера в диапазоне 2-50 нм. Материал и методы. Эксперимент выполнен на 240 белых беспородных крысах, разделенных на 4 группы. Животным опытных групп вводили перорально золотые наночастицы по определенной схеме. Результаты. Морфологические изменения в печени при введении золотых наночастиц зависят как от размера частиц, так и от длительности их введения. Развивающиеся патологические изменения в печени носят обратимый характер, о чем свидетельствует постепенное восстановление структуры органа через 14 дней после окончания эксперимента. Заключение. Наиболее выраженные изменения в печени обнаружены в опытных группах с 30-дневным введением 2 и 50 нм золотых наночастиц, что свидетельствует о размерозависимом характере их воздействия.
Золотые наночастицы, морфология, нанотоксикология, печень
Короткий адрес: https://sciup.org/14917941
IDR: 14917941
Текст научной статьи Морфологические изменения в печени лабораторных животных при пролонгированном введении золотых наночастиц
цы (ЗНЧ), в том числе для доставки лекарственных веществ, генетического материала, антигенов, для решения задач диагностики и одновременно терапии опухолей [1, 2].
Одновременно с началом широкого применения ЗНЧ в биомедицинских целях возникли вопросы об их возможной токсичности. В настоящее время в экспериментах in vivo большинство опубликованных результатов было получено при внутривенном введении ЗНЧ, в то время как токсические свойства частиц при внутрибрюшинном, респираторном и пероральном введении изучены недостаточно. Данный факт, скорее всего, объясняется поиском путей эффективной доставки конъюгатов ЗНЧ к клеткам-ми- шеням при внутривенном введении. В ранее опубликованных нами статьях, посвященных изучению токсичности металлического золота, отмечено, что введение ЗНЧ сопровождается развитием воспалительной реакции, дистрофическими и некротическими процессами, накоплением частиц в макрофагах и ретикулярных клетках лимфатических узлов, а также активацией клеточного и гуморального иммунитетов [3–5].
Учитывая данные о возможной токсичности ЗНЧ, используемых в терапии злокачественных новообразований, целью проводимого нами исследования стала оценка выраженности и обратимости морфологических изменений в печени лабораторных животных при длительном пероральном введении золотых наночастиц разного размера.
Материал и методы. Исследование проведено на кафедре патологической анатомии и базе научнообразовательного центра фундаментальной медицины и нанотехнологий ГБОУ ВПО «Саратовский ГМУ им. В. И. Разумовского» Минздрава России. Эксперимент выполнен на 240 здоровых белых беспородных половозрелых крысах-самцах массой 180–220 г. При разработке модели экспериментального исследования за основу положено «Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ» [6], а также методические указания МУ 1.2.2869–11 «Порядок оценки токсического действия наноматериалов на лабораторных животных».
В эксперименте использовали ЗНЧ, синтезированные в лаборатории нанобиотехнологии ИБФРМ РАН (г. Саратов): частицы коллоидного золота диаметром 2±1, 15±3 и 50±10 нм с числовой концентрацией 1014, 1.3*1012 шт/мл и 3.5*1010 шт/мл соответственно (концентрация золота 57 мкг/мл). Средний размер ЗНЧ определяли по электронно-микроскопическим изображениям на микроскопе Libra-120 (Carl Zeiss, Jena, Germany). Наночастицы коллоидного золота с размером 15 и 50 нм синтезировали цитратным методом Фрэнса путем восстановления золотохлористоводородной кислоты (HAuCl4, Sigma-Aldrich, USA) цитратом натрия. Наиболее мелкие частицы 2 нм получали по специальным методикам [7]. Для увеличения биодоступности и биосовместимости наночастицы были конъюгированы с полиэтиленгликолем PEG-SH (Nektar, USA).
Учитывая возможность длительного перорального применения ЗНЧ и препаратов на их основе, разделили эксперимент на 2 серии, в каждой серии по 9 опытных групп. Первая серия включала изучение морфологических изменений в печени лабораторных животных при пероральном введении ЗНЧ размерами 2, 15 и 50 нм продолжительностью 8, 16 и 30 дней. Вторая серия была посвящена анализу обратимости выявленных изменений, забор необходимого материала проводили через 14 дней после окончания введения ЗНЧ размерами 2, 15 и 50 нм в течение 8, 16 и 30 дней. К каждой опытной группе животных были сформированы контрольные группы, животным которых вводился физиологический раствор в объеме 1 мл в течение 8, 16 и 30 дней.
Для морфологического исследования образцы внутренних органов фиксировали в 10%-м растворе формалина, подвергали стандартной спиртовой и ацетоновой проводке, заливали в парафин. После депарафинизации срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином для обзорного гистологического изучения.
При морфологическом исследовании с использованием полуколичественных показателей применяли следующие критерии выраженности признака: «-» — признак отсутствует (0%); «+» — слабо выраженный признак (<30%); «++» — умеренно выраженный признак (30-60%); «+++» — сильно выраженный признак (>60%).
Морфометрический анализ гистологических препаратов проводили в 10 полях зрения с использованием системы анализа цифровых изображений микровизора медицинского μVizo-101 ЛОМО. Применяли также стандартный метод подсчета клеточных элементов при увеличении 200, 400 с использованием специализированной морфометрической сетки [8, 9].
Для выявления конгломератов ЗНЧ применяли метод микроскопии темного поля с использованием микроскопа Leica DM 2500 со специальной приставкой для темнопольной микроскопии при 400-кратном увеличении.
Для оценки размерозависимого воздействия ЗНЧ на морфологию печени использовали следующие морфометрические показатели: коэффициент нормализации паренхимы (КНП), количество непаренхиматозных элементов (НПЭ) в состав которых входили лимфоциты, клетки Купфера и клетки Ито и число двуядерных гепатоцитов [10]. КНП является одним из важнейших критериев в морфологической оценке состояния печени, поскольку он позволяет оценить интенсивность дистрофических и некробиотических изменений в печени на основе отношения количества нормальных гепатоцитов к гепатоцитам в состоянии дистрофии и некроза [11, 12].
Для изучения пролиферативной активности гепатоцитов проводили иммуногистохимическое исследование с использованием кроличьих поликлональных антител (Anti-Ki67, Abcam, United Kingdom). Выполняли одноэтапный протокол с трипсинизаци-ей — демаскировкой антигена по стандартной схеме проведения иммуногистохимического исследования [10]. Клетки, давшие положительную иммуногистохимическую реакцию, окрашивались в коричневый цвет. Результат реакции оценивали по системе подсчета Histochemical score. Система подсчета включает в себя интенсивность иммуногистохимической окраски по 3-балльной шкале и долю (%) окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски, на балл, соответствующий интенсивности реакции. Интенсивность окраски: 0 — нет окрашивания; 1 — слабое окрашивание; 2 — умеренное окрашивание; 3– сильное.
Формула подсчета:
Histochemical score = ∑ P (i) × i, где, i — интенсивность окрашивания, выраженная в баллах от 0 до 3; P (i) — процент клеток, окрашенных с разной интенсивностью.
Для обработки полученных в ходе исследований данных использован пакет прикладных статистических программ Statistica 10.0 (StatSoftInc, США). Предварительная статистическая обработка данных заключалась в проверке соответствия формы распределения количественных признаков нормальному, для чего применяли тест Колмогорова — Смирнова, а также определяли равенство генеральных дисперсий с помощью F-критерия Фишера. Нулевую гипотезу отвергали в случае р<0,05. Для каждого показателя в исследуемых группах вычисляли среднее арифметическое (М), ошибку среднего арифметического (m). Оценку различий между выборками про-
Таблица 1
Изменения гистологического строения печени с учетом длительности введения ЗНЧ размером 2 нм
|
Исследуемые показатели, M±m (в 30 полях зрения) |
Контрольная группа |
Длительность введения ЗНЧ размером 2 нм |
|||||
|
8 дней |
16 дней |
30 дней |
|||||
|
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
||
|
Степень выраженности дистрофии гепатоцитов |
-- |
+/++ |
+ |
++/+++ |
+ |
+++ |
+ |
|
Степень выраженности полнокровия |
+/++ |
++/+++ |
+/++ |
+ |
++/+++ |
+ |
+++ |
|
Феномен сепарации крови |
-- |
+/-- |
+/-- |
+/-- |
+ |
+/-- |
+ |
|
Кол-во гепатоцитов в состоянии дистрофии |
37,2±4,08 |
124,58±9,7* |
41±3,9 |
158,8±10,6* |
48,3±3,5 |
166,8±11,9* |
59±8,9* |
|
Кол-во неизмененных гепатоцитов |
431,5±24,9 |
143,7±11,9* |
383,9±11,7 |
67,5±6,87* |
377,5 ±11,3 |
33,8±9,4* |
364,7±14,3 |
|
Кол-во гепатоцитов в состоянии некроза |
0 |
43,9±6,0* |
15,5±2,64* |
54,2±9,18* |
22,5±1,18* |
79,7±8,08* |
28,5±3,8* |
|
КНП |
11,7±1,7 |
1,15±0,1* |
9,3±0,7 |
0,41±0,05* |
7,8±0,6* |
0,2±0,06* |
6,1±0,5* |
|
Общее кол-во НПЭ |
26,2±5,9 |
47,5±3,67* |
60±8,9* |
38,1±3,21 |
67,8±8,6* |
55,3±7,21* |
77,6±12,3* |
|
Кол-во лимфоцитов |
17,6±4,24 |
38,2±3,04* |
50,5±8,49* |
25,8±5,98 |
48,5±3,7* |
32,5±7,6 |
52,16±6,4* |
|
Кол-во клеток Купфера и Ито |
8,5±2,29 |
9,33±1,49 |
10,2±2,8 |
14,7±1,85 |
20,2±3,45* |
22,6±4,6* |
27,8±6,46* |
|
Кол-во двуядерных гепатоцитов |
5,6±1,5 |
7±1,41 |
16,16±3,8* |
8±1,87 |
17,7±1,48* |
5,08±1,24 |
16,8±3,3* |
П р и м еч а н и е : * – достоверность различий с группой контроля (Р<0,05).
водили с использованием t-критерия Стьюдента. Исследование корреляционной взаимосвязи между количественными признаками осуществляли при помощи метода Пирсона.
Результаты. Установлено, что выраженность и обратимость морфологических изменений в печени определялись как размером ЗНЧ, так и длительностью их введения (табл. 1–3). При этом с увеличением сроков эксперимента морфологические изменения в органе приобретали более выраженный характер.
В группах 8-дневного введения наиболее значимые морфологические изменения обнаружены при введении ЗНЧ размерами 2 и 50 нм: в цитоплазме гепатоцитов наблюдалась зернистая дистрофия и умеренно выраженные некробиотические изменения, в то время как в группе животных с введением ЗНЧ 15 нм дистрофические изменения носили незначительный характер.
В результате исследования установили, что при 8-дневном введении ЗНЧ во всех опытных группах наблюдалось повышение количества дистрофически и некротически измененных гепатоцитов, уменьшение числа неизмененных клеток и, как следствие, снижение КНП. Максимальное количество гепатоцитов в состоянии дистрофии и некроза обнаружено в группе введения ЗНЧ 2 нм — 124,58±9,7 (Р<0,001); минимальное — в группе введения ЗНЧ 15 нм (82,7±6,18, Р<0,001). Уменьшение количества неизмененных клеток и повышение числа гепатоцитов в состоянии дистрофии и некроза сопровождалось снижением КНП до 1,15±0,12 (ЗНЧ 2 нм) и 1,2±0,126 (ЗНЧ 50 нм).
Длительное пероральное введение ЗНЧ сопровождалось повышением во всех опытных группах животных с 8-дневным введением ЗНЧ числа НПЭ как за счет лимфоцитов, так и за счет клеток Купфера и Ито. Полученные результаты свидетельствуют о наличии активирующего влияния ЗНЧ на моноцитарно- макрофагальную систему печени. Незначительное увеличение числа двуядерных гепатоцитов говорит об усилении регенераторных процессов.
Для уточнения размерозависимого влияния ЗНЧ на морфологическую картину печени выполнен корреляционный анализ, в ходе которого обнаружено большое количество достоверных отрицательных взаимосвязей между исследуемыми показателями и размером ЗНЧ. Важным моментом, установленным при корреляционном анализе, является тот факт, что максимальное повреждающее действие на печень оказали ЗНЧ размером 2 нм.
При гистологическом исследовании, выполненном через 14 дней после окончания введения ЗНЧ, во всех опытных группах наблюдалось восстановление морфологической картины печени: уменьшались степень выраженности дистрофии и некроза гепатоцитов, полнокровия сосудов и отека стромы. По данным морфометрического исследования, практически все исследуемые морфологические показатели печени приближались к контрольным значениям, кроме КНП и общего числа НПЭ в группах животных, которым вводили ЗНЧ 2 и 50 нм. Обращает на себя внимание увеличение количества двуядерных гепатоцитов во всех группах: в группе введения ЗНЧ 2 нм — в 2,9 раза; ЗНЧ 15 нм — в 3,1 раза и ЗНЧ 50 нм — в 3,2 раза.
С увеличением длительности введения ЗНЧ до 16 дней выраженность морфологических изменений нарастала: во всех опытных группах наблюдались дистрофия и некроз гепатоцитов, а также различной степени выраженности признаки нарушения кровообращения в органе, особенно в группе животных с введением ЗНЧ размером 50 нм. По данным морфометрического анализа, минимальные значения КНП получены в группах введения ЗНЧ 2 и 50 нм (0,41±0,05 и 0,31±0,07 соответственно) (рис. 1). Общее число НПЭ увеличивалось во всех опытных группах как за счет повышения количества лимфоци-
Таблица 2
Изменения гистологического строения печени с учетом длительности введения ЗНЧ размером 15 нм
|
Исследуемые показатели, M±m (в 30 полях зрения) |
Контрольная группа |
Длительность введения ЗНЧ размером 15нм |
|||||
|
8 дней |
16 дней |
30 дней |
|||||
|
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
||
|
Степень выраженности дистрофии гепатоцитов |
-- |
+ |
+/-- |
++ |
+ |
++ |
+ |
|
Степень выраженности полнокровия |
+/++ |
+/++ |
+/++ |
+ |
++ |
++ |
++/+++ |
|
Феномен сепарации крови |
-- |
-- |
+/-- |
-- |
-- |
-- |
+ |
|
Кол-во гепатоцитов в состоянии дистрофии |
37,2±4,08 |
82,7±6,18* |
36,6±9,21 |
108,5±11,6* |
44,3±6,4 |
148,8±10,5* |
51,8±5,6 |
|
Кол-во неизмененных гепатоцитов |
431,5±24,9 |
243±21,2* |
393,8±17,4 |
151,4±10,3* |
383,3±8,3 |
122±33,13* |
375,7±10,8 |
|
Кол-во гепатоцитов в состоянии некрозов |
0 |
26,3±3,16* |
13±3,9* |
40,6±3,7* |
20,6±4,2* |
59,7±8,9* |
26,5±4,9* |
|
КНП |
11,7±1,7 |
2,9±0,23* |
10,6±1,7 |
1,4±0,18* |
8,6±0,78 |
0,82±0,43* |
7,65±0,7 |
|
Общее число НПЭ |
26,2±5,9 |
51,4±11,04* |
44,3±4,9* |
50±4,17* |
52,7±6,7* |
59,4±14,16* |
44,6±9,5* |
|
Кол-во лимфоцитов |
17,6±4,24 |
38,3±9,12* |
33,7±3,6* |
29,6±1,9* |
40,5±8* |
36,3±11,8* |
30,6±6,65* |
|
Кол-во клеток Купфера и Ито |
8,5±2,29 |
13,4±2,55 |
10,5±2,29 |
19,3±3,7* |
11,2±2,16 |
23,1±3,9* |
15,1±5,57* |
|
Кол-во двуядерных гепатоцитов |
5,6±1,5 |
6,7±1,5 |
17,4±2,29* |
7,2±1,24 |
17±2,7* |
6,9±1,8 |
18,5±1,7* |
П р и м еч а н и е : * – достоверность различий с группой контроля (Р<0,05).
Таблица 3
Изменения гистологического строения печени с учетом длительности введения ЗНЧ размером 50 нм
|
Исследуемые показатели, M±m (в 30 полях зрения) |
Контрольная группа |
Длительность введения ЗНЧ размером 50 нм |
|||||
|
8 дней |
16 дней |
30 дней |
|||||
|
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
В конце введения |
Через 14 дней |
||
|
Степень выраженности дистрофии гепатоцитов |
-- |
++ |
+ |
++/+++ |
+ |
+++ |
+ |
|
Степень выраженности полнокровия |
+/++ |
+/++ |
+++ |
+/++ |
++/+++ |
++/+++ |
++/+++ |
|
Феномен сепарации крови |
-- |
-- |
+/-- |
-- |
-- |
-- |
+/-- |
|
Кол-во гепатоцитов в состоянии дистрофии |
37,2±4,08 |
99,08±10,9* |
42,3±6,7 |
170,5±8,43* |
53,5±8,25 |
205±15,1* |
62,3±7,9* |
|
Кол-во неизмененных гепатоцитов |
431,5±24,9 |
122,8±9,8* |
385,5±23,9 |
53,9±9,62* |
386,7±11,5 |
20,6±6,34* |
379,4±15,3 |
|
Кол-во гепатоцитов в состоянии некрозов |
0 |
31,6±6,38* |
23,7±4,6* |
45,5±7,9* |
33,7±4,39* |
96,8±8,5* |
51,2±5,9* |
|
КНП |
11,7±1,7 |
1,2±0,126* |
9,1±0,7 |
0,31±0,07* |
7,2±0,68 |
0,09±0,03* |
6,2±0,56* |
|
Общее число НПЭ |
26,2±5,9 |
34±4,17 |
68,5±9,79* |
49,4±3,36* |
61,8±9* |
64,9±8,05* |
42,3±8,8* |
|
Кол-во лимфоцитов |
17,6±4,24 |
23,9±4,46* |
55,4±8,25* |
38,8±2,9* |
41±7,8* |
39,6±5,14* |
27,6±6* |
|
Кол-во клеток Купфера и Ито |
8,5±2,29 |
10±2 |
13,16±2,6 |
11,4±1,16 |
19,3±3,7* |
26,9±4,12* |
14,58±3,3 |
|
Кол-во двуядерных гепатоцитов |
5,6±1,5 |
8,4±2,15 |
18,4±2,57* |
6,4±1,3 |
15,58±2,23* |
6,41±1,8 |
15,5±2,46* |
П р и м еч а н и е : * – достоверность различий с группой контроля (Р<0,05).
тов, так и за счет увеличения числа клеток Купфера и Ито.
При изучении обратимости во всех опытных группах с 16-дневным введением ЗНЧ выраженность дистрофических и некротических изменений в гепатоцитах уменьшалась (рис. 2). Следует отметить, что минимальное количество гепатоцитов в состоянии дистрофии (44,3±6,4; Р<0,001) и максимальное значение КНП (8,6±0,78; Р<0,001) были получены в группе животных, которым вводили ЗНЧ 15 нм. Изменения со стороны моноцитарно-макрофагальной системы печени в группах введения ЗНЧ 2 и 50 нм носили однонаправленный характер и проявлялись в виде увеличения практически в два раза общего количества НПЭ как за счет повышения количества лимфоцитов, так и клеток Купфера и Ито. Увеличение количества двуядерных гепатоцитов наблюдалось во всех опытных группах: в 3 раза в ответ на
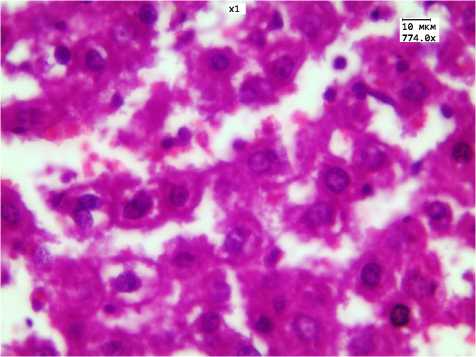
Рис. 1. Умеренно выраженные дистрофические изменения гепатоцитов. ЗНЧ размером 2 нм, 16-дневное введение.
Окр. Г.-Э. Ув. 774
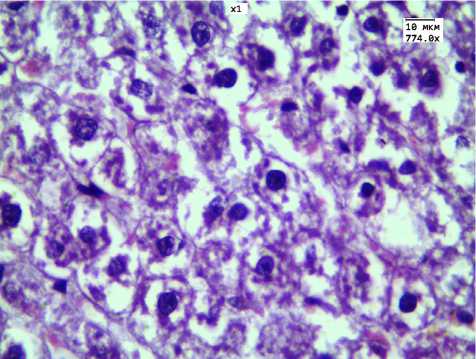
Рис. 4. Выраженная дистрофия гепатоцитов при 30-дневном введении ЗНЧ 50 нм.
Окр. Г.-Э. Ув. 774
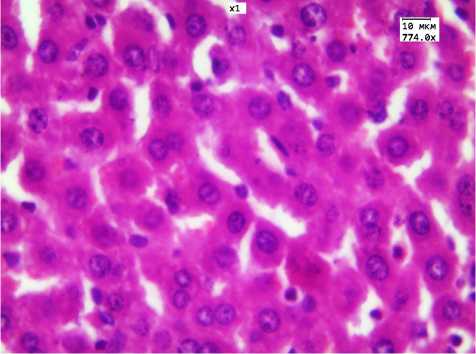
Рис. 2. Слабая дистрофия гепатоцитов на 14-й день после окончания 16-дневного введения ЗНЧ 2 нм. Окр. Г.-Э. Ув.
774.0
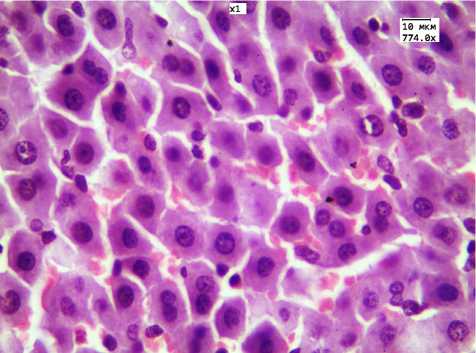
Рис. 5. Незначительная степень дистрофии гепатоцитов на 14-й день после окончания введения ЗНЧ 2 нм в течение 30 дней. Окр. Г.-Э. Ув. 774.0
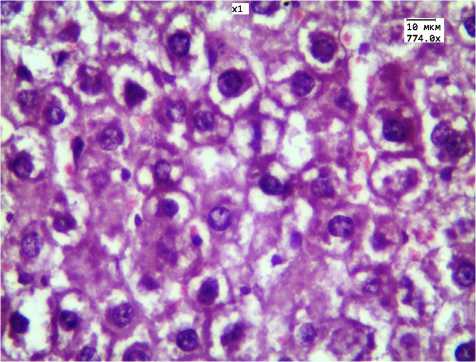
Рис. 3. Выраженные дистрофические изменения гепатоцитов при 30-дневном введении ЗНЧ размером 2 нм.
Окр. Г.-Э. Ув. 774
введение ЗНЧ размером 2 нм, в 2,3 раза — ЗНЧ 15 нм и в 2,8 раза — ЗНЧ 50 нм.
Наиболее выраженные изменения найдены в группах 30-дневного введения ЗНЧ размерами 2 и 50 нм. В препаратах данных групп обращало на себя внимание отсутствие балочного строения, выраженная вакуольная дистрофия гепатоцитов (рис. 3; 4). Следует отметить, что в группе животных, которым вводили ЗНЧ 15 нм, балочное строение гепатоцитов было сохранено, отмечалась умеренная дистрофия гепатоцитов.
По данным морфометрического исследования, во всех группах с 30-дневным введением ЗНЧ отмечалось дальнейшее уменьшение количества неизмененных гепатоцитов и КНП, при этом минимальные значения КНП (0,09±0,03) получены при введении ЗНЧ 50 нм. Общее число НПЭ печени увеличилось в два раза как за счет повышения количества лимфоцитов, так и за счет увеличения числа клеток Купфера и Ито. Количество двуядерных гепатоцитов увеличивалось незначительно.
При морфологическом исследовании печени через 14 дней после окончания 30-дневного введения ЗНЧ наблюдалось частичное восстановление струк-
а)
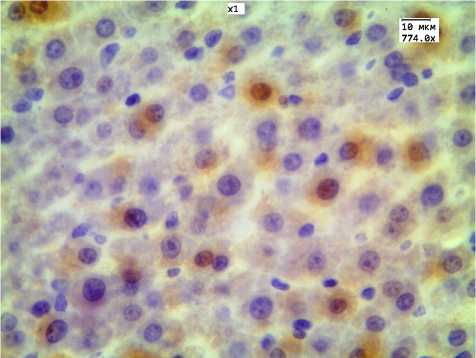
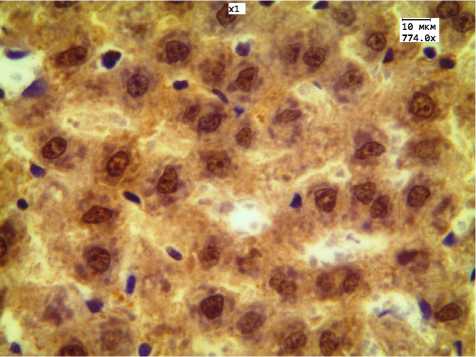
Рис. 6. Экспрессия антигена ядерного белка Ki-67: а) в контрольной группе; б) при 30-дневном введении ЗНЧ 2 нм.
ИГХ-реакция с антителами к Ki-67-антигену. Ув. 774
б)
туры органа, уменьшалась выраженность дистрофии и некроза, значительное увеличение КНП (рис. 5). В то же время изменения со стороны моноцитарно-макрофагальной системы носили разнонаправленный характер. В группах животных с введением ЗНЧ 2 и 50 нм во всех случаях к 14-м суткам и по окончании их введения регистрировали дальнейшее повышение количества НПЭ. Исключение составили группы животных, которым вводили ЗНЧ 50 нм в течение 30 дней, где на 14-е сутки после окончания введения отмечали 1,5-кратное снижение количества НПЭ по отношению к исходному значению и с введением ЗНЧ 15 нм, в которой на 14-й день после прекращения 8-и 30-дневного введения ЗНЧ также отмечалась тенденция к снижению общего числа НПЭ.
Учитывая, что в печени в группах 30-дневного введения ЗНЧ были получены наиболее выраженные морфологические изменения, провели ИГХ-исследование с маркером Ki-67 для оценки пролиферативной активности гепатоцитов в ответ на повреждающее воздействие ЗНЧ. Иммуногистохимическая реакция с маркером Ki-67 наблюдалась во всех группах животных ЗНЧ: среднее значение гистосчета в группе введения ЗНЧ размером 2 нм составило 144,4±12,4, ЗНЧ размером 15 нм — 141,5±10,3, ЗНЧ размером 50 нм — 150,3±13,2 (при контрольных значениях 4,14±1,04, Р<0,001) (рис. 6). При исследовании обратимости среднее значение гистосчета уменьшилось и составило в группе введения ЗНЧ размером 2 нм 102,3±8,2, ЗНЧ размером 15 нм — 98±7,4, ЗНЧ размером 50 нм — 123±11,5.
Обсуждение. Увеличение числа двуядерных гепатоцитов мы расценивали как проявление процессов регенерации, направленных на восстановление печёночной ткани за счёт увеличения количества функционирующих гепатоцитов. Это согласуется с мнением В. В. Садовниковой и др. (2001) о том, что повышение количества функционирующих гепатоцитов свидетельствует об усилении белково-синтетической функции печени, что может расцениваться как единый компенсаторно-приспособительный механизм, направленный на нормализацию структуры и функции органа [13].
При морфологическом исследовании печени не обнаружено скопления ЗНЧ при использовании световой микроскопии, ни при микроскопии методом темного поля. Мы зарегистрировали лишь косвенные признаки присутствия ЗНЧ в виде дистрофических и некротических изменений паренхимы и активации моноцитарно-макрофагальной системы.
Заключение. Таким образом, морфологические изменения в печени при длительном пероральном введении ЗНЧ зависят как от размера частиц, так и от длительности их введения. Развивающиеся патологические изменения в печени носят обратимый характер, о чем свидетельствует постепенное восстановление структуры органа через 14 дней после окончания эксперимента.
Список литературы Морфологические изменения в печени лабораторных животных при пролонгированном введении золотых наночастиц
- Khlebtsov NG, Dykman LA. Biodistribution and toxicity of engineered gold nanoparticles: a review of in vitro and in vivo studies. Chem Soc Rev 2011; 40: 1647-1671
- Khlebtsov BN, Panfilova EV, Khanadeev VA, et al. Nanocomposites containing silica-coated gold-silver nanocages and Yb-2,4-dimethoxyhematoporphyrin: Multifunctional capability of IR-luminescence detection, photosensitization, and photothermolysis. ACS Nano 2011; 5 (9): 7077-7089
- Наволокин H.A., Маслякова Г. H., Бучарская А. Б. и др. Динамика морфологических и биохимических изменений у лабораторных животных с перевитым раком почки при внутривенном введении золотых нанооболочек //Известия Саратовского университета: новая серия. Серия: Физика. 2012; 12 (2): 38-43
- Злобина О. В., Пахомий С. С, Бучарская А. Б. и др. Анализ накопления и биораспределения золотых наночастиц в мезентериальных лимфатических узлах при пероральном введении. Саратовский научно-медицинский журнал 2013; 8 (1): 17-20
- Маслякова Г. H., Пахомий С. С, Бучарская А. Б. и др. Морфологические изменения в органах лабораторных животных при длительном пероральном введении золотых наночастиц. Саратовский научно-медицинский журнал 2013; 9 (2): 208-213
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/под ред. Р. Ю. Хабриева. М: Медицина, 2005; 829 с.
- Дыкман Л. А., Богатырев В. А., Щеголев С. Ю., Хлебцов Н.Г. Золотые наночастицы: синтез, свойства, биомедицинское применение. М.: Наука, 2008; 319 с.
- Автандилов Г. Г. Медицинская морфометрия. М.: Медицина, 1990; 384 с.
- Автандилов Г. Г. Медицинская морфометрия. М.: Медицина, 1990; 384 с. 10. Петров С. В., Райхлин Н.Т. Руководство по иммуногистохимической диагностике опухолей. Казань: Титул, 2004; 452 с.
- Солопаева И.М., Солопаев Б. П. Стимуляция регенерации патологически измененной печени и хорионический гонадотропин. Н. Новгород: Изд-во ННГУим. Н.И.Лобачевского, 1991; 147 с.
- Coлопаева И.М. Стимуляция регенерации нормальной и патологически измененной печени: дис. д-ра мед. наук. Горький, 1969; 229 с.
- Садовникова, В. В., Садовникова И. В., Иванова Л.Н. Морфологические изменения в печени крыс при токсическом медикаментозном гепатите и стимуляции репаративных процессов. Морфология 2001; 120 (6): 63-65.


