Морфологические изменения в тканях головного мозга при экспериментальной ишемии
Автор: Шертаев Мухаметамин Маметжанович, Ибрагимов Уткур Кудратович, Икрамова Сурай Хакимовна, Якубова Фарида Темуровна, Ибрагимов Кудрат Уткурович
Журнал: Science for Education Today @sciforedu
Рубрика: Биологические, химические, медицинские науки
Статья в выпуске: 1 (23), 2015 года.
Бесплатный доступ
Противоречивость данных об особенностях метаболизма нейроцитов, факторах апоптоза в мозговых тканях в динамике ишемии-реперфузии, а также сложность прогнозирования эффективности реабилитации у больных инсультом определили целесообразность проведения морфологических исследований при экспериментальной ишемии головного мозга в различные сроки после реперфузии. Модель нарушения мозгового кровообращения воспроизводилась путем временного клипирования правого ствола безымянной артерии на 40 минут у крыс-самцов. Вивисекция животных проводилась спустя 1, 6, 24 часа, а также на третьи и седьмые сутки после реперфузии. Гистологические препараты изучали световой микроскопией после окраски гематоксилин эозином, иммуногистохимические исследования Bcl-2 проводили набором DAKO Citomation LCAB-2 (Дания). Установлено, что при экспериментальной окклюзии-реоксигенации головного мозга морфологические нарушения нарастают во времени после реперфузии. Наибольшие изменения обнаружены через шесть часов после реперфузии, когда появляются первые признаки апоптоза в виде реакции розеткообразования моноклонональных меченых Bcl-2 клеток вокруг нейрона, а на седьмые сутки апоптотическая гибель нейроцитов сменяется некротическим процессом, о чем свидетельствует зона некротического расплавления и независимое расположение Bcl-2 клеток в образцах. Морфологические изменения в тканях головного мозга проявляются в основном в виде отека, хроматолиза и достигают отчётливой выраженности через 24 часа после реперфузии, характеризуясь острым набуханием тел многих нейронов, распылением тигроида и базофилией ядер. Эти признаки являются неблагоприятными и могут рассматриваться как предикторы некроза, развивающегося на седьмые сутки в мозговых тканях после окклюзии-реперфузии.
Экспериментальная ишемия мозга, факторы апоптоза, хроматолиз, некроз
Короткий адрес: https://sciup.org/147137612
IDR: 147137612 | УДК: 616.058 | DOI: 10.15293/2226-3365.1501.07
Текст научной статьи Морфологические изменения в тканях головного мозга при экспериментальной ишемии
Высокие показатели летальности и инвалидизации больных инсультом обусловливают особую актуальность проблемы. В Европе заболеваемость инсультом составляет 220 случаев на 100 000 населения в год. Распространенность инсульта приближается к 600 на 100 000 населения, из них 360 (т. е. 60 %) – со стойким дефектом, и только около 15 % больных возвращаются к прежнему до инсультному уровню жизни [1].
Противоречивость данных об особенностях метаболизма нейроцитов, факторах апоптоза в мозговых тканях в динамике ишемии-реперфузии [2–3], а также сложность прогнозирования эффективности реабилитации у больных инсультом [4–5] определили целесообразность проведения морфологических исследований при экспериментальной ишемии головного мозга в различные сроки после реперфузии. Результаты этих исследований позволят, в определенной степени, представить взаимосвязь морфологических изменений в тканях головного мозга в различные сроки ишемии-реперфузии, выделить лимитирующие звенья в системе факторов апоптоза, что может стать предпосылкой для разработки патогенетически обоснованных путей повышения эффективности способов реабилитации.
Целью настоящего исследования стал морфологический анализ тканей головного мозга в различные сроки после экспериментальной ишемии-реперфузии.
Методы исследования.
Работа проведена на крысах-самцах весом 120–130 г, находящихся на стандартном рационе вивария. Модель нарушения мозго-
Для морфологического изучения фрагменты тканей головного мозга объёмом 0,2– 0,3 мм3 фиксировали в 12 % растворе формалина по общепринятой методике [6]. Парафиновые срезы окрашивали гематоксилином – эозином. Иммуногистохимические исследования Bcl -2 проводили набором DAKO Citoma-tion LCAB -2 (Дания) моноклональными первичными мышиными и кроличьими антителами к Bcl -2, содержащими стрептолизин-био-тин ( LCAB ), предназначенными для качественного определения в парафиновых срезах с помощью светооптической микроскопии при окраске гематоксилин-эозином. Светооптические микрофотографии получали на микроскопе « N- 800 M » c использованием цифровой камеры, сопряженной с оптической системой микроскопа с помощью специального адаптера.
Все права защищены

1(23)2015
ISSN 2226-3365
Полученные результаты.
Гистопатологические изменения в коре левых височных долей крыс после перенесенной экспериментальной ишемии имели определённую динамику развития во времени.
При пережатии у крыс левой сонной артерии наблюдались изменения, характерные для патологической картины кислородной недостаточности, так как сравнительно слабое развитие у крыс артериального круга большого мозга не создаёт достаточного кровоснабжения. Патологические изменения нервных клеток при гипоксии характеризовались, прежде всего, полиморфизмом. Началом структурных изменений нервных клеток при гипоксии-реоксигенации стало наличие хроматолиза различной степени через один час после восстановления кровотока по левой сонной артерии после ее пережатия. Повреждения нейронов начинались с появления периферического, центрального или сегментарного хроматолиза. Первые признаки хроматолиза обнаруживались в отдельных нервных клетках и сосудах в образцах коры, правой и левой височной области головного мозга крыс. Выявление начальных проявлений отёка мозга характеризовалось набуханием и увеличением в размерах, бледностью окрашивания нервных клеток, появлением бледных межклеточных полей нейроглии (рис.1).
При исследовании коры височных долей головного мозга крыс через один час после реперфузии с помощью моноклональных меченых Bcl -2 клеток реакции розеткообразования не обнаружено, что указывает на отсутствие активации апоптоза в этот период (рис. 2).
Рисунок 1
Кора правой височной области головного мозга крыс через один час после окклюзии – реперфузии
Примечание. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
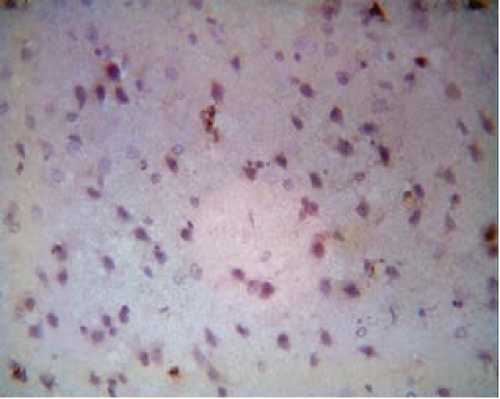
Рисунок 2
Кора левой височной области головного мозга крыс через один час после окклюзии – реперфузии
Примечание. Реакции взаимодействия Bcl-2
меченых моноклональных антител с клетками не наблюдается. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
Через шесть часов после окклюзии – реперфузии проявления хроматолиза достигали отчётливой выраженности, морфологические изменения становились более распространёнными и резкими, отмечалось острое набухание
Все права защищены

1(23)2015
ISSN 2226-3365
тел многих нейронов, распыление тигроида и базофилия ядер. Хроматолиз, как показатель реактивных изменений нервных клеток, отражает нарушения обмена функциональных белков [7], наблюдающегося в первые шесть часов после реоксигенации.
При исследовании коры височных долей головного мозга крыс с помощью моноклональных меченых Bcl -2 клеток через шесть часов после окклюзии – реперфузии в поле зрения светового микроскопа выявлялись единичные комплексы клеточного розет-кообразования, где один нейрон окружён множеством Bcl -2 клеток (рис. 3), что указывает на начало развития апоптотической гибели клеток мозга.
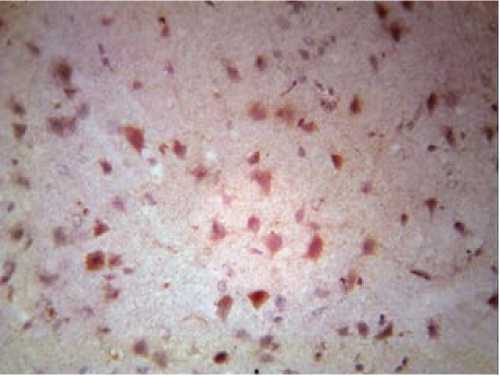
Рисунок 3
Единичный нейрон в окружении множества моноклональных меченых Bcl-2 клеток через шесть часов после окклюзии – реперфузии
Примечание. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
В течение 24–36 часов после реперфузии хроматолиз продолжал нарастать, в процесс вовлекались структурные белки клеток, распад которых выявлялся светооптически в виде инкрустаций, продуктов распада цитоплазмы, интенсивно окрашенных базофильных глыбок, которые формировались в течение первых суток после окклюзии – реперфузии и заканчиваются появлением клеток теней и картинами нейронофагии.
Как известно, повреждение структурных белков и липидов клетки включает в себя и изменения липопротеинов клеточных мембран, что свидетельствует об ещё большем нарушении электролитного и водного баланса клетки [8]. В результате этого, уже начиная с ранних стадий процесса, хроматолиз нередко сочетался с гидропическими изменениями, что выражалось в вакуолизации различной степени, увеличении размеров клетки, округлении её контуров, иногда с явлениями острого или сотовидного набухания тел нервных клеток.
Хроматолиз и гидропические изменения цитоплазмы в первые 24 часа после перенесенной гипоксии сопровождались морфологическими признаками компенсаторно-восстановительных реакций, которые выражались в гипертрофии и гиперхромности эктопированного к ядерной мембране ядрышка, перинуклеарном гиперхроматозе.
Через 24 часа после реперфузии в исследуемых образцах имелся тотальный тигролиз и гиперхроматоз ядер в преобладающем большинстве нейронов, «инкрустация» клеток, ка-риоцитолиз, «клетки-тени». Одни нейроны имели сотовидную цитоплазму, другие были тотально темноокрашенными, тела их были узкие, вытянутые. Во многих нейронах имелась центральная тинкториальная ацидофилия.
Наблюдалась дистония сосудистых стенок, утолщение и огрубление аргирофильных волокон, периваскулярные отёки и нередко мелкие периваскулярные кровоизлияния. Гипоксические нейроны с инкрустациями характеризовались наличием интенсивно окрашенных базофильных зёрен по периферии клетки,
Все права защищены

1(23)2015
ISSN 2226-3365
иногда по краю цитоплазмы имелась более тёмная базофильная каёмка.
Исследование коры височных долей головного мозга крыс с помощью моноклональных меченых Bcl -2 клеток через 24 часа после окклюзии – реперфузии показало наличие в поле зрения светового микроскопа хаотичного распределения Bcl -2 клеток, отсутствие их концентрирования вокруг нейроцитов и отсутствие связи с ними (рис. 4). Как результат этого, ожидалась резко отрицательная динамика с появлением очагового некроза.
темноокрашенность некоторых нейронов, уменьшение в размерах нейрональных клеток. Инкрустации нередко сочетались с появлением в клетках различных зернистостей, что проявлялось бледностью цитоплазмы, количество несвязанных Bcl -2 клеток было незначительным (рис. 5). Известно, что пикнотичные ядра могут значительно дольше обнаруживаться на фоне цитоплазмы, постепенно превращающейся в тень, в виде гиперхромных, неправильной формы, распадающихся на мелкие зёрна и глыбки, угловатых образований [9–10].
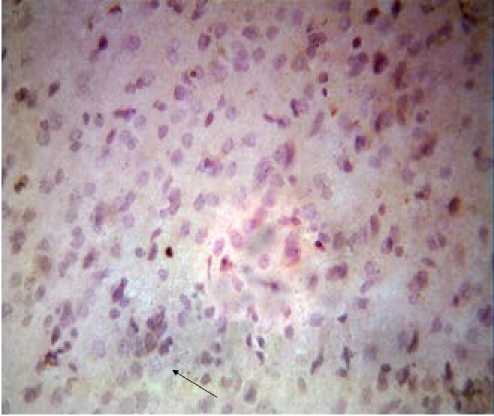
Рисунок 4
Хаотичное распределение Bcl-2 позитивных клеток вне их связи и расположения вокруг нейронов через 24 часа после окклюзии – реперфузии
Примечание. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
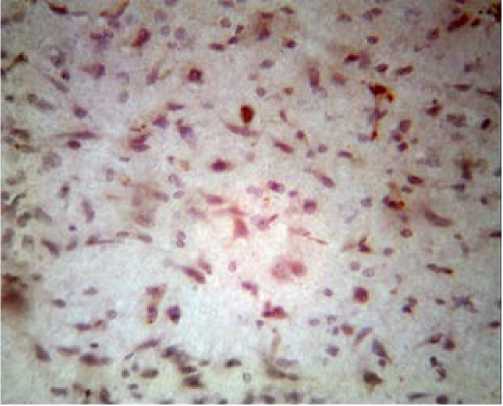
Рисунок 5
Обеднение нейрональными клетками с незначительным количеством несвязанных Bcl-2 клеток коры через трое суток после окклюзии – реперфузии
Примечание. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
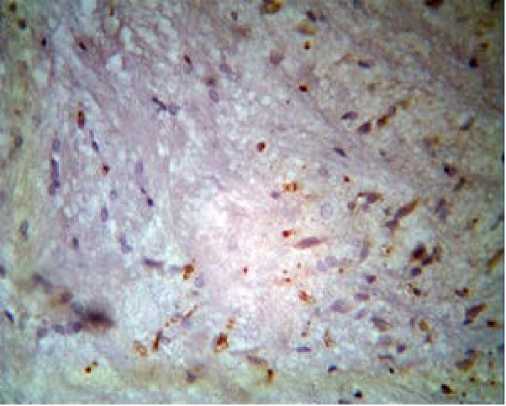
Через трое суток наблюдалось изменение морфологической картины. С одной стороны, можно было отметить некоторые признаки восстановления – снова начинал окрашиваться распылённый на мелкие глыбки тигроид, светлее становились ядра нейронов. С другой – продолжалось нарастание патологических процессов, появление вакуолизации,
Рисунок 6
Все права защищены
1(23)2015
ISSN 2226-3365
Зона некротического расплавления левой височной области головного мозга крысы на седьмые сутки после окклюзии – реперфузии Примечание. Независимое расположение Bcl-2 клеток. Окраска гематоксилин-эозином.
Увеличение: об. 40, ок. 10.
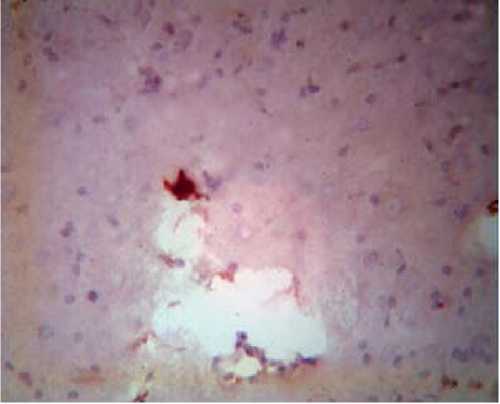
Усиление выраженности вакуолизации с образованием некротических полостей в зонах максимальной ишемии и зоны опустошения характеризовали происходящие морфологические процессы на седьмые сутки (рис. 6).
Заключение
При экспериментальной окклюзии-реоксигенации головного мозга наблюдающиеся изменения нарастают во времени после реперфузии. Наибольшие изменения обнаружены через шесть часов после реперфузии, когда появляются первые признаки апоптоза, а на седьмые сутки апоптотическая гибель нейроцитов сменяется некротическим процессом, о чем свидетельствует зона некротического расплавления и независимое расположение Bcl -2 клеток в образцах. Морфологические изменения в тканях головного мозга проявляются в основном в виде отека, хроматолиза и достигают отчётливой выраженности через 24 часа после реперфузии, характеризуясь острым набуханием тел многих нейронов, распылением тигроида и базофилией ядер.
Список литературы Морфологические изменения в тканях головного мозга при экспериментальной ишемии
- Назиров Ф. Г., Ибадов Р. А., Абролов Х. К. Принципы нейропротекторной терапии острых нарушений мозгового кровообращения: методические рекомендации. -Ташкент, 2011. -40 с.
- Бизенкова М. Н., Чеснокова Н. П., Неважжай Т. А. Активация процессов липопероксидации -эфферентное звено дезинтеграции клеточных структур при острой гипоксической гипоксии//Успехи современного естествознания. -2007. -№ 7. -С. 65-68.
- Болдырев А. А. Окислительный стресс и мозг//СОЖ. -2005. -№ 8 (4). -С. 4-9.
- Гусев Е. И., Скворцова В. И. Ишемия головного мозга. -М.: Медицина, 2001. -326 с.
- Кухтевич И. И. Ишемический инсульт. -М.: Медицина, 2006. -170 с.
- Пирс Э. Гистохимия. -М.: Медицина, 1962. -648 с.
- Ибрагимов У. К., Хайбуллина З. Р. Апоптоз: учебное пособие для магистров и клинических ординаторов. -Ташкент, 2007. -81 с.
- Ibragimov U. K. Hypoxi-ishemic encephalopathy in children//The 2th World Congress of Neonatology. 6th -9th January. 2010, Luxor, Egypt, p. 18.
- Muresanu D. F. Neurotrophic factors//Bucuresti: Libripress. 2003, 268 p.
- Sloviter R. Apoptosis: a guide for perplexed//Trends Pharmacol Sci. 2009, № 23, pp. 19-24.


