Морфологические изменения в вентральных отделах гиппокампа взрослых крыс при длительном воздействии комбинированного стресса
Автор: Смирнов А.В., Шмидт М.В., Экова М.Р., Медников Д.С., Бородин Д.Д., Тюренков И.Н.
Журнал: Волгоградский научно-медицинский журнал @bulletin-volgmed
Рубрика: Морфология
Статья в выпуске: 4 (40), 2013 года.
Бесплатный доступ
После воздействия хронического комбинированного стресса со сменой разномодальных стрессоров (шума, вибрации, пульсирующего яркого света) по стохастической схеме на фоне ограничения подвижности и повышения температуры в камере за время стрессирования от 20-22 до 25-27 °С у животных после семи ежедневных, 30-минутных сеансов в вентральных отделах гиппокампа взрослых (12 месяцев) крыс отмечены выраженные признаки повреждения нейронов в пирамидном слое поля CA3, а также нарушения кровообращения в сосудах микроциркуляторного русла.
Гиппокамп, нейрон, крыса, стресс
Короткий адрес: https://sciup.org/142149061
IDR: 142149061 | УДК: 616.091.8:616.-092.9
Текст научной статьи Морфологические изменения в вентральных отделах гиппокампа взрослых крыс при длительном воздействии комбинированного стресса
Стресс является одним из защитно-приспособительных механизмов организма к различным неблагоприятным или новым условиям существования. В процесс адаптации к стрессогенным факторам вовлекаются практически все органы и системы, однако ведущая роль принадлежит гипоталамо-гипофизно-надпочечниковой системе [1]. В ответ на стресс выделяются глюкокортикоиды, которые связываются с минералокортикоидными и глюкокортикоидными рецепторами, лиганд-активированными факторами транскрипции, участвующими в регуляции транскрипции генных сетей в головном мозге, необходимыми для преодоления стресса, восстановления и адаптации [6].
Рассматривая различные функциональные аспекты стрессовых реакций, можно отметить ключевые различия в процессах кратковременной (острой) и длительной (долговременной, хронической) адаптаций организма к стрессогенному стимулу [11]. В первом случае выброс гормонов и химических медиаторов, таких как глюкокортикоиды и катехоламины, приводит к увеличению частоты сердечных сокращений и повышению артериального давления. Подобные реакции наблюдаются как при простых актах, как утренний подъем с постели, так и при комплексных мультисистемных реакциях, например при заболеваниях, сопровождающихся болевым синдромом [4].
В условиях длительного (хронического) стресса происходит резкое увеличение нагрузки на нервную и эндокринную системы, особенно на центры, регулирующие кардио-респираторные функции [3], что приводит к постоянному и длительному повышению уровней гормонов, в частности, глюкокортикоидов и катехоламинов. Хронизация эпизодов тахикардии и артериальной гипертензии при стрессе рассматривается как важнейший фактор риска развития атеросклероза, гипертонической болезни (эссенциальной артериальной гипертензии) и, как следствие, инфарктов миокарда, головного мозга, внутримозговых кровоизлияний [1].
Представления о патогенетических механизмах стрессовых реакций включают сведения об активации вслед за стресс-реализующими стресс-лимитирущих систем организма, мини-мизирущих повреждающее действие стресса, в числе последних рассматриваются нейроны вентрального вагусного комплекса [3], гиппокампа [8] и др.
Гиппокамп играет важную роль в процессах снижения ответа гипоталамо-гипофизарно-надпочечниковой системы при стрессе и уменьшении повреждения [9]. Атрофия гиппокампа ухудшает его ограничительные влияния и ведет к более длительному ответу со стороны гипота-ламо-гипофизарно-надпочечниковой системы на психологические стрессоры [8]. Так, в исследованиях Lupien и соавт. [10] показано, что прогрессивное увеличение кортизола в слюне во время ежегодной сдачи экзаменов в течение 5-летнего периода прогнозировало уменьшение объема гиппокампа и снижение выполнения гиппокамп-зависимых задач на память.
Кроме того, обнаружено, что дорсальный отдел гиппокампа связан с пространственной ориентацией и обладает адаптивной пластичностью, тем самым являясь более стресс-устойчивым субрегионом. Напротив, вентральный отдел участвует в эмоциональных реакциях, возникающих в ответ на стрессогенные факторы, что приводит к снижению выживаемости клеток-предшественников и нейрогенеза [7], и как следствие – к нейродегенеративным изменениям [11, 12, 14]. Таким образом, морфофункциональные изменения в гиппокампе играют важную роль при стрессовом воздействии.
ЦЕЛЬ РАБОТЫ
Выявить структурные изменения в вентральных отделах гиппокампа взрослых 12-месячных крыс [5] на фоне комбинированного стрессового воздействия.
МЕТОДИКА ИССЛЕДОВАНИЯ
Моделирование комбинированного стрессового воздействия (вибрация, шум, свет) выполнено по методике [2] на 20 нелинейных белых крысах самцах (ФГПУ Питомник лабораторных животных «Рапполово») в возрасте 12 месяцев. Животные были разделены на 2 группы. 1 группа – контрольные крысы (n = 10), 2 группа – стрессированные крысы (n = 10). Эвтаназию проводили под эфирным наркозом с соблюдением «Правил проведения работ с использованием экспериментальных животных» (приказ № 755 от 12.08.1977 г. МЗ СССР). Головной мозг фиксировали в нейтральном 10%-м формалине. Парафиновые срезы, толщиной 5–7 мкм окрашивали гематоксилином и эозином, тионином по методу Ниссля. Фотодокументирование осуществляли цифровой фотокамерой Olympus (Япония). Степень повреждения нейронов определяли методом подсчета удельного количества сморщенных нейронов с гиперхроматозом цитоплазмы.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ
При микроскопическом изучении вентральных отделов гиппокампа у контрольных животных наблюдались следующие особенности гистологического строения. Нейроны пирамидного слоя СА1 зоны характеризовались округлой формой ядра и близкой к округлой форме перикариона, равномерным распределением субстанции Ниссля в цитоплазме. Однако встречались и единичные сморщенные гиперхромные клетки, удельное количество сморщенных нейронов с гиперхроматозом цитоплазмы составило (2,3 ± 0,5) %. В СА3 поле нейроны пирамидного слоя располагались более дисперсно, имели полигональную форму с четко визуализируемым ядром и одним ядрышком, обнаруживались лишь единичные гиперхромные нейроны, удельное количество сморщенных нейронов с гиперхроматозом цитоплазмы составило (5,6 ± 0,7) % (рис. 1).
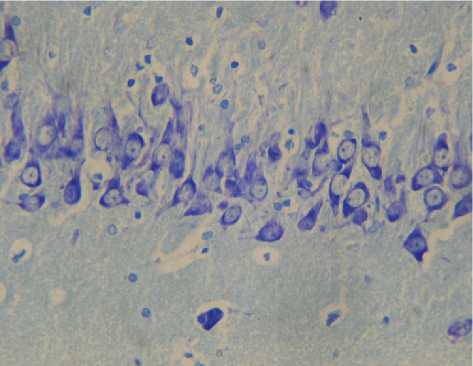
Рис. 1. Гистологическое строение поля СА3 гиппокампа взрослой крысы в возрасте 12 месяцев (контроль). Окраска тионином по методу Ниссля. Ув. Х 400
Необходимо отметить, что у большинства контрольных животных перикарионы нейронов гиппокампа характеризовались умеренной окраской цитоплазмы тионином. Базофильная субстанция носила мелкогранулярный равномерный характер распределения в цитоплазме и начальных сегментах аксонов. Встречались единичные гиперхромные нейроны. Среди клеток глии преобладали астроциты.
У стрессированных животных в вентральных отделах гиппокампа значимые морфологические изменения отмечались в СА3 зоне. Часть нейронов пирамидного слоя характеризовалась разнообразными неспецифическими изменениями в виде гиперхроматоза, хроматолиза и сморщивания. Наблюдались участки очаговых выпадений нейроцитов, а также уменьшение по сравнению с контролем как плотности расположения нейронов, так и ширины пирамидного слоя. Кроме того, в пирамидном слое выявлялись сморщенные нейроны с интенсивной базофилией цитоплазмы перикариона, а в ряде случаев кариопикнозом и уменьшением размеров перикариона (рис. 2). Удельное количество сморщенных нейронов с гиперхроматозом цитоплазмы составило (8,1 ± 0,8) %.
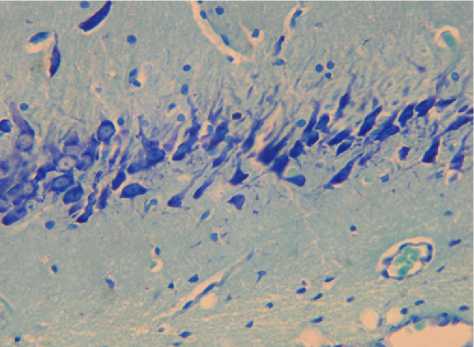
Рис. 2. Гистологическое строение поля СА3 гиппокампа взрослой крысы в возрасте 12 месяцев, находившейся в течение 7 суток под влиянием комбинированного стресса.
Наличие в пирамидном слое значительного количества поврежденных нейронов. Окраска тионином по методу Ниссля. Ув. Х 400
В остальных полях передних отделов гиппокампа (СА1, СА2, СА4) наблюдались менее выраженные дистрофические изменения в нейронах преимущественно пирамидного слоя, а также в зубчатой извилине в гранулярном слое. У многих животных подвергшихся комбинированному стрессовому воздействию наблюдались явления вакуольной дистрофии в различных структурах головного мозга, при этом выраженность подобных изменений существенно не отличалась в исследуемых группах животных.
Под воздействием комбинированного стресса в сосудах микроциркуляторного русла наблюдались неспецифические признаки нарушений кровообращения в виде полнокровия капилляров, спазма артериол, стаза эритроцитов.
Обнаруженные нами структурные признаки повреждения нейронов сочетались с уменьшением размеров перикарионов части клеток в пирамидном слое, особенно в поле СА3, что может рассматриваться как морфологическое проявление уменьшения влияния компонентов стресс-лимитирующих систем в условиях длительного (7 суток) комбинированного стрессового воздействия на взрослых животных (12-месячного возраста) и может служить предпосылкой для более длительного ответа со стороны гипоталамо-гипофизарно-надпочечниковой системы на стрессоры [8]. Под влиянием комбинированного 14-суточного стрессового воздействия (наклонное положение клетки, использование подкисленной уксусной кислотой воды, воздействие светом стробоскопа, использование запаха и звуков, издаваемых хищниками) у 3-месячных крыс наблюдались структурные отличия в вентральном и дорсальном субрегионах гиппокампа [7]. Различия в выживании, нейрональной дифференцировке в субрегионах гиппокампа при стрессе авторы связывают с уменьшением в вентральном и увеличением в дорсальном уровня экспрессии мозгового фактора роста ( brain derived neurotrophic factor , BDNF), что может при менее длительном воздействии стрессовых факторов способствовать формированию локальных атрофических изменений нейронов на фоне реализации процессов клеточного повреждения.
Нейроэндокринный ответ при остром стрессе имеет решающее значение для выживания вида, однако длительное воздействие хронического стресса может привести к патологическим изменениям в ЦНС, нарушениям процессов обучения и памяти [15], что связывается с механизмом включения в гиппокампе NMDA-рецепторов и PKA-зависимого компонента Са2+-проницае-мых АМРА-рецепторов в синапсах.
Другой механизм повреждения нейронов при длительном стрессе может быть связан с нарушениями кровообращения в сосудах мик-роциркуляторного русла в головном мозге, что рассматривается нами как результат активации стресс-реализующих систем и реализации каскада нейрогуморальных реакций на фоне нарастания патологических изменений, в том числе в результате эндотелиальной дисфункции, активации различных компонентов системы синтеза оксида азота [2].
ЗАКЛЮЧЕНИЕ
Таким образом, полученные нами данные свидетельствуют о том, что при длительном комбинированном стрессовом воздействии у 12-месячных крыс-самцов обнаруживаются наиболее выраженные изменения в нейронах пирамидного слоя поля СА3 гиппокампа, а также определяются признаки нарушений кровообращения в сосудах микроциркуляторного русла.


