Морфологические изменения внутренних органов у крыс при длительном избыточном потреблении углеводов и жиров
Автор: Чернышева Мария Борисовна, Макарова Мария Александровна, Цветков Иван Сергеевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.22, 2014 года.
Бесплатный доступ
Проведено исследование внутренних органов крыс после длительного (20 недель) избыточного потребления углеводов и жиров. Рацион опытных животных включал обогащенный жиром стандартный корм и 20% раствор фруктозы вместо питьевой воды. Показано, что в отсутствии увеличения массы тела и повышения уровня глюкозы и триглицеридов, у крыс развивается жировая дистрофия печени, липоматоз поджелудочной железы и коронообразные структуры в жировой ткани.
Ожирение, метаболический синдром, крысы, рацион с высоким содержанием жиров и углеводов
Короткий адрес: https://sciup.org/143177004
IDR: 143177004
Текст научной статьи Морфологические изменения внутренних органов у крыс при длительном избыточном потреблении углеводов и жиров
Введение. Ожирение - это хроническое полиэтиологическое заболевание, к причинам развития которого, в первую очередь, следует отнести высококалорийное питание, а именно, избыточное потребление жиров и углеводов, превышающее энергетические затраты организма, а также генетическую предрасположенность и прогрессирующую распространенностью заболеваний эндокринной системы и органов пищеварения [1]. Ожирение характеризуется избыточным накоплением жировой ткани и прогрессирует при естественном течении, после окончания курса лечения высока вероятность рецидива [2]. На фоне ожирения развивается метаболический синдром - совокупность метаболических, гормональных и клинических нарушений, являющихся факторами высокого риска развития сердечно-сосудистых, хронических воспалительных и онкологических заболеваний [3].
При ожирении в жировых депо увеличивается количество нейтрального жира, он откладывается в подкожной клетчатке, в большом сальнике, брыжейке и эпикарде. Также жировая ткань появляется в органах, где она обычно почти не встречается, например, в поджелудочной железе и стенках правого желудочка сердца. При ожирении развивается жировая дистрофия печени, липоматоз поджелудочной железы и ожирение сердца [4].
В литературе представлены сведения о структурных и морфофункциональных изменениях внутренних органов при ожирении и метаболическом синдроме у человека. Что касается их моделирования у лабораторных животных, то, напротив, в них, как правило, приводятся данные только о лабораторных биохимических показателях [5-9].
Ожирение и метаболический синдром у лабораторных животных можно вызвать с помощью специального рациона с высоким содержанием углеводов, жиров, углеводов и NaCl и рационы, имитирующие пищевые предпочтения человека, например, «диета кафетерия» [10]. Наиболее адекватным и простым методом моделирования ожирения является использование корма с высоким содержанием и углеводов, и жиров [5,6,7]. Показано, что обогащение рациона жирами различного происхождения способствует развитию ожирения, инсулинорезистентности и стеатоза печени [11, 12]. По данным литературы [6, 10] рацион экспериментальных животных обогащают жирами на 10-60% по калорийности, наиболее распространенным вариантом считается рацион с высоким (30-40%) содержанием жира. Для обогащения рациона углеводами в эксперименте используют сахарозу, глюкозу и фруктозу. Однако, для моделирования ожирения наиболее эффективна именно фруктоза. Даже за очень короткий срок (1-2 недели) у крыс, потребляющих фрук- тозу, развиваются проявления метаболического синдрома такие, как инсулинорезистентность и триглицеридемия [13].
Цель исследования - выявить морфологические изменения внутренних органов при длительном избыточном потреблении углеводов и жиров у крыс линии Спрэйг-Доули
Материал и методы исследования. В работе были использованы две группы половозрелых самцов крыс Спрейг-Доули (питомник «Столбовая») массой тела 226-236г. на начало эксперимента. Всех экспериментальных животных содержали в стандартных условиях освещения и температурного режима при свободном доступе к пище и воде. Экспериментальные животные контрольной группы (n=3) получали стандартный корм ПК-120-1 (ООО «Лабораторснаб») и обычную питьевую воду. Экспериментальные животные опытной группы (n=7) - рацион, включающий обогащенный жиром на 30% по калорийности стандартный корм ПК-120-1 и 20% раствор фруктозы в питьевой воде. Эксперимент длился 20 недель.
В течение всего эксперимента измеряли массу тела у крыс обеих групп. Животных выводили из эксперимента передозировкой диэтилового эфира. Проводили гистологическое исследование внутренних органов, которые в первую очередь вовлекаются в патологический процесс при ожирении - сердце, печень, поджелудочная железа и жировая ткань, окружающая придаток яичка. Органы фиксировали в жидкости Буэна, заливали в парафин, изготавливали гистологические срезы толщиной 5-7 мкм и окрашивали их гематоксилином и эозином.
Проводили забор крови, получали сыворотку, в которой определяли уровень глюкозы и триглицеридов (наборы Human GmbH 10260 и 10720P) на автоматическом биохимическом анализаторе Mindray BS (Китай).
Результаты исследования и их обсуждение. После окончания эксперимента показатели массы тела у крыс контрольной и опытной групп не различались (табл.). По данным биохимического исследования у животных опытной и контрольной групп статистически значимых различий содержания в сыворотке крови глюкозы и трилицеридов не выявлено (табл.).
При морфологическом исследовании печени балочное и дольковое строение сохранено у всех животных контрольной группы. Гепатоциты с мелкой базофильной зернистостью. По ходу балок диффузно рассеяные неэпителиальные клеточные элементы, неравномерное полнокровие синусоидных капилляров и вен. В опытной группе у всех крыс балочное и дольковое строение печени было также сохранено. В центрах долек - гепатоциты с мелкой базофильной зернистостью, а в периферических - с мелкокапельной и среднекапельной жировой дистрофией (Рис. 1).
Поджелудочная железа у всех животных
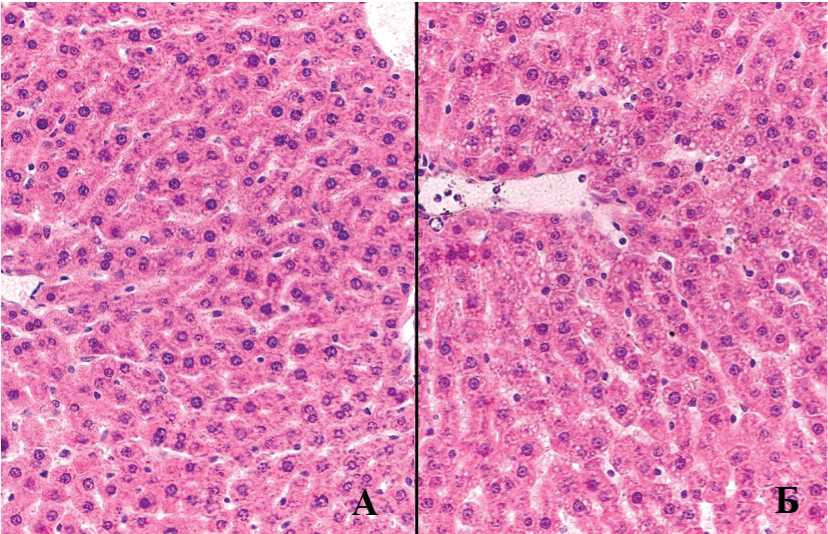
Рис. 1. Печень крыс контрольной (А) и опытной групп (Б). А) гепатоциты с мелкой базофильной зернистостью. Б) гепатоциты с мелко- и среднекапельной дистрофией. Окраска гематоксилином и эозином. Ув. 400
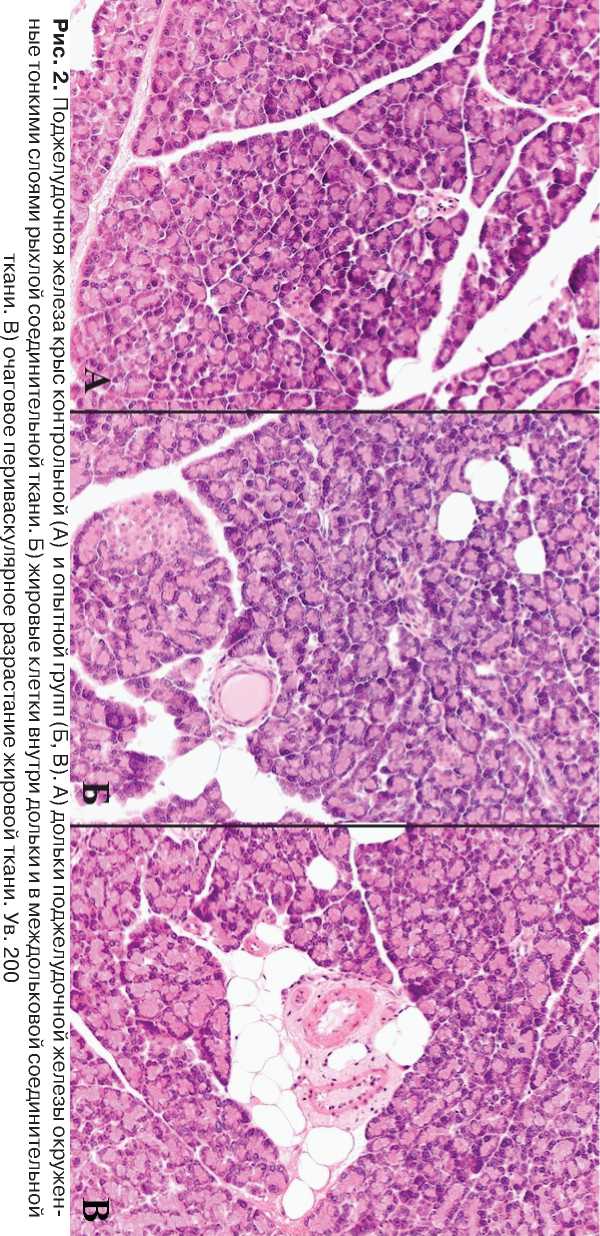
контрольной группы с тонкими прослойками соединительной ткани, строение серозных ацинусов и выводных протоков не нарушено. Единичные островки Лангерганса представлены эндо-криноцитами с нормохромными ядрами и окружены тонкими волокнами. Прилежащая жировая ткань имела равномерно ячеистый вид, короноподобные структуры (crown-like structures), характерные для ожирения, отсутствовали. В опытной группе в отличие от контрольной у 5 из 7 животных встречались единичные в препарате разрастания жировой ткани (липоматоз) внутри долек и вокруг сосудов (рис. 2.).
В контрольной группе у всех животных жировая ткань, прилежащая к придатку яичка, была представлена дольками, состоявшими из крупных клеток, плотно примыкающих друг к другу, с эксцентрично расположенными уплощенными ядрами. По сравнению с контрольной - у 5 из 7 животных опытной группы в препаратах встречались короноподобные структуры, представленные скоплениями макрофагов, окружающими адипоциты (рис. 3).
При моделировании ожирения исследователи чаще всего используют крыс Спрейг-Доули, в связи с тем, что эта линия отличается выраженными индивидуальными различиями. По данным литературы [5-9] при длительном (от 3 до 6 месяцев) избыточном употреблении углеводов и жиров у 50% животных развивается ожирение и метаболический синдром - значительно увеличивается масса тела и висцерального жира, повышается уровень инсулина, триглицеридов и холестерина, возникает инсулинорезистент-ность и нарушенная толерантность к глюкозе.
В нашем эксперименте показатели массы тела у животных опытной группы, при употреблении ими в течение 20 недель избыточного количества углеводов и жиров, не отличались от
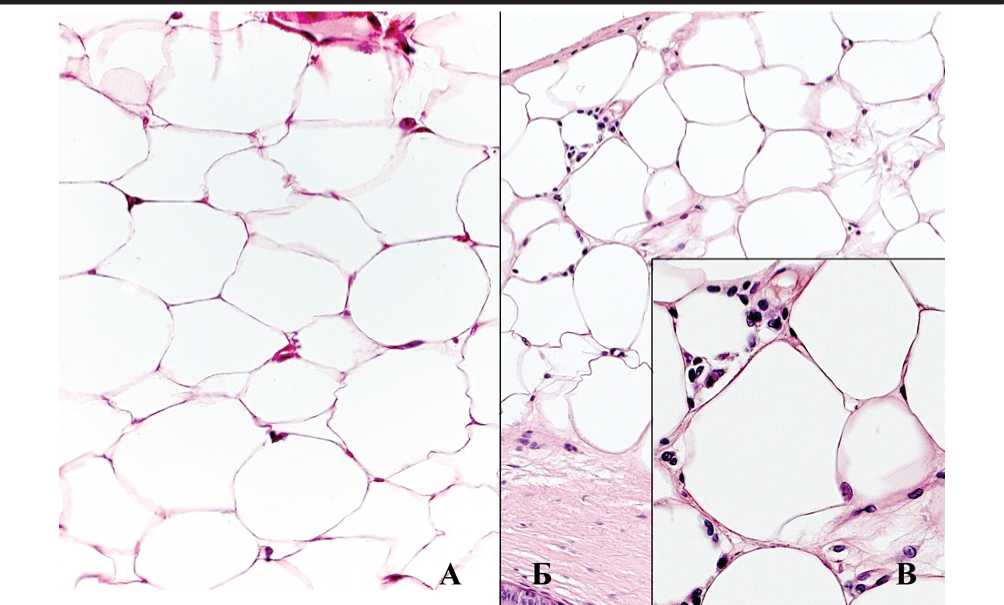
Рис. 3. Жировая ткань, окружающая придаток яичка, у крыс контрольной (А) и опытной групп (Б, В). А) – адипоциты сферической и многоугольной форм, жировая капля окружена цитоплазмой, ядро уплощено. Б), В) короноподобные структуры - скопления макрофагов, окружающих адипоциты. Ув.: А, Б - 200; В - 400.
Таблица.
Масса тела экспериментальных животных и биохимические показатели сыворотки крови у крыс опытной и контрольной группы
Заключение. Таким образом, при дли- тельном избыточном потреблении углеводов и жиров, при отсутствии увеличения массы тела и повышения уровня глюкозы и триглицеридов, развивается жировая дистрофия печени, липоматоз поджелудочной железы и коронообразные структуры в жировой ткани.
Список литературы Морфологические изменения внутренних органов у крыс при длительном избыточном потреблении углеводов и жиров
- Acosta A., Camilleri M. Gastrointestinal Morbidity in Obesity//Acad. Sci. 2014. V.1311. P. 42-56.
- Гинзбург М.М. Ожирение и метаболический синдром. Влияние на состояние здоровья, профилактика и лечение. Самара.: Парус, 2000. 160с.
- Ройтберг Г.Е. Метаболический синдром. М.: МЕДпресс-информ, 2007. 224 с.
- Струков А.И., Серов В.В. Патологическая анатомия. - М.: Медицина, 1979. 527с.
- Levin B.E., Dunn-Meynell A.A., Balkan B., Keesey R.E. Selective breeding for diet-induced obesity and resistance in Sprague-Dawley rats //American Journal of Physiology - Regulatory, Integrative and Comparative Physiology. 1997. V.273. Р.725-730.
- Ghibaudi L., Cook J., Farley C., Heek M., Hwa J.J. Fat Intake Affects Adiposity, Comorbidity Factors, and Energy Metabolism of Sprague-Dawley Rats // Obesity Research. 2002. V.10. N.9.
- Ricci M.R., Levin B.E. Ontogeny of diet-induced obesity in selectively bred Sprague-Dawley rats // American Journal of Physiology - Regulatory, Integrative and Comparative Physiology. 2003. V.285. Р.610-618.
- Deng J.Y., Huang J.P., Lu L.S., Hung L.M. Impairment of cardiac insulin signaling and myocardial contractile performance in high-cholesterol/fructose-fed rats// Am J Physiol Heart Circ Physiol. 2007. V. 293(2)
- Axelsen L.N., Lademann J.B., Petersen J.S., Holstein-Rathlou N.H., Ploug T., Prats C., Pedersen H.D., Kjølbye A.L. Cardiac and metabolic changes in long-term high fructose-fat fed rats with severe obesity and extensive intramyocardial lipid accumulation //Am J Physiol Regul Integr Comp Physiol. 2010. V. 298(6)
- Angelova P., Boyadjiev N. A review on the models of obesity and metabolic syndrome in rats // Trakia Journal of Sciences. 2013. V. 1. P. 5-12.
- Grundy S.M., Brewer H.B., Cleeman J.I., Smith S.C., Lenfant C. Definition of Metabolic Syndrome Report of the National Heart, Lung, and Blood Institute // American Heart Association Conference on Scientific Issues Related to Definition Circulation. 2004. V.109. P. 433-438
- Buettner R., Parhofer K., Woenckhaus M., Wrede C., Kunz-Schughart L., Scholmerich J. and Bollheimer L. Defining high-fat-diet rat models: metabolic and molecular effects of different fa t types // Journal of Molecular Endocrinology. 2006. V. 36. P. 485-501.
- Selder J., Chen, Y. D., Cully M. and Reaven, G., Hyperinsulinemia in fructose-induced hypertriglyceridemia in rat // Metabolism. 1980. V. 4. P. 303-305.


